INTRODUCCIÓN
Desde que a mediados del siglo XX se descubrió la acción de la PTH y se iniciaron los primeros tratamientos para evitar las consecuencias de la hipertrofia de las GPT, se han editado encontrar numerosas publicaciones en las que todos los tratamientos se centran en evitar las lesiones óseas. La osteodistrofia renal provocaba en los niños alteraciones del crecimiento, lo que se conocía como raquitismo renal, con talla baja, deformidades óseas, pérdida de piezas dentarias y fracturas. No hay que olvidar que las lesiones más frecuentes eran el cráneo «en sal y pimienta», la desaparición de la porción terminal de las falanges distales o la desaparición de la lámina dura dentaria, así como aplastamientos vertebrales, fracturas costales y hundimiento de los huesos de la cara. En los niños, además, si se asociaba con déficit de vitamina D podía dar lugar a osteomalacia.
En los años posteriores, la atención se centró en controlar el P como elemento que desempeñaba un papel fundamental en la aparición del HPT y, por tanto, fue prioritario el tratamiento con captores de fósforo, principalmente carbonato cálcico e hidróxido de aluminio. La consecuencia directa del aumento de P era la disminución de la síntesis de los metabolitos terminales de la vitamina D y, por tanto, también estos derivados, primero el alfacalcidol y después el 1,25 (OH)2 D3 fueron fundamentales en la prevención de la aparición y desarrollo del HPT secundario. De la combinación de estos tratamientos, de los que durante años se aconsejaron dosis cada vez más elevadas para frenar las GPT, se llegó a otra patología: el freno excesivo del turnover óseo (enfermedad ósea adinámica) que provoca acumulación de calcio en localizaciones extraóseas, dando lugar a calcificaciones metastásicas, calcifilaxis y calcificaciones vasculares que, a su vez, han producido un incremento de la mortalidad cardiovascular en los pacientes renales.
A la vista de la experiencia acumulada en la segunda mitad del siglo XX, se puede afirmar que el objetivo del tratamiento del HPT secundario comprende en la actualidad tres apartados fundamentales: a) evitar la hipertrofia de las glándulas paratiroides; b) prevenir las alteraciones del metabolismo mineral y óseo, y c) evitar las complicaciones cardiovasculares.
Para ello, a continuación se revisan los trabajos publicados durante el año 2008, dividiéndolos en cinco apartados:
- Captores de fósforo.
- Vitamina D y derivados.
- Calcimiméticos.
- Tratamientos combinados.
- Calcifilaxis y su tratamiento.
Captores de fósforo
Entre los trabajos que revisan la importancia de los niveles de P al inicio del HPT secundario y de evitar un producto fosfocálcico elevado debe destacarse el de Isakova et al.1 Se trata de una revisión de 10.044 pacientes incidentes en HD en la que se comparan los que reciben captores y los que no. La mortalidad es superior en los que no los reciben, independientemente de los niveles de P basales y a lo largo del estudio. También es interesante el trabajo de Yavuz et al.2, estudio multicéntrico realizado en 24 centros de Turquía, con 530 pacientes, donde se demuestra que la diálisis peritoneal, si se acompaña de una dieta adecuada y se elige bien el captor a emplear, puede ser un tratamiento adecuado de la hiperfosforemia.
Una vez conocidos los efectos negativos del hidróxido de aluminio, se empezaron a utilizar con mucha frecuencia los captores cálcicos: carbonato y acetato. Ambos tienen un gran poder quelante, y el acetato parece más aconsejable ya que aporta una cantidad menor de calcio a igualdad de captación del P. No obstante, ambos aportan una cantidad excesiva de calcio si los pacientes presentan un HPT secundario grave, con hipercalcemia o si los pacientes reciben excesivas dosis de vitamina D, que aumenta la absorción de calcio a nivel intestinal, con un gran riesgo de incrementar el producto fosfocálcico.
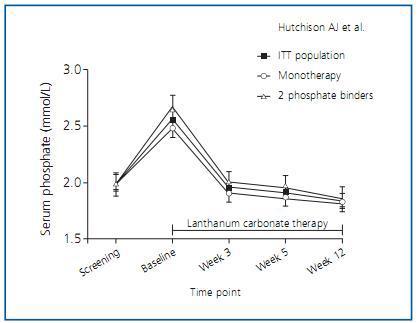
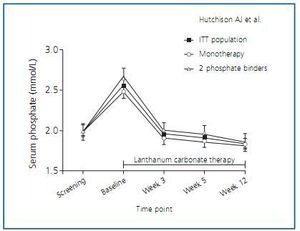
Por todo ello, en los últimos años se han empezado a utilizar captores cálcicos como el sevelamer o el carbonato de lantano. Sobre este último debemos destacar el trabajo de Hutchinson et al.3 que describe el ensayo clínico realizado en 49 centros de Europa, Israel y Canadá, con un total de 367 pacientes incluidos y dosis crecientes de carbonato de lantano, donde se demuestra que este captor en monoterapia consigue un buen control del fósforo por lo menos en tres cuartas partes de los pacientes, con una importante reducción en el número de tabletas que los pacientes ingerían en monoterapia o en terapia combinada (figura 1).
A lo largo de 2008 se han publicado varios trabajos4,5 que creen que el éxito del carbonato de lantano se debe no tanto a la capacidad captora del fósforo, sino a la facilidad en el cumplimiento del tratamiento, ya que el número de comprimidos diarios que el paciente precisa es menor que con otros captores y esto aumenta la adherencia al tratamiento y, por tanto, la labor del médico. Aunque el hidróxido de aluminio está hoy contraindicado como quelante del fósforo por las numerosas complicaciones que se describieron, tanto a nivel óseo como en otros órganos, existe un trabajo interesante de Arenas et al.6 que demuestra que, debido a los bajos contenidos de Al del agua ultrapura que hoy se utiliza en hemodiálisis, puede contemplarse el tratamiento con OHAl en casos puntuales. No obstante, en los 41 pacientes que recibieron este captor se observó un aumento progresivo de los niveles de Al en sangre, sin repercusión momentánea sobre los parámetros controlados; concluyen que el tratamiento debe ser vigilado de cerca.
Se ha descrito que el nivel de P salival se relaciona con los niveles de P plasmático. Este hecho parece demostrar que parte del P se elimina por la saliva, lo que dio pie a un trabajo en el que Savica et al.7 analizan unos chiclés compuestos por un polímero natural, el «chitosan», que puede quelar el P salival sobre todo en los periodos de ayuno y colaborar con los captores administrados durante las comidas. Es interesante saber que es un efecto de gran duración ya que el P salival vuelve a los niveles previos 15 días después de interrumpir el tratamiento, mientras que el P sérico puede tardar hasta 30 días.
Se han publicado también estudios comparativos entre diversos captores. Si se considera la comparación entre acetato cálcico y sevelamer cabría destacar dos: en el primero, Barreto et al.8 distribuyeron aleatoriamente a 101 pacientes de hemodiálisis a recibir tratamiento con uno de los dos captores y les practicaron una coronariografía y una biopsia ósea (BO) al inicio y 12 meses después. El grupo de sevelamer tenía más elevados los niveles de PTH, FA y desoxipiridinolina (DOP), pero la progresión de las calcificaciones coronarias y los cambios en la BO fueron similares en ambos grupos. El segundo estudio (CARE-2), realizado por Qunibi et al.9, se basa en la suposición de que el control del metabolismo lipídico puede ser responsable de las diferencias observadas entre captores en estudios anteriores. Se distribuyó aleatoriamente a 203 pacientes en hemodiálisis, procedentes de 26 centros, en dos grupos. Uno recibe sevelamer y el otro grupo, acetato cálcico suplementado con atorvastatina; los pacientes de ambos grupos deben conseguir niveles de colesterol-LDL inferiores a 70 mg/dl. Se valora la progresión de las calcificaciones coronarias mediante la realización de una tomografía computarizada por haz de electrones al inicio y a los 12 meses de la aleatorización. El resultado muestra que al disminuir los niveles de colesterol-LDL en ambos grupos la progresión de las calcificaciones es también similar en ambos.
Cabe destacar el trabajo de Shigematsu et al.10, ya que describe el primer estudio doble ciego, multicéntrico y prospectivo, que compara el carbonato de lantano con carbonato cálcico. La eficacia como captor del P fue similar entre ambos compuestos pero los cambios en los niveles de Ca y en el Ca x P fueron menores en el grupo de lantano.
Teniendo en cuenta todo lo descrito anteriormente sobre estudios comparativos entre diferentes captores, es interesante la revisión de Floege11 de tres estudios (Treat to goal study [TTG], Renagel in new dialysis patients study [RIND] y Calcium acetate renagel evaluation study [CARE-2]), que comparan los captores cálcicos con otro no cálcico como es el sevelamer, y en los que los resultados obtenidos difieren según el laboratorio que «patrocina» el estudio. Los dos patrocinados por el laboratorio que comercializa el sevelamer afirmanque éste produce menos calcificaciones mientras que el tercero, patrocinado por el que comercializa el acetato cálcico, afirma que no existen diferencias entre las dos ramas del estudio. De los tres se puede deducir que en los pacientes con insuficiencia renal avanzada es importante reducir el aporte de calcio.
En la misma línea destaca el trabajo de Novak et al.12 quienes revisan todas las publicaciones actuales sobre la utilización de captores del P, desde las más amplias hasta los casos puntuales, y concluyen que no existe evidencia de que ningún captor sea superior a los demás.
Vitamina D y derivados
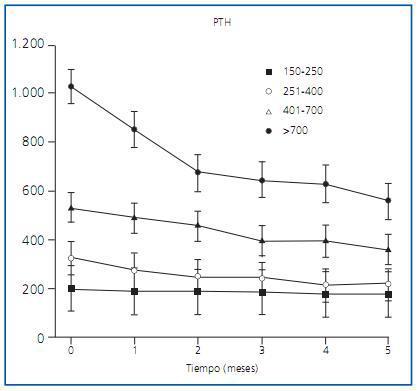
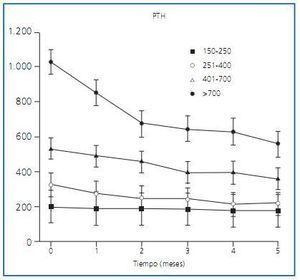
Shiizaki et al.13 han demostrado en ratas que la inyección directa, en las glándulas PT, de cualquiera de los derivados de la vitamina D, así como de etanol, produce apoptosis con la consiguiente reducción de PTH. Este hecho parece apoyar que existen diversos derivados de la vitamina D que pueden ser de utilidad para controlar el HPT en los enfermos con ERC. En esta línea estaría el trabajo publicado por González et al.14 que describe un estudio multicéntrico realizado en España con dosis progresivas de alfacalcidol según el grado de HPT que presentaban 185 pacientes en hemodiálisis, de los que 94 habían recibido tratamiento previo con algún derivado de la vitamina D y los 91 restantes no. Los resultados muestran que el HPT era más severo en mujeres y en individuos jóvenes y que, a pesar de ajustar las dosis de alfacalcidol, el HPT fue más fácil de controlar en los pacientes con niveles más bajos de PTH. Sin embargo, en todos ellos se consiguió una reducción de al menos el 25% de los niveles de PTH y el grado de hipercalcemia que obligó a reducir o retirar el tratamiento fue similar al publicado anteriormente con otros derivados de la vitamina D (figura 2).
Aparte del efecto directo de la vitamina D como supresor de la proliferación de las GPT, también se han observado efectos colaterales, como los que describen Kovesdy et al.15. En pacientes en prediálisis se ha encontrado una disminución de la mortalidad en un grupo tratado con calcitriol frente a otro grupo que no lo recibió. Incluso parece que el primer grupo tardó más en entrar en diálisis.
Entre los estudios que comparan distintos derivados de la vitamina D cabe destacar el de Noonan et al.16, quienes observaron en ratas que el paricalcitol controló el HPT sin alterar la velocidad de la onda del pulso ni aumentar las calcificaciones aórticas, mientras que el doxercalciferol produjo un aumento en ambos parámetros con un control similar del HPT.
Calcimiméticos
Se ha escrito mucho en los últimos años sobre la utilización de calcimiméticos en el tratamiento del HPT secundario por lo que cabe destacar algunos trabajos que se apartan de la línea de las publicaciones más frecuentes. En el raquitismo hipofosfatémico familiar, enfermedad relacionada con los polimorfismos del sensor del calcio, se sabe que el tratamiento clásico con P y vitamina D estimula el FGF 23 y como consecuencia la PTH, mientras que los calcimiméticos, al reducir la PTH pueden disminuir la excreción urinaria de P y, por tanto, los pacientes necesitarían menos dosis de los fármacos clásicos17.
Según Coen et al.18, en la ERC se pueden prevenir las calcificaciones vasculares al disminuir la PTH y el turnover óseo.
En HD, autores como Hanba et al.19 destacan la utilidad de cinacalcet en casos de HPT refractario.
Es también interesante la controversia que existe sobre la utilización de calciomiméticos después del trasplante renal (TR). Según algunos autores, como Evenepoel et al.20, en casos de HPT persistente pueden estar indicados para disminuir el turnover óseo, prevenir la desmineralización y evitar la nefrocalcinosis del injerto, mientras que Serra et al.21 opinan que la hipercalciuria transitoria que provocan podría favorecer la nefrocalcinosis y la reducción de la masa ósea y, por tanto, aconsejan utilizar dosis pequeñas en caso de ser necesarios.
Un 5% de los pacientes trasplantados requieren paratiroidectomía por HPT refractario. Según Komaba et al.22, pueden ser buenos candidatos a calcimiméticos, pero no existen trabajos suficientes para descartar efectos cardiovasculares o renales negativos, así como para conocer el momento de interrumpir el tratamiento.
Tratamientos combinados
Se ha observado que en la mayoría de los casos deben combinarse varios de estos tratamientos para alcanzar los objetivos de las guías KDOQI.
Según Lopez I et al.23, la utilización conjunta de calcitriol o paricalcitol y calcimimético controla el HPT secundario sin aumentar las calcificaciones extraóseas y aumentando la supervivencia en ratas.
Block et al.24 publicaron un estudio multicéntrico con un número elevado de pacientes (444) que compara la eficacia de cinacalcet, solo o en combinación con paricalcitol, para conseguir los parámetros recomendados en las guías KDOQI. Los resultados muestran que la asociación de calcimimético y vitamina D consigue una mayor proporción de pacientes que alcanzan estos parámetros.
Tratamientos combinados/Controversias
También en este tema existen controversias, unas veces derivadas del número de pacientes o de los métodos empleados, y otras de la situación económica de los centros o de los países en los que se realizan los estudios. Así, mientras autores como Spasovski et al.25, de Skopje (R. Macedonia), cuestiona la utilización de calcimiméticos (teniendo en cuenta la relación coste-efectividad), excepto en pacientes en los que los tratamientos previos con captores del fósforo (entre los que preconiza el lantano) y con derivados de la vitamina D no sean efectivos para reducir la PTH, otros autores, como Wetmore et al.26, de la Kansas University, argumentan que los calcimiméticos deben ser la primera elección después de reducir el P con captores porque en la célula paratiroidea es más sensible el sensor del calcio que el receptor de vitamina D. Se trata de una interesante revisión de los mecanismos fisiopatogénicos del HPT, incluyendo el FGF23, y de la secuencia de utilización de los distintos tratamientos.
Como colofón a estas propuestas de tratamiento con un producto único o con la combinación de varios de ellos es interesante la revisión histopatológica publicada por Malluche et al.27, que cabría resumir de la siguiente forma:
- Los captores con Al son tóxicos para el hueso, reducen la mineralización y el volumen óseo.
- Los captores de fósforo cálcicos producen enfermedad ósea adinámica, pérdida de masa ósea y aumento de las calcificaciones.
- Los nuevos captores de fósforo no cálcicos (sevelamer y Ca lantano) parecen favorecer la recuperación de la masa ósea.
- El calcidiol y el calcitriol parecen necesarios ya que los pacientes con ERC son deficitarios en estas hormonas pero su aporte favorece las calcificaciones extraóseas y la disminución del turnover óseo. En cambio existen datos experimentales de que el paricalcitol, el doxercalciferol y el maxacalcitol pueden controlar la PTH sin suprimir el turnover óseo.
- Los calcimiméticos disminuyen la PTH, pero también el turnover óseo.
Calcifilaxis y su tratamiento
En último lugar, pero no menos importante, cabe destacar un tema que ha sido objeto de atención en la literatura científicaen los últimos años: el aumento de la frecuencia de la calcifilaxis, fenómeno relacionado con una importante morbilidad del paciente y que, en muchos casos, comporta también una elevada mortalidad.
Sobre este tema cabe destacar la publicación de Rogers et al.28, quienes definen la calcifilaxis como una calcificación de la media de las arteriolas que se asocia con fibrosis endovascular y trombosis del tejido adiposo subcutáneo. Se caracteriza por isquemia grave, dolor intenso, úlceras necróticas y una mortalidad elevada. Su frecuencia va en aumento, tanto en los casos de HPT secundario grave como en pacientes no urémicos. Los nuevos tratamientos, como los calciméticos y los captores de fósforo no cálcicos, pueden ser útiles; si fallan, se debe considerar la posibilidad de la cámara hiperbárica y del tiosulfato sódico.
Hayden et al.29 describen la experiencia con este último fármaco, conocido desde hace muchos años. También es interesante la utilización de combinaciones con varios de los fármacos de los que se dispone en la actualidad, como la descrita por Raymond et al.30, que utilizan tiosulfato sódico asociado a bifosfonatos y calcimiméticos, o la de Kyritsis et al.31, quienes abogan por la combinación del tiosulfato sódico con paricalcitol y calciomiméticos, observándose buenos resultados en pacientes diabéticas, en HD, con HPT grave.
CONCLUSIÓN
Como resumen de la revisión sobre los tratamientos del hiperparatiroidismo secundario con los nuevos fármacos cabe destacar que el fósforo es uno de los principales factores responsables de la aparición del HPT secundario y de la mortalidad cardiovascular de los enfermos renales y, por tanto, debemos quelarlo desde el inicio de la ERC, con el captor que mejor tolere el paciente para favorecer el cumplimiento.
La vitamina D y derivados deben ser utilizados siempre ya que en la ERC existe un déficit de vitamina D que puede comprometer la supervivencia del paciente. Hay que emplear el derivado que mejor se ajuste a la situación del paciente considerando sus niveles de PTH, la calcemia, la fosforemia y el turnover óseo.
Los calciomiméticos ayudan a la utilización de los anteriores disminuyendo los niveles de Ca y P y, sobre todo, incidiendo de forma directa sobre el sensor del calcio en las GPT. Excepto en las primeras fases de la ERC, en la mayoría de los pacientes será necesario aplicar tratamientos combinados.
Por último, cabe destacar la importancia que ha adquirido el tiosulfato como tratamiento de rescate de la calcifilaxis, solo o asociado con algunos de los fármacos que revisados a lo largo de este trabajo.
Figura 1.
Figura 2.