INTRODUCCIÓN
El fósforo (P) lo descubrió, en 1669, el alquimista alemán, nacido en Hamburgo, Henning Brandt. Ya desde su descubrimiento tuvo que ver con la Nefrología, puesto que se obtuvo a partir de grandes cantidades de orina, que tras descomponerse durante largo tiempo fueron destiladas y al condensarse los vapores en agua se obtenía un producto blanco que en la oscuridad irradiaba luz. Por eso recibió un nombre tan hermoso phos phorus, que en griego significa «portador de luz».
El fósforo está en la propia esencia de la vida, todos los organismos vivos dependen totalmente de los fosfatos. El material genético de la vida consiste en unidades de azúcar, unidas mediante unidades de fosfato para formar la cadena en hélice. En el ADN y en el ARN las unidades fosfatos desempeñan un papel estrictamente estructural, pero también son esenciales en el metabolismo de las células. La formación y ruptura (hidrólisis) de los enlaces P-O sirve como almacén de energía en el trifosfato de adenosina (ATP). La energía liberada en esta hidrólisis se utiliza para realizar el trabajo mecánico en la contracción muscular y en muchas reacciones bioquímicas: ATP = ADP + energía (~ 33 kJ).
El fósforo activa y desactiva enzimas y proteínas, mediante la pérdida o ganancia de grupos fosfatos, con lo que controla parte de la actividad celular.
Forma parte de las membranas celulares que aíslan y protegen a las células y sus organelas, sin las membranas los compartimentos celulares o las propias células no existirían.
Compone la estructura de nuestros huesos y dientes, sin el fósforo probablemente nuestro aspecto sería diferente al que conocemos.
Sin embargo, hasta un «portador de luz» tiene un lado oscuro. El fósforo forma parte de los compuestos llamados organofosforados, que son tóxicos y provocan una sobrestimulación de los músculos, glándulas y órganos. La víctima de este veneno entra en convulsiones violentas y muere rápidamente. El fósforo causó la muerte de mujeres que trabajaban en fábricas de cerillas y aún hoy se usa en las guerras como arma química. Pero además, el fósforo ingerido en gran cantidad puede provocar un fallo renal agudo. Se ha relacionado con el desarrollo de hiperparatiroidismo (HPT) secundario, la inflamación, la alteración de la inmunidad, la progresión de la ERC, la morbimortalidad cardiovascular y la calcificación vascular. Además, disminuye la síntesis de calcitriol y promueve la elevación de FGF, ambas implicadas en la mortalidad de los pacientes con ERC. Todo ello se describirá a continuación.
Nefropatía aguda por fósforo
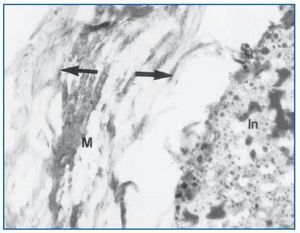
La detección del cáncer colorrectal, en individuos a partir de los 50 años, ha sido un éxito desde el punto de vista de la salud pública. La preparación previa para la colonoscopia requiere la utilización de una solución oral de fosfato sódico que generalmente es bien tolerada por individuos con función renal y gastrointestinal normales. Sin embargo, a partir del año 2003, se comenzaron a publicar casos aislados de nefropatía aguda por fósforo (NAF), ocasionada por la sobrecarga aguda de P debida a la utilización de la solución de fosfato sódico, con un contenido de más de 12g de fósforo, que ocasiona un fallo renal agudo a veces irreversible, objetivándose en la biopsia renal datos de nefroacalcinosis e inflamación intersticial. Esto ha llevado a la Food and Drug Administration (FDA) estadounidense a realizar una advertencia sobre la utilización de esta solución tanto en pacientes con ERC como en aquellos con comorbilidad cardiovascular.
En un artículo de revisión de Lien se recogen todos los casos conocidos hasta el momento. Se trata de 27 individuos, de ellos 22 mujeres, con una media de edad de 65 años, que refleja fundamentalmente la edad a la que se realiza la exploración de detección. Las mujeres más ancianas tienen mayor riesgo, probablemente porque su capacidad renal para manejar la sobrecarga de fosfato está más reducida, además su menor índice de masa corporal (IMC) las hace más sensibles a la sobrecarga de volumen. El periodo de tiempo entre la colonoscopia y el diagnóstico de la NAF varió entre 1 y 150 días, lo que refleja la naturaleza silente del fallo renal. En cuanto a la función renal, fue prácticamente normal en todos los pacientes antes de la exploración, con unos valores de creatinina entre 53 y 88 µmol/l, apareciendo posteriormente elevaciones entre 150 y 900 µmol/l. Los factores de riesgo más habitualmente encontrados fueron: diabetes mellitus (DM), hipertensión arterial (HTA), mayor edad, algún grado de ERC, o la toma de fármacos como inhibidores de la enzima de conversión de angiotensina (IECA), antagonistas de los receptores de angiotensina II (ARA II), antiinflamatorios no esteroideos (AINE), diuréticos y utilización de contrastes. Los datos analíticos fueron los siguientes:
- Elevación de la creatinina desde valores de 53-88 hasta 150-900 µg/l, permaneciendo al final del seguimiento entre 76-299 µg/l.
- Hiperfosfatemia secundaria a la sobrecarga oral de fosfato, habiéndose comunicado casos de hiperfosfatemia fatal.
- Hipocalcemia, desarrollada por la propia hiperfosfatemia.
- Hipopotasemia, ocasionada en parte por la pérdida gastrointestinal (GI) de potasio y también por la pérdida renal de este ión, facilitada por la hiperfosfaturia. Esta alteración hidroelectrolítica, junto con la hipocalcemia, puede afectar al ritmo cardiaco con prolongación del segmento QT.
- Hipernatremia, ocasionada por la sobrecarga oral, severa hipernatremia de 166 mmol/l.
Patogénesis
La sobrecarga de fosfato estimula la hormona paratiroidea (PTH) y reduce la síntesis de 1-25 (OH)2 D3. La fosfaturia se eleva de la primera a la segunda dosis de 4 a 8 veces. La hipercalciuria es debida a que la sobrecarga de sodio (Na) suprime la reabsorción de calcio en el túbulo proximal. En el asa de Henle, el líquido tubular sobresaturado en calcio y fósforo da lugar a la producción de un material sólido, probablemente apatita inmadura, que obstruye la luz; esta sustancia es internalizada por las células epiteliales dando lugar a una reacción inflamatoria y daño celular, que causará la fibrosis intersticial2.
Fósforo e hiperparatiroidismo secundario
Desde hace muchos años se sabe que las concentraciones plasmáticas de calcio y fósforo intervienen en el desarrollo del HPT secundario en la ERC. Posteriormente se descubrieron los mecanismos que lo desarrollan. Algunos trabajos muestran que las proteínas AUF1 y KSPR (K-homology splicing regulator protein) se unen al ARNm de la PTH estabilizándola en situaciones de depleción de calcio, cambios en la fosfatemia o en la ERC2.
Otro trabajo realizado con ratas muestra cómo se dividía a los animales en tres grupos, uno de ellos control: ratas sin daño renal y dieta normal, y otros dos grupos con ratas sometidas a nefrectomía 7/8. De ellos, en uno las ratas tomaban dieta pobre en fósforo y las del otro dieta rica en fósforo. Los animales son sacrificados, se extraen muestras de sangre y las glándulas paratiroides (GPT). Según los valores de PTH se dividen en tres grupos, con hiperparatiroidismo (HPT) normal, moderado y severo. Se estudia la expresión de genes en el material de las GPT. Las ratas con HPT severo presentaban GPT más grandes y P más elevado, calcio más bajo y peor función renal, junto con una marcada y generalizada disminución de la expresión génica. Sin embargo, algunos genes estuvieron sobreexpresados con las ciclinas B1 y B2 y algunos miembros de la familia de las Dual Specificity Phosphatases y TGF-beta 2. Los autores concluyen que la dieta rica en P es capaz de desarrollar un mayor grado de HPT secundario y en esta situación existen diferentes grados de expresión de los genes que intervienen en la hiperplasia y las apoptosis3.
Fósforo e inflamación
Las alteraciones del metabolismo mineral y la inflamación son factores que se han relacionado con el incremento del riesgo vascular y la mortalidad por esta causa en pacientes con ERC. En un trabajo de Navarro et al.4 los autores plantean analizar las posibles relaciones entre parámetros del metabolismo mineral, fundamentalmente el fósforo, y la inflamación a través de los marcadores de la proteína C reactiva (PCR), el factor de necrosis tisular alfa (TNF-α) y la interleucina-6 (IL-6).
Se estudió a 118 pacientes con ERC en estadio 3b-4, 68 varones y 61 años de media de edad, y se determinaron los valores de calcio, fósforo, producto calcio x fósforo y PTH. Resultados: la PCR se relacionó con el filtrado glomerular y el fósforo, pero no con el colesterol ni la PTH; la IL-6 se relacionó con el filtrado glomerular y el fósforo, pero no con el colesterol, la edad o el IMC. En el análisis de regresión múltiple se demostró que la concentración sérica de fósforo era un determinante independiente de los niveles de PCR (p <0,01) e IL-6 (p <0,05)4.
Fósforo e infección
La hiperfosfatemia es muy frecuente en pacientes en diálisis. La relación de la fosfatemia con la disfunción inmunitaria no se ha estudiado en profundidad. Los autores de este ensayo5 estudiaron una cohorte de 1.010 pacientes incidentes en diálisis entre 1995 y 1998 pertenecientes a 80 centros americanos. Se recogieron datos de cualquier tipo de infección, sepsis, infección respiratoria y osteomielitis a lo largo de todo el seguimiento. La fosfatemia >5,5 mg/dl se relacionó de forma significativa con la incidencia de todo tipo de infecciones, sepsis y osteomielitis, pero no se halló significación con la infección respiratoria. No se encontró relación con los valores de calcemia.
Fósforo y progresión de la ERC
En un trabajo realizado por Kusano et al.6, los autores pretenden discernir entre la sobrecarga proteica y la sobrecarga de fósforo, para ver cuál de los dos factores tiene más peso en el desarrollo de la progresión de la ERC. El estudio se realizó con ratas y dividió a los animales en siete grupos, uno de ellos el grupo control, y el resto de los animales fueron sometidos a nefrectomía unilateral e inyección de un anticuerpo monoclonal que les produjo una nefropatía que remeda la glomerulonefritis (GN) por inmunoglobulina A (IgA). A su vez, los seis grupos se dividieron en dos, tres grupos tomaron una dieta normal en fósforo y los otros tres una dieta pobre en fósforo, pero tanto unos como los otros también tomaron unos porcentajes del 16,9, 12,6 u 8,4% de proteínas en lo que los autores denominan dieta normal, pobre y muy pobre en proteínas.
La restricción de fósforo fue más eficaz para evitar la progresión que la dieta con restricción proteica6.
Otros estudios se diseñan para valorar los diferentes factores predictores de la evolución y progresión de la ERC. Quizá uno de los más representativos es el que realizaron Levin et al.7 Se trata de un estudio retrospectivo de una cohorte de 4.231 pacientes con TFGe <30 ml/min y una media de edad de 61 años, reclutados entre enero del 2000 y 2004. Se consideraron variables demográficas la edad, el sexo, la raza; patologías asociadas la HTA, la DM y la existencia de proteinuria; datos analíticos como la hemoglobina, el calcio, el fósforo, la PTH; tratamientos farmacológicos con IECA, ARA II, eritropoyetina o vitamina D. El estudio concluyó que el fósforo fue un factor de riesgo tanto para el declinar de la función renal como para la muerte7.
Fósforo y corazón
En 1984 se inició el Coronary Artery Risk Development in Young Adults8, conocido como estudio CARDIA. Se trata de un estudio prospectivo realizado sobre una cohorte de 5.116 individuos blancos y negros, hombres y mujeres, de 18 a 30 años y sanos. El seguimiento fue de 15 años con el objetivo de investigar si el estilo de vida, aspectos psicosociales y otros factores influyen favorable o desfavorablemente en la evolución de los factores de riesgo de la enfermedad coronaria. En más de la mitad de los participantes se midió la calcificación arterial coronaria (CAC) por técnicas de imagen. A todos ellos se les realizaron mediciones antropométricas y analítica en sangre y orina. Foley9 realizó un subanálisis de este estudio para investigar si existe asociación entre el nivel de fósforo y la calcificación coronaria. Al término del estudio se demostró una relación directa y significativa entre los niveles plasmáticos de fósforo y la calcificación de las arterias coronarias.
Otro estudio, el Dallas Heart Study10 realizado sobre 2.672 individuos con una media de edad de 45 años, permitió valorar factores de riesgo de calcificación vascular en los 220 pacientes que presentaban ERC. La calcificación vascular se midió mediante puntuaciones (scores) que podrían ser superiores o inferiores a 100. La prevalencia de la calcificación coronaria se incrementó significativamente a lo largo de las fases de la ERC. La asociación entre la ERC y la calcificación coronaria fue independiente de los factores de riesgo clásicos, pero desapareció al ajustar por el producto Ca x P, la homocisteína y la osteoprotegerina, mostrando de nuevo la relación entre la calcificación vascular y el metabolismo mineral.
Otro ensayo11 fue realizado en 85 pacientes con DM y nefropatía, ninguno de los cuales había requerido diálisis ni angioplastia o derivación coronaria. La calcificación coronaria se midió por tomografía computarizada con multidetector (TCMD), y se encontró una relación directa entre la calcificación coronaria, el fosfato, la osteoprotegerina, la presión arterial sistólica (PAS) y la edad.
Fósforo y mortalidad cardiovascular
El estudio ARIC12 es un gran estudio del que se han obtenido muy variados datos, además de los objetivos para los que se diseñó. Se comenzó en 1986, terminando el reclutamiento en 1989, y se consiguieron un total de 15.792 participantes de edades comprendidas entre 45 y 64 años, pertenecientes a diversas comunidades de EE.UU. Al inicio no debían padecer enfermedad cardiaca y su TFG debía ser >15 ml/min. Se realizaron analíticas de sangre para valorar lípidos, glucemia, hemograma TFGe por MDRD y hábitos tóxicos como el tabaco, el IMC, cifras de PA, actividad física, etc. En el año 2000 se llevó a cabo el estudio de resultados del que se extrajo un subanálisis en el que, ajustando por todas las demás variables, el fósforo se asoció con enfermedad coronaria; ictus o muerte con una ratio de 1,03 (0,89-1,08); 1,11 (1,02-1,21 p = 0,02); 1,14 (1,09-1,20, p <0,0001) respectivamente.
El Dialysis Outcomes and Practice Patterns Study (DOPPS)13 fue un estudio prospectivo de 25.588 pacientes con ERC en HD con más de 180 días de tratamiento sustitutivo. Hay tres fases en este estudio, 1996-2001 para DOPPS I; 2002-2004 para DOPPS II y 2005-2007 para DOPPS III. El objetivo era estudiar todas las causas de muerte así como la muerte, por causa cardiovascular. En la más reciente fase del DOPPS, el más bajo riesgo de mortalidad correspondió a valores de calcemia entre 8,6 y 10 mg/dl, fosfatemia entre 3,6 y 5 mg/dl y PTH entre 101 y 300 pg/dl, siendo el mayor riesgo de muerte para calcio >10 mg/dl; fósforo >7 mg/dl y PTH >600 pg/dl13.
Otro estudio14 se llevó a cabo con un cohorte de 22.937 incidentes en diálisis de julio de 2000 a julio de 2002, con 2 años de seguimiento. El objetivo fue doble:
- Ver cuántos pacientes tenían unas determinadas variables: calcio, fósforo y PTH dentro del rango aceptado.
- Cómo influía esto en la mortalidad.
Resultados: ninguna variable en rango: riesgo 51%; una variable en rango: riesgo del 35 al 39%; dos variables en rango: riesgo del 15 al 21 %. El mantenimiento del P en rango disminuía el riesgo en un 38%.
Fósforo y mortalidad global
La ERC es un poderoso factor de riesgo de mortalidad por cualquier causa y fundamentalmente para la mortalidad de causa cardiovascular. En un artículo de revisión15 se realizó una búsqueda sistemática en Medline, EMBASE y Cochrane de todos aquellos estudios publicados entre enero de 1980 y diciembre de 2007. Se incluyeron 35 estudios; en 29 se investigaba la mortalidad por cualquier causa, en 11 se describía el riesgo cardiovascular, pero sólo se detallan los episodios cardiovasculares (ECV) en 4 de ellos. Los trastornos del metabolismo mineral produjeron un aumento de la mortalidad ya fuera cardiovascular o por otra causa. El mayor riesgo fue debido al fósforo, seguido por el calcio y la PTH.
Las alteraciones del metabolismo mineral en el contexto de la ERC aumentan significativamente el riesgo cardiovascular, pero también hay un incremento del riesgo en pacientes malnutridos con valores de albúmina bajos. Para discernir entre las dos causas de riesgo se estudió a 1.007 pacientes en diálisis16 que habían comenzado el tratamiento de sustitución entre enero de 1990 y diciembre de 2004. El valor del fósforo, el calcio y la albúmina se midió entre el tercero y el sexto mes tras el comienzo de la diálisis y se comparó con la supervivencia. Resultados: el 18% de los pacientes tenían p >5,5 mg/dl y la supervivencia a los 5 años fue del 48,4% frente a los que tenían p <5,5 mg/dl, cuya supervivencia fue del 58,6%. En cuanto a la albúmina, el 34,9% tenían albúmina <35 g/l y la mortalidad era significativamente más alta. Los pacientes que combinaban calcio, fósforo y albúmina normales tenían una supervivencia del 62,5% frente al 30,7% de los que no tenían ninguno de los tres valores en rango.
Fósforo y calcificación vascular
La calcificación vascular no es una patología nueva. Mediante TAC se ha descubierto que el llamado «hombre las nieves», al que se atribuyen más de 5.000 años de antigüedad, tenía calcificación vascular. Alfrey et al.22 demostraron hace casi 30 años que los pacientes con ERC tenían mayor calcificación vascular que los individuos de la misma edad y sexo.
Teniendo esto en cuenta, ¿cuál es la razón del gran interés por la calcificación vascular que ha aparecido entre los nefrólogos en los últimos años?
- La consistente relación entre calcificación vascular y riesgo de morbimortalidad cardiovascular.
- La capacidad demostrada de conversión de las células de músculo liso vascular (CMLV) en condrocitos y osteoblastos-like.
- El conocimiento de que hay proteínas clave en el desarrollo de esta calcificación vascular.
- Una demostrada relación entre ERC y enfermedad ósea y vascular.
Sabemos ahora que el arduo empeño en tratar la osteodistrofia nos ha llevado en muchas ocasiones a acelerar la calcificación vascular.
La calcificación vascular requiere de dos fenómenos. Uno de ellos es la transformación fenotípica de las CMLV en condrocitos u osteoblastos-like, que podría considerarse como osificación, y el otro es un fenómeno fisicoquímico, el depósito de calcio y fósforo, muy pH dependiente, cuyo desarrollo no requiere siquiera de la presencia celular. Durante mucho tiempo se ha considerado que la concentración de calcio y fósforo conocida por el concepto «producto calcio-fósforo» era predictiva de mineralización extraesquelética en pacientes con ERC y daba seguridad a los médicos cuando este producto estaba en rango normal. Sin embargo, esto no es completamente cierto porque el riesgo asociado a un determinado producto calcio-fósforo depende, además, de la existencia de enfermedad arterial previa y de los factores que actúan inhibiendo o favoreciendo la mineralización. Estudios realizados con animales de experimentación han permitido completar los estudios clínicos en pacientes. Los modelos animales se clasifican en cinco grupos:
- Hiperfosfatémicos con ERC y dieta rica en fósforo o déficit de FGF y klotho.
- Hipercalcémicos por altas dosis de vitamina D.
- Aterosclerosis, por falta del receptor de Apo E y LDL.
- Alteraciones del remodelado óseo por falta de osteoprotegerina.
- Déficit de inhibidores de la mineralización como la proteína de matriz Gla.
Lo más interesante es que, en estos modelos animales, la calcificación puede prevenirse o reducirse con los tratamientos médicos actuales. Además, estos estudios muestran una robusta evidencia de que las sobrecargas de fósforo y calcio son claves en el defecto del remodelado óseo que dará lugar a la calcificación vascular, confirmando un nexo de unión entre ambos fenómenos.
Sin embargo, no todos los pacientes en diálisis o con ERC desarrollan calcificación vascular, lo que indica que existen factores protectores en su pared vascular o en su torrente circulatorio. En este último uno de los más importantes factores es la fetuín A, que actúa como un aspirador de moléculas de calcio y fósforo en el plasma. La concentración de fetuín A disminuye con la inflamación. Los bajos niveles de fetuín A en pacientes en diálisis se asocian con calcificación vascular y valvular y muerte. Otros factores, en este caso locales, son la proteína de matriz Gla, el pirofosfato y la osteopontina, aunque es posible que la pared vascular contenga además otros mediadores, e incluso que su concentración varíe en las diferentes localizaciones anatómicas.
En una situación normal, la célula madre mesenquimal dará lugar al adipocito y a la CMLV, además y a través de factores de expresión génica RUNX2 y MSX2 dará lugar al osteoblasto/condrocito. En situaciones de ERC, DM, inflamación, pacientes ancianos y en presencia de determinadas toxinas, el osteoblasto/condrocito también puede desarrollarse desde las CMLV dirigidas por los factores de expresión génica RUNX2 y MSX2. El fósforo actúa en este escenario de dos formas:
- Penetrando en la CMLV a través de un canal dependiente de Na y activando y desactivando genes hasta conseguir un cambio del fenotipo de la célula, que pasará de ser una CMLV a un osteoblasto/condrocito.
- Junto con el calcio, mineralizará el tejido osteoide formado, dando lugar a la calcificación vascular.
En los pacientes con ERC, ya sea con bajo o alto remodelado óseo, los niveles de calcio y fósforo pueden estar elevados. En el primer caso, porque el hueso no acepta los minerales y en el segundo, por aumento de la liberación de éstos.
Hay una robusta evidencia epidemiológica de que el fosfato sérico es un factor de riesgo independiente de morbimortalidad cardiovascular. El grupo de Hruska17, en St. Louis, desarrolló un modelo de ratas con deficiencia del receptor LDL a las que alimentan con una dieta rica en grasa. Los animales desarrollaron obesidad, dislipemia, DM e HTA, lo que en humanos se conoce como síndrome metabólico. Asu vez, se observó aterosclerosis con placas de calcificación localizadas en la neoíntima de las arterias y en las válvulas cardiacas de los animales. Sus CMLV expresaban las proteínas morfogénicas de hueso BPM-2 y BPM-4 y los factores de trascripción Runx2, Msx2, osteocalcina y osteopontina, proteínas que muestran la diferenciación celular de CMLV a osteoblastos. A pesar de ello, la calcificación vascular era baja. Posteriormente estas ratas fueron sometidas a ablación renal parcial, con lo que desarrollaron ERC e hiperfosfatemia, lo que produjo un aumento varias veces superior del factor de trascripción osterix, y esto multiplicó la calcificación por dos a cuatro veces.
Un segundo modelo de estudio18 consistió en CMLV de anillos de aorta humanos con placas de aterosclerosis, cultivados en medios habituales. Las células expresaban BPM-2, BMP-4, Runx2, Msx2 y osteocalcina. Cuando se incrementaba el fósforo en el medio de cultivo hasta un valor equiparable a una concentración plasmática de 6-9 mg/dl, aumentaba varias veces la expresión de osterix y esto promovía la mineralización de la matriz celular. Cuando se reducía la concentración de fósforo en sangre en los animales mediante quelantes o se bloqueaba la acción de fósforo en el medio de cultivo, se inhibía la mineralización de la matriz en la pared vascular.
Por todo esto, el fósforo es más que un estimulador de la calcificación vascular; actuando mediante una elevación del producto calcio x fósforo en la ERC y la IRC, es una molécula señal que sirve para completar la diferenciación de la CMLV a osteoblasto y para calcificar las lesiones ateromatosas a través del estímulo de factores como osterix.
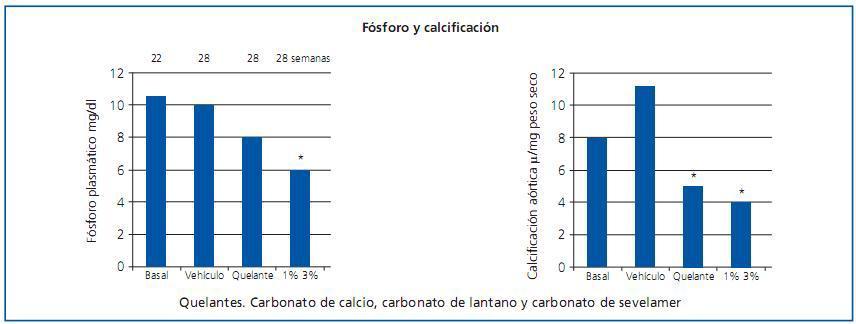
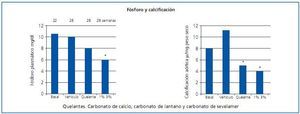
En las gráficas pueden verse los resultados del modelo 1 (figura 1). Ratas con deficiencia del receptor LDL alimentadas con dieta rica en grasas y con posterior ablación renal para desarrollar ERC e IRC. A las 22 semanas, las ratas presentaban unos valores de fósforo plasmático de 10 mg/ml. Se distribuyeron en tres grupos, unas tratadas con placebo, otras con quelantes del fósforo al 1 y 3% durante 6 semanas. Se utilizaron tres tipos de quelantes: carbonato de calcio, carbonato de lantano y carbonato de sevelamer. La fosfatemia descendió en los animales tratados con quelantes. De la misma manera, la calcificación de la aorta se redujo en los animales tratados, aunque esta reducción sólo resultó significativa en los animales que consiguieron un descenso del fósforo por debajo de 6 mg/dl.
Fósforo e inhibidores de la calcificación vascular
El pirofosfato (Ppi) es un inhibidor bien establecido de la calcificación en el cartílago, de la cristalización del oxalato de calcio en el riñón y de la calcificación vascular en ratas intoxicadas con vitamina D. Es un potente inhibidor de la hidroxiapatita, y mínimas concentraciones en plasma de pirofosfato son suficientes para inhibir la cristalización de soluciones sobresaturadas de fosfato y calcio. La fosfatasa alcalina no específica de tejido (FANT) es la llave que determina la concentración de Ppi, ya que hidroliza y, por ende, destruye la molécula. En ratas, a las que se les produce ERC e IRC mediante dieta rica en adenina o nefrectomía 5/6, se objetiva un aumento del 92% de la actividad de la FANT en cultivo de aortas de dichos animales. La eliminación de la adventicia y del endotelio de dichos vasos no modificó la actividad de la FANT, demostrando que las productoras de la FANT eran las CMLV. El aumento de la FANT podría ser regulado en parte disminuyendo su degradación. Entre los factores candidatos para ello se incluyen la hiperfosfatemia y el HPT secundario. Éste es otro mecanismo que se postula mediante el cual la hiperfosfatemia conduce a la calcificación vascular.
Formas de calcificación vascular
Se ha aceptado hasta ahora que la calcificación vascular tiene dos formas de presentación: aterosclerosis y esclerosis de Mönckeberg.
Aterosclerosis
La forma más trabajada de describir la aterosclerosis ha sido elaborada por el Comité de Lesiones Vasculares del Consejo de Arteriosclerosis de la Asociación Americana del Corazón. Se ha dividido en VI fases.
- Fase I: lesiones que contienen suficiente cantidad de lipoproteínas aterogénicas como para atraer macrófagos, que tras fagocitarlas se transforman en células espumosas.
- Fase II: aparición de láminas de células espumosas que se colocan entre la íntima y la capa de CMLV, en principio, sin romper la elástica interna, incluyendo lesiones conocidas como estrías grasas.
- Fase III: gotas de lípidos y partículas localizados a nivel extracelular y disrupción de la elástica interna.
- Fase IV: confluencia de lípidos formando un «núcleo». Disrupción mayor.
- Fase V: «núcleo» lipídico al que se le añade tejido fibroso. Dentro de esta fase V pueden desarrollarse calcificaciones y ésta se considera fase Vb, o no, en cuyo caso se denomina fase Vc.
- Fase VI: cuando la placa se fisura y aparecen hematoma y trombos.
Esclerosis de Mönckeberg
La esclerosis de Mönckeberg se caracteriza por una calcificación de la capa media de las arterias formada por CMLV. El hecho de que afectara o no a la lámina elástica interna ha sido motivo de controversia no del todo resuelta. Afecta a arterias musculares y los factores de riesgo para su aparición son: edad, DM, ERC y osteoporosis. No hay signos inflamatorios. Durante mucho tiempo se consideró una entidad benigna, sin repercusión patológica, pero actualmente se sabe que da lugar a una disminución de la compliance arterial, incremento de la presión del pulso, HVI, alteración de la perfusión coronaria y enfermedad vascular periférica.
A pesar de la aparente clara diferencia entre ambos tipos de lesiones vasculares, en el último año se ha creado una importante controversia entre los grupos que opinan que ambas lesiones son diferentes y los que defienden que son iguales, pero quizá valoradas en diferentes fases de su evolución. Esta última es la opinión de McCullough, quien sorprendió con esta comunicación personal en una reunión de expertos en 2007. En su revisión explica que las lesiones vasculares en que aparece una placa calcificada y que son denominadas esclerosis de Mönckeberg, podrían ser placas de ateromas calcificados19.
Según McCullough, Mönckeberg describe los hallazgos patológicos observados al microscopio óptico de 130 casos20, sin especificar morbilidad acompañante: 57 sin aparente enfermedad vascular; 43 con calcificación medial; 18 con aterosclerosis sin calcificación medial; 12 con aterosclerosis y calcificación medial. Tenían calcificación medial 55 casos, y Mönckeberg los describe así: a) estadio 1: placa elástica amarilla; b) estadio 2: placa de ateroma, y c) estadio 3: aparición de úlcera y trombos. Por tanto, se podría concluir que la descripción original de Mönckeberg no era otra cosa que las fases de la placa aterosclerótica.
En 1912 Faber23 publicó que la calcificación de las arterias coronarias es de etiología ateromatosa en origen y no esclerosis de Mönckeberg.
En 1965 Eggen24 publicó los hallazgos de una serie de 1.242 necropsias, el 73% de las cuales tienen menos de 60 años, más del 95% de las lesiones ateroscleróticas coronarias están calcificadas, y menos del 5% tienen estenosis significativas.
En una búsqueda sistemática en Medline con el término «esclerosis de Mönckeberg» en el título, de todo lo publicado entre 1957 y 2008, se encontraron 15 citaciones, algunos casos comunicaciones (reports) y otras series de casos. Muchos de los casos llamados esclerosis de Mönckeberg describían halazgos de calcifilaxis, y en otros no se buscaron o evaluaron hallazgos típicos de ateromatosis.
Sanahan27, en 1999, encontró hallazgos de ateromatosis intimal en cortes de la pared de arterias con calcificación medial.
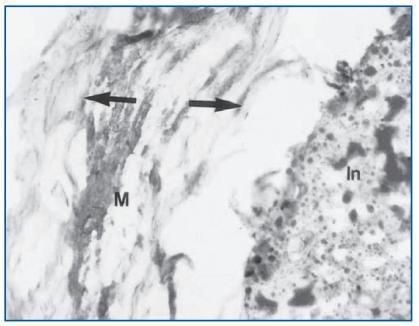
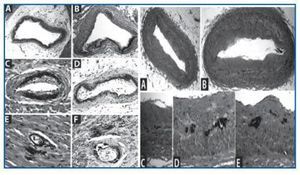
Asimismo, el McCullough25 presenta arterias en las que pueden verse calcificaciones mediales con signos inequívocos de ateromatosis y afectación neointimal (figura 2).
Amann21 apuesta por dos entidades diferentes, pero explica las razones que, en su opinión, han llevado a otros grupos a pensar que es una única patología.
A favor de dos entidades diferentes:
«La calcificación vascular en la ERC se divide morfológica y clínicamente en intimal (placa calcificada) o medial, ambas asociadas con aumento de morbimortalidad cardiovascular. Habitualmente indistinguibles a través del MO».
Los pacientes con ERC tienen lesiones ateromatosas muy evolucionadas, por tanto muy calcificadas, que afectan a gran parte de la pared vascular y son difíciles de diferenciar con técnicas de imagen.
Las lesiones varían con el tipo de arteria, coronaria frente a periférica, o la localización, distal frente a proximal, pero pueden coexistir en el mismo paciente.
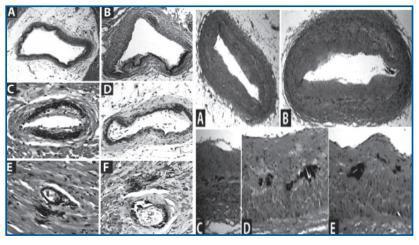
Se han encontrado arterias con calcificación de la media sin ninguna lesión ateromatosa (figura 3).
Al margen de estas disquisiciones, la controversia puede llevarse a cuatro niveles:
- Conceptual: ¿existe esclerosis de Mönckeberg?
- Morfológica: ¿dos lesiones diferentes?
- Clínica: ¿tienen la misma repercusión clínica?
- Terapéutica: ¿tienen el mismo tratamiento?
La repercusión médica implica fundamentalmente a la clínica y el tratamiento:
- Clínica: en la aterosclerosis, la calcificación de la íntima parece contribuir a la vulnerabilidad de la placa, posiblemente a través de la incapacidad para la vasoconstricción de las porciones de arteria calcificada, frente a la posibilidad de vasoconstricción de la pared sana, lo que produciría un estiramiento de la zona intermedia con probabilidad de rotura. Por otro lado, la calcificación de la media contribuye a la rigidez, al aumento de la PP, de la velocidad de la onda del pulso, la HTA, la HVI y a la disminución de la perfusión miocárdica. London et al.26 encuentran mayor riesgo de mortalidad en pacientes en diálisis con calcificación de la íntima que en aquellos con calcificación de la media, pero es muy difícil diferenciar con técnicas de imagen la localización de dicha calcificación en la pared vascular.
- Tratamiento: las estatinas han mostrado en varios estudios aleatorizados, frente a placebo, que no pueden disminuir la evolución de la calcificación vascular medida en aorta, que fue del 25% anual, pero sí se pudo reducir el riesgo cardiovascular, probablemente por estabilización de la placa.
Sin embargo, parece existir un tratamiento para atenuar la calcificación vascular, actuando sobre las alteraciones del metabolismo mineral. En el estudio Treat to Goal28 con 200 pacientes en diálisis, asignados a sevelamer frente a acetato o carbonato de calcio, la CAC disminuyó con sevelamer pero no el calcio, el fósforo o la PTH en plasma. Sin embargo, se redujo el col-LDL, haciendo suponer que ésta fue la causa de la disminución de la CAC. El estudio RIND, de similar diseño, mostró mayor mortalidad en los pacientes con quelantes de calcio que con sevelamer y mayor tasa de CAC. El estudio CARE-2 asignó 203 pacientes a recibir sevelamer o acetato de calcio más atorvastatina para conseguir los mismos valores de col-LDL. No hubo diferencias en la CAC.
CONCLUSIONES
- La sobrecarga oral de fósforo produce daño renal agudo.
- El fósforo está implicado en la progresión de la ERC.
- El fósforo está implicado en un aumento de la inflamación y la infección en pacientes en diálisis y ERC.
- El fósforo está implicado en un aumento de la mortalidad global y de la morbimortalidad cardiovascular.
- El fósforo está implicado en la calcificación vascular en varios niveles.
- Existe controversia en cuanto a la consideración de aterosclerosis y esclerosis de Mönckeberg como una única patología o dos cuadros diferentes.
Figura 1.
Figura 2.
Figura 3.