Definición: La definición de anemia más extendida es la establecida por la Organización Mundial de la Salud y que posteriormente fue adoptada por la Sociedad Americana de Trasplantes, que define como anemia la concentración de hemoglobina <12 g/dl en mujeres y <13 g/dl en varones. Prevalencia de anemia postrasplante: Varía a lo largo del período postrasplante y se asocia con el grado de función del injerto renal. La relación entre niveles de hemoglobina y filtrado glomerular no se comporta de la misma manera que en la población con enfermedad renal crónica (ERC). Los resultados de los diversos estudios muestran una prevalencia elevada en los primeros meses postrasplante (<6 meses), que disminuye a partir del año postrasplante y posteriormente se incrementa relacionándose con la pérdida de función del injerto. El estudio europeo sobre manejo de la anemia mostró una prevalencia de anemia del 38,6%, y sólo el 18% de los pacientes con anemia grave estaban en tratamiento con eritropoyetina (EPO). Fisiopatología: Se produce una disminución de la síntesis de EPO o un incremento en la resistencia a la EPO. Existen múltiples factores que pueden causar anemia postrasplante. Algunos de estos factores son únicos de los pacientes trasplantados y otros son comunes a otros pacientes con ERC. Entre los factores comunes se encuentran: el grado de función renal y el déficit de hierro, y entre los factores propios del trasplante están el rechazo agudo, la medicación postrasplante, infecciones y neoplasias. Resultados clínicos: Los datos disponibles que evalúan la asociación de anemia con la morbimortalidad del paciente y la supervivencia del injerto son escasos. La mayoría de los estudios son retrospectivos y analizan experiencias de centros aislados. En ellos se demuestra una mayor mortalidad y morbilidad entre los pacientes con una hemoglobina <11 g/dl (evidencia B). Tratamiento de la anemia postrasplante: - Agentes estimulantes de la eritropoyesis (AEE) y reposición de los depósitos férricos (evidencia A). - Respuesta al tratamiento: en los pacientes trasplantados puede existir cierta resistencia al tratamiento con AEE debido al uso de medicación mielosupresora, inflamación crónica y otros factores. - Efectos adversos del tratamiento con AEE: existen pocos estudios no controlados al respecto que muestran que los AEE son eficaces y probablemente no aceleran el deterioro de función renal, pero pueden agravar la hipertensión arterial.
Definition: The definition of anemia is established by the World Health Organization and was subsequently adopted by the American Society of Transplantation, which defines anemia as hemoglobin concentration <12 g/dl in women and <13 g/dl in men. Prevalence of anemia posttransplantation: Varies throughout the posttransplantation period and is associated with the degree of renal graft function. The relationship between hemoglobin levels and glomerular filtration does not behave the same way as in the population with chronic kidney disease. The results of various studies show a high prevalence in the first months after transplantation (<6 months), which decreases from the first year posttransplantation and then increases related to loss of graft function. European study on the management of anemia showed a prevalence of anemia in 38.6% and only 18% of patients with severe anemia were treated with erythropoietin (EPO). Pathophysiology: There is a decrease in the synthesis of erythropoietin (EPO) or an increase in resistance to EPO. There are many factors that can cause anemia post-transplantation. Some of these factors are specific to transplanted patients whilst others are common to all patients with chronic kidney disease. Among the common factors there are: the degree of renal function and iron deficiency and among the factors of transplantation there are acute rejection, post-transplantation medications, infections and malignancies. Clinical Results: The available data evaluating the association of anemia with morbidity and mortality of the patient and graft survival are scarce. Most studies are retrospective and analyze experiences of individual centers. They showed a higher mortality and morbidity among patients with a hemoglobin <11 g/dl. (Evidence B) Treatment of post-transplantation anemia: - Erythropoiesis-stimulating agents (ESA) and replenishment of iron deposits (Evidence A) - Response to treatment: In transplant patients there may be some resistance to treatment with erythropoiesis- stimulating agents (ESA) due to the use of myelosuppressive medications, chronic inflammation and other factors. - Adverse effects of treatment with ESA: There are few controlled studies failed to show respect to the ESA that are effective and unlikely to accelerate the deterioration of renal function but may aggravate hypertension.
INTRODUCCIÓN
El tratamiento de la anemia es clave dentro de los cuidados de los pacientes trasplantados con insuficiencia renal crónica. La anemia podría comportarse como un factor de riesgo cardiovascular en los pacientes trasplantados, ya que se asocia con mortalidad, riesgo cardiovascular en los pacientes diabéticos trasplantados, hipertrofia ventricular izquierda e insuficiencia cardiaca congestiva, lo cual es preocupante porque los eventos cardiovasculares son la principal causa de muerte en esta población1.
Los estudios sobre prevalencia y relevancia clínica de la anemia postrasplante han empezado a desarrollarse en los últimos años, pues hasta entonces a aquellos pacientes con injerto renal se les consideraban similares a los pacientes con insuficiencia renal crónica (no en diálisis) y se extrapolaba la evidencia disponible en estos pacientes a los pacientes con injerto renal. Sin embargo, existen varias razones que hacen que dicha extrapolación no sea equiparable: la presencia de medicación inmunosupresora y otros fármacos relacionados con el trasplante, la existencia de un estado inflamatorio alterado provocado por un sistema inmune alerta ante la presencia de aloantígenos y, por último, la exposición previa al tratamiento con diálisis en la mayoría de los pacientes trasplantados. Estos factores pueden inducir por sí mismos anemia postrasplante a través de diversos mecanismos, uno de ellos el de resistencia a la eritropoyetina, por lo que parece esencial establecer evidencias directamente de la población trasplantada renal2.
El riesgo de desarrollar anemia aparece en los primeros meses postrasplante y posteriormente a largo plazo, asociado con la pérdida de función renal. Por tanto, en la evaluación de la anemia es importante distinguir entre anemia precoz o tardía, ya que nos permite identificar posibles causas etiológicas. La anemia postrasplante precoz se refiere a aquella que aparece relativamente pronto en el postrasplante (antes de los seis meses) e incluye factores tales como pérdidas sanguíneas relacionadas con la cirugía, retraso en la función del injerto, déficit de hierro, infecciones, rechazo, etc. La anemia postrasplante tardía se asocia con deterioro de la función renal en el contexto de nefropatía crónica del injerto3.
EPIDEMIOLOGÍA DE LA ANEMIA POSTRASPLANTE
Los datos sobre prevalencia de la anemia en el período postrasplante varían en función de la definición de anemia que se use. La más extendida en la mayoría de los estudios es la definición establecida en 1964 por la Organización Mundial de la Salud y que posteriormente fue adoptada por la Sociedad Americana de Trasplantes en 2001, que define como anemia la concentración de hemoglobina <12 g/dl en mujeres y <13 g/dl en varones. Otras definiciones empleadas en los estudios se basan en las recomendaciones de las guías KDOQI y de las guías de buena práctica clínica europeas, que utilizan el punto de corte de Hb <11g/dl (Htco <33%) como indicación de inicio de tratamiento con AEE.
La evidencia disponible permite concluir que la anemia en la población trasplantada es una condición frecuente, común e infratratada. Yorgin et al.4 estudiaron en dos centros americanos a 128 pacientes trasplantados en 1995 y los siguieron durante cinco años. En el momento del trasplante, el 43% estaba anémico, con un hematocrito <33%; al año del trasplante, la prevalencia de anemia disminuyó al 12%, mientras que a los cinco años volvió a incrementarse de nuevo, llegando al 26%. Posteriormente, Winkelmayer et al.5 confirmaron estos datos en una población americana de 374 trasplantes, de los cuales el 29% tenía un hematocrito <33%. En Europa, en cuatro estudios diferentes, donde se aplica en todos la definición de anemia de la OMS, la prevalencia oscila entre el 39 y el 46%3,6,7.
En un estudio realizado en Canadá por Karthikeyan et al. sobre la prevalencia de ERC, según los estadios de las guías K/DOQUI y las complicaciones derivadas de la pérdida de función renal en una cohorte de pacientes trasplantados de riñón, vieron que la prevalencia de anemia (Hb <11 g/dl) se incrementaba desde un 0% en el estadio 1 hasta un 33% en el estadio 5 de ERC8.
En España, en un estudio multicéntrico realizado recientemente, se evidenció que el 8% de los pacientes presentaban anemia definida como Hb <11 g/dl, el 44,2% presentaba niveles de ferritina <100 ng/ml y sólo el 16% estaba en tratamiento con AEE. El grado de anemia empeoraba a medida que lo hacía la función renal9.
CAUSAS
Existen múltiples causas asociadas a la anemia postrasplante que nos permiten diferenciar entre anemia precoz y tardía. Algunos de los factores implicados son: deterioro de la función renal, supresión de la médula ósea, pérdidas sanguíneas, anemia hemolítica autoinmune, estado inflamatorio crónico, uso de IECA-ARA II, hiperparatiroidismo, infecciones virales, déficit de hierro y edad del donante2,10,11. Haremos una revisión de todos los factores, aunque se sabe que la anemia asociada a pérdida de la función del injerto es la anemia tardía.
La restauración de la secreción endógena de eritropoyetina y el impacto que tiene sobre la resolución de la anemia tras el trasplante se ha estudiado en diversos estudios. En los primeros días postrasplante se produce un pico inicial en los niveles de eritropoyetina que no se acompaña de una respuesta eritropoyética eficaz. La recuperación de la función renal conlleva la normalización de los niveles de eritropoyetina sérica y la normalización de las cifras de hemoglobina que tiene lugar entre el sexto y doceavo mes postrasplante12.
Los fármacos inmunosupresores contribuyen al desarrollo de anemia a través de varios mecanismos. Los antiproliferativos (azatioprina y micofenolato mofetil) provocan anemia por supresión directa de la médula ósea, aunque la azatioprina también puede producir anemia macrocítica13. La asociación de estos fármacos con la anemia postrasplante se ha demostrado en la mayoría de los estudios. Otros inmunosupresores que producen toxicidad directa sobre la médula ósea son el OKT3 y la globulina antitimocítica, usados en el tratamiento de inducción o en el tratamiento del rechazo agudo. De los inhibidores de la calcineurina, tanto ciclosporina como tacrolimus, pueden causar anemia. Sin embargo, tacrolimus es el que más se asocia con anemia5. Pueden causar anemia hemolítica, aunque estos hallazgos es improbable que aparezcan en la fase de mantenimiento y sí pueden aparecer en los primeros meses postrasplante14. En estadios tardíos, la anemia por inhibidores de la calcineurina se asocia con nefrotoxicidad. En el caso de los inhibidores de la rapamicina, sirolimus se asocia a anemia porque disminuye la producción de eritropoyetina e interfiere en la utilización del hierro, provocando que los niveles de hierro sérico no aumenten a pesar de los suplementos orales15.
Además de los inmunosupresores, otros fármacos que pueden asociarse a la anemia son los inhibidores del sistema reninaangiotensina aldosterona. El eje renina-angiotensina-aldosterona es un importante regulador de la eritropoyesis. Se ha visto que aquellos pacientes que están con IECA o ARA II tienen más posibilidades de desarrollar anemia que aquellos que no los toman, y este efecto es independiente de la función del injerto16. Otros medicamentos usados en el período postrasplante y que pueden producir anemia son antibióticos o antivirales como el trimetoprim-sulfametoxazol y el ganciclovir o valganciclovir. El estado inflamatorio crónico y el rechazo parece que actúan a nivel molecular, reduciendo la expresión de genes implicados en el proceso de la eritropoyesis, lo cual conduce a un estado de resistencia a la eritropoyetina y a anemia17. Aquellos pacientes que presentan uno o varios episodios de rechazo o que han recibido un segundo o tercer injerto renal tienen niveles de hemoglobina menores que aquellos que no tienen episodios de rechazo o son receptores de un primer injerto, según el estudio multicéntrico desarrollado en Europa por Varenterghem et al.6 Sin embargo, en estos pacientes son varios los factores que pueden tener un papel etiopatogénico, además del estado inflamatorio crónico, como son: una función renal subóptima, el tratamiento inmunosupresor más intenso para controlar el rechazo o el uso más frecuente de IECA o ARA II para el control de la tensión arterial, ya que estos pacientes tienen más posibilidades de tener cifras elevadas de ésta.
La edad del donante es otro factor de riesgo para la anemia. En los donantes mayores de 60 años, la presencia de anemia está significativamente elevada. En el futuro, esto puede tener implicaciones clínicas importantes, ya que la edad de los donantes se está incrementando progresivamente6.
La causa más importante de anemia postrasplante es la pérdida de función renal del injerto. La capacidad endocrina del riñón se relaciona con su función excretora medida a través del aclaramiento de creatinina. Todos los estudios demuestran esta asociación. Así, en el estudio de Mix et al.18 se demuestra que a partir del año postrasplante la proporción de pacientes con anemia aumenta progresivamente a medida que se deteriora la función renal. Y en el estudio realizado por Chadban et al.19, en el que comparan la prevalencia de anemia entre pacientes trasplantados de riñón y población general con un grado de función renal similar, se demuestra que en ambos grupos el CrCl se relaciona directamente con la concentración de hemoglobina. Sin embargo, la probabilidad de presentar anemia en el grupo de pacientes trasplantados es 10 veces mayor que en la población general.
Las infecciones recientes y los eventos clínicos se asocian con una mayor probabilidad de tener anemia. Por el contrario, la infección por los virus de la hepatitis B o C no se ha demostrado que tenga un mayor impacto en la anemia. Mix et al. encontraron asociación entre la serología para citomegalovirus D+/R- con la posibilidad de desarrollar anemia moderada. Este grupo de pacientes (D+/R-) tiene un alto riesgo de desarrollar infección por CMV, y tanto la propia infección como el tratamiento profiláctico frente a la infección por CMV se ha visto que tiene efectos supresores de la médula ósea que pueden explicar esta asociación con la anemia18.
Otro hecho importante a destacar en el desarrollo de anemia es el déficit de hierro.
CONSECUENCIAS DE LA ANEMIA POSTRASPLANTE
Desde el punto de vista clínico, hay que ser capaz de responder si la anemia en los pacientes trasplantados con deterioro de la función renal se asocia con resultados perjudiciales en esta población, sobre todo porque disponemos de medicación, como los agentes estimulantes de la eritropoyesis, para el tratamiento de la anemia postrasplante.
Los resultados perjudiciales incluyen la morbilidad y la mortalidad cardiovascular, la mortalidad global por todas las causas y la pérdida del injerto renal.
Son varios los estudios que investigan sobre las consecuencias de la anemia postrasplante. Sin embargo, los datos que se extraen de ellos son contradictorios debido a limitaciones en el diseño o diferencias en el análisis de los mismos.
En el estudio de Winkelmayer et al.20, donde se combinaron dos cohortes (una cohorte de la Universidad de Viena y otra de la Universidad de Massachussets), con un total de 825 pacientes trasplantados de riñón prevalentes con un aclaramiento de creatinina medio de 52,6 ml/min/1,73 m2, se analizó la asociación entre anemia, mortalidad global y pérdida del injerto. Tras ocho años de seguimiento, 251 pacientes murieron y 401 perdieron el injerto renal. En el análisis multivariante, la anemia no se asoció con la mortalidad global, pero sí con la pérdida del injerto renal, suponiendo un 25% más de riesgo de pérdida. Por otro lado, Molnar et al.7, en Budapest, en una cohorte de 938 pacientes trasplantados con un aclaramiento de creatinina medio de 49 ml/min/1,73 m2, demostraron que la anemia se asociaba significativamente e independientemente con la mortalidad y la pérdida del injerto renal.
No está claro por qué estudios similares llegan a conclusiones diferentes.
TRATAMIENTO DE LA ANEMIA POSTRASPLANTE
El tratamiento con AEE en todas las fases de la ERC, desde la prediálisis al trasplante, ha producido una mejora en la calidad de vida y una disminución de la hospitalización y la mortalidad21. Sin embargo, existen pocos estudios que hayan evaluado sistemáticamente el uso de AEE en la anemia postrasplante, así como el metabolismo del hierro.
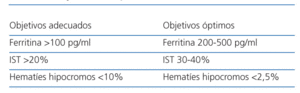
Al iniciar el tratamiento de la anemia de un paciente con insuficiencia renal crónica, debe hacerse una valoración de los depósitos de hierro. En la práctica clínica habitual, los más utilizados son la ferritina, el índice de saturación de la transferrina y el porcentaje de hematíes hipocromos. Para obtener y mantener el nivel deseado de hemoglobina, es necesario perseguir unos objetivos diana para los depósitos y disponibilidad del hierro que se muestran en la tabla 122.
Los requerimientos de hierro aumentan aún más cuando se administra EPO, especialmente en los tres primeros meses de tratamiento. No se debe iniciar tratamiento con AEE hasta que los depósitos de hierro estén replecionados, y en algunos casos esta corrección de la ferropenia es suficiente para corregir la anemia. La administración del hierro vía oral ofrece ventajas para el paciente; sin embargo, a veces la absorción es escasa, por lo que en estas situaciones es necesaria la administración intravenosa.
En la literatura, los datos que se extraen de los parámetros ferrocinéticos son escasos. Mix et al.18 encontraron que el estudio del metabolismo del hierro sólo se había realizado en el 36% de los pacientes anémicos (hematocrito <33%), y sólo el 46% recibía suplementos de hierro. De la misma manera, Karthikeyan et al.8 encontraron que el índice de saturación de la transferrina y la ferritina se determinaban en un 57% y un 61% de los pacientes anémicos. En cuanto al paciente trasplantado estable, Lorenz et al.22 referían una prevalencia del déficit de hierro del 20% y observaban la escasa información que daban tanto del índice de saturación de la transferrina como de la ferritina. Estos autores recomiendan la utilidad del porcentaje de células hipocromas, argumentando la gran variación que pueden presentar los niveles de ferritina, que pueden elevarse independientemente de los depósitos de hierro en ciertas condiciones como procesos inflamatorios, enfermedades infecciosas, procesos malignos o sobrecarga de hierro.
La situación actual descrita en los estudios sobre el uso de AEE para el tratamiento de la anemia postrasplante indica un escaso uso de los mismos. En el estudio europeo liderado por Vanrenterghem et al.6, sólo el 18% de los pacientes con anemia grave (Hb <11 g/dl en varones y <10 g/dl en mujeres) estaba en tratamiento con EPO. En los estudios americanos, el porcentaje es similar (25% de los pacientes con hemoglobina <11 g/dl), y aquéllos con una hemoglobina por debajo de 10 g/dl recibían EPO en el 40% de los casos.
Es importante diferenciar el período postrasplante en el que nos encontramos, ya que las razones clínicas y las causas de la anemia cambian. Así, en el período postrasplante inmediato, la corrección de la anemia con AEE aporta beneficios para reducir la hipoxia medular, mientras que en el período tardío tiene interés desde el punto de vista cardiovascular. El uso de AEE en las primeras semanas postrasplante es recomendable porque evita en muchos casos la necesidad de trasfusiones sanguíneas, reduciendo el riesgo de trasmisión de enfermedades virales y disminuyendo la producción de anticuerpos linfocitotóxicos, y probablemente requiera dosis más altas. Sin embargo, los resultados de los estudios sobre tratamiento de la anemia en el postrasplante inmediato son contradictorios, existiendo trabajos que demuestran mejoría de las cifras de hemoglobina en el grupo tratado y otros en los que no. En el postrasplante tardío, los pacientes que experimentan un fracaso lento del trasplante renal deben recibir los mismos cuidados y tratamientos que cualquier otro paciente con ERC.
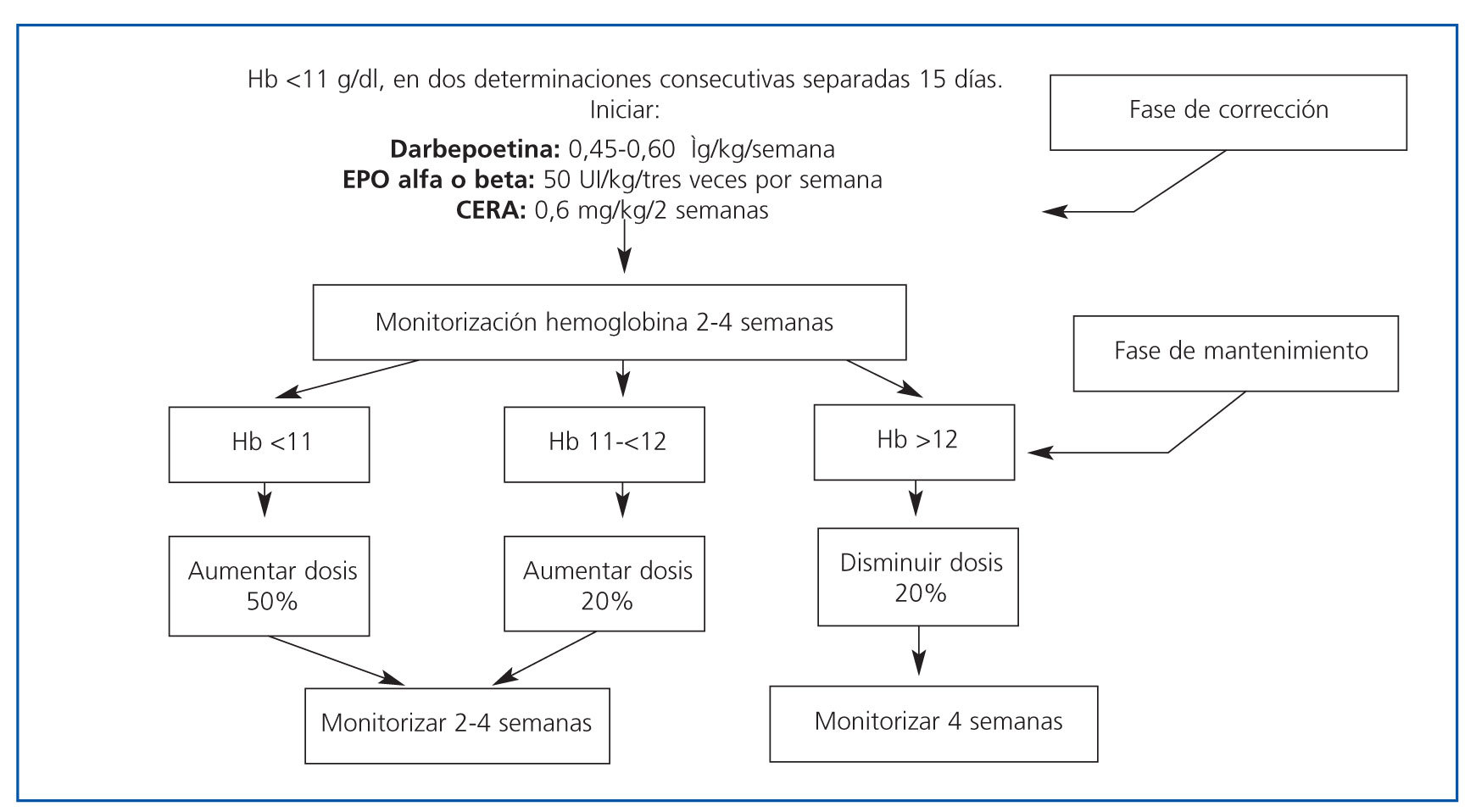
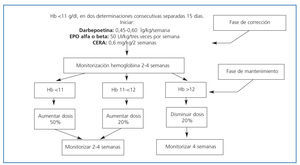
El tratamiento de la anemia con agentes estimulantes de la eritropoyesis debe iniciarse cuando los niveles de hemoglobina se mantienen por debajo de 11 g/dl en dos determinaciones consecutivas, separadas por un intervalo de dos semanas, siempre y cuando no haya carencia férrica ni otras causas de anemia además de la insuficiencia renal. Se ha demostrado beneficio clínico en aquellos pacientes que alcanzan una hemoglobina superior a 11 g/dl. En cuanto al nivel máximo, no se vieron beneficios significativos con niveles de Hb >13 g/dl, por lo que el objetivo debe adecuarse a cada situación particular y comorbilidad asociada23,24.
Actualmente existen, además de EPO alfa y EPO beta, otros agentes estimulantes de la eritropoyesis, tales como darbepoetina alfa y metoxi-polietilenglicol epoetin beta (CERA: activador continuo del receptor de la eritropoyetina). Todas estas moléculas, de diversa estructura o composición, han demostrado similar eficacia y, por el momento, seguridad, aunque las dos últimas presentan como ventaja una vida media más prolongada que la EPO, lo que permite administrar las dosis una o dos veces al mes. Pueden administrarse por vía sc. o iv., siendo la vía sc. la adecuada en los pacientes trasplantados.
Cuando se inicia tratamiento con AEE, la dosis inicial y el ajuste de dosis debe determinarse según el nivel de hemoglobina inicial, el porcentaje de aumento de hemoglobina y las características clínicas (tabla 2 y figura 1).
Tabla 1. Objetivos en parámetros ferrocinéticos
Tabla 2. Dosis inicial de AEE
Figura 1. Algoritmo de tratamiento de la anemia