Definición: Recientemente, la Fundación KDIGO (Kidney Disease: Improving Global Outcomes) ha propuesto nuevas definiciones para referirse a las alteraciones del metabolismo óseo-mineral de los pacientes con enfermedad renal crónica (ERC), relegando el término tradicional de «osteodistrofia renal» (ODR). Recomiendan:
- El término de ODR para definir exclusivamente las alteraciones de la morfología y la arquitectura ósea propias de la ERC.
- Y el término de alteración óseo-mineral asociada a la ERC para describir las alteraciones bioquímicas, esqueléticas y calcificaciones extraesqueléticas que ocurren como consecuencia de las alteraciones del metabolismo mineral en la ERC.
Fisiopatología: Las diferentes alteraciones metabólicas son secundarias a la pérdida progresiva de masa renal y función renal, que conlleva una retención de fósforo y descenso de los niveles de calcitriol que son responsables de la resistencia esquelética a la acción de la PTH
Manifestaciones clínicas: Las manifestaciones clínicas principales de las alteraciones del metabolismo óseo mineral postrasplante son la osteoporosis y la osteopenia, que producen un incremento de las fracturas, osteonecrosis y dolor óseo. Métodos diagnósticos: Parámetros bioquímicos (calcio, fósforo, PTH y 25 hidroxivitamina D), radiología ósea, densitometría y biopsia ósea (evidencia B).
Alternativas terapéuticas: Para el tratamiento y la prevención de la osteopenia-osteoporosis en pacientes trasplantados se recomienda basarse en los datos de evidencia clínica disponibles de otras poblaciones de estudio, como la de los pacientes con ERC. Además del tratamiento específico, hay que tener en cuenta las medidas preventivas para reducir el riesgo de fracturas. El tratamiento específico incluye medidas para la prevención de pérdida de masa ósea (metabolitos activos de la vitamina D, activadores selectivos de los receptores de la vitamida D y bifosfonatos) y el tratamiento del hiperparatiroidismo persistente (calcimiméticos) (evidencia B).
Description: Recently, the Foundation has proposed new definitions KDIGO to refer to the alterations of bone - mineral metabolism in patients with chronic renal disease (CRD), relegating the traditional term of renal osteodystrophy ODR). Recommend:
- The term ODR exclusively to define alterations in bone morphology and architecture characteristic of the ERC.
- And the term of bone-mineral alteration associated with the CRD to describe biochemical changes, and skeletal calcifications that occur as a result of alterations in mineral metabolism in the CRD.
Pathophysiology: The different metabolic abnormalities are secondary to the progressive loss of renal mass and renal function that leads to retention of phosphorus and a decrease in the levels of calcitriol which are responsible for the skeletal resistance to the action of PTH.
Clinical features: The main clinical manifestations of abnormal bone mineral metabolism are posttransplantation osteoporosis and osteopenia producing an increase in fractures, osteonecrosis, and bone pain.
Diagnostic methods: Biochemical parameters (calcium, phosphorus, PTH, 25 hydroxyvitamin D), X-ray bone densitometry and bone biopsy. (Evidence B)
Therapeutic alternatives: It is recommended for the treatment and prevention of osteopenia - osteoporosis in transplant patients based on data from clinical evidence available from other study populations, such as in patients with chronic kidney disease. In addition to specific treatment, we must take into account the preventive measures to reduce the risk of fractures. Treatment includes specific measures for the prevention of bone loss (active metabolite of vitamin D analogues and bisphosphonates) and the treatment of persistent hyperparathyroidism (calcimiméticos). (Evidence B).
INTRODUCCIÓN
La enfermedad ósea postrasplante es una entidad bien conocida1. Es un proceso heterogéneo en el que, además de la osteoporosis, se añaden otros procesos patológicos cuyos mecanismos etiopatogénicos no han sido aclarados de forma completa. Sin embargo, en varios trabajos se sugiere que la enfermedad ósea preexistente, el tratamiento inmunosupresor, la persistencia del hiperparatiroidismo y las alteraciones en el metabolismo del fósforo desempeñan un papel patogénico importante.
Recientemente, la Fundación KDIGO ha propuesto nuevas definiciones y un sistema de clasificación más integrado para referirse a las alteraciones del metabolismo óseo-mineral de los pacientes con ERC, relegando el término tradicional de ODR. Recomiendan2:
- El término de ODR para definir exclusivamente las alteraciones de la morfología y la arquitectura ósea propias de la ERC. El diagnóstico de confirmación se haría a través de la biopsia ósea.
- Yel término de alteración óseo-mineral asociada a la ERC para describir las alteraciones bioquímicas, esqueléticas y calcificaciones extraesqueléticas que ocurren como consecuencia de las alteraciones del metabolismo mineral en la ERC. Se manifiesta por una o la combinación de las siguientes manifestaciones:
- Anormalidades del calcio, fósforo, hormona paratiroidea (PTH) y vitamina D.
- Alteraciones en el remodelado, mineralización, volumen, crecimiento o fragilidad del esqueleto.
- Calcificaciones cardiovasculares o de otros tejidos blandos.
FISIOPATOLOGÍA
Un trasplante renal satisfactorio corrige muchas de las alteraciones metabólicas de la uremia gracias al incremento del filtrado glomerular y a la recuperación de la función tubular, permitiendo normalizar los niveles plasmáticos de calcio y fósforo, y disminuir los niveles sanguíneos de PTH, incrementando los niveles de metabolitos de la vitamina D y corrigiendo la acidosis metabólica de la uremia. Estos hechos de por sí deberían mejorar el metabolismo y la integridad del esqueleto. Sin embargo, tanto en el postrasplante inmediato como en el tardío frecuentemente se observa una elevada incidencia de osteopenia, hipercalcemia, hipofosforemia y, con menos frecuencia, necrosis aséptica ósea, a pesar del buen funcionamiento del injerto. Entre las causas potencialmente responsables de estos trastornos, se puede citar el tipo y la evolución de la osteodistrofia renal pretrasplante (tales como la gravedad del hiperparatiroidismo secundario), la menor movilización por la hospitalización en el postrasplante inmediato y el uso de fármacos inmunosupresores.
Según el momento evolutivo del trasplante, podemos diferenciar dos tipos de alteraciones del metabolismo Ca-P:
- En el postrasplante inmediato, el hiperparatiroidismo secundario es un hallazgo casi general, pudiendo persistir durante un largo período después del mismo debido a que la función paratiroidea no se normaliza inmediatamente. Es frecuente la aparición de hipofosforemia como consecuencia de una disminución de la reabsorción tubular de fosfatos con hiperfosfaturia, en la que está involucrado el hiperparatiroidismo secundario, entre otras causas. A estas alteraciones puede asociarse hipercalcemia, que puede ser persistente, aunque aproximadamente la mitad de los pacientes normalizan las cifras de calcio entre los 6 y 12 meses. Los niveles de 1,25 dihidroxivitamina D3 aumentan dentro de las 24-48 horas tras un trasplante normofuncionante, alcanzándose niveles normales estables dentro del primer mes. Un factor importante en la recuperación de los niveles normales de vitamina D es el descenso en el fósforo sérico que se produce después de un trasplante exitoso.
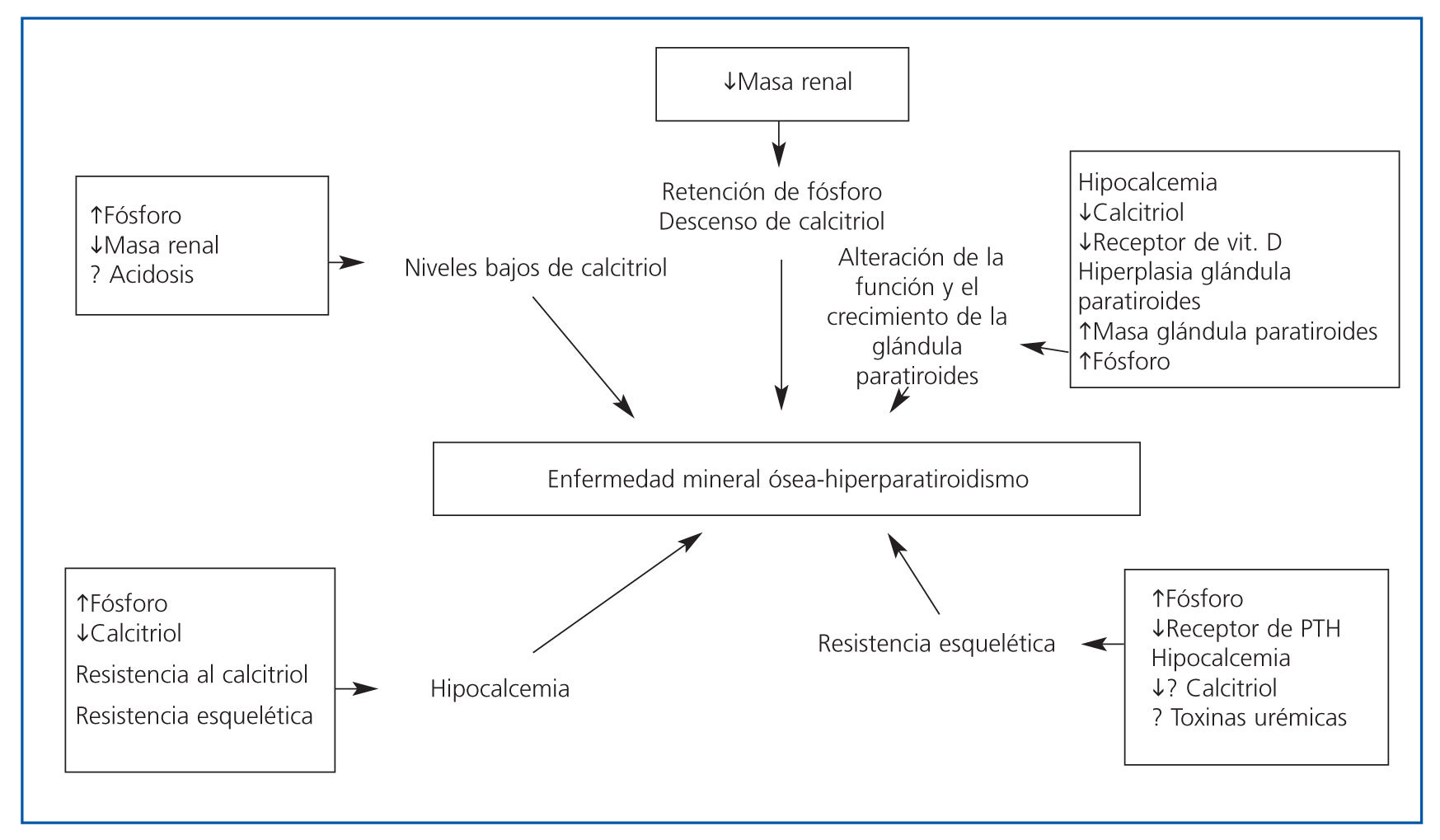
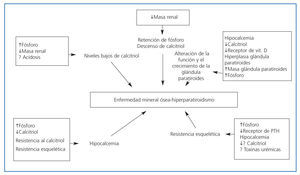
- En el postrasplante tardío, las diferentes alteraciones metabólicas son secundarias a la pérdida progresiva de masa renal y función renal (figura 1)3. Moderados descensos del aclaramiento de creatinina provocan un aumento de la fosfatemia y una disminución de los niveles de calcitriol que son responsables de la resistencia esquelética a la acción de la PTH4. En las glándulas paratiroides existen al menos dos receptores conocidos a través de los que se canalizan los efectos de las moléculas y hormonas que modulan tanto la síntesis y la secreción de PTH como el tamaño glandular. Estos receptores son: el receptor de la vitamina D, el cual, con la progresión de la ERC, disminuye contribuyendo a la resistencia a la acción de la vitamina D sobre la síntesis de PTH; y el receptor sensor de calcio, que disminuye con el desarrollo progresivo de hiperplasia paratiroidea secundaria a la ERC, contribuyendo a la resistencia a la acción del calcio sobre la glándula paratiroidea, por lo que deja de inhibirse la secreción de PTH5,6.
Estas alteraciones producen daños en tejidos diana, fundamentalmente en el esqueleto y el sistema cardiovascular. Como consecuencia de estos efectos, las alteraciones del metabolismo mineral han demostrado ser predictores independientes de mortalidad, especialmente de causa cardiovascular en la población urémica6.
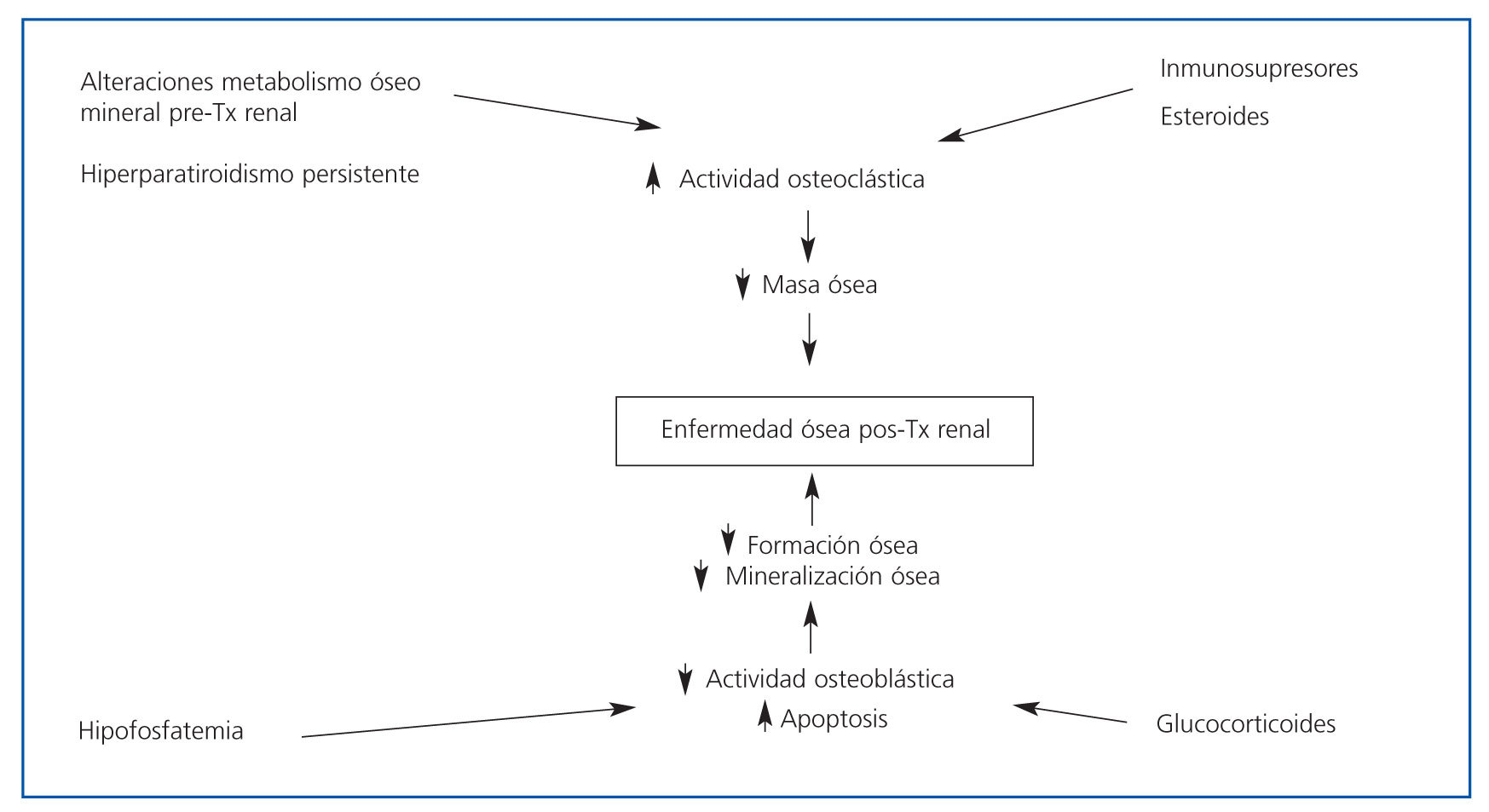
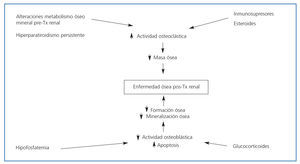
Por tanto, el curso de la enfermedad ósea postrasplante depende de la persistencia de estas anormalidades, como hiperparatiroidismo, hipercalcemia, hipofosfatemia e hipomagnesemia, además del tipo, la dosis y la duración de la medicación inmunosupresora que se requiere para disminuir la tasa de rechazo agudo7. En la figura 21 se resumen los principales factores implicados en la enfermedad ósea postrasplante.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas principales de las alteraciones del metabolismo óseo mineral postrasplante son la osteoporosis y la osteopenia, que producen un incremento de las fracturas, osteonecrosis y dolor óseo8.
El riesgo de fractura está incrementado en los pacientes trasplantados de riñón, en comparación con la población general o con los pacientes con insuficiencia renal crónica en diálisis, lo cual origina un aumento de la morbilidad9. Esta disminución de la masa ósea se produce principalmente en los 6 primeros meses postrasplante y tiende a estabilizarse después de los 12 meses. La pérdida ósea rápida que ocurre tras el trasplante condiciona la elevada prevalencia (7-20%) e incidencia (3-4%) de fracturas, muy superior a la de la población de la misma edad y sexo. Las fracturas suelen ocurrir en el postrasplante tardío y afectan mayoritariamente a pies y tobillos10.
Los cuidados deben individualizarse en base a la patología preexistente del paciente y a los recursos disponibles.
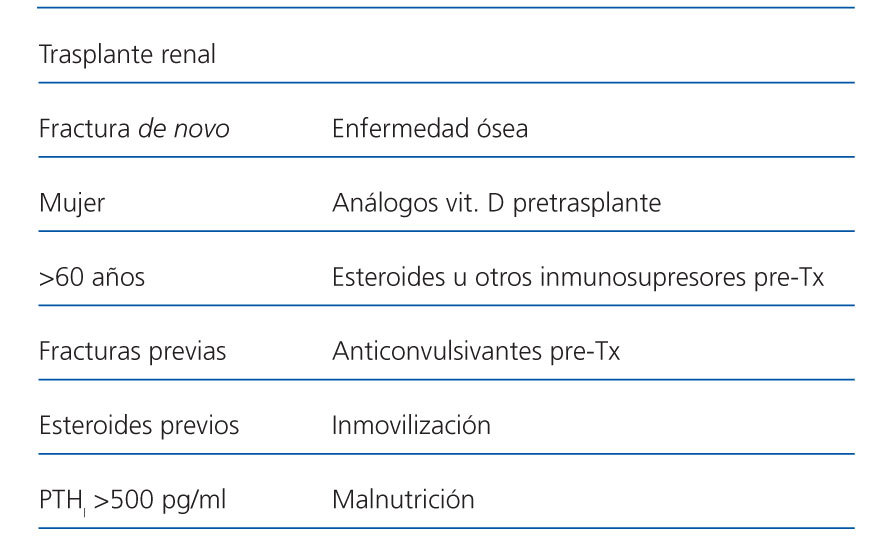
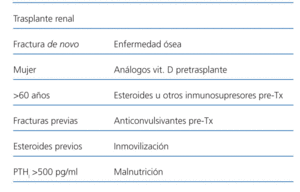
Los factores de riesgo de fractura en la población trasplantada renal descritos en la literatura son: edad superior a 60 años, mujer, antecedentes de fracturas previas, tratamiento previo con esteroides e hiperparatiroidismo persistente (PTHi superior a 500 pg/m) (tabla 1)11.
Los factores de riesgo para enfermedad ósea postrasplante son: tratamiento pretrasplante con análogos vitamina D, esteroides u otros inmunosupresores, o anticonvulsivantes. Asimismo, presentan más riesgo aquellos pacientes con historia de inmovilización, malnutrición, uso de diuréticos de asa e hipogonadismo persistente.
En un estudio realizado en España sobre la asociación de las complicaciones de la uremia y el estadio de función renal en los pacientes trasplantados de cuatro hospitales, se demostró que el 12,5% de los pacientes tenían hipercalcemia, mientras que el 75% de ellos presentaban niveles elevados de PTHi12.
MÉTODOS DIAGNÓSTICOS DE ESTUDIO DE LA ENFERMEDAD ÓSEA SUBYACENTE513
Parámetros bioquímicos:
- Calcio y fósforo: tienen poca capacidad predictiva de la enfermedad ósea subyacente. Sin embargo, su determinación periódica, junto con la PTH, es decisiva en el manejo terapéutico del paciente. Deben medirse tras el trasplante al menos mensualmente durante los primeros seis meses, después cada dos meses hasta final del primer año, y posteriormente anualmente. Puede ser necesaria una monitorización más estrecha en pacientes bajo tratamiento con análogos de la vitamina D o con calcimiméticos.
- PTH: es el parámetro bioquímico que mejor se correlaciona con las lesiones histológicas del hiperparatiroidismo secundario. Se debe medir a los 6 y 12 meses postrasplante, y posteriormente anualmente.
- 25 (OH) vitamina D: es aconsejable su medición para prevenir y tratar la frecuente insuficiencia de vitamina D detectada en los pacientes trasplantados.
Técnicas de imagen:
- Radiología ósea: en la actualidad, la evaluación radiológica ósea sólo está indicada en aquellos pacientes con historia previa de fracturas. En los pacientes asintomáticos no está justificada. Estos estudios son útiles para detectar calcificaciones vasculares.
- Densitometría ósea: proporciona información de cambios en el contenido mineral óseo, pero no del tipo de enfermedad ósea subyacente. Su relación con el riesgo de fractura en la población trasplantada no está claramente definida. Sin embargo, ha demostrado ser de gran utilidad para el seguimiento de la masa ósea postrasplante, por lo que debe utilizarse para el manejo terapéutico de los pacientes.
- Biopsia ósea: sólo está indicada de manera excepcional y en las siguientes situaciones: fracturas de estrés, sintomatología o analítica no clara y sospecha de enfermedad ósea por aluminio.
ALTERNATIVAS TERAPÉUTICAS
En ausencia de datos clínicos establecidos en la población trasplantada para el tratamiento y la prevención de la osteopenia-osteoporosis en pacientes trasplantados, las guías clínicas actuales recomiendan basarse en los datos de evidencia clínica disponibles de otras poblaciones de estudio. Además del tratamiento específico, que se desarrolla más adelante, hay que tener en cuenta las medidas preventivas para reducir el riesgo de fracturas. Éstas incluyen: uso de dosis bajas de corticoides durante un tiempo limitado en el período pretrasplante en pacientes en lista de espera de trasplante renal, ejercicio físico de al menos 30 minutos, identificación y tratamiento de factores de riesgo de osteoporosis, evitar consumo de alcohol o nicotina, y terapia sustitutiva hormonal en mujeres posmenopáusicas14.
El tratamiento específico incluye medidas para la prevención de pérdida de masa ósea y el tratamiento del hiperparatiroidismo persistente15. Algunas de estas medidas preventivas deben iniciarse inmediatamente después del trasplante. El tratamiento con bifosfonatos o vitamina D en cualquier momento del trasplante tiene un efecto beneficioso sobre las alteraciones del metabolismo óseo-mineral.
Tratamiento de prevención de pérdida de masa ósea tras el trasplante16-18:
- Metabolitos activos de la vitamina D y activadores selectivos de los receptores de la vitamina D como paricalcitol: reducen la pérdida ósea postrasplante, normalizando la absorción intestinal de calcio y suprimiendo la secreción de PTH. Deben administrarse en pacientes que reciban esteroides, junto con suplementos de calcio, como prevención de las fracturas postrasplante. Paricalcitol supone un avance terapéutico para el control del metabolismo mineral en los pacientes con insuficiencia renal crónica que tienen un déficit claro de vitamina D. Permite activar de forma selectiva los receptores de vitamina D presentes en múltiples órganos a nivel intestinal, cardiaco, vascular o renal, disminuyendo el riesgo de hipercalcemia e hiperfosfatemia. Paricalcitol está indicado para la prevención y el tratamiento de hiperparatiroidismo secundario en pacientes con ERC (estadios 3 y 4) y en pacientes con fallo renal (estadio 5) en hemodiálisis o diálisis peritoneal.
- Bifosfonatos: han demostrado su eficacia en disminuir el riesgo de fracturas y de pérdida de masa ósea en mujeres posmenopáusicas con osteoporosis, así como en la osteoporosis inducida por esteroides. Asimismo, en la población trasplantada también existen diversos estudios que han evaluado la eficacia de estos fármacos en el tratamiento de la osteoporosis en el postrasplante renal, obteniendo resultados favorables. Los bifosfonatos mejoran la densidad ósea y disminuyen el riesgo de fracturas. Deben reservarse para los pacientes con riesgo de fractura. Las dosis recomendadas de las diferentes alternativas son:
- Pamidronato, 60 mg iv. La dosis se puede repetir al mes o a los tres meses.
- Ác. zoledrónico, 4 mg iv. dosis única.
- Alendronato, 70 mg oral semanal.
- Risedronato, 35 mg oral semanal.
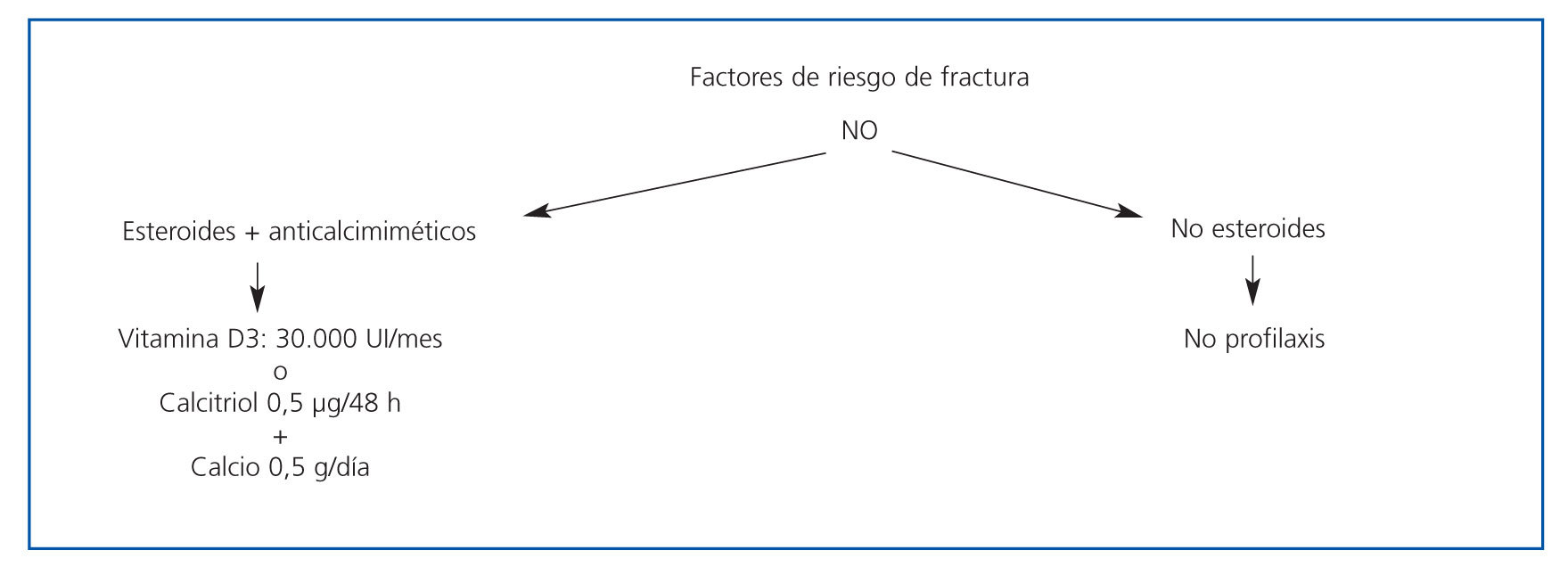
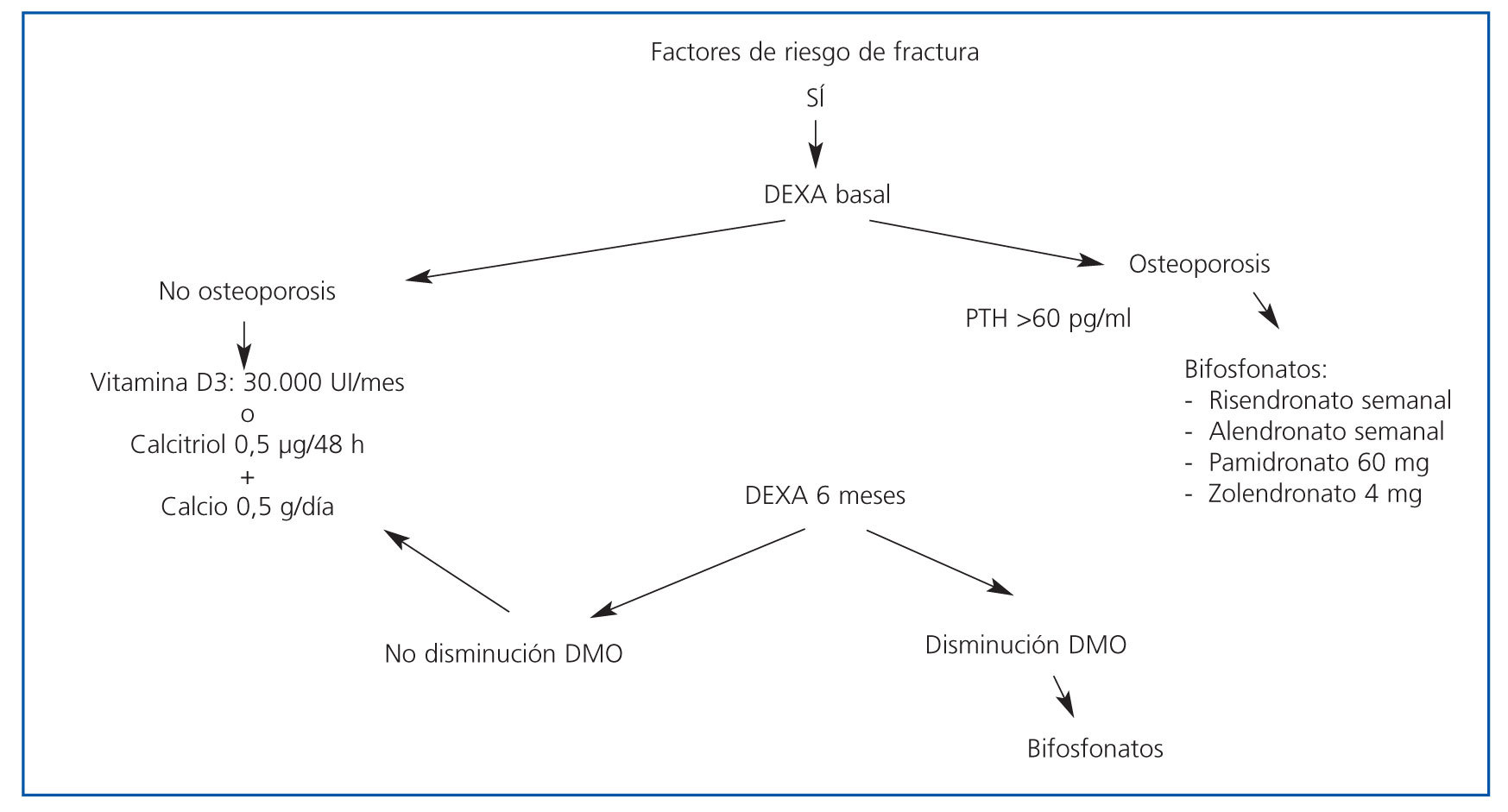
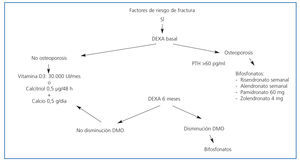
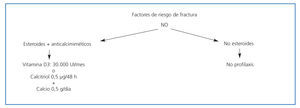
En las figuras 3 y 4 se muestran los algoritmos de tratamiento/prevención de pérdida de masa ósea en pacientes con trasplante renal, con y sin riesgo de fractura, propuestos por la S.E.N. para el manejo de las alteraciones del metabolismo óseo-mineral en los pacientes con ERC.
Tratamiento para controlar el hiperparatiroidismo persistente19-22:
- Cinacalcet: es un calcimimético tipo II. Se comporta como un activador alostérico del receptor sensor de calcio, incrementando la sensibilidad del receptor a la activación por el calcio extracelular. El cinacalcet directamente disminuye los niveles de PTH y de calcio sérico. Se ha aprobado su uso en pacientes con ERC. Sin embargo, se desconoce si tiene la misma eficacia en pacientes trasplantados. No obstante, se han publicado diversos estudios en los que el uso de calcimiméticos se ha demostrado eficaz en el control de la hipercalcemia se ha demostrado eficaz en el control de la hipercalcemia secundaria, ya que producen una reducción a corto plazo del calcio y una disminución de la PTH, cambios que se mantienen mientras se usa el fármaco, pues cuando se retira se observa en algunos casos una recaída del hiperparatiroidismo. La dosis inicial aconsejable es de 30 mg/día.
Nuevos tratamientos de la osteoporosis23-25: estroncio, PTH cíclico y denosumab. Todavía no se han empleado en el contexto del tratamiento de la osteopenia-osteoporosis en el postrasplante renal. Sin embargo, a medida que vamos conociendo mejor la fisiopatología de estas alteraciones, se presentan como una opción futura.
Figura 1. Factores implicados en la patogénesis de la enfermedad mineral ósea (modificado de Sadiddenn et al.)
Figura 2. Factores que contribuyen a la enfermedad ósea postrasplante (modificado de Sadiddenn et al.)
Tabla 1. Factores de riesgo de fractura de novo y enfermedad ósea en trasplante renal
Figura 3. Algoritmo de tratamiento de pérdida de masa ósea en pacientes con trasplante renal con riesgo de fractura
Figura 4. Algoritmo de tratamiento de pérdida de masa ósea en pacientes con trasplante renal sin riesgo de fractura