INTRODUCCIÓN
La enfermedad renal crónica (ERC) constituye un problema de salud pública por varias razones, entre las que destaca su interrelación con otras enfermedades epidémicas, crónicas y de mal pronóstico como la enfermedad cardiovascular (ECV)1. En efecto, la ERC facilita el desarrollo de la ECV, especialmente en los pacientes que presentan hipertensión arterial y/o diabetes mellitus2. Por otra parte, la ERC favorece la morbi-mortalidad de la ECV, a expensas de incrementar los eventos isquémicos ateroscleróticos y la insuficiencia cardíaca3.
La cardiopatía hipertensiva constituye un buen ejemplo para analizar la interrelación de la ERC con la ECV. Aunque el principal criterio para definirla es la presencia de hipertrofia ventricular izquierda (HVI) en ausencia de otra causa que no sea la hipertensión arterial4, la disfunción diastólica es el distintivo funcional de la cardiopatía hipertensiva5. La severidad de la disfunción diastólica se correlaciona con la de la HVI, de tal modo que entre el 30 y el 45% de los pacientes hipertensos con insuficiencia cardíaca crónica presentan HVI severa, signos ecocardiográficos de disfunción diastólica y fracción de eyección preservada6. De hecho, la cardiopatía hipertensiva constituye la primera causa de insuficiencia cardíaca con fracción de eyección preservada o insuficiencia cardíaca diastólica7.
Dado que la ERC puede facilitar el desarrollo de la cardiopatía hipertensiva y que esta puede condicionar críticamente el pronóstico del paciente renal, en esta revisión se considerarán algunos aspectos generales de su fisiopatología y de su expresión clínica, haciéndose énfasis en el modo particular en el que la ERC influye en el desarrollo y la evolución de esta cardiopatía.
REMODELADO ESTRUCTURAL DEL MIOCARDIO EN LA HIPERTENSIÓN
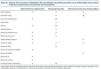
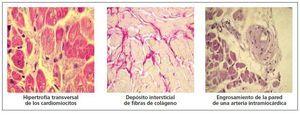
En la cardiopatía hipertensiva se dan una serie de cambios en la composición histológica del miocardio que constituyen la base de su remodelado estructural8. El remodelado incluye múltiples alteraciones de los elementos celulares (cardiomiocitos y no cardiomiocitos) y de los no celulares (matriz extracelular, vasos intramiocárdicos) (tabla I y fig. 1). Entre esas alteraciones destacan la hipertrofia de los cardiomiocitos, la fibrosis del intersticio y la región perivascular, y las alteraciones de la pared de las arterias intramiocárdicas y las arteriolas. Mientras que la primera y la tercera constituyen la respuesta adaptativa de las células musculares parenquimatosas y vasculares a la sobrecarga de presión en un intento de normalizar el estrés sistólico de la pared del ventrículo y de las arterias, respectivamente, la segunda está relacionada con alteraciones en el metabolismo miocárdico del colágeno que no están relacionadas tanto con la sobrecarga hemodinámica, cuanto con las acciones de diversos factores humorales.
Desde el punto de vista histológico, la fibrosis miocárdica es el resultado de una acumulación exagerada de fibras de colágeno, principalmente de tipo I (fig. 2)9. Dicha acumulación se produce como resultado de un incremento de la síntesis del colágeno por parte de los fibroblastos y miofibroblastos que no es compensada por un aumento similar de la degradación del colágeno por parte de las metaloproteinasas de la matriz. Dos tipos de evidencias sugieren que la fibrosis miocárdica hipertensiva se desarrolla en respuesta a factores no hemodinámicos8. En primer lugar, la fibrosis se produce no sólo en el ventrículo izquierdo, sino también en el ventrículo derecho, en el septo interventricular y en la aurícula izquierda de los pacientes hipertensos. En segundo lugar, se ha demostrado que la capacidad del tratamiento antihipertensivo para reducir la fibrosis en los pacientes hipertensos es independiente de su eficacia antihipertensiva. Por tanto, la fibrosis miocárdica hipertensiva puede considerarse como una consecuencia de la pérdida del equilibrio que existe en el miocardio entre los factores profibróticos y antifibróticos en favor de los primeros (tabla II). Junto a la propia hipertensión, otros factores ligados al sustrato genético, la demografía y el estilo de vida, así como con la coexistencia de enfermedades como la obesidad o la diabetes mellitus contribuyen también a ese desequilibrio.
IMPACTO DEL REMODELADO MIOCÁRDICO SOBRE LA FUNCIÓN DIASTÓLICA
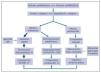
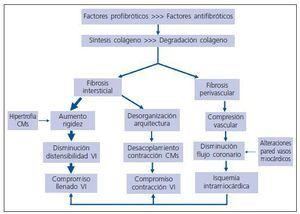
Aunque el remodelado del miocardio altera la función global del ventrículo izquierdo y la perfusión y la actividad eléctrica del miocardio (fig. 2), su impacto nocivo principal es el que afecta a la función diastólica. En la diástole se produce una fase temprana de llenado rápido relacionada con la relajación activa de los cardiomiocitos y una fase tardía pasiva, que depende de las propiedades elásticas del ventrículo izquierdo. Por ello, la disfunción diastólica se caracteriza por alteraciones en la relajación y/o la distensibilidad del ventrículo izquierdo. El remodelado miocárdico afecta adversamente a las dos fases de la diástole (fig. 2).
Impacto de la hipertrofia de los cardiomicitos
La hipertrofia cardiomiocitaria puede afectar a las dos fases de la función diastólica. Se ha descrito que en los cardiomiocitos hipertrofiados está reducida la velocidad de relajación debido a que está disminuido el transporte del calcio (Ca2+) citósolico al retículo sarcoplásmico por una menor actividad de la bomba de Ca2+ o Ca2+-ATPasa10. Por otra parte, en los cardiomiocitos hipertrofiados de pacientes con insuficiencia cardíaca diastólica se ha descrito una excesiva expresión de la isoforma N2B de la titina, en detrimento de la expresión de la isoforma N2BA11. La titina es una proteína del citoesqueleto cardiomiocitario que une las líneas Z con el centro del filamento grueso y determina la rigidez en reposo de los cardiomiocitos12. Dado que la isoforma N2B de la titina es más rígida que la N2BA, su exceso puede contribuir al deterioro de la función diastólica reduciendo la distensibilidad de la cámara ventricular.
Impacto de las alteraciones de los vasos intramiocárdicos
En los pacientes hipertensos se ha descrito una disminución de la reserva del flujo coronario, que no se relaciona directamente con la HVI, pues también se objetiva en pacientes sin hipertrofia cardíaca13. Entre los mecanismos vasculares responsables de dicha alteración cabe resaltar la presencia de lesiones en las arterias intramiocárdicas que engruesan su pared y disminuyen su luz, así como alteraciones de la reactividad de las arteriolas que conducen a una excesiva vasoconstricción14. Sasaki y cols.15, describieron una asociación entre el compromiso de la reserva coronaria y la afectación de la relajación diastólica en pacientes con hipertensión. Dado que la relajación de los cardiomiocitos es un proceso mediado por la Ca2+-ATPasa y, por tanto, dependiente de energía, es razonable pensar que la isquemia secundaria a una menor reserva coronaria comprometerá la función diastólica a través de esta vía.
Impacto de la fibrosis miocárdica
La fibrosis miocárdica es el determinante estructural más importante del aumento de la rigidez miocárdica y la consiguiente disminución de la distensibilidad ventricular16 (fig. 2). En efecto, utilizando el método del módulo elástico de Young se ha comprobado que la rigidez intrínseca de las fibras de colágeno tipo I es 30 veces superior a la rigidez de los cardiomiocitos. En este sentido, la asociación de la fibrosis con la disfunción diastólica en la hipertensión ha sido evidenciada por diversos estudios experimentales y clínicos. En ratas espontáneamente hipertensas (SHR) con HVI, Brilla y cols.17, demostraron una disminución de la distensibilidad del ventrículo izquierdo durante la diástole que se corregía cuando a la ratas se les administraba el inhibidor de la enzima convertidora de la angiotensina (ECA) lisinopril a dosis bajas que eliminaban la fibrosis miocárdica sin modificar la presión arterial ni la HVI. El mismo grupo corroboró los hallazgos precedentes en ratas SHR viejas con HVI e insuficiencia cardíaca y un compromiso aún mayor de la distensibilidad ventricular, al demostrar que la reducción de la fibrosis con lisinopril se asociaba con la mejoría de las propiedades mecánicas del ventrículo y de la función cardíaca independientemente de la presión arterial y la masa ventricular18. En pacientes hipertensos, Sugihara y cols.19, y Müller-Brunotte y cols.20, describieron una asociación inversa entre la función diastólica y la cuantía de la fibrosis miocárdica presente ya en pacientes sin HVI y que se reforzaba cuando existía HVI. Brilla y cols.21, demostraron en pacientes hipertensos con HVI que una disminución en la cuantía de la fibrosis tras tratamiento con lisinopril se acompañada de una mejoría de la función diastólica que era independiente de la regresión de la HVI. Por otro lado, nuestro grupo observó que en los pacientes hipertensos con HVI tratados con el antagonista del receptor AT1 de la angiotensina II se daba una asociación entre la reducción de la fibrosis y la disminución de la rigidez de la cámara del ventrículo izquierdo que era independiente de la reducción de la presión arterial y de la masa ventricular izquierda22.
En los casos más evolucionados y severos de cardiopatía hipertensiva se produce una gran y caótica acumulación de fibras, con los consiguientes cambios en su orientación espacial, lo que interfiere con el estiramiento de los cardiomiocitos que precede a su acortamiento contráctil, así como con la sinergia de la contracción de los haces de cardiomiocitos y la transmisión de la fuerza de eyección resultante a la cámara ventricular, factores todos ellos que comprometen la función sistólica16. Así, en ratas SHR viejas con insuficiencia cardíaca se ha hallado una asociación entre la presencia de fibrosis severa y el desarrollo de disfunción sistólica18. Además, en pacientes hipertensos con cardiopatía hipertensiva de larga evolución e insuficiencia cardíaca también se ha observado una asociación entre la presencia de fibrosis severa y la depresión de la fracción de eyección23,24.
LA CARDIOPATÍA HIPERTENSIVA EN EL PACIENTE CON ERC
Una vez revisados los aspectos generales de la cardiopatía hipertensiva, es preciso considerar ciertos aspectos de la misma que en el contexto de la ERC adquieren un carácter particular.
Factores facilitadores del remodelado miocárdico en la ERC
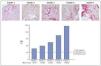
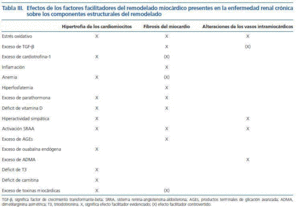
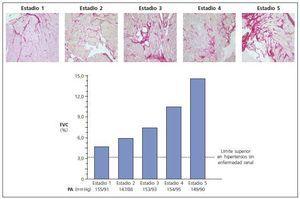
Las tres lesiones constitutivas del remodelado estructural del miocardio son un hallazgo constante en las biopsias cardíacas y los estudios necrópsicos de los pacientes con ERC e hipertensión25,26. Más aún, la severidad de las lesiones, por ejemplo la fibrosis, aumenta con el estadio de la ERC (fig. 3). Abundantes evidencias experimentales apoyan la noción de que en la evolución de la ERC concurren una serie de factores bioquímicos y hormonales que favorecen el desarrollo y la severidad de las lesiones del remodelado miocárdico (tabla III). Las evidencias clínicas disponibles sugieren que algunos de esos factores son operativos ya desde los estadios iniciales y otros actúan más en los estadios avanzados de la ERC. Entre los primeros cabe citar el estrés oxidativo resultante de la producción exagerada de anión superóxido27, un exceso de citoquinas como el factor de crecimiento transformante beta28 y la cardiotrofina-129, y un estado sistémico de inflamación30. Entre los segundos hay que reseñar la anemia31,32, la hiperfosfatemia, el exceso de parathormonay el déficit de vitamina D33,34, la hiperactividad del sistema nervioso simpático35, la activación exagerada del sistema renina-angiotensina-aldosterona36,37, el exceso de productos terminales de glicación avanzada38, ouabaína endógena39 y dimetilarginina asimétrica40, el déficit de triiodotironina libre41 y carnitina42, y la acumulación de factores filtrables tóxicos para el miocardio43. Conviene mencionar que es probable que entre los factores mencionados se establezcan sinergias que acaben dando lugar a mecanismos redundantes de daño miocárdico. Por ejemplo, la estimulación inicial en la producción miocárdica de cardiotrofina-1 como respuesta a la sobrecarga mecánica impuesta por la hipertensión sobre el miocardio44, puede incrementarse posteriormente en respuesta a la hipoxia miocárdica debida a la anemia45, así como a la influencia directa sobre las células cardíacas del exceso de angiotensina II46 y de norepinefrina47.
Por último, es preciso tener presente que en los estadios más avanzados de la ERC está alterada la actividad del proteasoma, lo que se traduce en excesiva o insuficiente degradación de las proteínas del músculo esquelético48. Una de las proteínas cuya degradación depende del proteasoma es la titina49, por lo que una menor actividad del proteasoma daría lugar a la acumulación de titina en los cardiomiocitos y al incremento de la rigidez de estos y el deterioro del llenado diastólico ventricular.
Características clínicas de la cardiopatía hipertensiva en la ERC
La hipertensión arterial es el principal factor asociado con el crecimiento y la disfunción del ventrículo izquierdo en los pacientes con ERC desde los estadios iniciales de la ERC, y esa asociación se mantiene independiente de otros factores en todos los estadios de la ERC50. Además, la prevalencia de HVI concéntrica51, 52 y de disfunción diastólica53, 54 es superior en los pacientes hipertensos con ERC que en los pacientes hipertensos sin ERC, y se incrementa a medida que progresa la ERC. Los pacientes con ERC y cardiopatía hipertensiva tienen un elevado riesgo de desarrollo de insuficiencia cardíaca crónica diastólica, que se manifiesta como intolerancia severa al ejercicio físico, que incluso puede llegar a cursar con edema agudo e pulmón, o como hipotensión súbita intradiálisis en los pacientes dializados53. En los pacientes con ERC, la mortalidad de la insuficiencia cardíaca diastólica es superior a la de la insuficiencia cardíaca con fracción de eyección deprimida o sistólica55. Además de asociarse con la insuficiencia cardíaca diastólica, en los pacientes con ERC la cardiopatía hipertensiva se asocia con un elevado riesgo de disfunción valvular aórtica, arritmias ventriculares, fibrilación auricular y agravamiento de una cardiopatía isquemia coexistente56, 57.
Diagnóstico de la cardiopatía hipertensiva en la ERC
Las observaciones del apartado precedente indican que la cardiopatía hipertensiva del paciente con ERC constituye una entidad relevante desde el punto de vista clínico y pronóstico, por lo que debe recabar una atención especial para su identificación y su tratamiento. En este contexto, la ecocardiografía con Doppler normal y tisular resulta esencial no sólo para caracterizar morfológica y funcionalmente el ventrículo izquierdo, sino también para estratificar a los pacientes según su riesgo de presentar complicaciones futuras (por ejemplo, a mayor sea la masa del ventrículo izquierdo mayor será la probabilidad de desarrollar insuficiencia cardíaca diastólica, y a mayores sean las dimensiones de la aurícula izquierda mayor será el riesgo de presentar fibrilación auricular)58. Con la ecocardiografía con backscatter integrado, una técnica que analizando la reflectividad del miocardio evalúa su composición tisular, se ha demostrado que la cuantía del tejido fibroso del miocardio está anormalmente aumentada en los pacientes con ERC59, 60. Recientemente, se ha propuesto que el estudio del corazón con resonancia magnética y gadolinio también permite valorar la severidad de la fibrosis miocárdica en estos pacientes61. Finalmente, se ha publicado que en los pacientes con ERC están incrementados los niveles sanguíneos de determinados péptidos derivados del metabolismo del colágeno tipo I que se consideran marcadores del depósito miocárdico de fibras de colágeno28, 59, 60.
Tratamiento de la cardiopatía hipertensiva en la ERC
El tratamiento de la cardiopatía hipertensiva en el paciente con ERC tiene un doble objetivo: en primer lugar, reducir la hipertensión arterial con fármacos antihipertensivos que hayan demostrado capacidad para reparar las lesiones del remodelado miocárdico, facilitar la regresión de la HVI y preservar la función diastólica, y, en segundo lugar, tratar eficazmente los factores presentes en la ERC que facilitan el remodelado del miocardio. Los únicos fármacos antihipertensivos que en estudios clínicos han demostrado la capacidad triple mencionada son el diurético torasemida62,63, el inhibidor de la ECA lisinopril21, y el antagonista del receptor AT1 de la angiotensina II losartán22, 64.
La medida destinada a corregir los trastornos bioquímicos y hormonales propios de la ERC que más eficacia ha demostrado desde el punto de vista de la protección cardíaca ha sido la corrección de la anemia con eritropoyetina recombinante65. Pero hay que señalar que hasta un 10% de los pacientes con ERC e insuficiencia cardíaca presentan resistencia a la eritropoyetina66, lo que obligará a utilizar dosis elevadas, con el consiguiente riesgo de efectos adversos, o a asociar levocarnitina, que además de mejorar la respuesta a la eritropoyetina, puede facilitar el metabolismo oxidativo de los ácidos grasos y la disponibilidad de ATP en los cardiomiocitos67. El control estricto de la fosfatemia y del producto calcio x fósforo, así como el de los niveles de parathormona, puede contribuir favorablemente a la protección cardíaca del paciente con ERC y cardiopatía hipertensiva68. Un número creciente de evidencias sugiere que la administración de vitamina D a pacientes con ERC y cardiopatía hipertensiva reduce la HVI y mejora la función ventricular a través de mecanismos no relacionados con el metabolismo mineral69. Finalmente, la optimización de la diálisis en los pacientes en tratamiento sustitutivo es preceptiva desde el punto de vista de la protección cardíaca, no tanto por incrementar la depuración de moléculas retenidas potencialmente cardiotóxicas, cuanto por evitar la expansión del volumen extracelular que a través de la elevación de la presión arterial puede repercutir desfavorablemente sobre un miocardio remodelado y disfuncionante70.
Desde un punto de vista de futuro cabe señalar el potencial farmacológico cardioprotector de la urotensina II, péptido cíclico producido por distintos órganos, incluyendo el corazón. Datos recientes indican que los pacientes con ERC que presentan niveles elevados de urotensina II tienen menos hipertrofia y disfunción ventricular71, y menor riesgo de eventos cardiovasculares72, que los pacientes con niveles normales pero similar prevalencia de los factores de riesgo tradicionales. Experimentalmente se ha demostrado que la urotensina II disminuye el crecimiento de los cardiomiocitos y favorece el llenado diastólico ventricular73. Por tanto, sería interesante estudiar si el empleo de los agonistas del receptor de la urotensina II, ya disponibles para uso farmacológico74, es eficaz en la prevención y el tratamiento de la cardiopatía hipertensiva de la ERC.
CONCLUSIONES
La cardiopatía hipertensiva es una complicación frecuente y de mal pronóstico en los pacientes hipertensos. El sustrato lesional de la misma, el remodelado miocárdico, es el determinante de las complicaciones que presentan los pacientes con esta cardiopatía, especialmente de la disfunción diastólica que evoluciona a la insuficiencia cardíaca diastólica. Dado que la ERC facilita el remodelado miocárdico desde sus estadios iniciales, los pacientes hipertensos con ERC están muy expuestos a esta cardiopatía y a sus complicaciones. De ello se infiere que el nefrólogo ha de estar sensibilizado y preparado para diagnosticarla y tratarla adecuadamente, lo que implica que la colaboración con el cardiólogo para una mejor asistencia del paciente con ERC se institucionalice definitivamente75. Esa colaboración ha de hacerse extensiva también a la investigación de los mecanismos de la cardiopatía hipertensiva en la ERC con el fin de desarrollar tratamientos más específicos para minimizar sus consecuencias y, de esta manera, mejorar el pronóstico cardiovascular del paciente renal.
Tabla 1.
Tabla 2.
Tabla 3.
Figura 1.
Figura 2.
Figura 3.