El término arteriolopatía calcificante urémica (ACU), acuñado por Coates (1998)1, debe reemplazar al de calcifilaxis, que fue introducido por Seyles (1962)2. Éste último, aunque ampliamente utilizado, corresponde a la unión de dos conceptos, calcificación y anafilaxis, que expresaban lo observado por el autor en sus experimentos pero que no se corresponden con la entidad clínica objeto de ésta editorial.
La ACU se desarrolla en la dermis y en el tejido celular subcutáneo, generalmente en áreas de gran adiposidad, provocando úlceras isquémicas. Se manifiesta como una paniculitis con una etapa inicial en la que se aprecian nódulos violáceos que posteriormente se ulceran. La isquemia de los vasos profundos se proyecta en la piel dando lugar a la lívedo reticularis que dibuja la distribución anatómica característica de los mismos. Es una entidad de curso fatal que se asocia mayoritariamente a la uremia pero que puede ocurrir asociada a otras enfermedades (diabetes, lupus eritematoso sistémico, enfermedad de Crohn, etcétera)3,4. En este número de la revista5 se presenta una revisión en la que se analizan las características de 8 pacientes en hemodiálisis que desarrollaron ACU, con el objeto de identificar los factores implicados en su patogénesis. La presencia mayoritaria de diabetes mellitus (DM), síndrome metabólico (SM) y obesidad hace que los autores consideren estas asociaciones como posibles factores favorecedores.
Tradicionalmente en los pacientes con enfermedad renal crónica (ERC) se ha enfatizado el papel de las alteraciones del metabolismo mineral. En la revisión objeto de este comentario y en otros casos de la literatura, llama la atención la ausencia de un producto CaXP elevado. El papel sensibilizante de algunos de estos factores (administración de compuestos de calcio, hiperfosforemia y elevadas dosis de calcitriol) han sido determinantes en los últimos años debido a las políticas de tratamiento vigentes6,7. En la actualidad, el seguimiento de las guías K/DOQI y las nuevas herramientas terapéuticas (calcimiméticos y Paricalcitol) han minimizado el peso de los mismos. Sin embargo, el cambio en el perfil de pacientes, de mayor edad y con una elevada proporción de diabéticos hace que nos planteemos un análisis más profundo de los factores relacionados con el SM, DM y obesidad, que promueven, la ateromatosis del árbol arterial, la calcificación activa de la pared vascular, los fenómenos inflamatorios acompañantes y la trombosis final.
La CUA requiere, por definición, que exista calcificación de la pared de las arteriolas de la dermis y del tejido celular subcutáneo, pero no todos los pacientes que la presentan desarrollan úlceras isquémicas. De la misma manera, que las calcificaciones de las arterias de mediano y gran tamaño no provocan isquemia a no ser que su luz esté comprometida por placas de ateroma. En las arterias de pequeño tamaño y arteriolas no existe ateromatosis y son otros los factores que conducen a la isquemia. Para analizar mejor el proceso, debemos separar el fenómeno de la calcificación vascular generalizado y que progresa lentamente durante años, de aquellos eventos agudos que bloquean el flujo en el interior de estos vasos calcificados. La calcificación vascular es necesaria pero no suficiente para que se manifieste clínicamente la enfermedad.
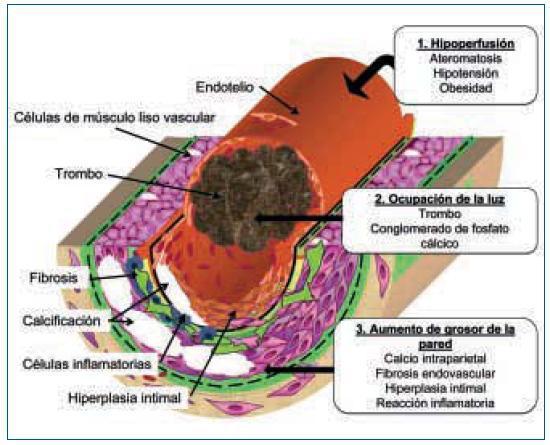
La figura 1 muestra de manera esquemática el conjunto de factores que conducen a la isquemia en la ACU: 1. El aumento del grosor de la pared del vaso; 2. La ocupación de la luz del mismo y 3. Las alteraciones hemodinámicas que provocan disminución del flujo periférico.
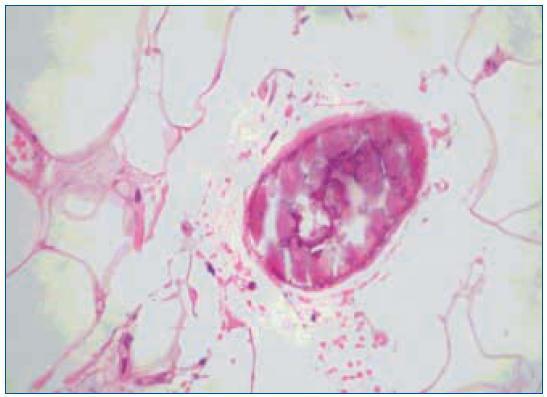
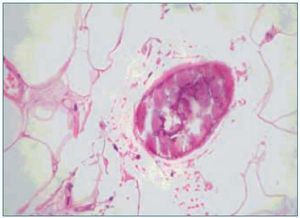
1. El aumento de grosor de la pared vascular, según los hallazgos histológicos encontrados en los vasos de las biopsias de las úlceras isquémicas, se produce por la existencia de extensas áreas de calcificación vascular, proliferación endotelial y fibrosis de la íntima. En ocasiones existe una reacción inflamatoria activa, que precede a la fibrosis, con células gigantes y que engloba las áreas de calcificación8. En el panículo adiposo también se observan fenómenos inflamatorios de distribución septal, con pequeñas zonas de calcificación extravascular y detritus celulares9. La presencia de reacción inflamatoria está en relación con la precocidad en la toma de la biopsia. En lesiones avanzadas el calcio desestructura la pared y ocupa la luz (fig. 2). Es de notar que en la revisión de Verdalles Guzman y cols., se especifica la presencia de alteraciones de los parámetros inflamatorios en todos los pacientes que podrían ser tanto la causa como la consecuencia de la ACU.
2. La ocupación de la luz del vaso. Con frecuencia los fenómenos anteriormente descritos se acompañan de trombosis de las pequeñas arterias, arteriolas. Las situaciones de hipercoagubilidad (déficits de proteínas C o S, síndrome antifosfolípido, etc.) favorecen este fenómeno. También se produce trombosis de las vénulas, frecuentemente infravalorada, pero que puede favorecer la isquemia por el edema que provocan. En la microvasculatura los conglomerados de calcio intravascular también pueden contribuir a la oclusión de la luz (figs. 1 y 2).
3. La disminución del flujo sanguíneo en áreas periféricas, puede ocurrir como consecuencia de compromiso de la circulación en lugares más proximales debido a enfermedad ateromatosa. La hipotensión o cualquier causa hemodinámica o pérdida de volumen que favorezca la hipoperfusión periférica puede agravar la isquemia tisular. En las pacientes de la serie que presentan Verdalles Guzmán y cols.5, existe factores de riesgo de enfermedad ateromatosa, obesidad y SM en el 100% de los casos y DM en el 85%. Además los autores nos llaman la atención sobre un mecanismo presente en estas pacientes, las cifras de presión arterial sistólica inferiores a 100 mmHg, provocadas por un control riguroso (¿o quizá excesivo?) de la volemia al inicio de diálisis. Este mecanismo se ve agravado por la rigidez de la pared del vaso debida a la calcificación vascular y que impide la vasodilatación periférica en respuesta a la hipoperfusión. Además en pacientes obesas puede coexistir un factor mecánico provocado por la tracción de los tractos vasculares del panículo adiposo debido al aumento de volumen del mismo9.
FENÓMENOS QUE FAVORECEN LA CALCIFICACIÓN VASCULAR EN LA DM Y SM
La CUA ocurre con mayor frecuencia en pacientes diabéticas11,12. La calcificación vascular en la ERC y DM afecta a las capas media e íntima13,14. Se inicia en las arterias de gran y mediano tamaño y progresa hasta afectar a las pequeñas arterias y arteriolas que son las que irrigan el tejido celular subcutáneo y la piel. Estas patologías desencadenan la formación ósea en la pared vascular como consecuencia de un desequilibrio entre factores promotores e inhibidores. El estudio de estos factores es un área de investigación activa de la que existen excelentes revisiones a las que remito al lector13,14.
La formación de vesículas en el core lipídico de la placa de ateroma o en el seno de la capa media es el inicio de la calcificación vascular. Estas vesículas matriz son reemplazadas por tejido osteoide sintetizado por células similares a los osteoblastos (osteoblast like cells) cuyo origen son células mesenquimales procedentes de las células de músculo liso vascular (CMLV) o de los pericitos. La posterior mineralización tiene lugar mediante un fenómeno de neovascularización por el que los vasa vasorum de la adventicia, que normalmente penetran hasta la capa media, invaden también la íntima y aportan mediadores de la inflamación, sales minerales (calcio, fósforo) y factores de crecimiento que hacen posible la mineralización12.
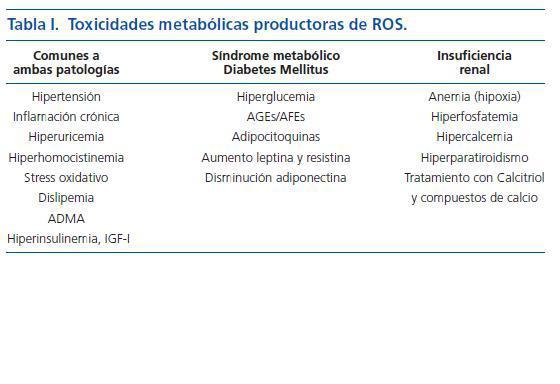
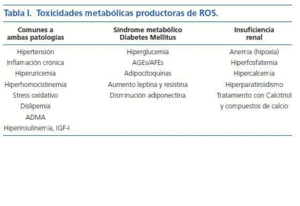
La puesta en marcha de este proceso requiere un daño vascular previo. El análisis de factores como el stress hemodinámico provocado por la HTA o los infecciosos, escapan del objetivo de ésta editorial. Me referiré aquí a la toxicidad metabólica múltiple, provocada por el SM y DM, que genera especies reactivas de oxígeno (ROS) las cuales juegan un papel central en el desarrollo de aterosclerosis. La ERC comparte algunos de estos factores y aporta otros que le son propios (Calcio, fósforo y PTH) que actúan «sensibilizando » a la pared arterial para que se desarrolle el proceso de osificación de la misma (tabla I). Señalo a continuación algunos de estos factores metabólicos tóxicos, invariablemente presentes en los pacientes con mayor riesgo de CUA, es decir, aquellos en los que coexiste la ERC y el SM o la DM:
La glucotoxicidad, induce el cambio fenotipíco de CMLV a Osteoblast like cell15,16. Ishimura y cols.16, fueron capaces de demostrar que por cada 1% de aumento de la HbA1, existe 2,1 veces más riesgo de calcificación vascular.
Los elevados niveles de ácido úrico, interfieren con el normal funcionamiento de la enzima óxido nítrico sintetasa (ONS) y por tanto en la producción de Óxido Nítrico endotelial (ONe)17,18.
La hiperhomocistinemia, induce fibrosis en la pared vascular a través de varios mecanismos que incluyen la activación y proliferación de las CMLV y la activación de ROS19-21.
Los mediadores de la inflamación (PCR, Citoquinas, etc...), se asocian a calcificación vascular en Aorta y manos de pacientes en hemodiálisis22. La Fetuina A, un reactante de fase aguda negativo y potente inhibidor de la calcificación vascular23, está aumentado en pacientes con enfermedad renal y la Interleuquina 10 con actividad antiinflamatoria se encuentra disminuida en la ERC24.
La obesidad, es una fuente de toxicidad metabólica, debido a la hiperlipemia y elevados niveles de leptina, resistina y adipocitoquinas que conducen también a la producción de ROS25.
La Hiperinsulinemia, hiperproinsulinemia y el aumento de insulin-like grow factor (IGF-I). Puede aumentar la osteogénesis de la capa media. La Amilina otra hormona secretada por las células beta pancreáticas que está también elevada en la ERC, es un regulador fisiológico del remodelado óseo y por tanto, puede estar implicado en la calcificación vascular12,26.
La dislipemia (Aumento de LDL-C, Triglicéridos y ácidos grasos libres junto a disminución de HDL-C). Estos productos lipídicos oxidados, en un medio abundante en ROS, proporcionan el núcleo (core lipídico), donde se inicia la calcificación de la placa de ateroma12,24,25.
La endoteliopatía, el endotelio regula a través de la síntesis y secreción de numerosas moléculas, el tono vascular, la inflamación, el metabolismo lipídico, la angiogenésis, el remodelado de la pared arterial/arteriolar, la coagulación y la fibrinólisis. Una enzima particular la NOSe y su producto el gas antioxidante y antiinflamatorio, NOe, juegan un papel clave. Cuando este sistema falla, debido a la toxicidad metabólica múltiple señalada anteriormente, se produce superóxido y ROS en lugar del beneficioso gas NOe. Esta disfunción endotelial a nivel de pequeñas arterias y arteriolas conduce a un estado protrombótico, a la vez que promueve la calcificación de su pared. Además, la disfunción endotelial y la calcificación hacen que los vasos sean incapaces de regular el tono y adaptarse a los cambios hemodinámicos27.
FUTURAS DIRECCIONES EN LA PREVENCIÓN Y TRATAMIENTO
El perfil actual de pacientes y el conocimiento de los factores descritos, nos obliga a tomar en consideración otras medidas preventivas y terapias más allá de las que conducen a controlar rigurosamente las alteraciones del metabolismo mineral. La reducción del stress oxidativo, se consigue llevando a la práctica las medidas que conducen a una reducción del riesgo cardiovascular global.
Recientemente se ha empezado a utilizar el Tiosulfato de sodio intravenoso, que cumple una función antioxidante y quelante del calcio. Tiene una estructura química tetraédrica con un átomo central de azufre rodeado de tres átomos de oxígeno y otro átomo de azufre. En la actualidad se usa como quimioprotector en el tratamiento con Cisplatino. En los casos descritos, se aprecia una rápida mejoría del dolor (días) y una más lenta resolución de las úlceras isquémicas (meses), cuando se utiliza junto con otras medidas como la cámara hiperbárica28. Sus propiedades antioxidantes ayudan a corregir la disfunción endotelial y favorece la vasodilatación. Además forma con el calcio Tiosulfato cálcico que es 3.600 veces más soluble que el fosfato cálcico (presente en la calcificación vascular) lo que podría favorecer la eliminación de los depósitos vasculares de calcio. La rápida mejoría del dolor puede deberse a sus efectos sobre los vasa nervorum y endoneuro también calcificados11. La ausencia de otros tratamientos eficaces y la baja toxicidad hacen que debamos considerar éste fármaco como de primera línea en la CUA, junto a otras medidas como la cámara hiperbárica y el control riguroso del metabolismo mineral.
Existen datos recientes que relacionan las nanobacterias con el desarrollo de enfermedad aterosclerótica y la calcificación vascular. Estas bacterias que pertenecen a la familia de las Gram negativas pero que son 100 veces más pequeñas, se han visualizado por técnicas de inmunohistoquímica en tejido cardiovascular humano calcificado29. Se ha podido demostrar mejoría significativa de la calcificación en arterias coronarias en pacientes tratados con Tetraciclinas durante cuatro meses. Estos hechos abren nuevas posibilidades de tratamiento.
La asociación entre osteoporosis y calcificación vascular, también nos sugiere que tratamientos antireabsortivos como los bifosfonatos y otros nuevos fármacos de próxima introducción en la práctica clínica como los anticuerpos anti-RankL, pueden tener un efecto beneficioso30. Los resultados del tratamiento con bifosfonatos en pacientes con ACU son controvertidos31,32.
Mientras tanto, la mejor herramienta es la prevención de la isquemia secundaria a ACU, identificando precozmente al paciente con riesgo de desarrollarlas: mujeres obesas con SM o DM. Especialmente en estas, debe realizarse un control riguroso de las múltiples toxicidades metabólicas (reducción de riesgo vascular global: estatinas, inhibidores del sistema renina- angiotensina-aldosterona, AAS, control glucémico y de la hipertensión arterial). De manera paralela deben evitarse los factores que predisponen a la ACU (traumas locales, obesidad, tratamiento con anticoagulantes orales dicumarínicos, hipotensión, etc...). Sólo el conocimiento de todos ellos por el equipo de profesionales que trata al paciente puede evitar que se desencadene ésta grave enfermedad.
Figura 1.
Figura 2.
Tabla 1.