Introducción y objetivos: El fracaso renal agudo (FRA) es una complicación frecuente tras la cirugía cardiaca y las intervenciones percutáneas coronarias cuya aparición empeora el pronóstico de manera marcada. En los últimos años se han identificado nuevos biomarcadores precoces de FRA, pero aún quedan muchos aspectos importantes por resolver. Klotho es una proteína pleiotrópica que actúa como un factor paracrino y endocrino en múltiples órganos. En diversos modelos animales de FRA se ha demostrado niveles disminuidos de Klotho renal. No se ha publicado ningún estudio en el que se haya probado Klotho como marcador precoz de FRA en humanos. El objetivo de este trabajo es investigar la utilidad de la determinación de Klotho en orina para el diagnóstico precoz del FRA en pacientes con síndrome coronario agudo o fallo cardiaco sometidos a cirugía cardiaca o angiografía coronaria.
Métodos: Se midió Klotho urinario 12 horas tras la intervención en 60 pacientes ingresados en la unidad de cuidados intensivos por síndrome coronario agudo o fallo cardiaco secundarios a enfermedad coronaria o valvular y a los que se realizó angiografía coronaria (30 pacientes) o cirugía cardiaca de recambio valvular o bypass (30 pacientes). El criterio de valoración primario fue la aparición de FRA según la clasificación RIFLE. Los niveles de Klotho humano se midieron utilizando un ensayo ELISA.
Resul**tados: No encontramos diferencias en los niveles de Klotho en orina entre los pacientes que desarrollaron FRA y aquellos que no. Además, no había correlación significativa entre niveles de klotho en orina y presencia de FRA.
Conc**lusión: Klotho urinario medido por ELISA no parece ser un buen candidato para ser usado como biomarcador precoz de FRA.
Introdu**ction and objectives: Acute kidney injury (AKI) is a common complication after cardiac surgery and percutaneous coronary interventions that markedly worsens prognosis. In the last years new early biomarkers for AKI have been identified, but many important aspects still remain to be solved. Klotho is a pleiotropic protein that acts as a paracrine and endocrine hormonal factor in multiple organs. Renal Klotho deficiency has been shown in several AKI animal models. No study has been published in which Klotho was tested in humans as an early biomarker of AKI. The aim of this study was to assess the usefulness of urinary determination of Klotho for the early detection of AKI in patients with acute coronary syndrome or heart failure undergoing cardiac surgery or coronary angiography.
Meth**ods: Urinary Klotho was measured 12hours after intervention in 60 patients admitted to the Intensive Care Unit with acute coronary syndrome or heart failure due to coronary or valvular pathologies, who underwent coronary angiography (30 patients), or cardiac bypass surgery or heart valve replacement (30 patients). The endpoint used for evaluating our patients was the appearance of AKI, in keeping with the RIFLE classification system. Human Klotho levels were measured using an ELISA assay.
Re**sults: We found no differences in urinary Klotho levels between patients with AKI and those who did not develop AKI. Moreover, there was no significant correlation between urinary Klotho levels and AKI development.
Con**clusions: Urinary Klotho measured by ELISA does not seem to be a good candidate to be used as an early biomarker of AKI.
El fracaso renal agudo (FRA) es una complicación frecuente tras la cirugía cardiaca y las intervenciones coronarias percutáneas, con una incidencia estimada en torno al 30% en la primera población1–3 y entre el 5 y el 20% en la segunda4–6. La aparición del FRA empeora de forma importante el pronóstico de estos pacientes2,3,7. El FRA aumenta la mortalidad en diferentes contextos clínicos y además los pacientes a menudo desarrollan enfermedad renal crónica (ERC) tras el mismo8,9. Los mecanismos implicados en el FRA incluyen toxinas endógenas y exógenas, factores metabólicos, isquemia y reperfusión, activación neurohumoral, inflamación y stress oxidativo10. El diagnóstico de FRA se basa en la detección del aumento de la creatinina sérica, que se produce tardíamente y no refleja adecuadamente el filtrado glomerular en el paciente agudo11. Sin embargo, los estudios experimentales demuestran que el FRA solo se puede prevenir o tratar mediante intervenciones precoces12.
En los últimos años se han identificado nuevos biomarcadores precoces de FRA, como NGAL (Neutrophil Gelatinase-Associated Lipocaline), KIM-1 (Kidney Injury Molecule 1), L-FABP (Liver Fatty Acid-Binding Protein), Cistatina C o IL-18 (Interleuquina 18), pero en la búsqueda del biomarcador ideal aún quedan muchos aspectos importantes por resolver13. El estudio de estas moléculas también ha permitido avanzar en el conocimiento de la patogenia del FRA.
El gen Klotho fue identificado en 1997 como un gen antienvejecimiento14. Este gen se expresa en múltiples tejidos, siendo el riñón el órgano en el que lo hace de forma más marcada15, especialmente en el túbulo distal pero también en el proximal16 y en el colector17,18. Klotho es una proteína transmembrana que actúa como correceptor para el fibroblast growth factor-23 19,20 (FGF-23). El ectodominio puede ser cortado y liberado al espacio extracelular por las proteasas ancladas a la membrana ADAM10 y ADAM1721, dando lugar al Klotho soluble, que está presente en sangre, fluido cerebroespinal22 y orina23. Existe otra proteína soluble Klotho que es más corta, pero su función no es bien conocida24. El Klotho soluble es una proteína pleiotrópica que actúa como un factor hormonal paracrino y endocrino, tanto en riñón como en otros órganos25. En el túbulo renal Klotho modula cotransportadores sodio-fosfato23, canales de calcio26 y canales de potasio27. Finalmente Klotho está también presente a nivel nuclear y citoplásmico, donde funciona como una proteína antienvejecimiento28,29.
El papel de Klotho en el envejecimiento y en el metabolismo fosfocálcico se conoce cada vez mejor16,30,31. Su implicación en la progresión de la ERC y sus complicaciones extrarrenales también ha sido sujeto de intense estudio en los últimos años25,32–34, así como la relación entre sus niveles circulantes, el filtrado glomerular y el pronóstico de la ERC35 o su potencial uso como agente antifibrótico36. Respecto al FRA, se ha demostrado la existencia de niveles disminuidos de Klotho en diversos modelos animales de FRA inducido por isquemia-reperfusión, obstrucción ureteral o agentes nefrotóxicos23,37–43. En 2010 Hu et al.23 midieron Klotho urinario en 17 pacientes con FRA y encontraron niveles disminuidos comparados con los valores obtenidos de 14 voluntarios sanos. No se ha publicado ningún otro estudio sobre Klotho como biomarcador de FRA en humanos. El objetivo de este trabajo ha sido evaluar la utilidad de la determinación de Klotho en orina para la detección precoz del FRA en pacientes con síndrome coronario agudo o fallo cardiaco sometidos a cirugía cardiaca o angiografía coronaria.
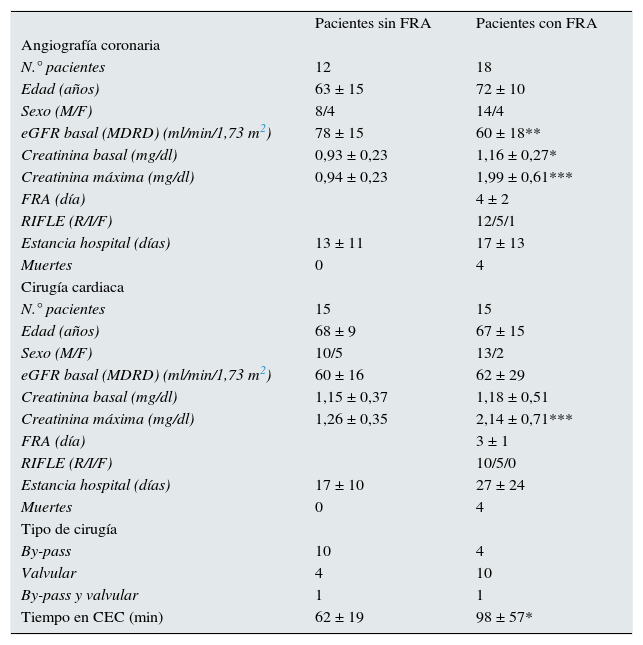
MétodosPacientesSe ha incluido 60 pacientes de una cohorte de 193 pacientes ingresados en la unidad de cuidados intensivos (UCI) del Hospital Clínico Universitario de Valencia con síndrome coronario agudo (SCA) o fallo cardiaco secundario a enfermedad coronaria o valvular y que fueron sometidos a angiografía coronaria con o sin angioplastia o cirugía cardiaca. El grupo de angiografía coronaria estaba compuesto por 30 pacientes: 18 que presentaron FRA tras la intervención y 12 que no lo presentaron. Otros 30 pacientes fueron también seleccionados en el grupo de cirugía cardiaca: 15 con y 15 sin FRA (tabla 1).
Características clínicas y demográficas de los pacientes
| Pacientes sin FRA | Pacientes con FRA | |
| Angiografía coronaria | ||
| N.° pacientes | 12 | 18 |
| Edad (años) | 63 ± 15 | 72 ± 10 |
| Sexo (M/F) | 8/4 | 14/4 |
| eGFR basal (MDRD) (ml/min/1,73 m2) | 78 ± 15 | 60 ± 18** |
| Creatinina basal (mg/dl) | 0,93 ± 0,23 | 1,16 ± 0,27* |
| Creatinina máxima (mg/dl) | 0,94 ± 0,23 | 1,99 ± 0,61*** |
| FRA (día) | 4 ± 2 | |
| RIFLE (R/I/F) | 12/5/1 | |
| Estancia hospital (días) | 13 ± 11 | 17 ± 13 |
| Muertes | 0 | 4 |
| Cirugía cardiaca | ||
| N.° pacientes | 15 | 15 |
| Edad (años) | 68 ± 9 | 67 ± 15 |
| Sexo (M/F) | 10/5 | 13/2 |
| eGFR basal (MDRD) (ml/min/1,73 m2) | 60 ± 16 | 62 ± 29 |
| Creatinina basal (mg/dl) | 1,15 ± 0,37 | 1,18 ± 0,51 |
| Creatinina máxima (mg/dl) | 1,26 ± 0,35 | 2,14 ± 0,71*** |
| FRA (día) | 3 ± 1 | |
| RIFLE (R/I/F) | 10/5/0 | |
| Estancia hospital (días) | 17 ± 10 | 27 ± 24 |
| Muertes | 0 | 4 |
| Tipo de cirugía | ||
| By-pass | 10 | 4 |
| Valvular | 4 | 10 |
| By-pass y valvular | 1 | 1 |
| Tiempo en CEC (min) | 62 ± 19 | 98 ± 57* |
FRA: Fracaso Renal Agudo; eGFR basal (MDRD): filtrado glomerular estimado por MDRD antes de la intervención. FRA (día): día de diagnóstico del FRA por creatinina en suero. Tiempo en CEC: tiempo de circulación extracorpórea en minutos. Los valores se dan como media ± DE.
Los valores de los pacientes con FRA que se diferencian significativamente de los pacientes sin FRA se expresan con *p < 0,05; **p < 0,01; ***p < 0,001.
Los criterios de exclusión fueron: edad menor de 18 años, ERC en tratamiento sustitutivo y FRA secundario a shock cardiogénico durante la hospitalización. Todos los pacientes fueron monitorizados prospectivamente desde el momento de la inclusión en el estudio. Se midió la creatinina sérica desde antes del procedimiento hasta seis días después y se siguió la evolución clínica de cada paciente hasta el alta. Se utilizó el primer valor de creatinina sérica obtenido en el ingreso como el nivel basal de creatinina. Las muestras de orina para la determinación de Klotho se recogieron 12 horas tras la intervención, y se procesaron inmediatamente tras su obtención. También obtuvimos muestras de orina de 10 voluntarios sanos para obtener valores de normalidad. Se recogió además la siguiente información de cada paciente: variables demográficas y comorbilidades, parámetros del procedimiento quirúrgico y complicaciones durante o tras las intervenciones (tabla 2). El criterio de valoración primario utilizado fue la aparición del FRA, definido como un aumento de la creatinina del 50% o mayor, siguiendo la clasificación RIFLE44 (Risk, Injury, Failure, Loss, End-stage renal disease). Este estudio fue aprobado por el comité ético del Hospital Clínico Universitario de Valencia y se siguieron los principios de la declaración de Helsinki45.
Valores de Klotho urinario utilizando dos kits ELISA comerciales
| Parámetro | Control (n = 10) | Angiografía | Cirugía cardiaca | Angiografía + Cirugía cardiaca | |||
|---|---|---|---|---|---|---|---|
| No FRA (n = 12) | FRA (n = 18) | No FRA (n = 15) | FRA (n = 15) | No FRA (n = 27) | FRA (n = 33) | ||
| Kit ELISA (Sun Red Biotechnologies) | |||||||
| Klotho (ng/ml) | 1,80 ± 0,04 | 1,87 ± 0,05 | 1,94 ± 0,05* | 1,80 ± 0,08 | 1,97 ± 0,04* | 1,85 ± 0,04 | 1,96 ± 0,03 |
| Klotho (ng/mg creatinina) | 1,37± 0,24 | 2,12 ± 0,38 | 2,40 ± 0,45 | 2,00 ± 0,23 | 2,51 ± 0,21** | 2,04 ± 0,20 | 2,45 ± 0,26* |
| Kit ELISA (IBL International) | |||||||
| Klotho (ng/ml) | 0,77 ± 0,18 | 1,24 ± 0,34 | 1,51 ± 0,25 | 1,34 ± 0,36 | 1,25 ± 0,33 | 1,29 ± 0,25 | 1,38 ± 0,15 |
| Klotho (ng/mg creatinina) | 0,62 ± 0,05 | 1,23 ± 0,20 | 1,53 ± 0,30 | 1,25 ± 0,25 | 1,70 ± 0,30* | 1,24 ± 0,30 | 1,60 ± 0,30 |
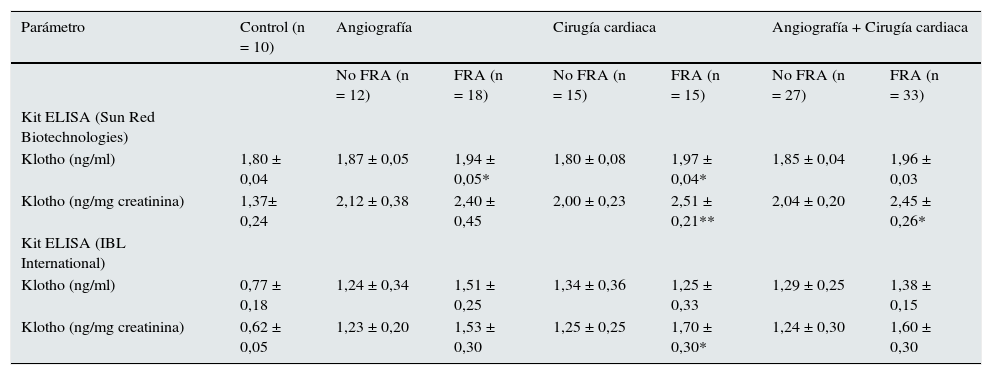
NO FRA: Pacientes que no desarrollaron fracaso renal agudo. FRA: Pacientes que desarrollaron fracaso renal agudo.
Los valores se expresan como media ± SEM. Los resultados se analizaron mediante ANOVA de un factor con análisis post-hoc de Bonferroni.
Los valores en pacientes que son significativamente diferentes del grupo control se indican como: *p < 0,05; **p < 0,01.
Las muestras de orina se centrifugaron inmediatamente tras su obtención, durante 10 minutos a 1500g y se almacenó el sobrenadante en alícuotas de 0,5ml a –80°C para su uso posterior.
Medición de los niveles de Klotho en orinaLos niveles de Klotho humano se determinaron en orina, tanto de los pacientes como de los controles, usando dos ensayos ELISA comerciales, uno de Shanghai Sunred Biological Technology Co., Ltd, con sensibilidad de 0,05 ng/ml y un rango del ensayo de 0,1-20 ng/ml, y otro de IBL International (Human soluble a-Klotho Assay Kit-IBL, Immuno-Biological Laboratories Co., Ltd), con sensibilidad de 0,006 ng/ml y un rango del ensayo de 0,093-6 ng/ml. Los valores obtenidos se ajustaron para creatinina en orina. La creatinina se midió en suero y orina utilizando técnicas standard.
Análisis estadísticoAnalizamos los resultados con GraphPad PRISM (versión 4.0) software. Se realizó un test de Kolmogorov-Smirnov para verificar que las variables seguían una distribución normal. Para la comparación de medias de más de dos variables, se realizó un ANOVA de un factor con análisis post-hoc de Bonferroni y para comparación de dos medias el test de Student o el test de Mann-Whitney en el caso de distribución no normal. Las correlaciones entre la presencia de FRA y los niveles de Klotho en orina se realizaron mediante correlación de Spearman. Las correlaciones entre los niveles de Klotho medidos con los dos ensayos ELISA y entre el nivel de Klotho (ng/mg creatinina) y el delta de creatinina sérica (creatinina máxima en suero – creatinina basal) se realizaron mediante correlación bivariada de Pearson, con el programa de análisis SPSS vs. 19. El nivel de significación se estableció en p < 0,05.
ResultadosCaracterísticas de los pacientesEn la tabla 1 se muestran las características clínicas y demográficas de los pacientes. El diagnóstico de FRA por creatinina necesitó 3 ± 1 días en los pacientes de cirugía cardiaca y 4 ± 2 días en el de angiografía. Respecto a la mortalidad, ocho pacientes fallecieron, 4 de ellos del grupo de cirugía cardiaca y los otros 4 del grupo de angiografía; todos ellos habían desarrollado FRA. Los pacientes con FRA presentaron una media de estancia hospitalaria mayor que los que no desarrollaron FRA en los dos grupos de pacientes, aunque las diferencias no eran significativas. En el grupo de angiografía la creatinina sérica pre-intervención era significativamente mayor (p < 0,05) en los pacientes que desarrollaron FRA que en los que no lo desarrollaron, mientras que el filtrado glomerular estimado basal (eGFR) era significativamente menor en los pacientes con FRA (p < 0,01). No se encontraron diferencias significativas en estos valores en el grupo de pacientes sometidos a cirugía cardiaca (tabla 1). En este grupo, los pacientes que desarrollaron FRA habían estado sometidos a mayor tiempo de circulación extracorpórea (CEC) (p < 0,05) que los que no lo desarrollaron (tabla 1).
Valores de Klotho urinarioLos niveles de proteína Klotho en orina estaban significativamente elevados en los pacientes con FRA tanto en el grupo de angiografía como en el de cirugía cardiaca, cuando se comparan con el grupo control (p < 0,05) (tabla 2). Al corregir las concentraciones de Klotho por los niveles de creatinina en orina solo los pacientes con FRA del grupo de cirugía diferían de los controles (p < 0,01), pero no había diferencias significativas respecto a los pacientes sin FRA (tabla 2). Considerando juntos los pacientes de ambos grupos, los niveles de Klotho en orina (corregidos por creatinina) eran significativamente mayores en los pacientes con FRA que en los controles sanos (p < 0,05), pero no había diferencias significativas respecto a los pacientes sin FRA (tabla 2). Cuando se realizó la prueba de Spearman tampoco se halló correlación entre los valores de Klotho y la presencia de FRA (r = 0,182, p = 0,67). Además se estudió si había correlación entre el nivel de Klotho (ng/mg creatinina en orina) y el delta de creatinina sérica (creatinina máxima en suero – creatinina basal) para ambos ensayos ELISA, no encontrándose correlaciones significativas considerando juntos los pacientes de ambos grupos ni en cada uno de los grupos por separado, independientemente del ensayo utilizado.
No había correlación significativa entre los niveles de Klotho urinario (ng/ml) medido en ambos ensayos ELISA (r = –0,079; p = 0,614), ni tras corregir con la creatinina en orina (r = –0,043; p = 0,792).
DiscusiónEn este estudio evaluamos la utilidad de la determinación por ELISA de proteína Klotho en muestras de orina para la detección precoz (a las 12 horas de la intervención) del FRA en un grupo de pacientes con síndrome coronario agudo o fallo cardiaco sometidos a cirugía cardiaca o angiografía coronaria con o sin angioplastia o implantación de endoprótesis y no encontramos diferencias significativas en los niveles de Klotho entre los pacientes que presentaron FRA y aquellos que no lo desarrollaron. También encontramos un pequeño pero significativo aumento en los niveles de Klotho urinario en los pacientes con FRA tras cirugía cardiaca en comparación con los controles sanos. La proteína Klotho se midió en orina con dos kits ELISA distintos para Klotho humano. No se ha publicado ningún otro estudio en el que se haya probado el Klotho urinario como biomarcador precoz de FRA en humanos. Existe un único estudio23 en el que se midió Klotho en orina en 17 pacientes con FRA por inmunoblot usando anticuerpos anti-Klotho, y los autores comunicaron una disminución de Klotho en los pacientes con FRA en comparación con 14 controles sanos, pero las muestras de orina se recogieron tarde en la evolución del fracaso renal. Se ha demostrado en modelos animales que Klotho está infraexpresado en tejido renal en FRA secundario a isquemia-reperfusión, obstrucción ureteral, sepsis o agentes nefrotóxicos23,37–43, y que la sobrexpresión de la proteína transmembrana o la administración de la proteína soluble tiene un efecto protector contra el daño renal inducido por isquemia y reperfusión23,38 o nefrotoxinas42. En 2010 Hu et al.23 midieron la expresión de Klotho en tejido renal así como los niveles de proteína Klotho en plasma y orina en un modelo animal de FRA inducido por isquemia y reperfusión, y encontraron que Klotho estaba disminuido a todos los niveles.
Nosotros ya habíamos estudiado la utilidad de distintos biomarcadores como predictores precoces de FRA en esta cohorte de pacientes y habíamos demostrado la elevada capacidad predictiva de NGAL46,47. Basándonos en la evidencia obtenida en los modelos animales de FRA, esperábamos encontrar una disminución en los niveles de proteína Klotho en orina en los pacientes con FRA. Hay varias explicaciones para estos resultados divergentes. En primer lugar, todos los experimentos han sido realizados en ratas y ratones. Es obvio que las condiciones en las que se desarrolla un experimento animal no son comparables con lo que sucede en un contexto clínico y que los resultados obtenidos no pueden ser directamente extrapolados. Más aún, es posible que la proteína Klotho no se comporte igual en humanos que en los modelos animales. Otra posible explicación radica en el momento de la recolección de la muestra. Hu et al.23 encontraron niveles disminuidos de Klotho en orina un día tras la isquemia-reperfusión, pero en nuestro estudio las muestras se recogieron 12 horas tras la intervención. También midieron Klotho en orina de 17 pacientes con FRA y encontraron que los niveles eran muy inferiores a los obtenidos de voluntarios sanos, pero en este estudio la población con FRA era muy heterogénea (incluyendo FRA pre-renal y asociado a sepsis, lupus, obstrucción, fallo hepático, trasplante, síndrome hemolítico urémico y embarazo) y no se mostraban los datos acerca del momento de recogida de las muestras. De cualquier modo, cuando se obtuvieron estas, la creatinina sérica era 3,76 ± 0,58 mg/dl, por lo que fueron recogidas muy tardíamente. También es posible que los niveles de Klotho urinario no reflejen bien la expresión de Klotho a nivel del tejido renal. Sabemos que los niveles circulantes no se relacionan con la expresión en tejido renal en ERC. Los datos de experimentación animal indican claramente que existe déficit de Klotho a nivel renal en la ERC48. Sin embargo, la determinación de la proteína Klotho en plasma ofrece resultados divergentes. Hu et al.48 encontraron niveles muy bajos de Klotho en tejido renal, plasma y orina en ratones con ERC mientras que Sugiura et al.49 hallaron niveles elevados en plasma obtenido de pacientes con ERC. Devaraj et al.50 comunicaron niveles disminuidos en pacientes diabéticos y elevados en pacientes con ERC, y además estos valores se correlacionaban con la creatinina plasmática. Propusieron la hipótesis de que la proteína Klotho se podría estar sintetizando a nivel extrarrenal para proveer protección renal por mecanismos anti-oxidantes y antiinflamatorios. Sin embargo Seiler et al.35 determinaron niveles de Klotho plasmático en una cohorte de 312 pacientes con ERC estadio 2-4 y no encontraron correlación con el filtrado glomerular. Los niveles plasmáticos de Klotho no se relacionaban con la función renal y no predecían la evolución en pacientes con ERC. Es posible que en los pacientes con FRA la proteína Klotho se esté sintetizando a nivel extrarrenal también para proveer protección renal y que, debido a la filtración glomerular, esté apareciendo en orina. Hu et al.23 y Moreno et al.40 encontraron niveles disminuidos de Klotho en plasma en modelos animales de FRA. Hasta ahora, no hay estudios en los que se haya determinado Klotho en plasma en humanos con FRA. Incluso aunque los niveles de Klotho no estuvieran aumentados en plasma, pudiera ser que se estuviera sintetizando a nivel extrarrenal y pasando a la orina. Por tanto, los niveles en plasma u orina pueden no reflejar lo que está sucediendo a nivel tisular. Se requerirían más estudios para clarificar esta cuestión.
Otra posible explicación para los resultados es obviamente la existencia de diferencias metodológicas. Para dotar de mayor robustez a los resultados se utilizaron dos kits ELISA humanos distintos, procedentes de distintos fabricantes para medir los niveles de Klotho urinario, no encontrando con ninguno de los dos kits diferencias entre los pacientes con y sin fracaso renal agudo. Destaca además la escasa concordancia obtenida entre ambos ensayos. Es posible que distintos ensayos reconozcan diferentes partes de la molécula y que algunos reconozcan la molécula entera y otros reconozcan fragmentos. Heijboer et al.51 evaluaron tres ensayos ELISA distintos, entre ellos el de IBL, encontrando importantes diferencias en calidad entre ellos, siendo claramente superior el de IBL a los otros dos evaluados.
ConclusiónA pesar de la evidencia en experimentación animal de que Klotho está infraexpresado en el riñón tras FRA tanto tóxico como isquémico, en este estudio no encontramos ninguna correlación entre la presencia de FRA y los niveles de Klotho en orina 12 horas tras la intervención en un grupo de pacientes ingresados en la UCI por síndrome coronario agudo o fallo cardiaco y sometidos a cirugía cardiaca o angiografía coronaria con o sin angioplastia o implantación de endoprótesis. Aunque estos resultados necesitan confirmación, Klotho en orina medido por ELISA no parece ser un buen candidato para ser usado como biomarcador precoz de FRA.
FinanciaciónEste trabajo ha recibido ayudas del Ministerio de Ciencia e Innovación [PS09/00806 (CM), PI10/01434 (AM) y PI12/00884 (CM)] co-financiados por el Fondo Europeo de Desarrollo Regional (FEDER); ayudas de la Consellería de Educación de la Generalitat Valenciana (ACOMP/2009/191 y ACOMP/2012/056 a CM) y Sanitat (AP-028/10, AP-087/11 a CM); Consellería de Educación, Cultura y Deportes ACOM/2012/238; Instituto Carlos III; PI10/00802; PI13/01848; CIBEROBN 12/03/30016.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Referencia no citada[45].