Introducción: La corrección de la acidosis metabólica provocada por la insuficiencia renal se consigue aportando bicarbonato durante la diálisis. Para evitar la precipitación de carbonato cálcico y magnésico que se produce en el líquido de diálisis (LD) al añadir bicarbonato, es necesario añadir un ácido, habitualmente acetato, que no está exento de efectos secundarios. Así, el citrato se presenta como una alternativa ventajosa al acetato, aunque sus efectos agudos no se conocen con precisión.
Objetivo: Evaluar el efecto agudo sobre los parámetros del equilibrio ácido base y del metabolismo calcio-fósforo con la utilización de un líquido de diálisis con citrato en lugar de acetato.
Material y métodos: Estudio prospectivo y cruzado realizado en veinticuatro pacientes (15 hombres y 9 mujeres). Todos los pacientes se dializaron con monitor AK- 200-Ultra-S con líquido de diálisis SoftPac®, elaborado con 3 mmol/l de acetato y con SelectBag Citrate®, con 1 mmol/l de citrato, libre de acetato. Se extrajeron pre y post-diálisis: gasometría venosa, calcio (Ca), calcio iónico (Cai), fósforo (P) y hormona paratiroidea (PTH).
Resultados: Encontramos diferencias (p < 0,05) cuando utilizamos el baño con citrato (C) frente a acetato (A) en los valores postdiálisis de: pH (C: 7,43 (0,04) vs. A: 7,47 (0,05)), bicarbonato (C: 24,7 (2,7) vs. A: 27,3 (2,1) mmol/L), exceso de base (BEecf) (C: 0,4 (3,1) vs A: 3,7 (2,4) mmol/L), calcio corregido (Cac) (C: 9,8 (0,8) vs A: 10,1 (0,7) mg/dl) y Cai (C: 1,16 (0,05) vs A: 1,27 (0,06) mmol/L). No encontramos diferencias en ninguno de los parámetros medidos prediálisis.
Conclusión: La diálisis con citrato consigue un mejor control de equilibrio ácido base postdiálisis disminuyendo/evitando la alcalemia postdiálisis y un menor aumento de calcio corregido (Cac) y Cai. Este hallazgo es de especial interés en pacientes con factores predisponentes a arritmias, pacientes con insuficiencia respiratoria, retención de carbónico, calcificaciones y hepatopatía avanzada.
Introduction: Correcting metabolic acidosis provoked by renal failure is achieved by supplying bicarbonate during dialysis. To prevent the precipitation of calcium and magnesium carbonate produced in the dialysis fluid (DF) when bicarbonate is added, it is necessary to add an acid (normally acetate), which involves secondary effects. Consequently, citrate is presented as an advantageous alternative to acetate, although its acute effects are not known with precision.
Objective: Our objective was to assess the acute effect of using a DF with citrate instead of acetate on the parameters of acid-base balance and of phosphorus-calcium metabolism.
Material and methods: We carried out a prospective, cross-over study on 24 patients (15 males and 9 females). All the patients were dialysed using an AK 200 ULTRA-S monitor with SoftPac® DF, prepared with 3 mmol/l of acetate, and with SelectBag Citrate®, with 1 mmol/l of acetate-free citrate. Before and after dialysis we extracted: venous blood gases, calcium (Ca), ionized calcium (Cai), phosphorus (P) and parathyroid hormone (PTH).
Results: We found differences (P<.05) when we used a dialysate with citrate (C) compared with using acetate (A) in the post-dialysis values of pH (C: 7.43 [0.04] vs A: 7.47 [0.05]), bicarbonate (C: 24.7 [2.7] vs A: 27.3 [2.1] mmol/L), base excess of extracellular fluid (BEecf) (C: 0.4 [3.1] vs A: 3.7 [2.4] mmol/L), corrected calcium (cCa) (C: 9.8 [0.8] vs A: 10.1 [0.7] mg/dl) and Cai (C: 1.16 [0.05] vs A: 1.27 [0.06] mmol/L). We found no differences in any of the parameters measured before dialysis.
Conclusion: Dialysis with citrate achieves better post-dialysis acid-base balance, lowering/avoiding post-dialysis alkalemia and producing a lower increase in corrected calcium (Cac) and Cai. This finding is of special interest for patients with predisposing factors to arrhythmia and patients with respiratory failure, carbon dioxide retention, calcifications or advanced hepatopathy.
La corrección de la acidosis metabólica es uno de los objetivos del tratamiento de la enfermedad renal crónica. Para lograrlo en los pacientes en hemodiálisis se aporta bicarbonato durante las sesiones. La concentración óptima de bicarbonato con la que debemos mantener a estos pacientes no se conoce con exactitud. La guía KDOQI recomienda mantener un bicarbonato prediálisis de 22 mEq/L en todos los pacientes1, mientras que la UK Renal Association propone distintos objetivos para los pacientes en diálisis peritoneal (25-29 mmol/L) y hemodiálisis2 (HD) (20-26 mmol/L).
Podríamos definir la concentración de bicarbonato óptima del LD como aquella que previene la acidosis metabólica interdiálisis evitando la alcalosis intra y postdiálisis. Conseguir este objetivo es complejo, ya que el paciente en hemodiálisis tiene una depleción progresiva de bicarbonato en el periodo interdialítico y durante la diálisis se produce una sobrecarga brusca del mismo.
Desde el punto de vista técnico, para evitar la precipitación de carbonato cálcico y magnésico que se produce en el LD al añadir bicarbonato, es necesario añadir un ácido, de forma que se utiliza un sistema de generación de LD con 2 concentrados, uno con el bicarbonato y el otro con el ácido. El ácido utilizado habitualmente es el acético, a unas concentraciones que oscilan entre los 3 y 10 mmol/L. Esta pequeña cantidad hace que se transfiera acetato al paciente durante la HD, elevando su concentración en sangre, ya que el LD tiene concentraciones 30-40 veces superiores a los valores normales en sangre (0,1 mmol/L). Esta exposición al acetato aumenta en técnicas de hemodiafiltración (HDF) online3 debido a la mayor cantidad de líquido infundido. Entre los efectos secundarios descritos con el acetato cabe destacar por su importancia durante la HD la inestabilidad hemodinámica producida por la vasodilatación mediada por la liberación de óxido nítrico4 y la activación de citoquinas proinflamatorias por la hipoxia5. Aún comparado con un LD con pequeñas concentraciones de acetato (3 mmol/L), se ha descrito un menor riesgo de complicaciones hemodinámicas cuando los pacientes se dializan con LD libre de acetato6.
Por ello, desde hace años se han buscado otros ácidos como estabilizantes del LD. Los primeros intentos de sustitución del acetato se realizaron con ácido clorhídrico. Con ese LD sin acetato, se pudo objetivar que el incremento habitual en la acetatemia que presentaban los pacientes dializados con LD con bicarbonato y 4 mmol/L de acetato, podía corregirse al usar un concentrado con clorhídrico7,8. El problema con este LD con alto contenido en cloro es que modifica la relación concentración de sodio y conductividad, produciendo cambios en los iones séricos de modo que es necesario cambiar las conductividades total y parcial de bicarbonato no estando su forma de uso claramente estandarizada.
En la actualidad disponemos de un LD con citrato, que surge como una alternativa para acidificar sin usar acetato. El citrato es un quelante del calcio (Ca) que se usa por su efecto anticoagulante al disminuir el calcio iónico (Cai). Se estima que produce una disminución de un 10% del Cai, por ello la mayoría de los autores recomiendan cuando se utiliza citrato como ácido suplementar el calcio del LD para corregir estas diferencias. Según demostraron Steckiph y cols9, por cada mmol de citrato, la concentración de calcio debe aumentar 0,15 mmol/L para mantener el balance de calcio durante el tratamiento y prevenir la hipocalcemia. Se han descrito varios efectos beneficiosos a largo plazo en relación al citrato como son una menor trombogenicidad10, mejoría de los aclaramientos11,12, de la inflamación13, nutrición14, la tolerancia15,16 y del control ácido-base con menor acidosis prediálisis17.
ObjetivoEvaluar el efecto agudo sobre los parámetros del equilibrio ácido base y del metabolismo calcio-fósforo con la utilización de un LD con citrato en lugar de acetato en pacientes en HD crónica.
Material y métodosSe trata de un estudio prospectivo realizado en un único centro de diálisis hospitalario, con un diseño cruzado.
PacientesSe incluyeron veinticuatro pacientes (15 hombres y 9 mujeres) clínicamente estables Los criterios de inclusión fueron una edad superior a 18 años, tiempo en tratamiento con diálisis superior a tres meses, situación clínica estable y dar el consentimiento informado.
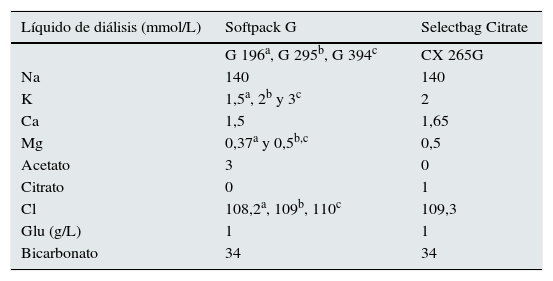
MétodosEstudio prospectivo y cruzado, comparando una única sesión de diálisis realizada con LD con acetato frente a otra sesión de diálisis con citrato. Todos los pacientes se dializaron con monitor AK-200-Ultra-S con líquido de diálisis SoftPac®, elaborado con 3 mmol/L de acetato y con SelectBag Citrate®, con 1 mmol/L de citrato y libre de acetato. La composición de los líquidos de diálisis utilizados se muestra en la tabla 1.
Composición calculada de los electrolitos del LD con acetato y del LD con citrato
| Líquido de diálisis (mmol/L) | Softpack G | Selectbag Citrate |
|---|---|---|
| G 196a, G 295b, G 394c | CX 265G | |
| Na | 140 | 140 |
| K | 1,5a, 2b y 3c | 2 |
| Ca | 1,5 | 1,65 |
| Mg | 0,37a y 0,5b,c | 0,5 |
| Acetato | 3 | 0 |
| Citrato | 0 | 1 |
| Cl | 108,2a, 109b, 110c | 109,3 |
| Glu (g/L) | 1 | 1 |
| Bicarbonato | 34 | 34 |
aG196; bG295; cG394.
Cada paciente sirvió como control de sí mismo y no se realizaron modificaciones de la pauta de diálisis ni del tratamiento farmacológico durante el estudio, siguiéndose la pauta habitual de trabajo. Se utilizó una concentración de calcio del líquido que fue mayor en el LD de citrato: de 1,5 mmol/L en el líquido de acetato y de 1,65 mmol/L en el de citrato. Se utilizaron 3 concentraciones de K en el LD con acetato (de 1,5, 2 y 3 mmol/L) que eran las que los pacientes tenían previas a la inclusión en el estudio, y 2 mmol/L de K en el LD de citrato.
Parámetros demográficos y de diálisis recogidosSe recogieron una serie de parámetros demográficos: edad, enfermedad de base, peso, técnica de diálisis: HD o HDF, el tipo de acceso vascular: fístula (FAV) o catéter (CT), y la función renal residual (FRR) medida como el aclaramiento medio de urea y creatinina ((CCr+CU)/2) en orina de 24 horas (Si este era < 1ml/min o la diuresis < 100ml/día se consideró ausencia de FRR).
Los parámetros de diálisis: tiempo, flujo sanguíneo (Qb), flujo del líquido de diálisis (Qd), conductividades de sodio y bicarbonato, temperatura del líquido, dializador, tipo y dosis de heparina, volúmenes de infusión en HDF, el Kt medido automáticamente por el biosensor Diascan®, la ultrafiltración (UF) por sesión y la tensión arterial (TA) pre y post HD. También se recogieron el número de hipotensiones definidas como toda disminución aguda de la presión arterial percibida por el paciente que precisara la intervención del personal de enfermería.
Determinaciones analíticasTodas las muestras de sangre se obtuvieron a través de la línea arterial del acceso vascular, las prediálisis extraídas inmediatamente antes de iniciar la técnica y postdiálisis después de disminuir el Qb a 50ml/min durante 60 segundos en el momento de finalizar la sesión.
En sangre se determinaron:
- •
Parámetros ácido-base mediante gasometría venosa que incluía pH, presión parcial de anhídrido carbónico (PCO2), presión parcial de oxígeno (PO2), bicarbonato, exceso de base en el líquido extracelular (BEecf), saturación medida de oxígeno (sO2m).
- •
Parámetros bioquímicos: sodio (Na), potasio (K), magnesio (Mg), Ca, Cai, fósforo (P) y hormona paratiroidea (PTH).
El pH se determinó por potenciometría, la pCO2 por electrodo de Sveringhaus, la pO2 por amperometría y el Cai por electrodo selectivo de iones (ISE). Las determinaciones bioquímicas se determinaron con un autoanalizador (ADVIA® 2400 Chemistry System, Bayer). Las determinaciones de PTH se realizaron por quimioluminiscencia, mediante el sistema ADVIA CENTAUR de Bayer.
La concentración de Ca se corrigió para el pH (Cac) mediante la siguiente fórmula:
Cac = Ca medido x [1-0,53 × (7,40 – pH medido)]
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS 15.0 (SPSS INC., Chicago IL, USA). Los datos descriptivos se presentan como la media y desviación estándar (DE).
Para la comparación de dos variables continuas independientes se utilizó el test de la t de Student para muestras pareadas. Para la comparación de más de dos variables cuantitativas se utilizó el ANOVA. La p < 0,05 fue considerada como estadísticamente significativa.
ResultadosLa edad media de los veinticuatro pacientes era de 68,1 (19,2) (rango 19-92) años. El peso seco de 72,7 (20,5) Kg. Las etiologías de la insuficiencia renal fueron: glomerulonefritis (n = 8), nefritis intersticial (n = 3), poliquistosis (n = 1), vascular (n = 3), diabetes mellitus (n = 2) y desconocida (n = 7). Diez (41,7%) pacientes tenían FRR, siendo el (CCr+CU)/2 de 6,5(3,2) [2,7-14,4] ml/min. De ellos 6 se dializaban 2 veces en semana (25%). Esta es la frecuencia con la que dializamos habitualmente si el paciente cumple los siguientes requisitos: (CCr+CU)/2 ≥ 5ml/min, normotensión arterial, adecuado control de P y de volumen. Dieciocho (75%) se dializaban mediante fístula arteriovenosa y 6 (25%) con catéter. Trece (54,2%) pacientes se dializaron con HD de alto flujo y 11 (45,8%) con HDF. El tiempo medio de diálisis fue de 250 (16) [210-270] minutos. Todos los pacientes tenían individualizado el bicarbonato: 30,8 (2,4) [26-34] mmol/l, la conductividad al sodio: 13,8 (0,1) [13,7-14,1] mS/cm y la temperatura del LD: 35,8 (0,4) [35-36,5] °C.
Todos los pacientes fueron informados de las características del estudio y dieron su consentimiento para participar en él.
Los dializadores fueron los mismos y se distribuyeron de la siguiente manera: 5 (21%) polietersulfona de 1,8 m2 (Xenium®), 8 (33%) helixona de 1,8 m2 (FX80 y FX 800®) y 11 (46%) poliamida de 2,1 m2 (Poliflux210H®). La técnica de HDF se realizó en 11 (45,8%) pacientes, con un volumen de infusión medio de 27,7(3,8) [20,8-33,9] litros.
Las concentraciones de potasio utilizadas en el LD de acetato fueron 1,5, 2 y 3 mmol/l en 9 (37,5%), 12 (50%) y 3 (12,5%) pacientes respectivamente.
La anticoagulación se realizó con heparina sódica al 1% en todos salvo en uno de los pacientes que utilizó enoxaparina, siendo la dosis media de heparina de 51,6(18,5) [20-90] unidades.
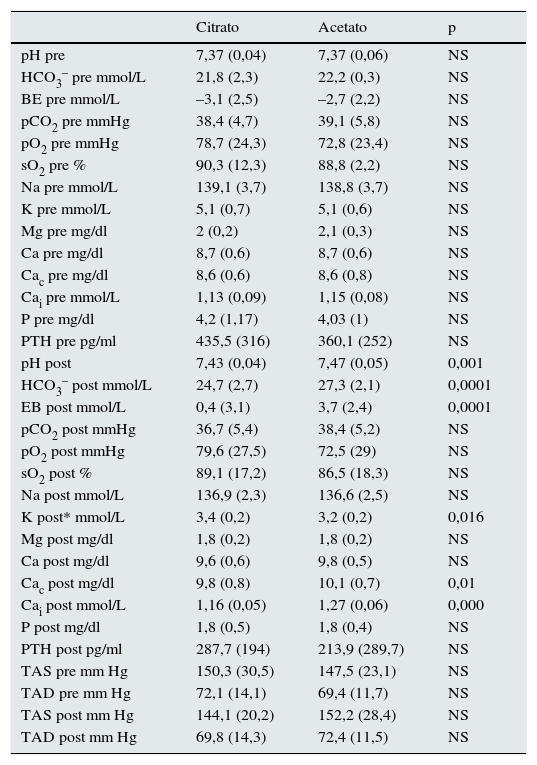
En la tabla 2 se muestran los valores medios de los parámetros analizados. Encontramos diferencias estadísticamente significativas cuando utilizamos el baño con citrato frente a acetato en los valores postdiálisis de: pH, bicarbonato, EBef, K, Cac y Cai. No encontramos diferencias en ninguno de los valores prediálisis, ni en el resto de los valores postdiálisis analizados. Pese a incrementar la concentración de Ca en el baño los valores de Cai postHD fueron inferiores en los dializados con citrato sin cambios en la PTH.
Resultados de los valores medios de los parámetros analizados con citrato y acetato
| Citrato | Acetato | p | |
|---|---|---|---|
| pH pre | 7,37 (0,04) | 7,37 (0,06) | NS |
| HCO3– pre mmol/L | 21,8 (2,3) | 22,2 (0,3) | NS |
| BE pre mmol/L | –3,1 (2,5) | –2,7 (2,2) | NS |
| pCO2 pre mmHg | 38,4 (4,7) | 39,1 (5,8) | NS |
| pO2 pre mmHg | 78,7 (24,3) | 72,8 (23,4) | NS |
| sO2 pre % | 90,3 (12,3) | 88,8 (2,2) | NS |
| Na pre mmol/L | 139,1 (3,7) | 138,8 (3,7) | NS |
| K pre mmol/L | 5,1 (0,7) | 5,1 (0,6) | NS |
| Mg pre mg/dl | 2 (0,2) | 2,1 (0,3) | NS |
| Ca pre mg/dl | 8,7 (0,6) | 8,7 (0,6) | NS |
| Cac pre mg/dl | 8,6 (0,6) | 8,6 (0,8) | NS |
| Cai pre mmol/L | 1,13 (0,09) | 1,15 (0,08) | NS |
| P pre mg/dl | 4,2 (1,17) | 4,03 (1) | NS |
| PTH pre pg/ml | 435,5 (316) | 360,1 (252) | NS |
| pH post | 7,43 (0,04) | 7,47 (0,05) | 0,001 |
| HCO3– post mmol/L | 24,7 (2,7) | 27,3 (2,1) | 0,0001 |
| EB post mmol/L | 0,4 (3,1) | 3,7 (2,4) | 0,0001 |
| pCO2 post mmHg | 36,7 (5,4) | 38,4 (5,2) | NS |
| pO2 post mmHg | 79,6 (27,5) | 72,5 (29) | NS |
| sO2 post % | 89,1 (17,2) | 86,5 (18,3) | NS |
| Na post mmol/L | 136,9 (2,3) | 136,6 (2,5) | NS |
| K post* mmol/L | 3,4 (0,2) | 3,2 (0,2) | 0,016 |
| Mg post mg/dl | 1,8 (0,2) | 1,8 (0,2) | NS |
| Ca post mg/dl | 9,6 (0,6) | 9,8 (0,5) | NS |
| Cac post mg/dl | 9,8 (0,8) | 10,1 (0,7) | 0,01 |
| Cai post mmol/L | 1,16 (0,05) | 1,27 (0,06) | 0,000 |
| P post mg/dl | 1,8 (0,5) | 1,8 (0,4) | NS |
| PTH post pg/ml | 287,7 (194) | 213,9 (289,7) | NS |
| TAS pre mm Hg | 150,3 (30,5) | 147,5 (23,1) | NS |
| TAD pre mm Hg | 72,1 (14,1) | 69,4 (11,7) | NS |
| TAS post mm Hg | 144,1 (20,2) | 152,2 (28,4) | NS |
| TAD post mm Hg | 69,8 (14,3) | 72,4 (11,5) | NS |
Se analizaron también los resultados en función de la técnica (HD vs. HDF) y no encontramos diferencias estadísticamente significativas en los parámetros analizados. Tampoco encontramos diferencias cuando comparamos los pacientes en HDF con volumen de infusión mayor o menor de 27 L.
En relación al K, la concentración utilizada solo fue la misma con ambos LD en 12 (50%) pacientes en los que se utilizó 2 mmol/L, y no encontramos diferencias en las concentraciones de K postdiálisis (3,2(0,2) y 3,4(0,3) mmol/l para el acetato y citrato respectivamente). Sí en las concentraciones de potasio postdiálisis en el total de los pacientes, y como era de esperar entre el LD de acetato con 1,5 mmol/L de K y el de citrato con 2 mmol/L de K (3,05 (0,1) vs 3,48 (0,1) respectivamente).
En cuanto a la eficacia, no encontramos diferencias (Kt 58,8 (9,2) vs 61,6 (6,8) l) con el LD de citrato y acetato respectivamente.
Finalmente, aunque no encontramos diferencias en las cifras de TA sistólica ni diastólica postdiálisis con ambos LD (tabla 2), sí existieron en el número de hipotensiones sintomáticas. Se produjeron 3 hipotensiones sintomáticas (6,2%) del total de sesiones (48) y en los tres casos se estaba usando un LD con acetato (12,5%). No se objetivó ninguna hipotensión arterial en las 24 sesiones realizadas con citrato (0%). No hubo diferencias en las ultrafiltraciones medias en ambos grupos (1849 (884) vs. 1904 (847) ml para el citrato y acetato respectivamente).
DiscusiónEl principal resultado de nuestro trabajo es que la diálisis con citrato consigue un mejor control de equilibrio ácido base postdiálisis que cuando se utiliza acetato, disminuyendo/evitando la alcalemia postdiálisis.
La alcalemia aguda inducida por el aporte de bicarbonato durante la diálisis es un problema de considerable trascendencia clínica, ya que se ha relacionado con importantes efectos adversos como la inestabilidad hemodinámica18–20, arritmias cardíacas, parestesias-calambres21, disminución del flujo sanguíneo cerebral, depresión respiratoria22,23, cefalea y un efecto procalcificante. Finalmente también una mayor concentración de bicarbonato en el líquido de diálisis se ha asociado con aumento de la mortalidad24.
La mayor excitabilidad cardiaca se explica por varios mecanismos entre los que figura el efecto que la alcalosis metabólica tiene sobre la redistribución transcelular de potasio. El aumento de la concentración de bicarbonato favorece la redistribución del potasio al espacio intracelular, lo que puede producir un descenso más brusco de las cifras de potasio durante la diálisis y precipitar arritmias cardíacas25. La conductividad al bicarbonato del LD y la bicarbonatemia plasmática se han asociado con un aumento del intervalo QT en electrocardiogramas postdiálisis, efecto probablemente mediado por la disminución brusca de tanto el K como el Cai.
El equilibrio ácido base también tiene un papel relevante en la regulación del depósito de calcio en los vasos, de forma que la alcalosis favorece la calcificación26. El trabajo de Solis y cols.27 analiza el efecto del pH sobre la calcificación a través de 2 aproximaciones experimentales: el efecto in vitro del suero urémico sobre la calcificación de células del músculo liso a diferentes pH y el efecto in vivo del tratamiento con bicarbonato en ratas nefrectomizadas. Sus resultados se resumen en que la alcalinización extracelular promueve la calcificación vascular mientras que la acidificación la previene, tanto en cultivos celulares como en ratas urémicas. Los autores de este trabajo reproducen la situación a la que sometemos a nuestros pacientes en diálisis que tienen habitualmente una acidosis metabólica moderada y en las sesiones de diálisis sufren episodios repetidos de alcalinización brusca.
Existen situaciones especiales en las que evitar la alcalosis intra y postdiálisis tiene especial interés, tal es el caso de los pacientes con hepatopatía crónica avanzada28 o con insuficiencia respiratoria con retención extrema de carbónico, situaciones clínicas que pueden agravarse por pequeñas modificaciones en el equilibrio ácido base ocurridas durante la diálisis llegando a comprometer la vida del paciente. El aumento del pH puede precipitar la encefalopatía hepática en pacientes con insuficiencia hepática grave, tanto aguda como crónica, ya que aumenta la relación NH3/NH4+, y el NH3 atraviesa con mayor facilidad la barrera hematoencefálica29. La insuficiencia respiratoria y la retención de CO2, pueden agravarse al inducir alcalosis metabólica ya que la compensación respiratoria disminuye el estímulo del centro respiratorio (menor frecuencia y amplitud ventilatoria). Estas complicaciones pueden prevenirse disminuyendo la concentración de bicarbonato del LD30 y/o utilizando un LD como el citrato que produzca una menor alcalinización.
Solo hemos encontrado un trabajo que analice el efecto agudo del citrato sobre el equilibrio ácido-base. Encuentran una mayor alcalinización durante la diálisis con citrato frente al acetato (7,38 a 7,50 y 21 a 29,2 mmol/L vs 7,39 a 7,45 y 22,4 a 24,3 para los valores de pH y bicarbonato con LD de citrato y acetato respectivamente)31. Nuestro trabajo muestra que el LD de citrato produce menor alcalemia que el de acetato, mostrando diferencias en los parámetros gasométricos postdiálisis (pH, HCO3– y EB). Es importante tener en cuenta que mantuvimos las conductividades de sodio y bicarbonato estables, y que en nuestra unidad la conductividad de bicarbonato se individualiza, siendo nuestro objetivo conseguir unos valores de bicarbonato prediálisis > 18 mmol/L y postdiálisis < 28 mmol/L. Creemos que la diferencia encontrada podría ser aún mayor en unidades donde el bicarbonato no se adecua a las necesidades de cada paciente. De ahí que en nuestro estudio, donde el rango de conductividad al bicarbonato se sitúa entre 26 y 34 mmol/l, los pacientes dializados con acetato muestran alcalemia ligera postdiálisis, solo 3 (12,5%) pacientes presentaron cifras de HCO3– superiores a 30 mmol/l y con el LD de citrato no se objetiva alcalemia (cifras medias de pH 7,43, HCO3– 24,7 mmol/l y EB 0,4), ningún paciente presentó cifras de HCO3– superiores a 30 mmol/l. Las diferencias se mantuvieron en todos los rangos de conductividad utilizados, sin diferencias entre ellas (resultados no mostrados).
El segundo resultado que queremos resaltar está en relación con la calcemia postdiálisis. La mayoría de los estudios que analizan el efecto del citrato sobre el metabolismo calcio-fósforo han observado una disminución de los niveles de Cai y aumento de PTH17. Nosotros, con la concentración de calcio utilizada en el LD de citrato que fue 0,15 mmol/L superior a la del acetato, no observamos ninguna hipocalcemia clínica ni analítica y los valores postdiálisis tanto de Cac como Cai fueron significativamente inferiores utilizando el LD con citrato frente a acetato, y con ambos LD a las concentraciones de calcio utilizadas los valores postdiálisis de Cac y Cai fueron superiores a los obtenidos prediálisis. Este resultado tiene aún mayor valor si tenemos en cuenta como los cambios en el pH modifican el Cai32. Los hidrogeniones desplazan el Ca de la albúmina, de forma que una disminución del pH de 0,1, aumenta aproximadamente 0,1 meq/l la concentración de Cai, mientras que la alcalosis disminuye el Ca libre aumentando la unión de Ca a la albúmina. En nuestro caso el pH postdiálisis fue más elevado en la diálisis realizada con acetato, por lo que si esto no hubiera sido así, esta diferencia sería todavía mayor. De hecho, no encontramos diferencias en los valores de Ca postdiálisis sin corregir, pero si en los corregidos (9,8 y 10,1mg/dl con citrato y acetato respectivamente).
No hemos encontrado un mayor aclaramiento con el LD con citrato como lo han hecho otros autores16. Este hallazgo se ha puesto en relación con el efecto local anticoagulante del citrato que conllevaría una menor trombogenicidad y por lo tanto una menor pérdida de la superficie útil del dializador y por lo tanto de la eficacia dialítica. Hemos analizado en 12 pacientes el efecto de ambos LD sobre la coagulación mediante la clasificación visual del estado de las líneas, cámaras y dializador (resultados no mostrados), y tampoco encontramos diferencias.
Por último, en relación a la mayor estabilidad hemodinámica descrita con citrato15, nosotros no hemos encontrado diferencias en la tensión arterial (TA), pero si en la incidencia de hipotensiones arteriales sintomáticas. Si bien el número de hipotensiones encontrado fue muy bajo, ya que solo en 3 de las 48 sesiones presentaron hipotensión (6,2%), en los tres casos se produjo utilizando un LD con acetato y no se objetivó ninguna hipotensión arterial en las 24 sesiones realizadas con citrato (12,5 vs 0%). Queremos destacar que nuestra incidencia de hipotensión arterial es muy inferior a la reportada en la literatura que se sitúa entre el 15-60%33,34. Este resultado podría explicarse además de por el efecto vasodilatador conocido del acetato, por la menor bicarbonatemia encontrada con el citrato, ya que se ha descrito una relación directa entre la concentración de bicarbonato en el LD y la estabilidad hemodinámica19. La mayor estabilidad hemodinámica también podría deberse a una concentración de sodio [Na] del LD más elevada a igual conductividad debido a que se haya modificado la relación entre ambas ([Na] y conductividad). Disponemos de datos no publicados que apoyarían esta hipótesis.
Es indudable que la individualización de la terapia dialítica debe incluir también la concentración de bicarbonato en el baño35, pero considerando los resultados obtenidos en nuestro trabajo, ¿debería esta individualización extenderse al tipo de ácido empleado? Una primera consideración que debemos hacer es que la concentración de bicarbonato que pautamos infraestima la concentración real del mismo, ya que parte del acetato o citrato del LD van a transformarse después en bicarbonato. Tanto la transferencia de citrato como la del acetato al plasma, dependen del tipo de diálisis, del aclaramiento y del tiempo de tratamiento entre otros factores. Como resultado el nivel de citrato en plasma aumenta de < 0,1 mmol/l a 0,2-0,3 mmol/l36 durante la diálisis con LD con 1 mmol/L citrato y el de acetato de 0,2 a 0,5 mmol/l con un LD con 4 mmol/L de acetato8. Una vez metabolizados, el acetato y citrato contribuyen a elevar la concentración de bicarbonato plasmática en 2-8 mEq/L y esta puede contribuir al desarrollo de alcalosis postdiálisis. Este hecho llevó a la Food and Drug Administration a hacer un comunicado advirtiendo a los clínicos del impacto que tanto el acetato como otras fuentes de álcali tienen sobre la prescripción de bicarbonato en la diálisis37, y de los riesgos de la alcalosis inducida por el mismo. La forma y el tiempo en que se metabolizan estos ácidos va a repercutir en los valores postdiálisis del equilibrio ácido base. La relación de la concentración de acetato y citrato en los LD que hemos utilizado es de 3/1 (3 mmol de acetato y 1 mmol de citrato por litro), aunque podría pensarse que esto podría explicar en parte los resultados no es así, ya que cada molécula de citrato metabolizada es equivalente a la generación de 3 moléculas de bicarbonato, mientras que en la metabolización del acetato se produce una generación estequiométrica de bicarbonato, por consumo equimolar de un protón cuando es activado por la Acetil CoA sintetasa para formar acetil CoA. Por lo tanto, teóricamente 1 mmol/l de citrato y 3 mmol/l de acetato, cuando se metabolizan en el organismo, deberían generar una cantidad similar de bicarbonato. Es por esto por lo que, no se considera necesario cambiar el nivel de bicarbonato prescrito cuando se cambia de un LD con 3-4 mmol/L a un LD con 1 mmol/L de citrato. Debemos pues recurrir para explicarlo a la química: el citrato es la base del ácido cítrico, un ácido orgánico débil, cuya forma dominante a pH fisiológico es el citrato trivalente C3H5 (COO)3–, de pm 189 D y vida media de 30-60min. El metabolismo es fundamentalmente hepático y también muscular, el citrato entra en la célula por unas proteínas transportadoras; allí pasa a la mitocondria donde en el ciclo de Krebs se convierte en isocitrato y posteriormente alfa-cetoglutarato, metabolizándose para generar bicarbonato y energía. Se produce por lo tanto una conversión rápida de citrato en bicarbonato, pero la diferencia fundamental con el acetato radica en que esta metabolización es incompleta durante la diálisis, ya que el metabolismo hepático y muscular ocurre en parte después de finalizar la técnica. Además hay pacientes metabolizadores rápidos y lentos del mismo dependiendo de la función hepática y de la masa muscular, factores que también deben tenerse en cuenta. En pacientes a los que se les infunde citrato como anticoagulación regional los niveles de citrato en plasma son de 1 mmol/l, y los pacientes en HD presentan niveles similares a los que tienen función renal normal38, no así los pacientes con insuficiencia hepática en los que el aclaramiento de citrato se reduce en un 50%39. Otra posible explicación a la menor alcalosis con citrato podría deberse a la diferente composición de ambos LD (tabla 1), con componentes con distinta fuerza iónica.
Así, respondiendo a la anterior pregunta, la conductividad ideal al bicarbonato con la que debemos dializar a cada paciente no se conoce con exactitud. Esta cifra dependerá de factores relacionados con el paciente (concentración de bicarbonato prediálisis, generación de hidrogeniones, espacio de distribución del bicarbonato…) y de factores relacionados con el tratamiento dialítico (concentración de bicarbonato en el baño, tipo de técnica, frecuencia, ultrafiltración, flujos sanguíneo y de baño…) entre otros, a los que probablemente, a la luz de nuestros resultados, haya que sumar el tipo y la concentración de ácido utilizado en el LD.
La principal limitación de nuestro estudio es que el número de pacientes incluido es pequeño, pero el diseño cruzado del mismo permite comparar cada paciente consigo mismo reforzando los resultados. Una segunda limitación es que no se ha aleatorizado el orden de utilización de cada ácido en el LD, si bien al analizar el efecto agudo del mismo pensamos que la repercusión de esta aleatorización sería mínima. Por último, el estudio se ha realizado en un único centro, pero creemos que los resultados pueden ser válidos en otros centros donde las condiciones de diálisis sean similares.
Hubiera sido de interés medir concentraciones de citrato y los parámetros del equilibrio ácido base no solo postdiálisis sino también en el periodo interdialítico para profundizar en los mecanismos de metabolización de ambos ácidos. Este trabajo abre las puertas a otros que analicen diferencias clínicamente significativas en pacientes tratados de forma crónica con LD con citrato.
ConclusionesLos resultados del presente trabajo muestran que la diálisis con citrato consigue un mejor control de equilibrio ácido base postdiálisis disminuyendo/evitando la alcalemia postdiálisis. La menor alcalemia postdiálisis, junto a una menor elevación de la calcemia, apoyan un perfil menos calcificante del LD con citrato.
Este hallazgo es de especial interés en pacientes con factores predisponentes a arritmias, pacientes con insuficiencia respiratoria, retención de carbónico, calcificaciones y hepatopatía avanzada.
FinanciaciónNinguna.
Conflicto de interesesLa Dra. P. de Sequera, la Dra. M. Albalate y el Dr. R. Pérez García han participado como ponentes en reuniones organizadas por Gambro® y Fresenius®.
AgradecimientosAl personal de enfermería de la Unidad de Diálisis del Hospital Universitario Infanta Leonor, por su colaboración en el estudio.
Los resultados presentados en este trabajo no han sido enviados a publicar o publicados previamente en su totalidad o en gran parte, excepto como póster, resumen, presentación en reunión científica o registro de ensayos clínicos, en cuyo caso se indican las referencias si las hay: Sociedad Madrileña de Nefrología y Sociedad Española de Nefrología.