INTRODUCCIÓN
El trasplante renal constituye la mejor alternativa terapéutica de los pacientes con insuficiencia renal avanzada. Con respecto a la diálisis, disminuye significativamente la morbimortalidad cardiovascular mejorando el pronóstico de estos enfermos.1 La introducción de nuevos fármacos inmunosupresores, la mejoría de las técnicas quirúrgicas y la optimización del cuidado general de estos pacientes son algunas de las razones que justifican tal beneficio. Sin embargo, también somos concientes de que las tasas de supervivencia de injertos y pacientes son inferiores a lo esperado para estos progresos asistenciales. En efecto, aunque en los últimos años ha mejorado espectacularmente la tasa de rechazos agudos, los resultados a medio y largo plazo no llevan un curso paralelo y la pérdida crónica e inexorable de los injertos con el transcurso de los años constituye un problema preocupante. Estudios epidemiológicos de grandes bases de datos apuntan a que la supervivencia del injerto renal a los 10 años de seguimiento ronda el 60%. La muerte prematura del enfermo con un injerto funcionante y la pérdida progresiva de función renal por el desarrollo de la Nefropatía Crónica del Injerto (NCI) representan las causas más importantes de esta alarmante situación. Al mismo tiempo, han aflorado otros retos clínicos, como la presencia de nuevos virus o el incremento de procesos tumorales en el marco de una población más envejecida que recibe injertos más añosos. De ahí que en los últimos años muchos de los estudios en el campo del trasplante renal se hayan centrado en conocer el origen y la magnitud de estos problemas.
Es muy posible que la medicación inmunosupresora contribuya sustancialmente a esta situación. Estos fármacos no están exentos de efectos colaterales indeseables que los convierten en un arma de doble filo en estos pacientes. La nefrotoxicidad crónica inducida por anticalcineurínicos es un fenómeno prácticamente universal tras el trasplante renal, aun en las mejores condiciones clínicas, que condiciona disfunción renal y pérdida crónica de los injertos a largo plazo. Asimismo, el riesgo cardiovascular asociado a la hipertensión arterial, Diabetes Mellitus (DM), dislipemia o la anemia se magnifica tras el trasplante renal con el concurso de la inmunosupresión. Desde esta perspectiva, se infiere que la individualización de la inmunosupresión constituye un objetivo clínico inexcusable a largo plazo, entendiendo por individualización la capacidad de adaptar la terapia inmunosupresora a las características del donante/receptor durante la evolución del trasplante para obtener mayores supervivencias de injerto y paciente con la mejor calidad de vida posible.
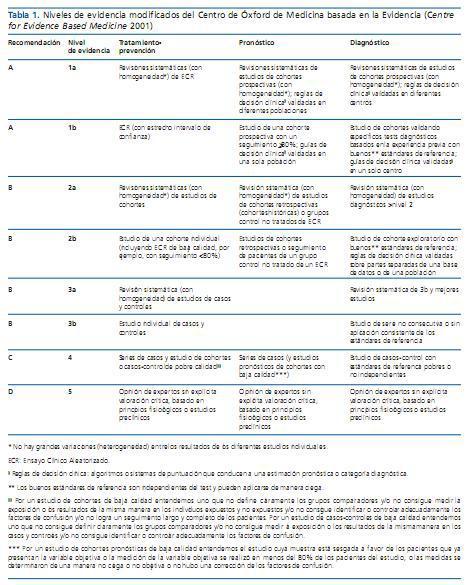
Obviamente, con estas premisas es fácil entender que la Medicina Basada en la Evidencia (MBE) constituye una buena herramienta clínica para lograr tal objetivo. Conceptualmente, la MBE nos permite el empleo de las mejores aportaciones científicas con la finalidad de mejorar los resultados en el diagnóstico y tratamiento de las enfermedades. En otras palabras, nos ayuda a optimizar la práctica clínica mediante la aplicación de la mejor evidencia resultante de los estudios científicos más contundentes.2 La MBE no pretende que los Ensayos Clínicos (EC) aleatorizados y los metaanálisis sean la única forma de proceder en la práctica clínica diaria. Sólo intenta evitar actitudes terapéuticas ineficaces basadas en aportaciones o procedimientos que carecen del apoyo científico suficiente. Desde esta perspectiva, se ha jerarquizado el nivel de evidencia de los estudios publicados a partir de la calidad científica de los mismos.3 Los metaanálisis de EC y aquellos EC de gran número de pacientes y estrecho intervalo de confianza lideran la clasificación en la vertiente terapéutica, mientras que las revisiones sistemáticas lo hacen en el ámbito diagnóstico y pronóstico (tabla 1). De esta manera, se han desarrollado guías de práctica clínica o recomendaciones terapéuticas, pronósticas y diagnósticas en diversas facetas del trasplante renal, expresadas como niveles decrecientes de evidencia en función de la relativa calidad científica de dichos estudios.4,5
Con todo, es posible que no tengamos una respuesta contundente a cada una de las cuestiones que se plantean en la individualización de la inmunosupresión. A título de ejemplo, aún no sabemos con claridad si la suspensión de los esteroides o la sustitución de los anticalcineurínicos por los inhibidores de la mTOR puede traducirse en una reducción de la mortalidad cardiovascular o en una mejoría de la función renal en estos enfermos.6 Ni siquiera estamos seguros de los beneficios de individualizar la inmunosupresión antes del trasplante para mejorar el pronóstico. Desde esta visión, se vislumbra que en pocas áreas de la medicina se hace tan necesaria la integración de la práctica clínica con la mejor evidencia posible como en el trasplante renal. Es posible que la gran variabilidad en el manejo clínico de estos pacientes se deba a un desequilibrio entre un abundante nivel de evidencia en algunas áreas frente a otras como el riesgo cardiovascular postrasplante o la NCI, que obviamente carecen de este respaldo científico.
Preocupados por estas cuestiones, se ha constituido un foro de trabajo para la Individualización de la Terapia Inmunosupresora (FITI), con el fin de abordar y optimizar los problemas de la inmunosupresión con los que nos enfrentamos en nuestra práctica clínica diaria. El primer paso ha sido recabar la opinión de la comunidad nefrológica mediante la elaboración de una encuesta anónima (cuyos resultados se adjuntan en esta monografía) sobre aquellos aspectos más relevantes en estas cuestiones. En segundo lugar, el grupo de trabajo también se ha propuesto la elaboración de un documento donde se analice en profundidad las evidencias científicas más importantes en relación con la individualización de la terapia inmunosupresora. En esencia, se trata de proporcionar una visión global de la individualización de la inmunosupresión y de proponer alternativas terapéuticas que buscan el equilibrio entre la eficacia y la baja toxicidad a partir del máximo nivel de evidencia de diversos estudios que apoyen algunas de las siguientes líneas de actuación: 1) establecer la mejor estrategia para evitar la disfunción inmunológica; 2) individualización de la inmunosupresión de mantenimiento para minimizar el riesgo cardiovascular o evitar la NCI; 3) profundizar en el papel de los anti-mTOR en la optimización de la función del injerto y la prevención de la NCI; 4) búsqueda de los regímenes más idóneos para minimizar la aparición de nuevos virus y tumores; y 5) establecer la inmunosupresión ideal en la población más longeva que recibe injertos de más edad.
En cualquier caso, las reflexiones aportadas no deben considerarse como definitivas, sino que deben estar abiertas a modificaciones futuras que se generen mediante nuevas aportaciones científicas en este campo. Por ello, deben revisarse y adaptarse regularmente a medida que surjan nuevos EC en el transcurso del tiempo.
Finalmente, el grupo FITI quiere agradecer la colaboración de la comunidad nefrológica y del panel de expertos que ha contribuido a la elaboración de estas recomendaciones. Esperamos que este esfuerzo haya valido la pena y suponga dar un pequeño paso más en el camino de optimizar el pronóstico del mejor tratamiento de la insuficiencia renal crónica terminal: el trasplante renal.
Tabla 1. Niveles de evidencia modificados del Centro de Óxford de Medicina basada en la Evidencia (Centre for Evidence Based Medicine 2001)