En Diciembre de 2019 un brote de enfermedad por coronavirus (COVID-19) causante de neumonía comenzó en Wuhan, China1. En pocas semanas, la infección se propagó a nivel mundial, se clasificó como pandemia por la Organización Mundial de la Salud (OMS)2 y causó un colapso en el sistema de salud de muchos países con un incremento en la mortalidad asociada con el síndrome respiratorio agudo por coronavirus 2 (SARS-CoV-2). Si bien no existe evidencia científica consistente que establezca un tratamiento viral definitivo, el manejo con soporte ventilatorio ha sido la base fundamental de supervivencia de muchos pacientes3. Los pacientes con enfermedad renal crónica (ERC) en terapia renal sustitutiva (TRS) tienen un riesgo incrementado de mortalidad por coronavirus3. Omalizumab es un anticuerpo monoclonal humanizado que reduce los niveles de inmunoglobulina E libre y evita que esta se una a su receptor FceRI, reduciendo así la activación de la cascada alérgica y de los basófilos y mastocitos4.
Describimos el primer caso de COVID-19 en una paciente en hemodiálisis (HD) tratada con omalizumab. Se trata de una mujer de 56 años con historia de urticaria crónica conocida desde 2013 que desarrolló ERC secundaria a glomerulonefritis rápidamente progresiva asociada con vasculitis ANCA-MPO refractaria a tratamiento (pulsos de esteroide, micofenolato de mofetil, rituximab, ciclofosfamida y plasmaféresis), requiriendo inicio de HD en abril de 2019. Los brotes de vasculitis urticarial se consideraron un trigger del deterioro de la función renal, por lo que se inició con la administración de omalizumab. La paciente no ha recuperado función renal, por lo que se mantiene en HD. Su tratamiento de mantenimiento consiste en prednisona (12,5 mg/día) y omalizumab (300 mg/una vez al mes [última dosis el 17 de abril de 2020]).
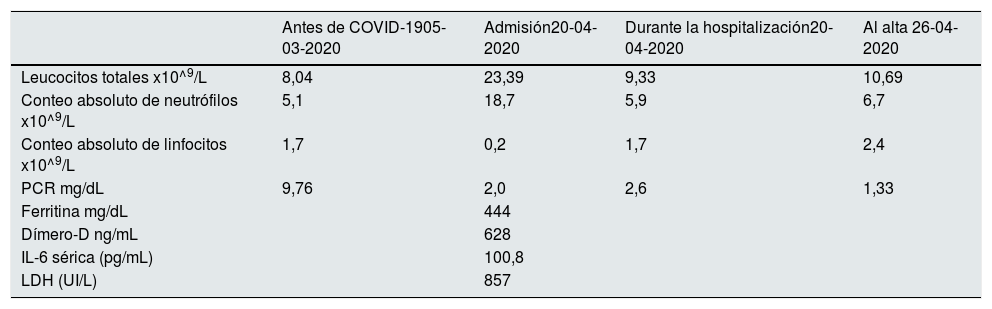
El 20 de abril de 2020, al finalizar su sesión habitual de HD, la paciente fue referida a urgencias de nuestro hospital con fiebre (38,4C°, 48 horas de evolución), tos no productiva y dolor abdominal inespecífico. A su ingreso, la saturación arterial de oxígeno a aire ambiente era de 98% y permaneció estable durante el período de hospitalización. La analítica sanguínea mostró leucocitosis con neutrofilia. Los reactantes de fase aguda estaban significativamente elevados, siendo el dímero D, la proteína C reactiva (PCR) y la interleucina 6 (IL 6) de 628 ng/mL, 2 mg/dL y 100, 8 pg/mL, respectivamente (tabla 1). La radiografía de tórax no mostró infiltrados ni derrame pleural. La infección por SARS-CoV-2 fue diagnosticada por PCR en tiempo real del frotis nasofaríngeo. La paciente recibió tratamiento con azitromicina e hidroxicloroquina durante tres y cinco días, respectivamente. De acuerdo con la OMS2, nuestra paciente desarrolló un curso clínico leve de la enfermedad. Como proceso intercurrente, presentó una sepsis urinaria causada por Pseudomona aeruginosa, que fue tratada empíricamente con ceftazidima, y posteriormente con amikacina según ajuste por antibiograma, completando en total dos semanas de tratamiento. Tras una semana de hospitalización, la evolución clínica fue satisfactoria sin requerimiento de soporte ventilatorio en ningún momento, disminuyendo los leucocitos y presentando una mejoría en la condición clínica inicial, por lo que fue dada de alta con su tratamiento inmunosupresor habitual.
Hallazgos de laboratorio antes de la infección por COVID-19, durante la hospitalización y al momento del alta
| Antes de COVID-1905-03-2020 | Admisión20-04-2020 | Durante la hospitalización20-04-2020 | Al alta 26-04-2020 | |
|---|---|---|---|---|
| Leucocitos totales x10^9/L | 8,04 | 23,39 | 9,33 | 10,69 |
| Conteo absoluto de neutrófilos x10^9/L | 5,1 | 18,7 | 5,9 | 6,7 |
| Conteo absoluto de linfocitos x10^9/L | 1,7 | 0,2 | 1,7 | 2,4 |
| PCR mg/dL | 9,76 | 2,0 | 2,6 | 1,33 |
| Ferritina mg/dL | 444 | |||
| Dímero-D ng/mL | 628 | |||
| IL-6 sérica (pg/mL) | 100,8 | |||
| LDH (UI/L) | 857 |
Recientemente, Henry et al. realizaron un metaanálisis de cuatro estudios que incluyó 1.389 pacientes COVID-19 para analizar el efecto de la ERC en la severidad de la infección por COVID-19. Sus resultados sugieren que la ERC es un factor de riesgo para desarrollar una forma severa de SARS-COV-25. Aunque individualmente los estudios no pudieron concluir que la ERC fuese un predictor clínico significativo de la forma severa de COVID 19, cuando los datos de los mismos se analizaron en conjunto se observó una asociación significativa entre ERC y la forma severa de la enfermedad.
El registro en marcha de pacientes en TRS realizado por la Sociedad Española de Nefrología (SEN) incluyó 868 pacientes en su primera publicación (trasplantados renales, pacientes en programa de diálisis peritoneal y pacientes en programa de hemodiálisis crónica), demostrando la severidad de la enfermedad en esta cohorte con un muy alto porcentaje de ingreso (85%) y mortalidad (23%)6. Un estudio observacional de un solo centro realizado por Goicoechea et al.7 en una población de pacientes en HD mostró que la tasa de mortalidad es muy alta (hasta 30,5%), comparado con la mortalidad observada en la población general secundaria a la infección por COVID-19 (1,4-8%). Interesantemente, la mortalidad de los pacientes en HD de los dos estudios españoles fue casi la misma o incluso superior que la reportada en una unidad de cuidados intensivos (UCI) en Italia (26%)8. Linfopenia y niveles elevados de LDH (ambos presentes en nuestros pacientes) fueron asociados con mal pronóstico7. Nosotros creemos que el curso clínico leve de COVID-19 en nuestra paciente en HD podría ser debido, en parte, a la protección conferida por el tratamiento con omalizumab.
Conflicto de interesesDr. MJ Soler declara honorarios de NovoNordisk, Jansen, Boehringer, Eli Lilly, AstraZeneca, Esteve, FMC y Mundipharma no relacionados con el trabajo actual.