La infección por citomegalovirus (CMV) tiene un importante impacto en la morbimortalidad tras el trasplante. Las medidas encaminadas a prevención, diagnóstico y tratamiento permiten mejorar los resultados en trasplante renal1.
Presentamos el caso de un varón de 59 años, con enfermedad renal crónica desconocida, receptor de trasplante renal de donante fallecido en junio de 2019. Inducción con basiliximab e inmunosupresión con tacrolimus (TAC), micofenolato (MMF) y prednisona (PRD). Profilaxis con valganciclovir oral (VGCV) al ser D+/R− durante 3 meses, Septrin Forte e itraconazol. El paciente recibió el alta hospitalaria con creatinina 2,8mg/dl.
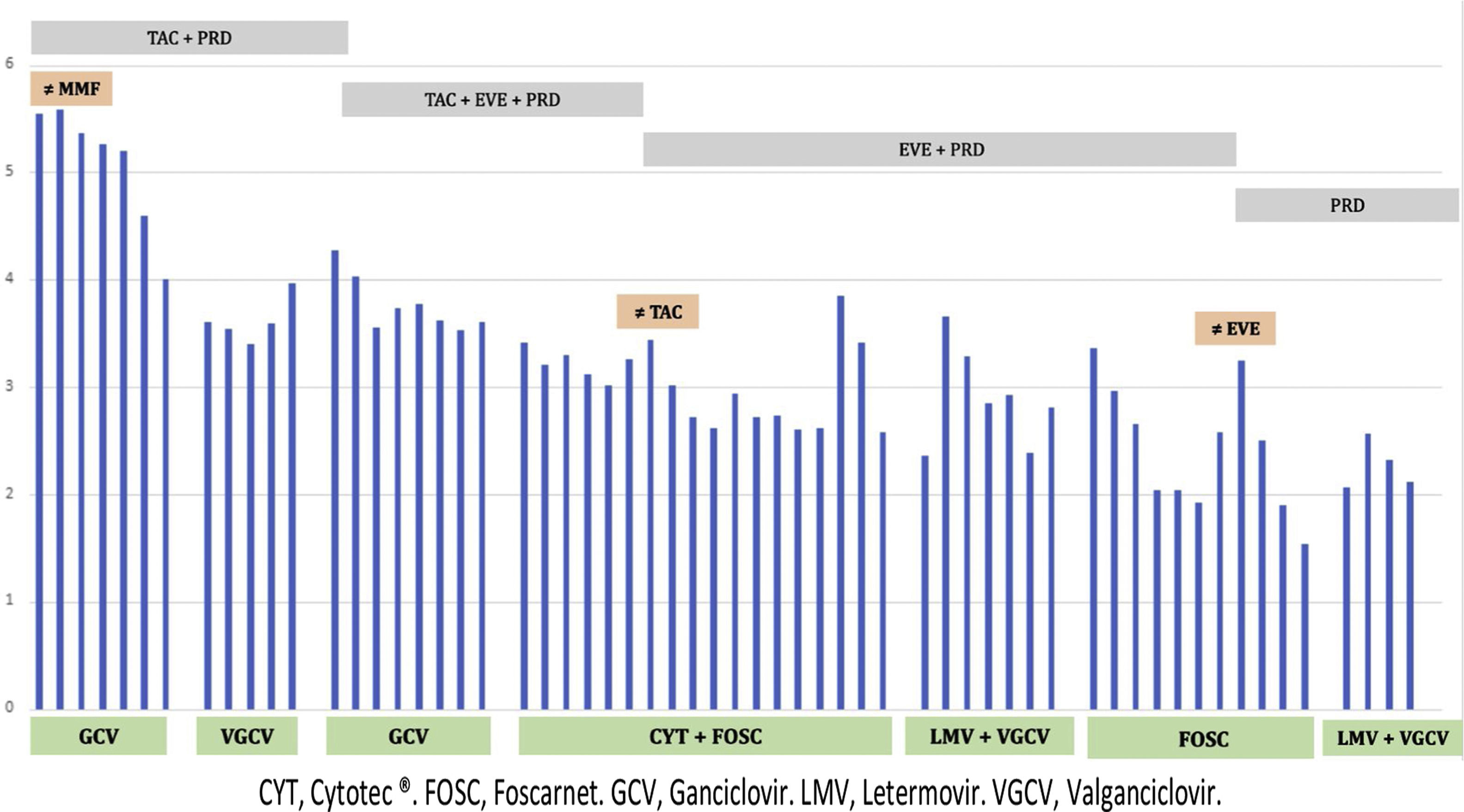
Ingresó al cuarto mes, un mes después de finalizar VGCV, por síndrome viral y PCR CMV 350.000UI/ml. Se suspendió MMF, permaneciendo con TAC y PRDa e iniciándose ganciclovir intravenoso (GCV) ajustado a función renal. Tras mejoría clínica y PCR CMV 4000UI/ml, el paciente recibió el alta con creatinina de 2,1mg/dl y tratamiento con VGCV.
Dos meses más tarde, ingresó por fiebre, astenia, diarrea y persistencia de replicación viral. Se inició GCV a dosis de 10mg/kg/día sin respuesta viral. Presentó resistencia a GCV debido a mutación A594V, gen UL97. El paciente continuó con fiebre y diarrea y una colonoscopia demostró enfermedad intestinal CMV. Se suspendió GCV, se inició Foscarnet® (FOS) (3000mg/12h) asociado a inmunoglobulinas anti-CMV (Cytotec®) (70ml/48h) y sustituyendo TAC por everolimus (EVE). Durante el ingreso, el paciente presentó hipocalcemia, hipomagnesemia y poliuria, precisando reposiciones intravenosas. Tras mejoría clínica y descenso de la replicación viral con FOS, el paciente presentó shock séptico de origen en catéter venoso central que precisó ingreso en UCI. Se suspendió FOS y una semana después, tras un nuevo repunte de CMV (7000UI/ml), se reinició, asociándose letermovir (LMV) 800mg al día. Fue dado de alta con LMV y VGCV con una carga viral de 231UI/ml e inmunosupresión con EVE y PRD.
Un mes tras el alta, tuvo nuevo episodio de anemia, leucopenia, trombocitopenia y repunte CMV (2290UI/ml). Se iniciaron FOS e inmunoglobulina inespecífica 500mg/kg/día por la presencia de coinfección por Parvovirus (1.000.000UI/ml). A pesar de la buena evolución inicial, se apreció aumento PCR CMV suspendiéndose EVE y manteniendo la inmunosupresión sólo con PRD. Buena evolución posterior siendo alta hospitalaria nuevamente con LMV 400mg/día y VGCV 450mg/día y con 116UI/ml CMV.
Después de 3 meses, se suspendió el tratamiento antiviral por ausencia de replicación viral. A los 6 meses de seguimiento la creatinina es 2mg/dl, proteinuria 0,3mg/dl sin evidencia de replicación CMV, BK, EBV o Parvovirus.
En la figura 1 se muestra la evolución de replicación de CMV, el tratamiento antiviral y el tratamiento inmunosupresor.
Siguiendo las guías de práctica clínica2, nuestro paciente ha sido tratado con VGCV como profilaxis durante 3 meses; con GCV por enfermedad tardía, manteniéndose hasta 3 semanas con VGCV después de lograr supresión de la carga viral.
Se sospecha resistencia a fármacos antivirales y se debe solicitar estudio genético ante persistencia o aumento de carga viral, o de sintomatología clínica, a pesar del tratamiento adecuado2. Nuestro paciente presentaba mutación en fosfotransferasa viral (A594V, gen UL97). Las mutaciones en UL97 son las más comunes que conducen a la resistencia al GCV, de las cuales UL97 A594V es la más frecuente, aumentando 8,3 veces la resistencia al GCV3. GCV y VGCV requieren una fosforilación mediada por UL97 para bloquear la replicación del ADN del CMV humano, mientras que FOS actúa de forma independiente4. Ante resistencia a GCV, se recomienda el uso de FOS1,2.
El efecto adverso más importante del FOS es la nefrotoxicidad, caracterizada por depósito de cristales de calcio en los capilares glomerulares5, que puede prevenirse con una hidratación adecuada. Debemos valorar el uso de FOS en pacientes con disfunción renal por problemas asociados a sobredosificación6.
Dada la severidad de la enfermedad asociamos inmunoglobulinas anti-CMV (CMVIG) a FOS, a pesar de que su papel no está bien definido1,2. Schulz et al.7 concluyen que, aunque la decisión sobre el uso de CMVIG se basa en la experiencia clínica, parece razonable considerarlo en casos de CMV resistente a GCV o en casos graves y complicados.
Otras alternativas para el manejo de CMV resistente a GCV han sido descritas2. LMV es un antiviral que inhibe el complejo de la terminasa viral y ha sido aprobado para profilaxis del CMV en trasplante de células hematopoyéticas8, desconociéndose su eficacia en otros órganos. Turner et al.9, y Phoompoung et al.10, coinciden en que el uso de LMV mejora la sintomatología clínica, sin efectos adversos, aunque no siempre alcanza la supresión virológica.
Dada la refractariedad del tratamiento en nuestro paciente, decidimos suspender EVE, manteniéndolo inmunosuprimido solo con corticoide, y continuando con LMV 400mg/día y VGCV 450mg/día, consiguiendo así una respuesta viral sostenida.
Concluimos que LMV podría ser una alternativa terapéutica en casos de enfermedad CMV resistente. Se precisan más estudios que avalen su uso.