Conocer la incidencia de casos de acidosis láctica por metformina durante el periodo enero de 2014 y marzo de 2017 en el Área Sanitaria III de Aragón. Analizar los factores clínicos y analíticos asociados y la mortalidad.
ResultadosTreinta y un casos (61,3% varones). Incidencia: 79,76 casos/100000 pacientes-año; edad media 75,39 ± 9,34 años; 23 de ellos con niveles séricos de metformina (21,91 ± 15,52 mcg / mL); miligramos/día de metformina ingeridos: 1790,32 ± 499; 96,8% de casos en el contexto de fracaso renal agudo; 11 casos con antecedentes de enfermedad renal crónica (35,5%); 12 requirieron UCI (38,7%); 13 requirieron tratamiento depurador (41,9%; 3 hemodiafiltración, 10 hemodiálisis) Existió correlación significativa entre: miligramos diarios ingeridos de metformina y niveles del fármaco; niveles de metformina y: creatinina pico, pH y lactato. La mortalidad fue del 25,8%. Solo hubo diferencias significativas entre los fallecidos y los supervivientes respecto a la duración de la estancia y la creatinina final. La regresión logística multivariante no detectó ninguna variable del estudio asociada con la mortalidad.
ConclusionesLa incidencia en nuestra área sanitaria es más elevada que en otras series, con 25,8% de mortalidad. Prácticamente todos los casos en el contexto de fracaso renal agudo de origen prerrenal. En un 29% de los casos hubo sobredosificación. Es necesario advertir a los pacientes de las situaciones más frecuentes potencialmente inductoras de acidosis láctica, especialmente la deshidratación, si siguen tomando el fármaco durante las mismas.
To determine the incidence of metformin-induced lactic acidosis during the period January 2014 to March 2017 in Aragon Healthcare Area III. To analyse the associated clinical and analytical factors and mortality.
ResultsA total of 31 cases (61.3% males). Incidence: 79.76 cases/100,000 patients-year; mean age 75.39±9.34 years; 23 of them with levels of serum metformin (21.91±15.52 mcg/ ml); milligrams/day of metformin ingested: 1790.32±499; 96.8% of cases in the context of acute kidney failure; 11 cases with a history of chronic kidney disease (35.5%); 12 required intensive care (38.7%); 13 required purification treatment (41.9%; 3 haemodiafiltration, 10 haemodialysis). There was a significant correlation between daily milligrams of metformin ingested and drug levels; levels of metformin; and peak creatinine, pH and lactate. Mortality was 25.8%. There were only significant differences between the deceased and survivors regarding the duration of stay and final creatinine. Multivariate logistic regression did not detect any study variables associated with mortality.
ConclusionsThe incidence in our healthcare area is higher than in other series, with a 25.8% mortality rate. Virtually all cases were in the context of prerenal acute kidney failure. In 29% of cases, there was an overdose. Patients must be warned about the most common lactic acidosis-inducing situations, especially dehydration, if they continue taking the drug at such times.
Actualmente la metformina es uno de los fármacos más prescritos en el mundo y todo hace pensar que continuará siéndolo en el futuro1. Esto hace que cobre especial importancia prestar atención a sus posibles efectos adversos entre los que destaca por su gravedad la posible inducción de acidosis láctica, aunque con este fármaco la complicación se presenta en menor medida que con otras biguanidas como la butformina y fenformina, precisamente eliminadas del mercado como consecuencia de este problema2. Según algunas series la mortalidad de este cuadro es muy elevada, situándose entre 25-50%2,3.
No obstante, se discute en la literatura médica la verdadera incidencia y trascendencia práctica de la acidosis láctica asociada a la metformina (MALA). También se ha cuestionado la relación causa-efecto del fármaco con la aparición del cuadro4,5.
En el presente trabajo pretendemos analizar cuál ha sido la incidencia de la MALA en los últimos años en nuestra área sanitaria. También realizamos un análisis descriptivo de nuestra muestra de pacientes afectados y de las variables clínicas y analíticas relacionadas con el resultado del ingreso.
Material y métodosEmplazamiento: Área Sanitaria III de Aragón. Población: 306.200 habitantes. Hospital de referencia: Hospital Clínico Universitario Lozano Blesa de Zaragoza (HCULB). Periodo de estudio: enero 2014 - marzo 2017.
Fuentes de datos: el Servicio de Toxicología del HCULB, que centraliza en exclusiva la realización de estas determinaciones en nuestra área sanitaria, nos facilitó el listado de los 23 pacientes a los que se les midieron niveles de metformina durante el periodo de estudio con resultado por encima de 5 mcg/ mL (valores terapéuticos: 1-2 mcg/ mL), límite a partir del cual se considera que existe toxicidad. En estos pacientes se comprobó además que cumplían los criterios analíticos definitorios de acidosis láctica: pH ≤ 7,35 y nivel de lactato ≥ de 5 mmol/litro. El Servicio de Documentación Clínica del HCULB nos facilitó un listado adicional de doce pacientes con códigos diagnósticos al alta compatibles con acidosis láctica en pacientes diabéticos que tomaban metformina, aunque en estos casos no se determinaron los niveles del fármaco. Tras revisar las historias clínicas de estos pacientes se comprobó que cinco de ellos no cumplían estrictamente los criterios analíticos de MALA (pH ≤ 7,35 y nivel de lactato ≥ de 5 mmol/litro) por lo que solo se incluyeron siete pacientes para el estudio. El Servicio de Farmacia del HCULB nos facilitó la cifra de pacientes diabéticos que recibían tratamiento con metformina en dos momentos del periodo de estudio, junio de 2014 (10.636 pacientes) y enero de 2017 (12.510 pacientes). Se utilizó la media aritmética de las dos cifras (11.573) para efectuar los cálculos de incidencia, expresada como casos/100.000 pacientes-año, con una muestra de 30 casos de MALA en total.
Cabe resaltar que poco después de cerrado el periodo de observación de la incidencia se registró otro caso en el Servicio de Nefrología, que aunque no computó para dicha estimación, puesto que deberíamos haber recurrido de nuevo a una búsqueda de casos sin determinación de los niveles del fármaco en los datos del Servicio de documentación clínica en el periodo adicional en que se dio este caso, sí se incluyó para el análisis de las variables clínicas y analíticas. Decidimos incluirlo al tratarse del paciente que mostró unos niveles del principio activo más elevados de toda la serie (74,04 mcg/mL).
Los niveles de metformina se determinaron mediante el método de cromatografía líquida-tándem masas (high-performance liquid chromatography coupled with triple-quad tandem mass spectometry) Agilent Technologies®.
Se revisaron las historias clínicas de todos los pacientes incluidos recopilando las siguientes variables clínicas y analíticas: sexo, edad, índice de comorbilidad de Charlson, miligramos de metformina al día ingeridos, formulación de metformina (sola o en combinación), número de principios activos ingeridos al día, cuadro clínico al ingreso, servicio hospitalario de ingreso, presencia de fracaso renal agudo (FRA), estadio del FRA, etiología del FRA, creatinina basal, filtrado glomerular basal (FG) estimado con la fórmula CKD-EPI, creatinina pico durante el ingreso, creatinina final al alta, días de estancia hospitalaria, necesidad de ingreso en Unidad de Cuidados Intensivos (UCI), necesidad de tratamiento renal sustitutivo (TRS), tipo de TRS (hemodiálisis [HD]/hemofiltración venovenosa continua), número de sesiones de TRS, pH, lactato, bicarbonato, anión GAP, pCO2, actividad de protrombina, potasio, hemoglobina, niveles plasmáticos de metformina, resultado final del ingreso (fallecido/no fallecido), causa de la muerte, presencia de sobredosificación de metformina. Para determinar esta última variable se tuvieron en cuenta las recomendaciones de la Agencia Española de Medicamentos y Productos sanitarios6: FG < 30mL/minuto, contraindicada; FG entre 30-44, dosis máxima total 1000mg/día; FG entre 45-59, dosis máxima total 2000mg/día, FG entre 60-89, dosis máxima total 3000mg/día.
Análisis estadístico: para comparar las variables entre el grupo de fallecidos y supervivientes se utilizó el test no paramétrico de Mann Whitney. Las variables categóricas se analizaron mediante el test de Chi cuadrado. Si las condiciones requeridas para la utilización de este test no se cumplían se sustituyó por el test exacto de Fisher. Se efectuó un análisis de correlación entre variables cuantitativas mediante el coeficiente de Spearman. Finalmente se realizó un análisis de regresión logística binaria multivariante para seleccionar las variables asociadas con la mortalidad en nuestra serie.
ResultadosLa incidencia de MALA en nuestra área sanitaria durante el periodo de estudio se situó en 79,76 casos por 100.000 pacientes-año (61,15 casos por 100.000 pacientes año si solo tuviéramos en cuenta aquellos casos en los que se disponía de niveles séricos de metformina).
La muestra la compusieron 19 varones (61,3%) y 12 mujeres (37,8%) de 75,39±9,34 años de edad (varones 75,58±8,7; mujeres 75,08±10,71. Diferencia no significativa). Índice de Charlson 6,77±1,71 (varones 6,84±1,5; mujeres 6,67±2,1; diferencia no significativa). Número de principios activos ingeridos al día 10,19±4,33 (varones 9,58±4,1; mujeres 11,17±4,7; diferencia no significativa). Al analizar los diferentes grupos de principios activos se comprobó cómo 23 pacientes estaban tomando un IECA o ARA II, 22 pacientes diuréticos, 20 estatinas, 9 pacientes tomaban AINE, 5 pacientes tomaban simultáneamente IECA/ARA II, diurético y AINE. El 58% de los pacientes tomaban la metformina sola y el restante 42% en combinación con otro antidiabético oral. La pauta más frecuente fue la de 850 miligramos de metformina cada 12 h en 10 pacientes. Seis pacientes también recibían insulina. La dosis diaria media ingerida del fármaco fue de 1790, 32±499 miligramos. El cuadro clínico más frecuente que motivó la consulta fue de náuseas, vómitos o diarreas en 15 casos, seguido de lejos por dolor torácico, fiebre, insuficiencia cardiaca o hipoglucemia. Estos cuadros motivaron la consulta en dos casos. El resto de los pacientes consultaron por otros motivos. El mayor número de casos, doce de ellos, fue atendido en el Servicio de Nefrología, seguido por el Servicio de Medicina Interna, con once casos. El resto de los pacientes fueron ingresados en otros servicios: endocrinología, cardiología, psiquiatría, cirugía general y digestivo acogieron a un caso cada uno de ellos. Otro paciente solo fue atendido en Urgencias, donde falleció y finalmente dos pacientes fueros ingresados directamente en la UCI, donde fallecieron. La duración media de la hospitalización fue de 11,23±7,7 días.
En cuanto a la función renal basal de los pacientes en la mayoría, en 20 casos (64,5%), no existían datos de enfermedad renal crónica (ERC) siendo su FG basal > de 60mL/min. Tres pacientes presentaban un estadio 3a (FG entre 60 y 45), 6 paciente un estadio 3b (FG entre 44 y 30) y finalmente 2 pacientes un estadio 4 (FG < 30). Como consecuencia de ello se comprobó la existencia de sobredosificación de metformina en 9 pacientes (29% de la muestra), los dos del estadio 4 en los que la metformina está contraindicada, 6 casos del estadio 3b y un caso del estadio 3a.
Tan solo hubo un caso de sobredosificación voluntaria y fue precisamente este el único en el que no se acompañó de deterioro de la función renal. En todos los demás el cuadro se presentó en el contexto de un episodio de FRA, en 3 casos de origen parenquimatoso y en 27 de origen prerrenal. En 25 casos (83,3%) el FRA alcanzó el estadio III según la clasificación KDIGO, en tres casos estadio II y en los dos restantes estadio I.
Un total de doce pacientes (38,7%) precisaron ingreso en la UCI, frente a 19 casos (61,3%) que no lo requirieron. En 13 casos (41,9%) fue necesario aplicar TRS frente a 18 casos (58,1%) en que no se tuvo que realizar. Respecto al tipo de TRS, la HD se empleó en 10 casos (76,9%), el número de sesiones fue de 2,3±1,1 (rango 1-5). La hemofiltración venovenosa continua se aplicó en 3 casos (23,1%), con un número de sesiones de 2,33±1,53 (rango 1-4). La duración de las sesiones de HD llevadas a cabo por el Servicio de Nefrología fue programada en cuatro h. La duración de las sesiones de HDFVV en la UCI se situó en torno a seis h.
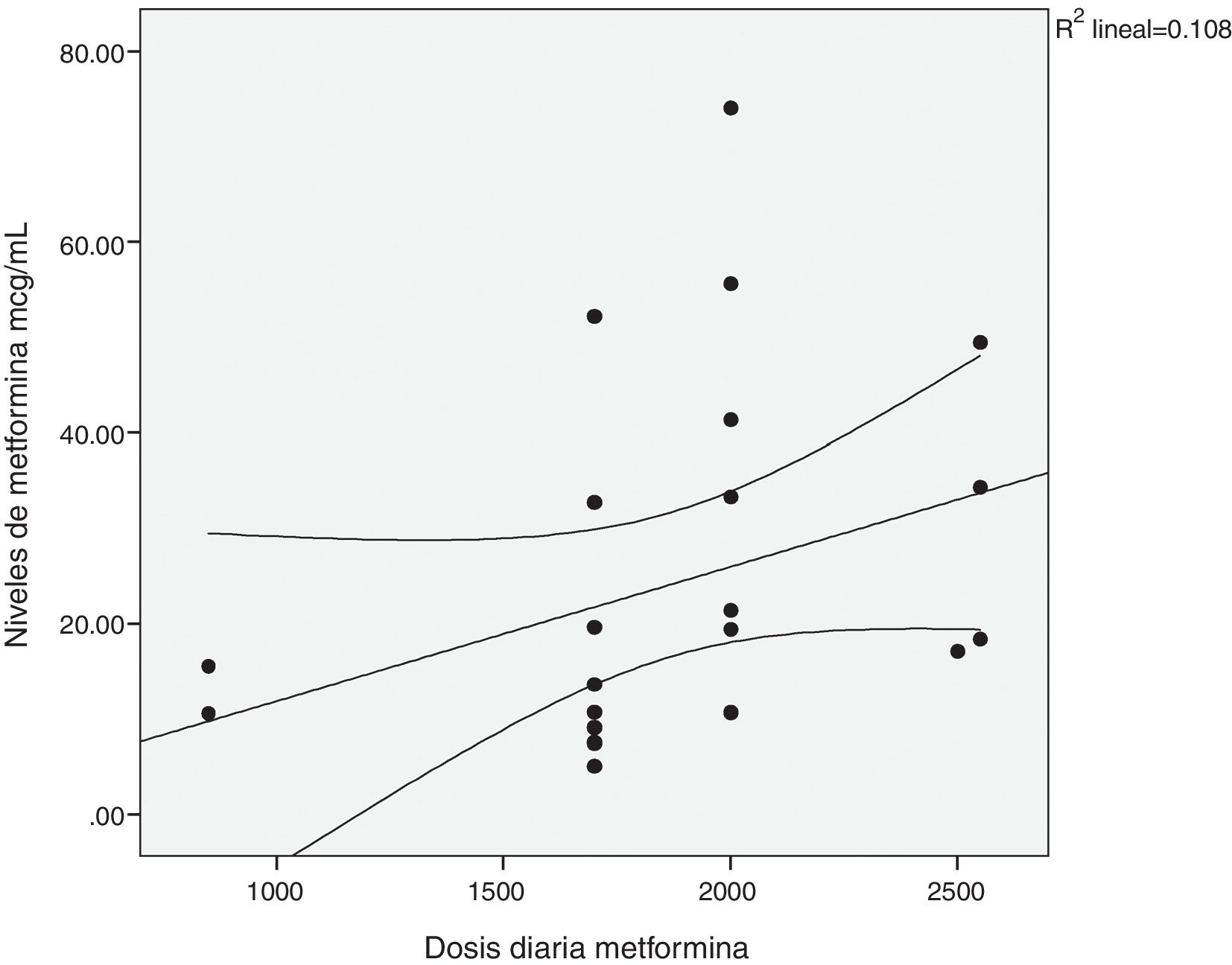
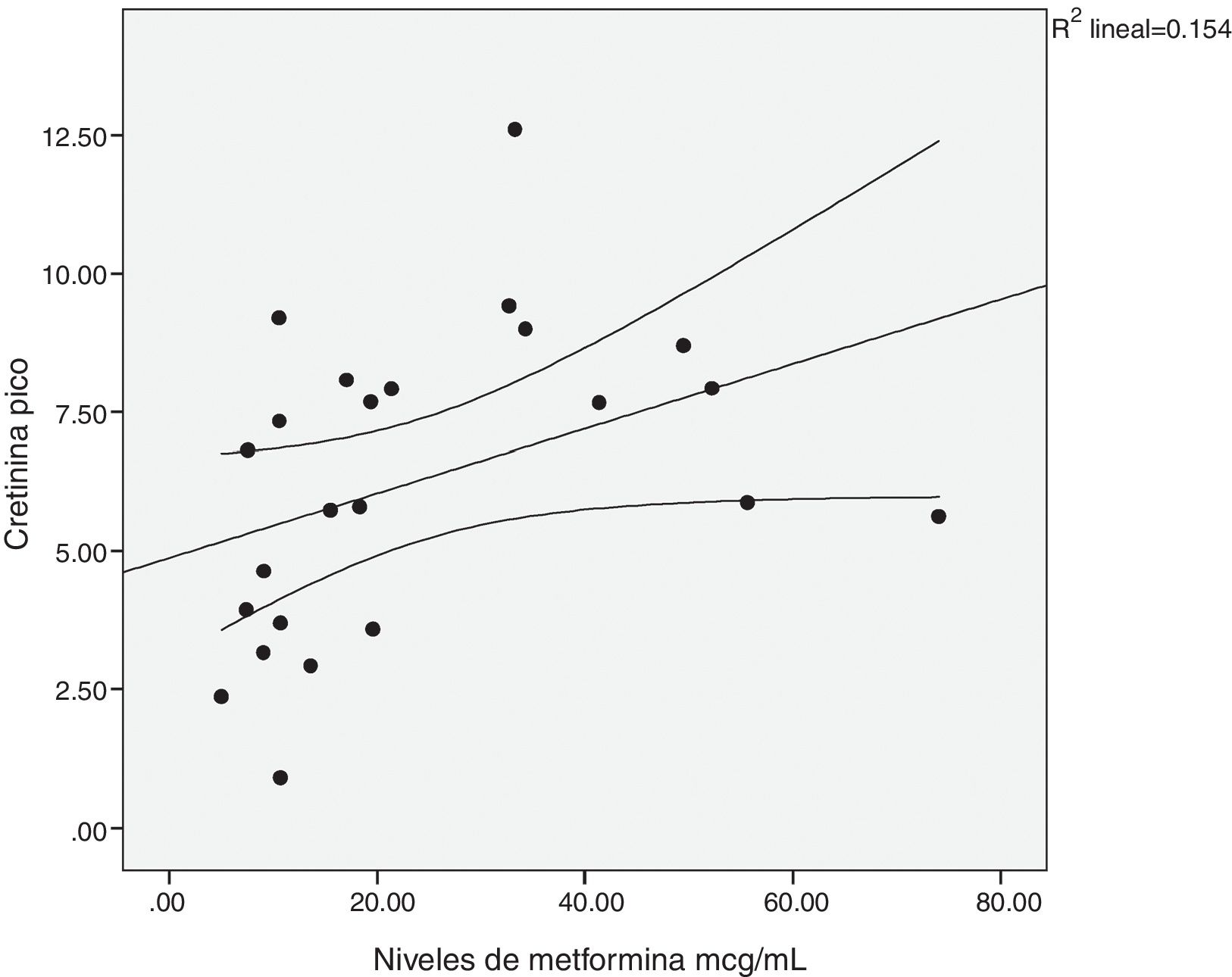
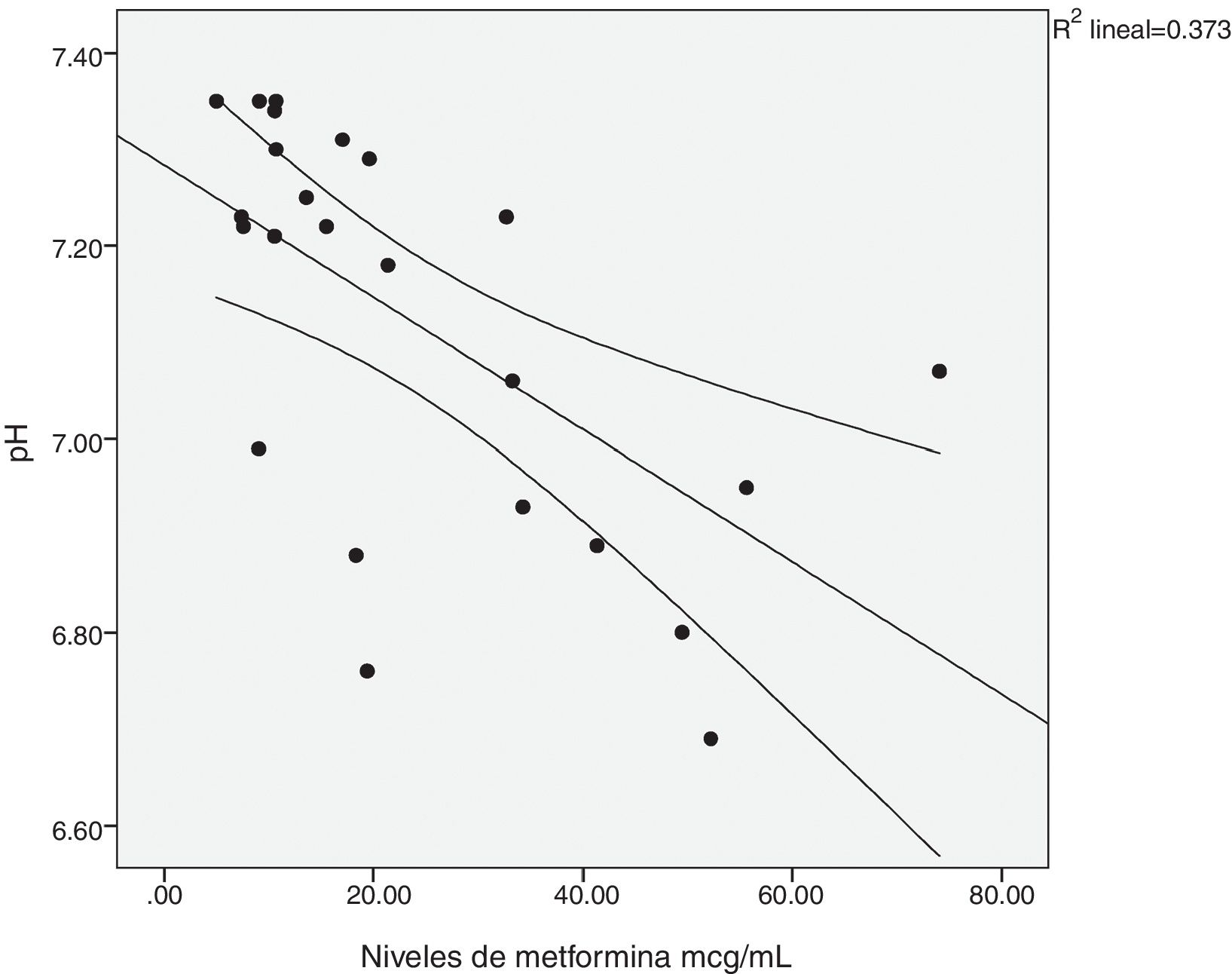
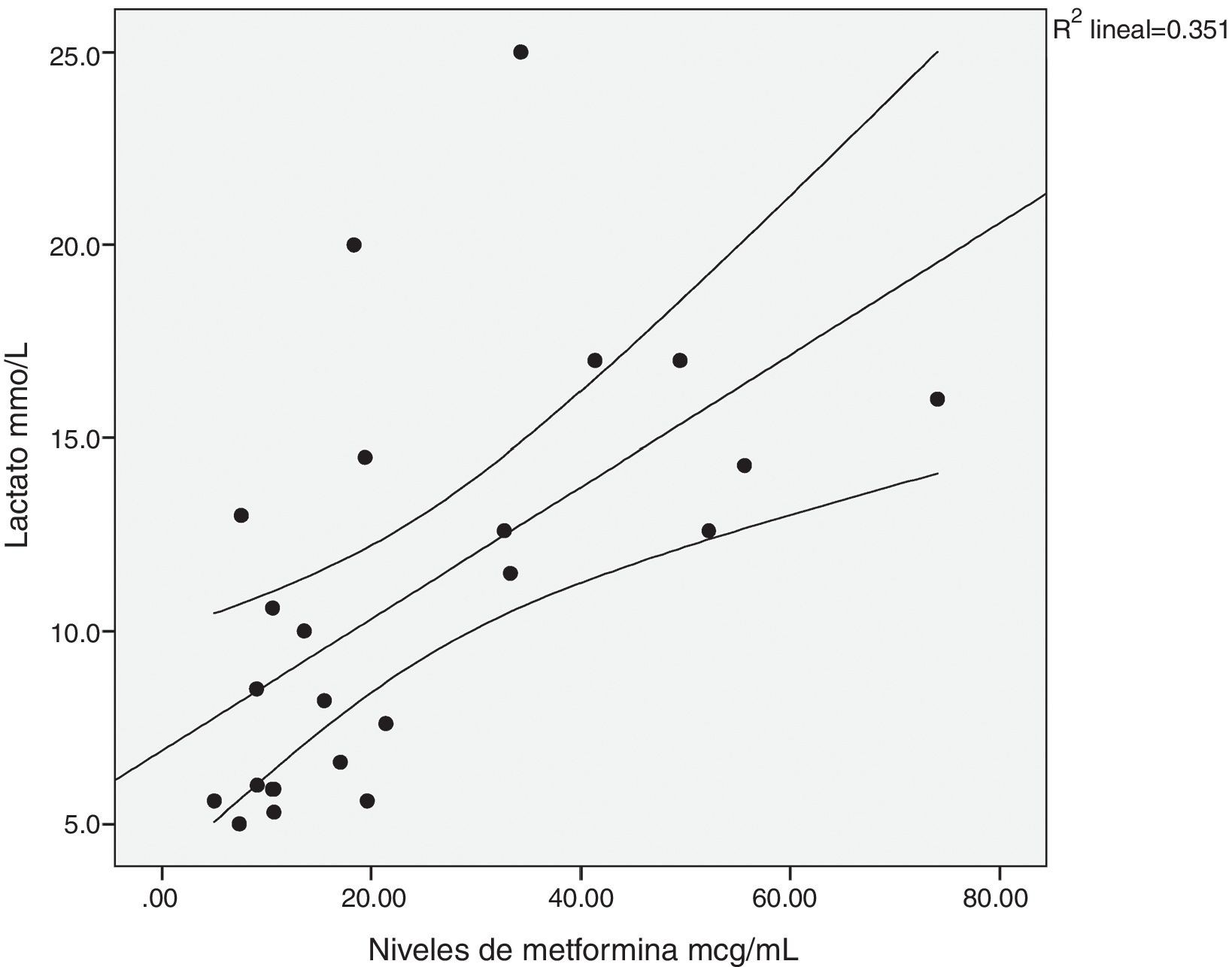
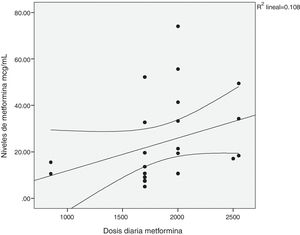
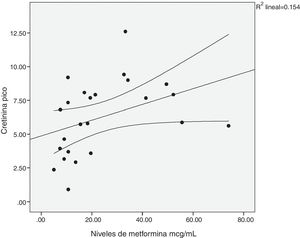
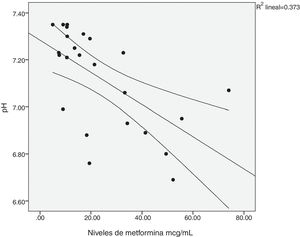
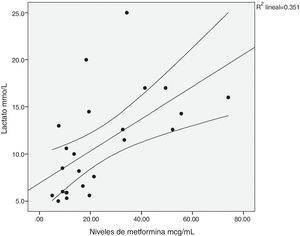
Existió una correlación significativa entre la dosis diaria de metformina ingerida y los niveles séricos del fármaco (fig. 1). También entre los niveles de metformina y otras tres variables: la creatinina pico, el pH y el lactato sérico (figs. 2-4). Así mismo se detectó correlación entre el índice de comorbilidad de Charlson y el número de principios activos ingeridos, como también existió entre el pH y el nivel de potasio sérico.
Un total de 8 pacientes (25,8%) de nuestra serie fallecieron durante el ingreso, frente a 23 (74,19%) que sobrevivieron. Tres pacientes fallecieron en la UCI, uno de ellos debido a un cuadro de asistolia refractaria a maniobras de reanimación, el segundo como consecuencia de shock refractario y disfunción multiorgánica y el tercero por un cuadro de sepsis. Otro paciente falleció en el servicio de urgencias por parada cardiorrespiratoria sin respuesta a maniobras de reanimación sospechándose un cuadro subyacente de isquemia mesentérica. El resto de los pacientes fallecieron en la planta de hospitalización. Uno de ellos debido a sedación paliativa en el contexto de neoplasia diseminada, otro caso por edema agudo de pulmón e insuficiencia respiratoria, el tercero de este grupo presentó insuficiencia cardiaca y respiratoria con mala evolución y el último paciente presentó una neumonía bilateral con mala evolución falleciendo por una sepsis de origen respiratorio.
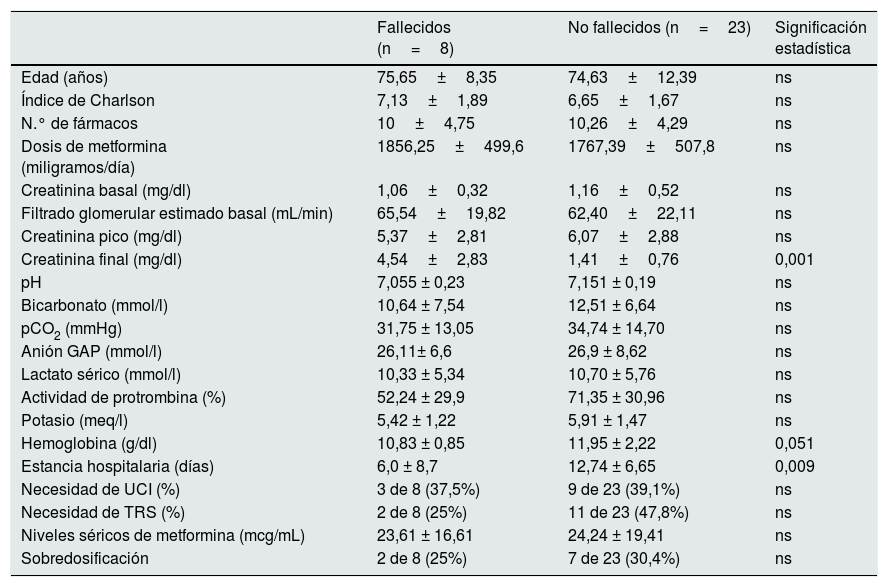
En la tabla 1 se muestra la comparación entre las variables clínicas y analíticas entre los dos grupos, los fallecidos y los supervivientes. Solo existieron diferencias significativas con respecto a la creatinina final y la duración de la estancia hospitalaria. Ninguna variable se asoció de modo independiente con la mortalidad en el análisis de regresión logística multivariante.
Comparación de diversas variables entre los grupos de fallecidos y supervivientes
| Fallecidos (n=8) | No fallecidos (n=23) | Significación estadística | |
|---|---|---|---|
| Edad (años) | 75,65±8,35 | 74,63±12,39 | ns |
| Índice de Charlson | 7,13±1,89 | 6,65±1,67 | ns |
| N.° de fármacos | 10±4,75 | 10,26±4,29 | ns |
| Dosis de metformina (miligramos/día) | 1856,25±499,6 | 1767,39±507,8 | ns |
| Creatinina basal (mg/dl) | 1,06±0,32 | 1,16±0,52 | ns |
| Filtrado glomerular estimado basal (mL/min) | 65,54±19,82 | 62,40±22,11 | ns |
| Creatinina pico (mg/dl) | 5,37±2,81 | 6,07±2,88 | ns |
| Creatinina final (mg/dl) | 4,54±2,83 | 1,41±0,76 | 0,001 |
| pH | 7,055 ± 0,23 | 7,151 ± 0,19 | ns |
| Bicarbonato (mmol/l) | 10,64 ± 7,54 | 12,51 ± 6,64 | ns |
| pCO2 (mmHg) | 31,75 ± 13,05 | 34,74 ± 14,70 | ns |
| Anión GAP (mmol/l) | 26,11± 6,6 | 26,9 ± 8,62 | ns |
| Lactato sérico (mmol/l) | 10,33 ± 5,34 | 10,70 ± 5,76 | ns |
| Actividad de protrombina (%) | 52,24 ± 29,9 | 71,35 ± 30,96 | ns |
| Potasio (meq/l) | 5,42 ± 1,22 | 5,91 ± 1,47 | ns |
| Hemoglobina (g/dl) | 10,83 ± 0,85 | 11,95 ± 2,22 | 0,051 |
| Estancia hospitalaria (días) | 6,0 ± 8,7 | 12,74 ± 6,65 | 0,009 |
| Necesidad de UCI (%) | 3 de 8 (37,5%) | 9 de 23 (39,1%) | ns |
| Necesidad de TRS (%) | 2 de 8 (25%) | 11 de 23 (47,8%) | ns |
| Niveles séricos de metformina (mcg/mL) | 23,61 ± 16,61 | 24,24 ± 19,41 | ns |
| Sobredosificación | 2 de 8 (25%) | 7 de 23 (30,4%) | ns |
ns: diferencia no significativa; TRS: tratamiento renal sustitutivo; UCI: Unidad de Cuidados Intensivos.
Desde su descripción en 1957 por Jean Stern la metformina se ha convertido en una de los fármacos más prescritos del mundo2. Actualmente se estima que unos 150 millones de pacientes están en tratamiento con ella en todo el planeta para controlar su diabetes1. El estudio United Kingdom Prospective Diabetes Study mostró que este fármaco se asoció en pacientes diabéticos tipo 2 con un descenso de la mortalidad de todas las causas y de origen cardiovascular respecto a los tratados con sulfonilureas o insulina7. Además de su efecto hipoglucemiente son otras muchas aplicaciones las que se están describiendo en los últimos años: cáncer8, ovario poliquístico9, entre otras. Es destacable también su posible beneficio en términos de combatir el envejecimiento y las enfermedades neurodegenerativas incluso en los no diabéticos, hecho que está siendo evaluado actualmente en un ensayo clínico10. Por lo tanto no sería extraño que en un futuro próximo el uso de este fármaco se incrementara aún más. En este contexto es importante recordar que la metformina también puede producir efectos secundarios, entre los que tradicionalmente ha destacado la posible inducción de acidosis láctica que en algunos casos puede llegar a ser letal. No obstante, existe un debate en la literatura acerca de la verdadera incidencia e importancia de este problema. En una revisión Cochrane de 2010 concluyeron que no hay claras evidencias de que la metformina se asocie a un mayor riesgo de acidosis láctica en comparación con otros tratamientos hipoglucemiantes4.
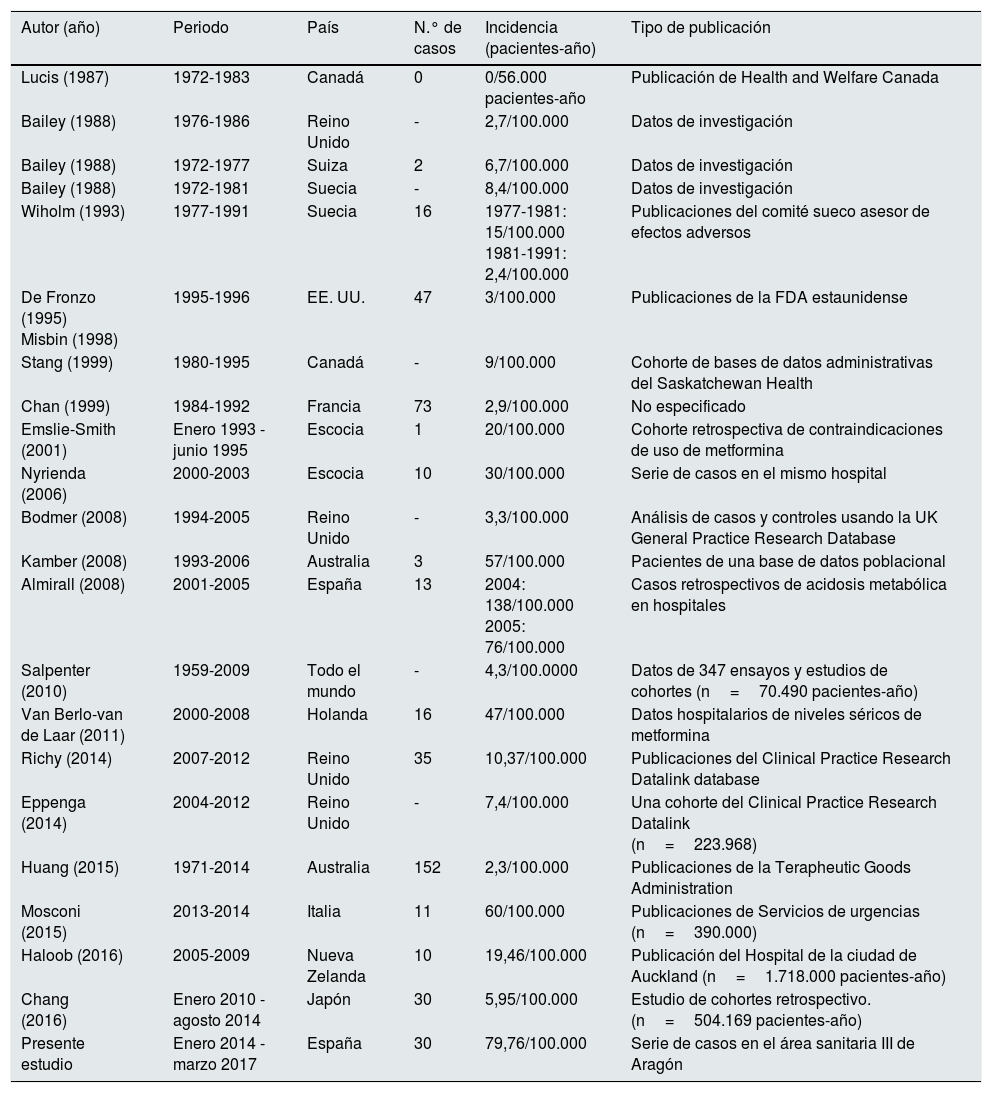
Por el contrario en nuestro estudio la incidencia es ciertamente elevada, bastante por encima de lo reportado en otros estudios previos, como muestran los datos de la tabla 2,4,11–29 adaptados y ampliados de Lalau5, por lo que en nuestra opinión nos encontramos ante un problema real cuya importancia no hay que minimizar. No realizamos una estimación promedio de los pacientes tratados con metformina de todo el periodo de estudio porque la obtención de los datos en las dos fechas concretas que se utilizaron ya resultó muy laboriosa. Por lo tanto se optó por utilizar la media aritmética de las dos cifras para efectuar los cálculos. Con esta estrategia de recogida de datos para estimar la incidencia, de haberse producido algún sesgo, este sería el de la infraestimación, pues se pudo haber dado algún caso no detectado en la búsqueda del Servicio de Documentación Clínica debido a una codificación deficiente. No obstante, todos los casos en los que se determinaron los niveles de metformina están recogidos adecuadamente y sin posibilidad de error, dado que solo existe un laboratorio de toxicología en nuestra área sanitaria que centraliza estas peticiones de niveles del fármaco. Por lo tanto creemos que la cifra obtenida es un fiel reflejo de la incidencia en el área sanitaria de nuestro hospital durante el periodo de estudio.
Incidencia de MALA publicada en diversos trabajos
| Autor (año) | Periodo | País | N.° de casos | Incidencia (pacientes-año) | Tipo de publicación |
|---|---|---|---|---|---|
| Lucis (1987) | 1972-1983 | Canadá | 0 | 0/56.000 pacientes-año | Publicación de Health and Welfare Canada |
| Bailey (1988) | 1976-1986 | Reino Unido | - | 2,7/100.000 | Datos de investigación |
| Bailey (1988) | 1972-1977 | Suiza | 2 | 6,7/100.000 | Datos de investigación |
| Bailey (1988) | 1972-1981 | Suecia | - | 8,4/100.000 | Datos de investigación |
| Wiholm (1993) | 1977-1991 | Suecia | 16 | 1977-1981: 15/100.000 1981-1991: 2,4/100.000 | Publicaciones del comité sueco asesor de efectos adversos |
| De Fronzo (1995) Misbin (1998) | 1995-1996 | EE. UU. | 47 | 3/100.000 | Publicaciones de la FDA estaunidense |
| Stang (1999) | 1980-1995 | Canadá | - | 9/100.000 | Cohorte de bases de datos administrativas del Saskatchewan Health |
| Chan (1999) | 1984-1992 | Francia | 73 | 2,9/100.000 | No especificado |
| Emslie-Smith (2001) | Enero 1993 -junio 1995 | Escocia | 1 | 20/100.000 | Cohorte retrospectiva de contraindicaciones de uso de metformina |
| Nyrienda (2006) | 2000-2003 | Escocia | 10 | 30/100.000 | Serie de casos en el mismo hospital |
| Bodmer (2008) | 1994-2005 | Reino Unido | - | 3,3/100.000 | Análisis de casos y controles usando la UK General Practice Research Database |
| Kamber (2008) | 1993-2006 | Australia | 3 | 57/100.000 | Pacientes de una base de datos poblacional |
| Almirall (2008) | 2001-2005 | España | 13 | 2004: 138/100.000 2005: 76/100.000 | Casos retrospectivos de acidosis metabólica en hospitales |
| Salpenter (2010) | 1959-2009 | Todo el mundo | - | 4,3/100.0000 | Datos de 347 ensayos y estudios de cohortes (n=70.490 pacientes-año) |
| Van Berlo-van de Laar (2011) | 2000-2008 | Holanda | 16 | 47/100.000 | Datos hospitalarios de niveles séricos de metformina |
| Richy (2014) | 2007-2012 | Reino Unido | 35 | 10,37/100.000 | Publicaciones del Clinical Practice Research Datalink database |
| Eppenga (2014) | 2004-2012 | Reino Unido | - | 7,4/100.000 | Una cohorte del Clinical Practice Research Datalink (n=223.968) |
| Huang (2015) | 1971-2014 | Australia | 152 | 2,3/100.000 | Publicaciones de la Terapheutic Goods Administration |
| Mosconi (2015) | 2013-2014 | Italia | 11 | 60/100.000 | Publicaciones de Servicios de urgencias (n=390.000) |
| Haloob (2016) | 2005-2009 | Nueva Zelanda | 10 | 19,46/100.000 | Publicación del Hospital de la ciudad de Auckland (n=1.718.000 pacientes-año) |
| Chang (2016) | Enero 2010 -agosto 2014 | Japón | 30 | 5,95/100.000 | Estudio de cohortes retrospectivo. (n=504.169 pacientes-año) |
| Presente estudio | Enero 2014 -marzo 2017 | España | 30 | 79,76/100.000 | Serie de casos en el área sanitaria III de Aragón |
La metformina actúa inhibiendo la neoglucogénesis hepática como consecuencia de un déficit energético relativo originado por la disminución del adenosín trifosfato producido en las mitocondrias30. Otras acciones importantes del fármaco son mediadas tras la activación del enzima AMPK, responsable de los efectos pleiotrópicos del fármaco1,31. También se ha descrito un efecto beneficioso sobre la microbiota intestinal32. En las mitocondrias el fármaco inhibe el complejo I de la cadena respiratoria por un mecanismo no bien conocido30. Sí que está mejor descrita su otra acción inhibiendo el enzima glicerol-3-fosfato deshidrogenasa mitocondrial que también origina un desacoplamiento del mecanismo de respiración celular33. Cuando existe hipoxia tisular el ácido pirúvico producido como producto final de la glucólisis citoplasmática es metabolizado por la enzima lácticodeshidrogenasa hacia la producción de ácido láctico (acidosis láctica tipo A). Cuando no existe hipoxia el ácido pirúvico se incorpora a la mitocondria y es utilizado como sustrato del ciclo de Krebs que se acopla a la cadena respiratoria para producir adenosín trifosfato mediante la fosforilación oxidativa. El efecto final de las biguanidas es similar al producido por la hipoxia (acidosis láctica tipo B)34. En el caso de la metformina cuando se usa a dosis terapéuticas este efecto es despreciable, pero cuando se ingiere en exceso de modo intencional o cuando la ingesta a dosis normales se produce en determinado contexto clínico (insuficiencia cardiaca, situaciones de hipoxia, insuficiencia hepática, deshidratación, ERC) y si además se asocia a determinados factores (contrastes radiológicos, fármacos como los AINE, IECA o ARA II) aumenta el riesgo de sobredosificación e inducción de acidosis láctica35, máxime si el contexto clínico es el de un FRA, dada la eliminación del fármaco fundamentalmente por vía renal de modo inalterado36.
El debate también se extiende a la definición del cuadro. Algunos autores como Lalau distinguen en la práctica clínica hasta tres situaciones diferentes5: 1) la denominada Metformin-unrelated hyperlactatemia –MULA–, en ausencia de acumulación de metformina. Es especialmente cierto cuando los niveles sanguíneos de metformina son normales, por debajo de lo normal o incluso indetectables. Lalau sostiene que este grupo es más numeroso y el que comporta peor pronóstico. 2) Metformin-induced hyperlactatemia –MILA–. Se refiere a la hiperlactacidemia causada únicamente por la metformina. Un caso típico es la intoxicación voluntaria por metformina en ausencia de drogas concomitantes. Un caso similar es la acumulación aguda de metformina debida únicamente al fracaso renal agudo. 3) Metformin-associated hyperlactatemia,
–MALA– el caso más complejo. La palabra «asociada» significa que la inducción de la hiperlactacidemia es consecuencia (aunque en diferente grado, quizás) de la acumulación de metformina y una o más enfermedades concomitantes asociadas. Según Lalau este grupo sería menos frecuente de lo sospechado y su pronóstico sería mejor que el de la MULA, otorgando a la metformina un factor «protector». La dificultad de la aplicación de estas definiciones, algo engorrosas en sí, reside además en disponer de la determinación de los niveles de metformina en tiempo real, hecho que no se suele producir en la práctica habitual. En todo caso y en aras de una mayor simplicidad se podrían dividir a los pacientes en dos grupos, aquellos en los que la metformina no está relacionada con la inducción del cuadro de acidosis láctica (la denominada MULA) y aquellos en los que el fármaco sí lo está y es el principal responsable (MILA) o comparte esa responsabilidad con otra serie de patologías concomitantes (MALA).
También existe disparidad entre los estudios sobre la relación entre los niveles de metformina y el grado de acidosis láctica, pues los resultados son discordantes entre diferentes trabajos37–41. No obstante cabe resaltar aquí los hallazgos del reciente estudio de Boucaud-Maitre et al. de amplio tamaño muestral en el que quedó patente la correlación entre ambos parámetros42, como también hemos podido comprobar en nuestro trabajo. La controversia así mismo se extiende a las recomendaciones de la dosificación del fármaco en pacientes afectos de insuficiencia renal pues estas difieren según las sociedades científicas y la opinión de algunos expertos43. En este sentido es pertinente recordar los resultados de un estudio de Taiwan en el que se comparó la mortalidad de una amplia cohorte de pacientes afectos de ERC estadio 5 tratados con metformina con pacientes no tratados44. El grupo tratado mostró de modo significativo una mayor mortalidad que paradójicamente no se relacionó con una mayor incidencia de acidosis láctica en este grupo. Los autores argumentan que la alteración de la cadena respiratoria mitocondrial podría ser más nociva en los pacientes con enfermedad renal crónica avanzada, incluso sin llegar a provocar acidosis láctica.
En nuestro estudio detectamos un 29% de casos de sobredosificación según FG. Este es un aspecto en el que hay que hacer hincapié, pues sería fácilmente evitable con una adecuada prescripción, para lo que el clínico que prescribe el fármaco debería previamente solicitar una analítica para conocer la función renal basal del paciente y realizar los ajustes oportunos en la dosificación. En el seguimiento posterior la función renal debería ser monitorizada periódicamente según recomiendan las guías. Queremos resaltar que probablemente ese elevado número de episodios de MALA detectados en nuestro trabajo se ha debido a una inadecuada vigilancia en la prescripción/dosificación por falta de insistencia de los facultativos que prescriben el fármaco en la adecuación de las dosis de metformina con arreglo a la función renal (en todos los casos excepto en uno que fue por voluntad del paciente).
No obstante, en defensa de los médicos prescriptores puede argumentarse que en el pasado reciente ha existido discordancia entre las últimas guías europeas, más laxas para el tratamiento con metformina en la ERC45, y americanas, que siguen contraindicándola con FG por debajo de 30mL/min46. De hecho la ficha técnica hasta fechas recientes señalaba que metformina no debía utilizarse en pacientes con FG <60mL/min, pero se prescribía en la práctica clínica de forma amplia por debajo de esos límites de FG. Recientemente la ficha técnica ha sido modificada por la European Medicines Agency47. En la literatura médica española reciente también existen guías y revisiones recientes sobre este tema48,49.
De los datos de nuestro estudio se puede definir un patrón típico de presentación de caso: paciente de edad avanzada, con comorbilidad importante y polimedicado, en muchos casos con fármacos potencialmente causales de FRA, que sufre un proceso de deshidratación en el contexto de un cuadro generalmente gastrointestinal durante el cual sigue ingiriendo la metformina. La consecuencia es un episodio de FRA estadio III con la consiguiente acumulación de metformina y de modo proporcional a la elevación de los niveles séricos del fármaco se incrementan los niveles de lactato y disminuye el pH. Aproximadamente el 40% de los pacientes van a requerir ingreso en UCI y un porcentaje similar el inicio de TRS, datos que ponen de relieve la potencial gravedad del cuadro, que finalmente se tradujo en nuestra serie en una mortalidad del 25%. La mayoría de los pacientes fueron atendidos en los servicios de nefrología y medicina interna. Solo hubo diferencias significativas entre los fallecidos y los supervivientes respecto a la creatinina final y la duración de la estancia hospitalaria, obviamente más elevada la primera y más reducida la segunda en los fallecidos. Ninguna variable mantuvo su significación en el análisis multivariante, reflejo quizá del tamaño muestral. En el estudio de Boucaud Maitre anteriormente citado el nivel de lactato sí se asoció de modo independiente con la mortalidad42.
La metformina es una molécula pequeña (129 Daltons) con una baja unión a proteínas por lo que difunde libremente a través de los dializadores y los hemofiltros. El factor limitante para su depuración extracorpórea es su volumen de distribución relativamente grande (1-5 L/kg) aunque este puede verse reducido en el contexto del FRA. La justificación del TRS va más allá de la eliminación del fármaco del organismo puesto que además incluye: 1) la corrección más rápida, previsible y eficaz de la acidosis que la que se consigue con tratamiento con bicarbonato, 2) mejorar la hiperlactacidemia, 3) corregir las alteraciones electrolíticas, y 4) dar soporte a los riñones cuya función esta deteriorada36. Respecto a la modalidad del TRS a emplear, una reciente revisión sistemática del grupo de trabajo del tratamiento extracorpóreo de las intoxicaciones pone de relieve la superior eficacia de la hemodiálisis frente a las técnicas continuas, por lo que si la estabilidad hemodinámica del paciente lo permite es preferible optar por la primera opción utilizando bicarbonato en el baño y sometiendo al paciente a una monitorización exhaustiva durante la sesión36. De modo adicional, un elegante trabajo reciente ha puesto de manifiesto que la duración de las sesiones debe ser prolongada, entre cinco y seis h, y que hay que monitorizar los niveles de metformina y de lactato ante el posible rebote de los mismos al finalizar la sesión de diálisis. No existen recomendaciones específicas sobre la conductividad a emplear ni otras especificaciones técnicas50.
Este estudio presenta una serie de limitaciones. En primer lugar es retrospectivo por lo que se han podido producir sesgos en la selección de los pacientes incluidos y errores en la recogida e interpretación de los datos de la historia clínica, aunque se ha prestado atención al detalle al realizar esta labor. En segundo lugar no existe un grupo control, pero podemos argumentar que hubiera resultado difícil reunir en nuestro medio una serie de 31 casos afectos de acidosis láctica no atribuible a MALA durante el periodo de estudio para utilizarlos como controles. A pesar de ello el tamaño de la muestra de nuestro trabajo es considerable por lo que pensamos que aporta información clínica relevante.
Como conclusión, en este trabajo hemos detectado una elevada incidencia de MALA en nuestra área sanitaria, aunque si aplicamos las definiciones de Lalau buena parte de nuestros casos se podrían englobar dentro del grupo denominando MILA. Nuestra incidencia es muy superior a lo tradicionalmente publicado, por lo que creemos que no se debe bajar la guardia ante este problema que potencialmente puede acarrear graves consecuencias. Hemos comprobado cómo el 25% de los pacientes de nuestra muestra fallecieron durante el ingreso. De los datos extraídos de nuestra serie de casos, y en consecuencia con el cambio sustancial emitido por la European Medicines Agency en 201647, cabe destacar la importancia de advertir a los pacientes a la hora de la prescripción de los efectos nocivos que pueden desencadenarse al seguir ingiriendo el fármaco en situaciones que supongan un estado de deshidratación, con el consiguiente riesgo de FRA y acumulación del fármaco, por lo que es importante que se consulte con el médico cuando estas situaciones se producen. Así mismo también es preciso realizar una adecuada dosificación inicial, acorde con el nivel de función renal basal de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.