El cierre percutáneo de la orejuela izquierda (CPOI) se ha propuesto como una alternativa al tratamiento anticoagulante en pacientes con fibrilación auricular no valvular para disminuir el riesgo tromboembólico, evitando los riesgos de la anticoagulación. Esta opción puede ser atractiva en pacientes con fibrilación auricular no valvular y enfermedad renal crónica (ERC), ya que presentan un alto riesgo tanto tromboembólico como hemorrágico.
ObjetivoDeterminar el papel pronóstico de la presencia de ERC en pacientes con fibrilación auricular sometidos a un CPOI periprocedimiento y durante el seguimiento comparado con los pacientes con función renal preservada.
MétodosEstudio retrospectivo, observacional de muestreo consecutivo que incluyó 124 pacientes sometidos a CPOI por fibrilación auricular en un hospital universitario y se compararon los resultados según la función renal basal.
ResultadosLa mediana de edad fue 75,5 años (RIQ 67,6-80), el 62,1% eran hombres, la mediana de CHA2DS2-Vasc y HASBLED era de 4 (RIQ 3-4) para ambas escalas. El 57,3% de la muestra tenía ERC. Las características basales eran similares entre ambos grupos, salvo una media de edad y un score de HASBLED superiores en los pacientes con ERC. Durante el procedimiento, no se observó ningún evento tromboembólico, de sangrado o muerte. Durante el tiempo de hospitalización y de seguimiento combinados, no hubo diferencias significativas entre grupos en la tasa anual de episodios tromboembólicos (0,97/100 pacientes-año [100PA] vs. 4,06/100PA, p=0,092), pero si se observó una mayor tasa de sangrados (5,67/100PA vs. 13,3/100PA, p=0,033), y de mortalidad (6,50/100PA vs. 17,2/100PA, p=0,009) en el grupo de ERC, con una odds ratio para mortalidad de 2,711 (IC95% 1,96-6,95). En el análisis multivariante, el FGe preservado se asoció independientemente con una menor mortalidad.
ConclusionesEl CPOI es una alternativa válida a la anticoagulación oral en pacientes con ERC y fibrilación auricular, con una baja tasa de eventos peri- y posprocedimiento. No obstante, los pacientes con ERC presentan mayor riesgo de sangrado y de mortalidad durante el seguimiento. Aunque estas mayores tasas no están necesariamente relacionadas con el procedimiento.
Percutaneous left atrial appendage closure (LAAC) has been proposed as an alternative to anticoagulation therapy in patients with nonvalvular atrial fibrillation to decrease the thromboembolic risk, while avoiding the risks of chronic anticoagulation. This option may be attractive in patients with nonvalvular atrial fibrillation and chronic kidney disease (CKD), since they exhibit both high-thromboembolic and bleeding risks.
ObjectiveTo evaluate the prognostic impact of the presence of CKD in patients with atrial fibrillation undergoing LAAC peri-procedure and during the follow-up as compared with patients with preserved renal function.
MethodsRetrospective, observational study that included 124 consecutive patients with atrial fibrillation undergoing LAAC in a university hospital, and the results were evaluated according to the baseline renal function of the patients.
ResultsThe median age was 75.5 years (IQR 67.6–80) and 62.1% were men, the median of CHA2DS2-Vasc and HASBLED scores was 4 (IQR 3–4) for both scores. Up to 57.3% of the total sample had CKD. Baseline characteristics were similar between groups, but CKD patients were older and had a higher HASBLED score. During the procedure, no thromboembolic, bleeding events, or deaths were observed. Combining the time of hospitalization and follow-up, no significant differences were observed between groups in the annual rate of thromboembolic events (0.97/100 patient-years [100PY] vs. 4.06/100PY, p=.09), but there was a higher rate of bleeding events (5.67/100PY vs. 13.3/100PY, p=.033) and mortality among CKD patients (6.50/100PY vs. 17.2/100PY, p=.009), with an odds ratio of 2.711 (95% CI 1.96–6.95). In the multivariate analysis, a preserved eGFR was independently associated with a lower mortality risk.
ConclusionsLAAC is a valid alternative to oral anticoagulation in patients with CKD and atrial fibrillation, with a low-rate of peri- and post-procedure complications, although CKD patients exhibited a higher risk of bleeding and mortality during the follow-up. However, these higher rates may not be necessarily related to the procedure.
La fibrilación auricular no valvular (FANV) es la arritmia crónica más frecuente en el mundo1 y está relacionada con un aumento de la morbimortalidad por el riesgo tromboembólico que conlleva. Por ello, las guías recomiendan la tromboprofilaxis con anticoagulación oral (ACO), ya sean agentes anti vitamina K (AVK o cumarínicos) o más recientemente anticoagulantes orales de acción directa (ACOD), en pacientes con un riesgo trombótico elevado, evaluado generalmente mediante la escala CHA2DS2-Vasc2.
Los pacientes con enfermedad renal crónica (ERC) presentan una mayor incidencia de FANV que la población general3, y cuya prevalencia aumenta con el deterioro de la función renal. Además, los pacientes con ERC presentan un mayor riesgo de eventos tromboembólicos, así como de sangrado, lo que complica su manejo4. Adicionalmente, los pacientes en estadios avanzados de la ERC tratados con AVK se mantienen menos tiempo en rango terapéutico de INR en comparación con pacientes con ERC moderada o sin ERC y ello se relaciona con un aumento del riesgo tromboembólico, hemorrágico y de mortalidad5. Además, los agentes AVK, como acenocumarol, favorecen la calcificación vascular, ya que inhiben la γ-carboxilación vitamina K-dependiente que precisa Matrix Gla Protein, proteína que inhibe la calcificación vascular, para su activación6. En pacientes con ERC, ello puede agravar el mayor riesgo cardiovascular y de calcificación vascular asociados a las alteraciones del metabolismo óseo-mineral, propios de la enfermedad, así como el riesgo de calcifilaxis7.
Tampoco existe evidencia sobre la eficacia y seguridad de la ACO en pacientes con ERC estadios 4 o 5, ya que estos pacientes han sido generalmente excluidos de los estudios aleatorizados fundamentales8. Las guías actuales de manejo de la FA aconsejan el uso de ACOD vs. AVK por su mejor perfil riesgo-beneficio, en pacientes con función renal preservada o con ERC estadio 3. En estadio 4 y, especialmente, estadio 5 o pacientes en diálisis, las guías hacen diferentes recomendaciones dada la falta de evidencia sobre su eficacia y seguridad, tanto de los AVK, como los ACOD, como ya se ha comentado9–12. Todo lo anterior dificulta la decisión de iniciar ACO o no en estadios avanzados de ERC.
El cierre percutáneo de la orejuela izquierda (CPOI) es una alternativa no farmacológica a la anticoagulación oral en pacientes con FANV, que tiene como objetivo disminuir el riesgo tromboembólico13,14. En ritmo sinusal, la orejuela izquierda (OI) es una estructura contráctil que vacía su contenido al ventrículo en cada latido. En cambio, en la FANV, la OI pierde esta capacidad contráctil y se dilata progresivamente, favoreciendo la estasis sanguínea y aumentando consecuentemente el riesgo de trombosis intraluminal. Es por ello que, en pacientes con FANV, el 90% de los trombos de la aurícula izquierda se localizan u originan en la OI15,16. Ello se agrava en presencia de ERC, que es un factor de riesgo para la presencia de trombos en la OI en pacientes con FANV17. Así pues, el hecho de que el CPOI no requiera anticoagulación oral, lo convierte en una opción atractiva para los pacientes con ERC, especialmente en pacientes con ERC avanzada o en diálisis, por los motivos mencionados anteriormente. No obstante, y dado que los procedimientos invasivos se asocian con una mayor morbimortalidad en pacientes con ERC, son necesarios estudios en esta población para confirmar su eficacia y seguridad18.
El objetivo primario de este estudio fue determinar si los pacientes con función renal disminuida (definida como un filtrado glomerular estimado basal [FGe]<60mL/min/1,73m2) sometidos a CPOI presentaban una mayor incidencia de eventos tromboembólicos, de sangrado y de mortalidad que los pacientes con función renal preservada. Los objetivos secundarios fueron valorar las diferencias entre el grupo de función renal preservada y disminuida en cuanto al procedimiento y las complicaciones derivadas de este, así como evaluar los cambios de la función renal posprocedimiento en ambos grupos.
Pacientes y métodosSe trata de un estudio observacional, retrospectivo con muestreo consecutivo que ha analizado los pacientes sometidos a CPOI realizados en un hospital universitario entre enero de 2011 y julio de 2019. Se incluyeron todos los pacientes sometidos a la técnica. Los principales criterios de inclusión de esta fueron: pacientes con indicación de anticoagulación que por alguna razón no podían tomar anticoagulantes, o pacientes con accidente vascular cerebral de origen cardioembólico a pesar del tratamiento anticoagulante. Los principales criterios de exclusión de la técnica fueron: contraindicación para sonda transesofágica, trombos que protuyeran la luz de la orejuela, sangrado activo o ictus reciente (menos de tres meses).
Se recogieron los principales datos demográficos, variables sobre su situación basal (comorbilidades, tratamiento anticoagulante/antiagregante), función renal basal y tras el procedimiento, causa de la contraindicación para la anticoagulación, características y complicaciones del procedimiento y complicaciones durante el seguimiento. Los datos se recogieron en una base de datos anonimizada para proteger la identidad de los pacientes.
La función renal de los pacientes se evaluó mediante el filtrado glomerular estimado (FGe) basal y al alta, utilizando la fórmula Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI)19. Los pacientes se clasificaron en los siguientes estadios de función renal según los criterios de las guías Kidney Disease Improving Global Outcomes (KDIGO)20: estadio 3a (FGe 45-59mL/min/1,73m2), estadio 3b (FGe 30-44mL/min/1,73m2), estadio 4 (FGe 15-29mL/min/1,73m2) y estadio 5 (FGe <15mL/min/1,73m2 y/o diálisis).
Los diferentes estadios de fibrilación auricular se definieron de acuerdo con los criterios de la Sociedad Europea de Cardiología21: la FA paroxística se definió como episodios autolimitados de FA que duran menos de 7 días. La FA persistente se definió como episodios que duran 7 días o más que requieren cardioversión eléctrica para revertirla. La FA permanente se definió como FA que dura más de 7 días y en la que médico y paciente deciden conjuntamente que no se planteará la restauración del ritmo sinusal, ni farmacológica, ni eléctricamente. En todos los pacientes se calcularon las escalas de evaluación de riesgo trombótico (CHA2DS2-Vasc) y hemorrágico (HASBLED)2,22.
El CPOI es un procedimiento percutáneo que se realiza bajo sedación profunda o anestesia general y guiado por ecografía transesofágica (ETE). La primera exploración ecográfica permite analizar la morfología de la OI y descartar la presencia de trombos dentro de la misma. Con la ETE también se puede analizar la presencia y grado de derrame pericárdico preprocedimiento, la función de la válvula mitral y la permeabilidad de la vena pulmonar superior izquierda. Posteriormente, se obtienen varias medidas basales de la OI en diferentes planos.
El acceso vascular preferentemente es la vena femoral derecha, ya que facilita la punción transeptal, que se realiza en la parte posterior e inferior del septum interauricular bajo guía fluoroscópica y ETE. A continuación, se intercambia el catéter transeptal por el catéter liberador del dispositivo y se coloca este último en la zona del implante de la OI (a 10-15mm del ostium). Finalmente, se comprueba la posición y estabilidad del dispositivo con la ETE. Un procedimiento exitoso se definió como la implantación correcta del dispositivo en la OI23.
El tratamiento antitrombótico habitualmente prescrito para evitar la formación de trombos sobre el dispositivo después del procedimiento fue la doble antiagregación durante tres meses, y posteriormente, tratamiento en monoterapia con ácido acetilsalicílico (AAS). Sin embargo, en los últimos meses se ha propuesto alternativamente el tratamiento con ACOD a dosis bajas durante tres meses.
Los pacientes realizaron un seguimiento clínico rutinario al primer, tercer y duodécimo mes posprocedimiento. Durante el seguimiento, se realizó una ETE entre los 3-6 meses posprocedimiento. En algunos casos, y siempre siguiendo los protocolos clínicos habituales, se contactó telefónicamente con los pacientes más allá de los doce meses. Se recogieron datos de mortalidad, eventos tromboembólicos y hemorragia. En cuanto a los datos de la ETE, se recogió la presencia de trombos sobre el dispositivo.
Se consideraron eventos tromboembólicos, el ictus, el embolismo sistémico y el accidente isquémico transitorio (AIT). Los episodios de sangrado se clasificaron según la definición del «Bleeding Academic Research Consortium» (BARC)24. El tipo 0 es la no evidencia de sangrado. El tipo 1 corresponde a aquel sangrado que no requiere atención médica. El tipo 2 es un sangrado que requiere estudios diagnósticos, hospitalización o tratamiento por un profesional de la salud, y que no cumple los criterios de los tipos 3, 4 o 5. El tipo 3 se divide en tres subtipos: 3a es un sangrado con descenso de la hemoglobina ≥ 3 y <5g/dl o que requiere transfusión, 3b es un sangrado con descenso de la hemoglobina ≥ 5g/dl o un sangrado que requiere intervención quirúrgica o fármacos vasoactivos intravenosos, o taponamiento cardíaco; y 3c incluye hemorragia intracerebral y sangrado intraocular que compromete la visión. El tipo 4 incluye el sangrado relacionado con la cirugía de bypass coronario, y el tipo 5 es el sangrado fatal que podría conducir o conduce a la muerte. Se definió sangrado mayor aquel ≥ 3a de la clasificación BARC.
El estudio cumplió todos los criterios éticos de la institución donde se ha realizado el estudio (Hospital Clínic de Barcelona). Todos los pacientes firmaron el consentimiento informado antes del procedimiento.
Análisis estadísticoLas variables cualitativas se expresan como frecuencias absolutas y relativas, así como tasa anual (número x 100 pacientes/año), según procediera, y las variables cuantitativas como media± desviación típica o como mediana (rango intercuartílico [RIQ]), según si la distribución era normal o no, según la prueba de Kolmogorov-Smirnov. Para comparar variables cuantitativas entre los dos grupos se utilizó la prueba t de Student para datos independientes si seguían una distribución normal, o la U de Mann-Whitney en caso contrario. Se ha utilizado la prueba de Chi-cuadrado para las variables cualitativas.
La supervivencia se definió como el tiempo transcurrido desde la fecha del procedimiento hasta el último seguimiento o la muerte del paciente. Se calcularon las curvas de supervivencia para los grupos de interés según el método de Kaplan-Meier. Se calculó la odds ratio para determinar la relación entre presencia o no de función renal disminuida y la mortalidad posprocedimiento. Dado que las diferencias en las características basales podrían interferir sustancialmente en los resultados, se realizó un análisis de sensibilidad mediante la realización de un modelo de regresión multivariante de Cox.
Se consideró el nivel de significación para un p-valor inferior a 0,05. Todos los análisis estadísticos se realizaron con el programa estadístico IBM SPSS Statistics versión 25 para Windows.
ResultadosDurante el período de estudio, se incluyeron 124 pacientes consecutivos con fibrilación auricular sometidos a CPOI (42,7% con FGe preservado y 57,3% pacientes con FGe reducido).
En la tabla 1 se presentan las características basales de los pacientes, así como el tratamiento anticoagulante/antiagregante prescrito antes de la intervención en los subgrupos de función renal preservada y disminuida. La mediana de edad de los pacientes fue de 75,5 (RIQ 67,6-80) años y el sexo predominante fue el masculino (62,1%). La mediana de CHA2DS2-Vasc fue 4 (RIQ 3-4) y la de HASBLED 4 (RIQ 3-4). No se observaron diferencias significativas entre los grupos de función renal preservada y disminuida en cuanto a las características basales de los pacientes, a excepción de la edad, que fue superior en el grupo de FGe reducido (70,5 años [RIQ 65-78] vs. 77,0 años [RIQ 69-81], p=0,048) y el riesgo de sangrado (HASBLED 3 [RIQ 3-4] vs. 4 [RIQ 3-4], p=0,026). Once de los pacientes analizados habían sufrido cirugía reparadora de válvulas cardíacas. De los 100 pacientes con antecedentes de sangrado, 45% correspondían a hemorragias gastrointestinales, 38% a hemorragias intracraneales, 6% a sangrado en el área otorrinolaringológica, 3% a sangrado respiratorio, 1% a sangrado abdominal, 1% a un hematoma retroperitoneal y 6% a otros orígenes (hematoma glúteo, 2 hematomas relacionados con la diálisis, sangrado oftálmico, hematuria, y un sangrado relacionado con infiltraciones). La mediana de la creatinina basal fue 1,16mg/dl (RIQ 0,88-1,54); 0,86mg/dl (RIQ 0,76-1) en el grupo de función renal preservada y 1,48mg/dl (RIQ 1,25-1,90) en el grupo de función renal disminuida (excluidos los pacientes en diálisis). De los 71 pacientes con FGe reducido, 51 pacientes se encontraban en estadio 3 (71,8%), 10 pacientes en estadio 4-5 no D (14,1%) y 10 pacientes en estadio 5 en diálisis (14,1%%). Todos los pacientes presentaban contraindicación absoluta o relativa para la ACO (96,8%) o antecedentes de ictus tromboembólico a pesar de la anticoagulación (3,2%) (en la tabla 1 del material suplementario están las características según estadio de ERC, observándose diferencias significativas en la edad, y escalas de CHA2DS2-Vasc y HASBLED entre los 3 grupos).
Características basales de los pacientes
| Total(n=124) | FGe> 60(n=53) | FGe <60(n=71) | p | |
|---|---|---|---|---|
| Edad, años | 75,5 (67,6-80) | 73 (65-78) | 77 (69-81) | 0,048 |
| Sexo femenino, n (%) | 47 (37,90) | 21 (39,62) | 26 (36,62) | 0,733 |
| IMC (kg/m2) | 26,63±4,36 | 27,28±4,52 | 26,11±4,18 | 0,178 |
| Hipertensión arterial, n (%) | 112 (90,32) | 47 (88,32) | 65 (91,55) | 0,593 |
| Diabetes mellitus, n (%) | 34 (27,42) | 11 (21,75) | 23 (32,39) | 0,151 |
| Tipo fibrilación auricular | 0,409 | |||
| Paroxística, n (%) | 44 (37,29) | 22 (44,00) | 22 (32,35) | |
| Persistente, n (%) | 2 (1,70) | 1 (2,00) | 1 (1,47) | |
| Permanente, n (%) | 72 (61,02) | 27 (54,00) | 45 (66,18) | |
| Antecedente ictus, n (%) | 42 (45,16) | 23 (56,10) | 19 (36,54) | 0,093 |
| Antecedente AIT, n (%) | 7 (5,65) | 2 (3,77) | 5 (7,04) | 0,435 |
| Antecedente embolismo sistémico, n (%) | 4 (3,23) | 2 (3,92) | 2 (2,82) | 1,000 |
| Antecedente insuficiencia cardíaca, n (%) | 40 (32,26) | 12 (24,53) | 27 (38,57) | 0,100 |
| Antecedente enfermedad vascular, n (%) | 29 (23,39) | 9 (16,98) | 20 (28,17) | 0,145 |
| Antecedente hemorrágico, n (%) | 100 (80,65) | 42 (79,25) | 58 (81,69) | 0,733 |
| Disfunción ventrículo izquierdo*, n (%) | 24 (19,35) | 7 (13,21) | 17 (24,29) | 0,125 |
| Escala CHA2DS2Vasc | 4 (3-4) | 4 (3-5) | 4 (3-6) | 0,086 |
| Escala HASBLED | 4 (3-4) | 3 (3-4) | 4 (3-4) | 0,026 |
| Tratamiento basal | ||||
| AAS, n (%) | 40 (32,26) | 17 (33,33) | 23 (31,51) | 0,830 |
| Inhibidor ADP, n (%) | 11 (8,87) | 5 (9,80) | 6 (8,22) | 0,486 |
| Warfarina, n (%) | 22 (17,74) | 11 (21,57) | 11 (15,07) | 0,351 |
| Otros, n (%) | 33 (26,61) | 19 (33,00) | 14 (21,12) | 0,119 |
| Creatinina basal, mg/dL** | 1,16 (0,88-1,54) | 0,86 (0,76-1) | 1,48 (1,25-1,9) | ≤0,001 |
| Filtrado glomerular estimado basal*** | 63,24±33,01 | 86,32±30,88 | 42,56±17,59 | ≤0,001 |
Media±desviación estándar, mediana (rango intercuartílico) o frecuencia (%).
AAS: ácido acetilsalicílico; AIT: accidente isquémico transitorio; IMC: índice de masa corporal.
En cuanto al tratamiento anticoagulante/antiagregante basal, 10 pacientes (8,1%) recibían doble antiagregación, 2 pacientes triple terapia (1,6%), 80 pacientes (64,5%) recibían un único fármaco y 32 pacientes (25,8%) no recibían tratamiento. Cuarenta pacientes recibían AAS, 10 clopidogrel, 1 ticagrelor, 22 AVK y 33 estaban tratados con otros anticoagulantes (mayoritariamente heparinas de bajo peso molecular y ACOD).
Se realizó ETE al 100% de los pacientes. En 12 casos (9,7%), se realizó un procedimiento combinado, mayoritariamente con la reparación percutánea de la válvula mitral con el dispositivo MitraClip® (Abbott Laboratories, Abbott Park Illinois, EE. UU.). Los datos relacionados con el procedimiento se pueden observar en la tabla 2. No se observaron diferencias estadísticamente significativas entre grupos en la fracción de eyección del ventrículo izquierdo, ni tampoco en la cantidad de contraste administrado, tiempo de fluoroscopia, ni tipo de dispositivo implantado. Se utilizaron los dispositivos AmplatzerTM Cardiag Plug (ACP) y Amplatzer AmuletTM (St. Jude Medical, Minnesota, EE. UU.), WatchmanTM (Boston Scientific; Massachusetts, EE. UU.) y otras (la mayoría, LAmbreTM, Lifetech Scientific; Shenzhen, China), siendo el más frecuente el Amulet (70,16%). En la tabla 2 del material suplementario se presentan los datos en función del estadio de ERC, observándose que los pacientes con ERC estadios 4-5 no diálisis recibieron menos contraste en promedio durante el procedimiento.
Detalles del procedimiento
| Total | FGe> 60 | FGe <60 | p | |
|---|---|---|---|---|
| FEVI | 60 (50-60) | 57 (50-60) | 60 (50-60) | 0,737 |
| Contraste, mL | 70 (50-108,5) | 70 (57,5-113) | 62,5 (45-103,5) | 0,487 |
| Tiempo fluoroscopia, min | 13,85 (10-21,7) | 14,1 (11-20) | 13,7 (10-23) | 0,205 |
| Tipo de dispositivo, n (%) | ||||
| ACP | 16 (12,90) | 5 (9,80) | 11 (15,07) | 0,783 |
| Amulet | 87 (70,16) | 38 (71,69) | 49 (69,01) | |
| Watchman | 2 (1,61) | 1 (1,96) | 1 (1,37) | |
| Otros | 19 (15,32) | 9 (17,65) | 10 (13,70) |
Variables expresadas como mediana (rango intercuartílico) o frecuencia (%).
ACP: Amplatzer Cardiac Plug; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado (mL/min/1,73m2).
Se objetivaron complicaciones intraprocedimiento en dos casos: un derrame pericárdico sin taponamiento cardíaco y un pseudoaneurisma de vena femoral superficial. No se observó ningún evento tromboembólico, muerte, ni embolización del dispositivo durante el procedimiento. Se logró una correcta implantación del dispositivo en la OI en el 99,2% de los casos, sin diferencias estadísticamente significativas entre el subgrupo de FGe reducido y el de FGe normal.
Respecto al tratamiento anticoagulante/antiagregante de los pacientes al alta, 7 (5,65%) no recibieron tratamiento, 58 (46,77%) recibieron tratamiento con un solo fármaco y 59 pacientes (47,58%) recibieron tratamiento con doble antiagregación. Sesenta y nueve (55,6%) pacientes fueron tratados con AAS, 63 (50,8%) pacientes con inhibidores de ADP (62 con clopidogrel y 1 con ticagrelor), 2 (1,6%) pacientes tratados con AVK, 10 (8,1%) con enoxaparina y 32 (25,8%) tratados con otros anticoagulantes (mayoritariamente ACOD). Las diferencias de tratamiento entre el grupo de función renal preservada y disminuida no fueron significativas, a excepción de los inhibidores de ADP al alta, que fueron prescritos más frecuentemente en el grupo de FGe reducido.
SeguimientoLos resultados desglosados por hospitalización y seguimiento se muestran en la tabla 3 (y en la tabla 3 del material suplementario según estadío de ERC). Los pacientes fueron seguidos durante una mediana de 567 (RIQ 207-944) días. Ello representa un seguimiento de 235,4 pacientes/año para toda la serie (127,7 pacientes/año en el grupo de pacientes con función renal disminuida y 107,7 pacientes año en el grupo de función renal preservada).
Eventos tromboembólicos, episodios de sangrado y mortalidad durante la hospitalización y seguimiento
| Total | FGe> 60 | FGe <60 | p | |
|---|---|---|---|---|
| Tiempo de seguimiento (días) | 567 (207-944) | 567 (208 – 1021) | 592 (207 – 917) | 0,500 |
| Eventos tromboembólicos, n (%)/ y tasa anual | ||||
| Hospitalización | 0 | 0 | 0 | NA |
| Seguimiento | 6 (4,84)/2,66 | 1 (1,96)/0,97 | 5 (6,85)/4,06 | 0,092 |
| H+S | 6 (4,84) /2,66 | 1 (1,96) /0,97 | 5 (6,85) /4,06 | 0,092 |
| Episodios de sangrado, n (%)/ y tasa anual | ||||
| Hospitalización | 2 (1,61) | 0 | 2 (2,82) | 0,507 |
| Seguimiento | 21 (16,94) /8,97 | 6 (11,76) /5,67 | 15 (20,55) /11,7 | 0,065 |
| H+S | 23 (18,55) /9,82 | 6 (11,76) /5,67 | 17 (23,29) /13,3 | 0,033 |
| Mortalidad, n (%)/ y tasa anual | ||||
| Hospitalización | 1 (0,81) | 0 | 1 (1,63) | 0,401 |
| Seguimiento | 28 (22,58) /12,1 | 7 (13,73) /6,50 | 21 (28,77) /17,1 | 0,009 |
| H+S | 29 (23,39) /12,3 | 7 (13,73) /6,50 | 22 (30,14) /17,2 | 0,009 |
Variables expresadas como frecuencia (%) y tasa anual (en número por 100 pacientes/año) en seguimiento y H+S.
FGe: filtrado glomerular estimado (mL/min/1,73m2); H+S: hospitalización y seguimiento.
Durante el tiempo de hospitalización, un paciente falleció (FGe disminuido), se observaron dos episodios de sangrado, ambos en el grupo de FGe reducido (2,74%), y ningún evento tromboembólico. Asimismo, se detectaron 3 derrames pericárdicos significativos sin taponamiento cardíaco, ninguno de ellos requirió pericardiocentesis o cirugía.
Durante el seguimiento, 28 pacientes fallecieron (7 pacientes del grupo de FGe preservado [13,73%] y 21 pacientes del grupo de FGe reducido [28,8%]). Se observaron 21 episodios de sangrado (6 pacientes del grupo de FGe preservado [11,76%)] y 15 pacientes del grupo FGe reducido [20,55%]). Los episodios de sangrado durante el seguimiento fueron: tipo 1 (3), tipo 2 (2), tipo 3a (11), tipo 3b (1), tipo 3c (3) y uno de tipo 5. De los sangrados mayores (BARC ≥ 3a) 3 se observaron en pacientes con FGe preservado y 13 en pacientes con FGe disminuido (p=0,094). De estos episodios, 10/21 sucedieron durante los tres primeros meses en que los pacientes estaban recibiendo tratamiento antiagregante/anticoagulante. Asímismo, se registraron 6 eventos tromboembólicos (1 paciente del grupo de FGe preservado [1,96%] y 5 pacientes del grupo FGe reducido [6,85%]), (5 ictus isquémicos y un accidente isquémico transitorio) (tabla 4).
Eventos tromboembólicos, episodios de sangrado y mortalidad observados durante la hospitalización y el seguimiento
| Evento | Total(n=124) | FGe> 60 ml/min/1,73 m2(n=53) | FGe <60 ml/min/1,73 m2(n=71) |
|---|---|---|---|
| Eventos tromboembólicos, n (%) | |||
| ACV | 5 (4,1) | 1 (1,9) | 4 (5,6) |
| AIT | 1 (0,8) | 0 | 1 (1,4) |
| Embolismo sistémico | 0 | 0 | 0 |
| Episodios de sangrado, n (%) | |||
| Gastrointestinal | 10 (8,1) | 1 (1,9) | 9 (12,7) |
| Intracraneal | 3 (2,4) | 1 (1,9) | 2 (2,8) |
| Otros* | 10 (8,1) | 4 (7,5) | 6 (8,5) |
| Mortalidad, n (%) | |||
| ACV | 2 (1,6) | 0 | 2 (2,8) |
| Insuf. cardíaca | 3 (2,4) | 1 (1,9) | 2 (2,8) |
| Muerte súbita | 9 (7,6) | 4 (7,5) | 5 (7,1) |
| Infecciosa | 9 (7,6) | 1 (1,9) | 8 (11,3) |
| Sangrado | 3 (2,4) | 0 | 3 (4,2) |
| Otros** | 3 (2,4) | 2 (3,8) | 1 (1,4) |
Eventos se muestran en frecuencia (%).
ACV:accidente cerebrovascular; AIT:accidente isquémico transitorio.
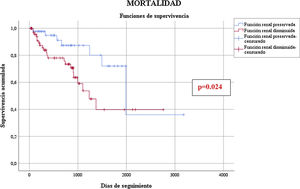
No hubo diferencias estadísticamente significativas durante el período de hospitalización y seguimiento combinados respecto a la tasa anual de eventos tromboembólicos (0,97/100PA vs. 4,06/100PA, p=0,092), aunque estos fueron numéricamente superiores en el grupo de FGe reducido; pero sí en la tasa de episodios de sangrado (5,67/100PA vs. 13,3/100PA, p=0,033), y de mortalidad (6,50/100PA vs. 17,2/100PA, p=0,009), que fueron superiores en el grupo de FGe reducido. De las 29 muertes, catorce fueron de causa cardiovascular (5 en el grupo de FGe preservado y 9 en el grupo de FGe reducido) (tabla 4). La presencia de un FGe reducido se asoció con un incremento del riesgo de mortalidad (odds ratio: 2,711; intervalo de confianza del 95%, 1,06-6,95) (fig. 1).
En el análisis multivariante los factores independientes asociados con la mortalidad fueron el FGe preservado (asociación negativa), la insuficiencia cardíaca y la diabetes mellitus (tabla 5).
Predictores independientes de muerte por todas las causas durante el seguimiento
| HR (95% IC) | Valor p | |
|---|---|---|
| Filtrado glomerular> 60 ml/min | 0,33 (0,13 – 0,83) | 0,018 |
| Insuficiencia cardíaca previa | 3,25 (1,51 – 6,95) | 0,002 |
| Diabetes mellitus | 2,64 (1,21 – 5,76) | 0,015 |
Hazard ratios (HR) y sus intervalos de confianza (IC) al 95% se calcularon mediante un análisis de regresión multivariable de Cox. Variables incluidas en el análisis multivariante: edad, hipertensión arterial, diabetes mellitus, insuficiencia cardíaca previa, filtrado glomerular>60 ml/min/1,73 m2, antecedente previo de evento hemorrágico.
El seguimiento realizado con ETE estaba disponible en 95 de los 124 pacientes (76%). Durante el seguimiento, se detectó la formación de trombos sobre el dispositivo en 7 pacientes (5,64%): 2 pacientes con FGe preservado (3,92%) y 5 con FGe reducido (6,85%), sin observarse diferencias estadísticamente significativas entre los grupos (p=0,451).
Respecto a los cambios de la función renal tras el procedimiento, se observó una disminución discreta, pero significativa, del FGe medio en el grupo de FGe reducido en comparación al grupo de FGe preservado (3,5mL/min/1,73m2 [RIQ -2,5 - 14,5] vs. 0,0mL/min/1,73m2 [RIQ -4 – 4]) (p=0,040).
DiscusiónLos principales resultados de este estudio son: 1) el cierre percutáneo de la orejuela izquierda se asocia a una alta tasa de éxito del implante y un bajo número de complicaciones del procedimiento, tanto en pacientes con FGe reducido, como preservado; 2) durante el seguimiento, se objetivó una mayor tasa de mortalidad y de sangrados de los pacientes con FGe reducido, y una tendencia a un mayor número de eventos tromboembólicos, 3) la incidencia de trombos sobre el dispositivo durante el seguimiento fue baja en ambos grupos, pero numéricamente superior en el grupo de FGe reducido, 4) el procedimiento se asoció a una discreta, pero significativa, disminución de la función renal en los pacientes con FGe reducido en comparación con el grupo de FGe preservado.
Así pues, el CPOI es un procedimiento seguro en la población con FGe reducido, con una tasa de éxito global del 99,2% de los casos en nuestro estudio, similar a la de estudios anteriores25–28 y superior a la de los primeros estudios aleatorizados13,14, lo que podría explicarse por la mayor experiencia actual de los equipos. También confirma los resultados de estudios anteriores25–28, en cuanto a la tasa de eventos durante el procedimiento y hospitalización, que fue muy baja, y sin diferencias estadísticamente significativas en eventos tromboembólicos y de sangrado entre los pacientes con FGe preservado y reducido. De todo ello se deduce la necesidad de que el procedimiento se realice por un equipo de cardiología intervencionista experimentado y con apoyo multidisciplinar (cirujano cardiaco para posibles emergencias, ecocardiografista para guiar el procedimiento, equipo de enfermería especializado, etc.) para realizar la técnica.
En nuestro estudio los pacientes con FGe reducido durante el seguimiento presentaron numéricamente más eventos tromboembólicos, aunque no alcanzaron significación estadística. Sí se observó una mayor tasa de sangrados en el subgrupo de función renal disminuida (que basalmente ya presentaba un HASBLED mayor). El CPOI requiere después del procedimiento de antiagregación durante al menos tres meses, y los pacientes con ERC presentan un mayor riesgo de sangrado4,8, lo que podría contribuir a la mayor tasa de sangrado observada en estos pacientes, especialmente al inicio del seguimiento. De hecho, en nuestro estudio casi la mitad de los sangrados se registraron en estos tres primeros meses, similar a lo observado en el estudio de Genovesi et al, en que la mayoría de los sangrados después del CPOI (6 de 8) ocurrieron durante los tres primeros meses posprocedimiento31.
En nuestro estudio la mortalidad durante el seguimiento fue superior en pacientes con FGe disminuido, con una tasa 2,7 veces superior en los pacientes con FGe reducido, y mayor a la descrita en estudios anteriores25,26, lo que podría explicarse por diferencias entre poblaciones. Sin embargo, es poco probable que esté relacionada con el procedimiento, como se ha visto en otros estudios, y sí con el peor pronóstico que confiere la ERC per se25,26.
Los tres únicos estudios multicéntricos aleatorizados publicados sobre este tratamiento tuvieron un diseño de no inferioridad, y compararon el CPOI (con el dispositivo WatchmanTM) vs. la anticoagulación con warfarina en pacientes con fibrilación auricular, pero sin contraindicación de anticoagulación oral los dos primeros13,14; y el tercer estudio comparó el CPOI con varios dispositivos vs. ACOD en pacientes con FANV y antecedentes de sangrado, eventos tromboembólicos a pesar de anticoagulación oral, o de alto riesgo (27,8%)28. Comparando con nuestra población, en los dos primeros estudios, la mediana de edad, el porcentaje de mujeres, y las prevalencias de hipertensión arterial y diabetes mellitus fueron similares, pero nuestra población presentaba más antecedentes tromboembólicos y de sangrado y una puntuación en las escalas CHA2DS2-Vasc y HASBLED superior, lo que se explica por el mayor riesgo de nuestra población. Esto podría justificar que la tasa de eventos observados durante el seguimiento fue más elevada en nuestra población, especialmente respecto al estudio PROTECT AF13. Nuestra serie se asemeja más a los del tercer estudio aleatorizado, aunque este excluyó pacientes con ERC estadios 4-528, y de los registros más importantes publicados hasta la fecha sobre el CPOI, que son el EWOLUTION y el ACP Multicentric Registry en que la mayoría de sus pacientes presentaban contraindicación para la anticoagulación y por lo tanto, la indicación de esta técnica era similar a la de nuestra serie27,29. Las características basales fueron similares en cuanto al sexo, edad, hipertensión arterial, diabetes mellitus y puntuación en la escala CHA2DS2-Vasc, pero nuestros pacientes presentaban una puntuación media de HASBLED superior, así como más antecedentes tromboembólicos. Durante el seguimiento, hemos observado una mayor tasa de sangrado (se recogieron sangrados mayores y menores), de eventos tromboembólicos y de mortalidad. El estudio más importante que comparó los pacientes con ERC con los pacientes con función renal preservada, observó también un mayor aumento de mortalidad, pero no de sangrado o eventos tromboembólicos entre ambos grupos25; similares resultados se observaron en el estudio de Brockmeyer et al.30, así como el de Xue et al, que también observó una tendencia a una mayor mortalidad en el subgrupo con ERC26. Nuestros resultados muestran también diferencias significativas en la tasa de sangrado entre ambos grupos y numéricamente más episodios tromboembólicos, resultados peores a los estudios previos en pacientes con ERC25,26,30, lo que podría deberse a diferencias entre las poblaciones, que en nuestra serie se recogieron sangrados mayores y menores (vs. solo sangrados mayores en los estudios anteriores), mayor porcentaje de pacientes con ERC avanzada o en diálisis, o en el tiempo de seguimiento. Estudios en pacientes con ERC estadio 5 en hemodiálisis también muestran que el CPOI es un procedimiento seguro y eficaz para esta población de alto riesgo31–33. De hecho, nuestro estudio incluyó parte de pacientes que previamente estuvieron incluidos en un estudio multicéntrico25 y en un análisis de casos de pacientes en diálisis32, lo que podría explicar en parte la similitud de resultados. Sería interesante la realización de estudios multicéntricos en nuestro país con la colaboración estrecha entre los servicios de cardiología y nefrología, para conocer los resultados de esta técnica con un número mayor de pacientes y poder evaluar su eficacia. En este sentido existe un estudio observacional español en pacientes con enfermedad renal crónica estadio 5 en hemodiálisis, que evalúa la eficacia y seguridad del CPOI en esta población (WATCH-HD, NCT03446794).
A pesar de que los pacientes con ERC presentan un aumento del riesgo tromboembólico, la disfunción renal no se incluye en la escala CHA2DS2-Vasc y, aunque nosotros no hallamos diferencias entre ambos grupos, en otros estudios los pacientes con función renal disminuida presentan una puntuación de esta escala mayor que aquellos con función renal preservada25,26,29. Otro aspecto a tener en cuenta es la trombosis sobre el dispositivo, ya que la presencia de ERC es un factor de riesgo para la formación de trombos en la orejuela izquierda17. Aunque nosotros no observamos diferencias estadísticamente significativas en la formación de trombos sobre el dispositivo entre grupos, los pacientes con función renal disminuida presentaron numéricamente una mayor prevalencia respecto a aquellos con función renal preservada, aunque esta fue baja en ambos grupos.
El CPOI es un procedimiento invasivo y estos se relacionan con una mayor morbimortalidad en pacientes con ERC18. Además, un FGe basal disminuido es el principal factor para el deterioro de la función renal después del procedimiento34. En nuestro estudio los pacientes con función renal disminuida, a pesar de no recibir más contraste intravenoso, presentaron un deterioro de la función renal medio superior al grupo de función renal preservada al alta. Ello coincide con el estudio de Brockmeyer et al.29 que objetivó una mayor incidencia de insuficiencia renal aguda en el grupo ERC que en el grupo de función renal preservada (11% vs. 0%). Es por ello aconsejable monitorizar la función renal basal y después del procedimiento de los pacientes que se sometan a un CPOI, así como minimizar o evitar la administración de contraste, especialmente en pacientes con ERC.
Entre las limitaciones de este estudio destacan que se trata de un estudio observacional, retrospectivo y sin grupo control tratado con ACO, así como su tamaño muestral relativamente pequeño. La definición de ERC se basó en la determinación del FGe basal y no un descenso confirmado del FGe durante al menos 3 meses, como aconsejan las guías. Asimismo, se han utilizado diferentes pautas y duración de tratamiento antitrombótico tras el alta, que podrían explicar complicaciones durante el seguimiento, y el período de seguimiento de los pacientes ha sido muy diverso. La falta de datos por pérdidas durante el seguimiento y el sesgo subjetivo de recoger parte de los datos mediante contacto telefónico a partir del primer año después del procedimiento, puede haber influenciado la calidad de los resultados de este estudio. Otra limitación del estudio es que el número de pacientes con ERC estadios 4, 5 o 5D, en que la anticoagulación con AVK se asocia con un alto riesgo de sangrado y existe poca evidencia de su beneficio y el uso de ACOD tiene poca evidencia de eficacia y seguridad (estadio 4) o están contraindicados (estadio 5) y, por tanto, los pacientes con un mayor beneficio potencial, es limitado.
En conclusión, el cierre percutáneo de la orejuela izquierda parece ser una técnica segura, tanto en la población con función renal preservada, como en la población con FGe reducido, ya que no se han observado diferencias significativas en las complicaciones intraprocedimiento ni en la tasa de eventos tromboembólicos durante el seguimiento. Sin embargo, sí se han observado diferencias en cuanto a las tasas de sangrado y de mortalidad en el seguimiento entre los pacientes con función renal disminuida y los pacientes con función renal preservada, que podrían deberse a la propia ERC. Es por esto, que el CPOI podría ser una opción válida en pacientes con fibrilación auricular no valvular y enfermedad renal crónica con un alto riesgo trombótico y hemorrágico, ya que disminuiría el riesgo tromboembólico, reduciendo el riesgo de sangrado asociado a la ACO.
Conceptos claveLos pacientes con ERC avanzada presentan una mayor prevalencia de fibrilación auricular, y esta se asocia con un mayor riesgo tromboembólico, de sangrado y de mortalidad.
Las evidencias del beneficio-riesgo de los AVK y ACOD en la ERC estadios ≥ 4 es limitada, pues los ensayos clínicos han excluido generalmente estos pacientes.
El CPOI puede ser una estrategia alternativa para prevenir el riesgo tromboembólico sin los riesgos de una anticoagulación crónica en esta población de alto riesgo.
Nuestra experiencia confirma que el CPOI es una alternativa válida en pacientes con ERC, con bajo riesgo de complicaciones periprocedimiento, aunque se precisan estudios más amplios, especialmente en pacientes con ERC estadios 4-5 que confirmen su eficacia y seguridad a largo plazo.
Autoría/colaboradoresTodos los autores han hecho contribuciones sustanciales en cada uno de los siguientes aspectos: 1) la concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos, 2) el borrador del artículo o la revisión crítica del contenido intelectual, 3) la aprobación definitiva de la versión que se presenta.
Conflicto de interesesXF es proctor de Abbott Medical. El resto de los autores declaran no tener ningún conflicto de intereses.
Este manuscrito no ha sido publicado anteriormente, excepto en forma de abstract para congresos o como trabajo de fin de grado de Julia Benini.