El número de personas que inician diálisis por el fracaso del injerto aumenta cada día. La modalidad de diálisis mejor para este tipo de pacientes no está bien definida y la mayoría de ellos son derivados a hemodiálisis (HD). El objetivo de nuestro estudio es evaluar el impacto de la modalidad de diálisis sobre la morbilidad y la mortalidad en individuos trasplantados que inician este procedimiento tras el fracaso del injerto.
Material y métodosEstudio multicéntrico retrospectivo observacional y de cohortes que compara la evolución de los pacientes que inician diálisis tras el fracaso del injerto, desde enero del año 2000 a diciembre del 2013. Un grupo lo hace en diálisis peritoneal (DP) y otro en HD. Se realizó un seguimiento a los pacientes hasta el cambio de técnica de diálisis, retrasplante o fallecimiento. Se analizaron datos antropométicos, comorbilidad, el filtrado glomerular (FG) con el que iniciaban la diálisis, la presencia de un acceso óptimo para esta, la presencia de intolerancia al injerto y el retrasplante. Estudiamos el motivo de los 10 primeros ingresos hospitalarios tras el inicio de la diálisis. Para el análisis estadístico, se tuvo en cuenta la presencia de eventos competitivos que dificultaran la aparición del evento de interés, muerte o ingreso hospitalario.
ResultadosSe incluyeron 175 pacientes. En DP 86 y 89 en HD. Los individuos que iniciaron DP eran más jóvenes, tenían menor comorbilidad y lo hacían con FG más bajos que los de HD. El seguimiento medio fue de 34 ± 33 meses, con una mediana de 24 (IQR siete a 50 meses), siendo mayor en los pacientes en HD que en los de DP (35 vs. 18 meses, p = < 0,001). Los factores de riesgo que influyeron en la mortalidad fueron la edad (coeficiente del sub Hazard Ratio [sHR] 1,06 (IC 95%: 1,033 a 1,106, p = 0,000), el uso no óptimo del acceso (sHR 3,00 (IC 95%: 1,507 a 5,982, p = 0,028) y el tipo de diálisis, la DP sHR[DP/HD] 0,36 (IC 95%: 0,148 a 0,890, p = 0,028). Los pacientes en DP tenían menos riesgo de un ingreso hospitalario sHR[DP/HD] 0,52 (IC 95%: 0,369 a 0,743, p = < 0,001) y menos probabilidad de desarrollar una intolerancia al injerto HR 0,307 (IC 95% 0,142 a 0,758, p = 0,009).
ConclusionesCon las limitaciones de un estudio retrospectivo y no randomizado, es la primera vez a nivel nacional que se demuestra que la DP en términos de supervivencia es mejor que la HD cuando fracasa el injerto durante el primer año y medio en diálisis. La presencia de un acceso no óptimo para este procedimiento es un factor de riesgo de mortalidad independiente y modificable. La remisión precoz de los pacientes a las unidades de enfermedad renal crónica avanzada (ERCA) es fundamental para que estos elijan la técnica que más se adapte a sus circunstancias y preparar un acceso óptimo para el inicio de diálisis.
The number of patients who start dialysis due to graft failure increases every day. The best dialysis modality for this type of patient is not well defined and most patients are referred to HD. The objective of our study is to evaluate the impact of the dialysis modality on morbidity and mortality in transplant patients who start dialysis after graft failure.
Material and methodsA multicentre retrospective observation and cohort study was performed to compare the evolution of patients who started dialysis after graft failure from January 2000 to December 2013. One group started on PD and the other on HD. The patients were followed until the change of dialysis technique, retransplantation or death. Anthropometric data, comorbidity, estimated glomerular filtration rate (eGFR) at start of dialysis, the presence of an optimal access for dialysis, the appearance of graft intolerance and retransplantation were analysed. We studied the causes for the first 10 hospital admissions after starting dialysis. For the statistical analysis, the presence of competitive events that hindered the observation of the event of interest, death or hospital admission was analysed.
Results175 patients were included, 86 in DP and 89 in HD. The patients who started PD were younger, had less comorbidity and started dialysis with lower eGFR than those on HD. The mean follow-up was 34 ± 33 months, with a median of 24 months (IQR 7 - 50 months), Patients on HD had longer follow-up than patients on PD (35 vs. 18 months, p = < 0.001). The mortality risk factors were age sHR 1.06 (95% CI: 1.033 - 1.106, p = 0.000), non-optimal use of access for dialysis sHR 3.00 (95% CI: 1.507 - 5.982, p = 0.028) and the dialysis modality sHR (PD / HD) 0.36 (95% CI: 0.148 - 0.890, p = 0.028). Patients on PD had a lower risk of hospital admission sHR [DP / HD] 0.52 (95% CI: 0.369-0.743, p = < 0.001) and less probability of developing graft intolerance HR 0.307 (95% CI 0.142-0.758, p = 0.009).
ConclusionsWith the limitations of a retrospective and non-randomized study, it is the first time nationwide that PD shows in terms of survival to be better than HD during the first year and a half after the kidney graft failure. The presence of a non-optimal access for dialysis was an independent and modifiable risk factor for mortality. Early referral of patients to advanced chronic kidney disease units is essential for the patient to choose the technique that best suits their circumstances and to prepare an optimal access for the start of dialysis.
Los nefrólogos nos enfrentamos cada día a un número creciente de pacientes trasplantados en los que fracasa el injerto renal y deben volver a la diálisis. En los últimos años, en España, entre un 2 y un 4% de las personas que iniciaron diálisis, lo hicieron por disfunción de un injerto renal. En números absolutos, esta cifra supone cerca del millar de pacientes al año1,2.
Informar a las personas con insuficiencia renal no trasplantadas sobre qué modalidad de terapia renal sustitutiva se adapta mejor a sus circunstancias puede resultar sencillo, pero en aquellas con el fracaso de un injerto renal, esta decisión se complica. La base de evidencia para ese consejo sigue siendo incompleta, dado que las comparaciones de supervivencia entre las modalidades de diálisis están llenas de dificultades metodológicas, en las que un ensayo aleatorizado es casi imposible de realizar.
Existen escasas publicaciones que evalúen el impacto de la modalidad de diálisis sobre la supervivencia del paciente trasplantado con un injerto no funcionante que vuelve a diálisis. La mayoría son series locales con pocos participantes en las que se reportan resultados similares en relación con la supervivencia entre diálisis peritoneal (DP) y hemodiálisis (HD)3–6. Actualmente, solo un estudio demuestra la superioridad de la DP en términos de mortalidad frente a la HD durante el primer año tras el fracaso el injerto7. Ninguno de estos trabajos ha tenido en cuenta la presencia de eventos competitivos para el análisis estadístico. Entendemos por evento competitivo aquel que dificulta o modifica la posibilidad de observar el suceso de interés8,9. De tal modo que, cuando estamos estudiando la muerte o la tasa de ingresos hospitalarios en una determinada técnica de diálisis, el abandono de esta por trasplante o por la transferencia a otro tipo de diálisis supone un evento competitivo, ya que el paciente deja de estar en riesgo de fallecer o de tener un ingreso hospitalario en la técnica de diálisis a estudio. En presencia de eventos competitivos, los métodos habituales de análisis del tiempo hasta el evento como las curvas de supervivencia de Kaplan-Meier no son adecuadas ya que pueden sobreestimar la tasa real del suceso10,11.
Es un hecho conocido que los pacientes trasplantados que están en DP tienen una alta tasa de transferencia a HD debido a la rápida pérdida de la función renal residual (FRR)4,12, por lo tanto, el análisis, teniendo en cuenta los eventos competitivos, debería ser prioritario cuando queremos estudiar la supervivencia en una determinada modalidad de diálisis.
El objetivo de nuestro estudio fue analizar el impacto de la modalidad de diálisis (DP vs. HD) del paciente trasplantado que vuelve a diálisis sobre la morbimortalidad (ingresos hospitalarios y muerte), teniendo en cuenta la presencia de eventos competitivos.
Material y métodosSelección de pacientes y diseño del estudioSe trata de un estudio multicéntrico, retrospectivo, observacional y de cohortes en el que se compara la evolución de dos grupos de pacientes trasplantados que presentaron fracaso del injerto renal e iniciaron diálisis desde enero del año 2000 a diciembre del 2013. Una cohorte inició este procedimiento mediante DP y la otra lo hizo mediante HD. Los pacientes se siguieron hasta su fallecimiento, cambio de técnica de diálisis, nuevo trasplante o fin del estudio (diciembre del año 2013).
La cohorte de DP procede de pacientes trasplantados que presentaron disfunción del injerto e iniciaron DP en hospitales pertenecientes al Registro de Levante de DP. Este se trata de una base de datos demográficos, clínicos y analíticos de personas en DP en el que participan 18 hospitales de la Comunidad Valenciana, Murcia y Albacete desde el año 1990 hasta la actualidad. A partir de los datos del registro, incluimos todos los pacientes que iniciaron DP tras el fracaso del injerto desde enero del año 2000 a diciembre del 2013 y que fueran mayores de 18 años. Excluimos a aquellos con una supervivencia del injerto menor a tres meses.
La cohorte de pacientes de HD procede de aquellos trasplantados en el Hospital Universitario Dr. Peset de Valencia y que, tras el trasplante, presentaron disfunción del injerto e iniciaron HD en este centro, en sus hospitales de origen o en centros de HD concertados dependientes del hospital desde enero del año 2000 hasta diciembre del 2013. En los años de seguimiento del estudio, en el Hospital Universitario Dr. Peset, el 4,8% de los pacientes con fracaso del injerto iniciaban DP y el 95,2% lo hacían en HD. Excluimos a quienes iniciaran HD en hospitales o en centros de diálisis no dependientes del hospital en los que no se pudo tener acceso a su historia clínica y aquellos con una duración del injerto menor a tres meses.
Recogida de datosSe analizaron las variables antropométricas, la etiología de la insuficiencia renal, los factores de riesgo cardiovascular, la fecha del fracaso del injerto e inicio de diálisis, el filtrado glomerular estimado (FGe) mediante modification of diet in renal disease (MDRD) en mL/min/1,73m2 y el tratamiento con inhibidores de la enzima conversora de angiotensina y antagonistas del receptor de angiotensina II (IECAs/ARAII) en el momento del inicio de la diálisis. También analizamos el comienzo de la técnica de diálisis mediante un acceso no óptimo. Se consideró acceso no óptimo el inicio de HD mediante un catéter venoso central, temporal o permanente y para DP, la utilización del catéter peritoneal antes de los 28 días necesarios para su maduración13. Registramos la causa y la fecha de la muerte. Analizamos los datos de los diez primeros ingresos hospitalario tras el inicio de la diálisis, la fecha y el motivo del ingreso. Revisamos la presencia de intolerancia al injerto y la necesidad de embolización y/o trasplantectomía. Documentamos aquellos pacientes que se incluyeron de nuevo en lista de espera y que accedieron a un trasplante renal.
El seguimiento se realizó desde que el paciente comenzó la diálisis por fracaso del injerto hasta que salió de esta por finalización del estudio (muerte o diciembre del 2013) o por pérdida de seguimiento (cambio de técnica de diálisis, trasplante o recuperación de la función renal). Para el cálculo de la tasa de ingresos hospitalarios, el seguimiento se efectuó desde el inicio de la diálisis hasta la salida del estudio o hasta la fecha del décimo ingreso. Las variables de exposición fueron el tratamiento mediante DP y HD y las variables de resultado fueron muerte, ingreso hospitalario, intolerancia al injerto y retrasplante, el objetivo del estudio fue estimar dichos valores y su asociación con la elección de técnica (HD o DP).
Método estadísticoLos resultados de las variables cualitativas se expresan mediante frecuencia absoluta y relativa. Las variables continuas se muestran mediante la media ± desviación estándar o mediana y rango intercuartílico (percentil 25 y 75), según presenten distribución normal o no. La comparación de las variables cualitativas entre el grupo de DP y de HD se realizó mediante la prueba de X2. Las variables cuantitativas se compararon mediante la prueba t de Student o la de Mann-Whitney, según la distribución fuera o no normal.
La supervivencia cruda del paciente se analizó mediante la realización de curvas de Kaplan-Meier, comparando los resultados por medio del test de Breslow y exponiendo las tablas de individuos en riesgo. La gráfica incluye el tiempo de seguimiento hasta que quedan menos del 10% de los pacientes en riesgo14.
Para determinar la asociación de la modalidad de diálisis (HD vs. DP) sobre la supervivencia y sobre los ingresos hospitalarios (objetivo principal), se efectuó un análisis de riesgos competitivos, siendo considerados como tales: el cambio de modalidad de diálisis, la realización de un trasplante y la recuperación de la función renal, dado que su aparición competía con la de muerte o ingreso.
Se efectuaron distintos modelos donde se fueron seleccionando aquellas variables con sentido clínico sobre el evento de estudio y que cumplieran con la asunción de riesgo proporcional. El modelo máximo inicial en cada caso incluyó una cantidad de variables, junto con sus posibles interacciones, que no superó el 10% del número de eventos. El modelo final se construyó tras una estrategia «backwards» o hacia atrás. Las variables incluidas en el modelo final para la supervivencia fueron: modalidad de diálisis, edad y uso no óptimo del acceso y para la hospitalización fue el tipo de diálisis. El criterio para evaluar la confusión fue un cambio en más del 10% del coeficiente del sub Hazard Ratio (sHR) de la variable de interés (modalidad de diálisis) al comparar un modelo ajustado por el posible confusor y uno sin ajustar. Para controlar el sesgo de selección de la técnica de diálisis se exploró la realización de un índice de propensión, pero, debido al número limitado de pacientes y homogeneidad de los grupos, este no convergió adecuadamente. Para determinar la asociación de la modalidad de diálisis sobre la aparición de intolerancia al injerto y el retrasplante (objetivos secundarios) se realizó un análisis de Cox. Debido al limitado número de eventos, solo se pudieron incluir en el modelo final, además de la modalidad de tratamiento, la edad y el filtrado glomerular (FG) al inicio de la diálisis.
Se consideraron significativos los valores de p < 0,05. Se utilizó el paquete estadístico STATA® 13.1 (StataCorp, College Station, TX) para el análisis con riesgos competitivos y el paquete SPSS® 15.0 (SPSS Inc., Chicago, EE. UU.) para el resto del análisis estadístico.
ResultadosSe analizaron un total de 175 pacientes que iniciaron la diálisis tras el fracaso del injerto, 89 lo hicieron en HD y 86 en DP desde enero del año 2000 hasta diciembre del 2013. El seguimiento medio de toda la serie fue de 34 ± 33 meses, con una mediana de 24 (RIQ siete a 50 meses).
Características basales de los pacientesEn la tabla 1 se describen las características basales de toda la población. Comparado con los pacientes de HD (n = 89), los de DP (n = 86) eran más jóvenes y tenían menor comorbilidad. El FGe al inicio de la técnica de diálisis en toda la serie fue de 13,1 ± 8,3 mL/min. El grupo de pacientes que inició DP lo hizo con un FGe significativamente menor que aquellos que comenzaron con HD (8,2 ± 4,2 vs. 17,3 ± 8,6 mL/min, p = 0,000). El tiempo de seguimiento fue menor en el grupo de DP, ya que hubo más pérdidas de este por trasplante y salidas de la técnica por trasferencia a HD.
Características clínica y analíticas de toda la serie, y dividida por grupos de diálisis (DP vs. HD)
| DPn = 86 | HDn = 89 | p(DP vs. HD) | |
|---|---|---|---|
| Edad media, años (media ± DE) | 45,8 ± 13,06 | 50,6 ± 13,17 | 0,018 |
| Año 2000-2004 | 42,6 ± 11,75 | 48,7 ± 16,4 | |
| Año 2005-2009 | 46,5 ± 13,71 | 47,4 ± 13,5 | |
| Año 2010-2013 | 48 ± 13,2 | 53,7 ± 10,8 | |
| Sexo mujer, n (%) | 47 (55) | 57 (49) | 0,202 |
| Etiología de la insuficiencia renal, n (%) | |||
| Glomerulonefritis | 28 (32,6) | 19 (21,3) | 0,300 |
| No filiada | 14 (16,3) | 19 (21,3) | |
| Intersticial | 16 (18,6) | 8 (9) | |
| Vascular | 4 (4,7) | 17 (19,1) | |
| Poliquistosis | 5 (5,8) | 14 (15,7) | |
| Otras | 9 (10,5) | 2 (2,2) | |
| Sistémica | 3 (3,5) | 7 (7,9) | |
| Diabetes | 7 (8,1) | 3 (3,4) | |
| Diabetes mellitus, n (%) | 11 (13) | 17 (8) | 0,198 |
| Modalidad de diálisis | |||
| DPCA/DPA (%) | 76/24 | - | |
| HF-HD (%) | - | 100 | |
| Comorbilidad cardiovascular, n (%) | 24 (28) | 56 (63) | < 0,001 |
| Índice de Charlson corregido por edad* | 3,4 ± 1,5 | 4 ± 1,3 | 0,005 |
| Dislipemia, n (%) | 40 (47) | 51 (60) | 0,062 |
| Tratamiento con IECA/ARAII, n (%) | 44 (55) | 41 (62) | 0,242 |
| FGe al inicio de diálisis (mL/min) | 8,2 ± 4,2 | 17,3 ± 8,6 | < 0,001 |
| Uso no óptimo del acceso para diálisis, n (%) | 27 (34,6) | 19 (22,4) | 0,059 |
| Seguimiento (meses); mediana (RIQ) | 18 (6-34) | 35 (10-70) | < 0,001 |
| Pérdidas de seguimiento; n (%) | < 0,001 | ||
| Trasplante | 16 (18,6) | 11 (12,4) | |
| Cambio técnica de diálisis | 26 (31,4) | 1 (1,1) | |
| Peritonitis (n) | 8 | - | |
| Pérdida de ultrafiltración (n) | 8 | - | |
| Infradiálisis (n) | 4 | - | |
| Complicaciones técnicas (n) | 6 | - | |
| Voluntad del paciente (n) | 0 | 1 | |
| Recuperación de función renal | 1 (1,1) | 0 (0) | |
| Muerte | 10 (11,6) | 28 (31,5) | |
| Activos a diciembre 2013, n (%) | 33 (38,4) | 49 (55) | 0,034 |
DE: desviación estándar; FGe: filtrado glomerular estimado; RIQ: rango intercuartílico; DPCA: diálisis peritoneal continua ambulatoria; DPA: diálisis peritoneal automatizada; HF-HD: hemodiálisis de alto flujo.
A lo largo de todo el seguimiento, hubo 38 muertes en 175 personas (22% de los pacientes), 10 en el grupo de DP y 28 en el de HD. Un 42% fue de causa cardiovascular, un 15,8% infecciosa, 7,9% neoplásica, otro 15,8% desconocida y un 18,4% misceláneas, sin diferencias entre las dos modalidades de diálisis. La supervivencia del paciente en toda la serie fue del 93% al año y del 70% a los cinco años.
Durante todo el seguimiento se analizaron un total de 439 ingresos en 129 pacientes (74%). La tasa cruda de ingresos hospitalarios para la serie global fue de 0,89 ingresos por año en riesgo (uno cada 13 meses).
La causa más frecuente de ingreso fue la cardiovascular con 121 (28%) seguida por la infecciosa con 96 (22,2%). La intolerancia al injerto fue la causa de 62 ingresos (14,3%) y las complicaciones de la técnica de diálisis causaron 59 (13,6%), siendo 93 restantes (21,5%) debidos a patologías diversas, las dos más frecuentes fueron la hemorragia digestiva y la paratiroidectomía.
Durante todo el seguimiento, 44 pacientes (25,1%) presentaron algún episodio de intolerancia al injerto, 35 de ellos (79%) requirieron embolización del injerto y cinco (11%) una trasplantectomía. El tiempo medio post diálisis hasta la aparición de la intolerancia fue de 10 ± nueve meses, con una mediana de ocho (RIQ cinco a 13 meses).
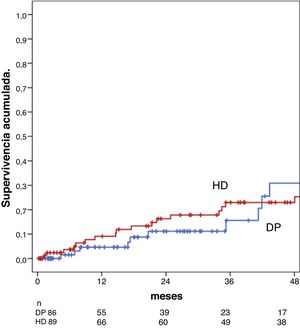
Asociación entre la modalidad de diálisis y la supervivenciaNo hubo diferencias en la supervivencia entre el grupo en DP y el de HD al año ni a los cinco años: 95% en DP vs. 92% en HD al año y 69% a los cinco años en ambos grupos, test de Breslow, p = 0,30 (fig. 1).
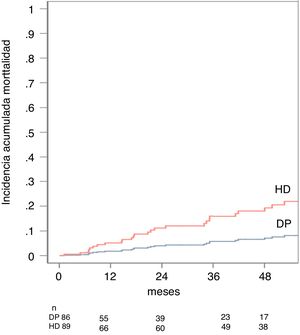
En el análisis univariante, la mortalidad se relacionó con la modalidad de diálisis (sHR[DP/HD] 0,37 IC 95%: 0,175 a 0,774, p = 0,008), la edad (sHR 1,05 IC 95%: 0,06 a 1,09, p = 0,000), un mayor índice de Charlson (sHR 1,59 IC 95%: 1,28 a 1,98, p = 0,000) y la presencia de comorbilidad vascular (sHR 2,78 IC 95%: 1,41 a 5,50, p = 0,003. El modelo predictivo estableció que las variables que mejor predecían la mortalidad del paciente en nuestra serie eran la edad con un sHR 1,06 (IC 95%: 1,033 a 1,106, p = 0,000), el uso no óptimo del acceso con un sHR 3,00 (IC 95%: 1,507 a 5,982, p = 0,028) y el tipo de diálisis, en este caso la DP obtuvo un sHR[DP/HD] 0,36 (IC 95%: 0,148 a 0,890, p = 0,028) (tabla 2). La incidencia acumulada de muerte ajustada por el modelo de riesgo competitivo al año fue de 3% para DP y del 11% para HD y a los cinco años de 8% para DP y de 21% para HD, p = 0,028 (fig. 2).
Análisis por riesgos competitivos, según la modalidad de diálisis DP vs. HD (sHR). Ref 1 = HD
| Variables | SHR | IC (95%) | p |
|---|---|---|---|
| Mortalidad | 0,36 | 0,148-0,894 | 0,02 |
| Ingreso hospitalario | 0,52 | 0,369-0,743 | < 0,001 |
Mortalidad ajustada por: edad, comorbilidad vascular, uso no óptimo del acceso. Ingreso hospitalario ajustado por: edad, comorbilidad vascular, filtrado glomerular al inicio de diálisis y uso no óptimo del acceso. SHR: sub Hazard Ratio.
La tasa de hospitalización fue significativamente más baja para el grupo de DP, 0,68 ingreso/paciente/año (un ingreso cada 17 meses) que para el grupo de HD, 1,01 ingreso/paciente/año (un ingreso cada 12 meses), p = 0,0011. No encontramos diferencias significativas en las causas de ingreso entre ambos grupos de diálisis (DP y HD) (tabla 3).
Descripción de todas las causas de ingreso en la serie global y análisis comparativo entre ambos grupos de diálisis (p = 0,257)
| Causa ingreso | Todosn = 431 | DPn = 117 | HDn = 314 |
|---|---|---|---|
| Cardiovascular, n (%) | 120 (28) | 40 (34,1) | 80 (25,4) |
| Infecciosa, n (%) | 98 (22,2) | 22 (18,8) | 76 (24,2) |
| Intolerancia injerto, n (%) | 63 (14,3) | 15 (12,8) | 48 (15,2) |
| Relacionadas con la técnica de diálisis, n (%) | 58 (13,6) | 15 (12,8) | 43 (13,6) |
| Otras, n (%) | 92 (21,5) | 25 (21,3) | 67 (21,3) |
DP: diálisis peritoneal; HD: hemodiálisis.
En el análisis multivariante, el modelo inicial incluyó la edad, el uso no óptimo del acceso, la comorbilidad vascular, el índice de Charlson, la DM y la modalidad de diálisis. El modelo final estableció que la variable que mejor predecía la probabilidad de ingreso hospitalario del paciente en nuestra serie era la modalidad de diálisis, que, en caso de la DP presentó un sHR[DP/HD] 0,52 (IC 95%: 0,369 a 0,743, p = < 0,001) (tabla 2).
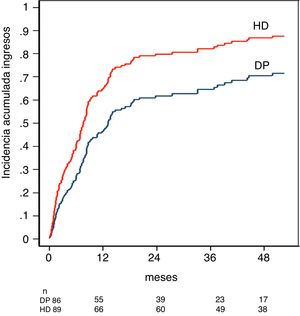
La incidencia acumulada de ingreso hospitalario ajustada por el modelo de riesgo competitivo fue del 47% para DP y de 63% para HD el primer año, y de 71% para DP y 88% para HD a los cinco años, p < 0,001 (fig. 3).
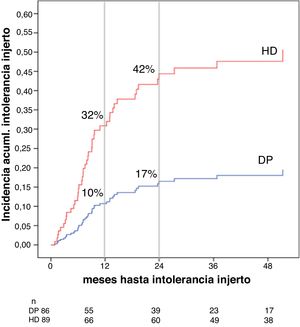
Asociación entre la modalidad de diálisis y el riesgo de síndrome de intolerancia al injertoLa incidencia acumulada de intolerancia al injerto fue del 32% a los 12 meses y del 42% a los 24 para HD y de 10% a los 12 meses y 17% a los 24 para DP (fig. 4). Los pacientes que desarrollaron intolerancia al injerto presentaban un FGe más alto al inicio de la diálisis (16 ± 9 vs. 12 ± 8 mL/min/1,72m2, p = 0,016) y un mayor porcentaje estaba en HD (32,8 vs. 11,6%, p = < 0,001), sin diferencias significativas en cuanto al momento de presentación, mediana de siete meses (RIQ cinco a 12 meses) en HD frente a 12 meses (RIQ seis a 20 meses) en DP, p = 0,257. En el análisis multivariante, tras el ajuste por edad y FGe al inicio de la diálisis, la DP se asociaba, en menor frecuencia, con la aparición de un síndrome de intolerancia al injerto, HR 0,307 (IC 95% 0,142 a 0,758, p = 0,009) (tabla 4).
Análisis de Cox para el estudio de factores de riesgo para desarrollar intolerancia al injerto
| Variable | HR | IC (95%) | p |
|---|---|---|---|
| Modalidad diálisis DP(ref 1 = HD) | 0,307 | (0,142-0,758) | 0,009 |
| Edad (año) | 0,994 | (0,962-1,009) | 0,22 |
| FG al inicio de diálisis | 0,998 | (0,962-1,035) | 0,89 |
DP: diálisis peritoneal; HD: hemodiálisis; HR: Hazard Ratio; FD: filtrado glomerular.
De toda la serie de pacientes, 88 (50,2%) se incluyeron en lista de espera para un nuevo trasplante. De estos, 41 acabaron el seguimiento sin realizarse este procedimiento, 17 cambiaron de técnica antes del trasplante y 27 (15,4%) se trasplantaron estando en la técnica en la que iniciaron la diálisis, tres sujetos murieron estando activos en lista de espera. El tiempo medio hasta el retrasplante fue de 26 ± 24 meses con una mediana de 22 (RIQ cuatro a 35 meses). Los pacientes que se sometieron al procedimiento fueron más jóvenes (39 ± 11 vs. 50 ± 13, años, p = 0,000) y en mayor porcentaje mujeres (63 vs. 46%, p = 0,008) con respecto a los que no se trasplantaron. En el análisis multivariante, solo la edad resultó ser un factor asociado con la probabilidad de recibir un trasplante renal, de tal modo que las personas de mayor edad presentaron menor probabilidad de trasplantarse (HR 0,969, IC 95% 0,941 a 0,997, p = 0,032).
DiscusiónDesde nuestro conocimiento, este es el primer estudio a nivel nacional en el que la DP ha sido más ventajosa en términos de morbimortalidad que la HD tras el fracaso del injerto renal, teniendo en cuenta los eventos competitivos. En la literatura, encontramos numerosas publicaciones que estudian la morbimortalidad del paciente trasplantado que vuelve a diálisis y la comparan con aquellos no trasplantados12,15–19, pero tan solo cinco publicaciones que relacionan el impacto de la modalidad de diálisis sobre dicha morbimortalidad3–7. Nuestros resultados tienen gran relevancia clínica, dado que nos deberían hacer reconsiderar la tendencia actual de no incluir en DP a los pacientes tras fracaso el injerto, ya que la gran mayoría de los que vuelven a la diálisis lo hacen mediante HD20.
En nuestro trabajo, los pacientes que se incluyeron en DP tras el fracaso del injerto fueron significativamente más jóvenes y con menor morbilidad cardiovascular que los que se incorporaron a HD, hecho que fue concordante con la mayoría de las series publicadas3,6,7. Esta característica supone un sesgo importante que puede corregirse parcialmente a través del análisis estadístico ajustado a las variables clínicas y demográficas disponibles4,5. Sin embargo, según algunos autores21, existen unas características como la capacidad de autocuidado, la responsabilidad hacia el tratamiento de diálisis y la cumplimentación de este, que no se recogen en la mayoría de los estudios y que, por lo tanto, no están disponibles en el momento del análisis comparativo de grupos de diálisis. Estas características, consideradas como «funcionales» suponen un confusor estadístico importante, de tal forma que pacientes que tuvieran un mayor grado de compromiso con su enfermedad, mayor capacidad para el autocuidado y que gozaran de un mejor estado de salud, tiendan a preferir una técnica de diálisis domiciliaria como es la DP. Por el contrario, individuos menos disciplinados, menos cumplidores y por lo tanto, con un potencial de peor pronóstico elegirían la HD, empeorando así la supervivencia global de este grupo.
En estudios con elevado número de pacientes, el uso de herramientas estadísticas sofisticadas como el test de propensión permite establecer dos grupos comparables y eliminar parcialmente el sesgo de selección de la técnica7. En nuestro trabajo, se exploró la posibilidad de realizar un test de propensión pero este no convergía adecuadamente, debido al limitado número de pacientes, por lo que no fue posible su aplicación. En consecuencia, una de las limitaciones fundamentales es la presencia de un sesgo de selección que puede justificar, pese al ajuste estadístico, que el grupo de personas en DP presente mejor supervivencia que aquellas incluidas en HD tras el fracaso del injerto.
Otra diferencia destacable en nuestra serie fue que los pacientes en HD iniciaron diálisis con FGe más altos que aquellos en DP. Al igual que acontecía en el estudio de Perl et al.7, consideramos que este fenómeno podría estar relacionado con que el sujeto que comience HD lo haga en más ocasiones por episodios de insuficiencia cardiaca derivado de un peor estado clínico y necesite diálisis con FGe más altos que aquellos que lo hacen en DP. La existencia de una fístula arteriovenosa interna (FAVi) funcionante o la facilidad que supone la colocación de un catéter venoso central y su uso inmediato podrían favorecer también este inicio más precoz. Por el contrario, para aquellos pacientes que desean comenzar con DP, se debe programar el implante de un catéter peritoneal y asegurar un tiempo mínimo de maduración del mismo, hechos que podrían retrasar el inicio de la diálisis semanas incluso meses.
Otro hecho a destacar es que el porcentaje de personas diabéticas que inician DP es tan solo del 13%. Probablemente se deba a la poca inclusión de sujetos diabéticos en DP en los hospitales del Registro del Levante, ya que, si analizamos la incorporación de pacientes en DP de novo (no trasplantados), vemos también que el porcentaje de diabéticos es menor respecto al reportado a nivel nacional (14,9 vs. al 25%)1,2.
El seguimiento medio de toda la serie fue de 24 meses, al igual que en estudios previos7,18,22, siendo menor en el grupo de DP debido a la necesidad de trasferencia a HD por la incapacidad de obtener una adecuada dosis de diálisis. Según reportan algunos autores, la causa de esta insuficiente dosis podría estar relacionada con la pérdida rápida de la FRR que presentan los injertos trasplantados, sobre todo, si se decide suspender la inmunosupresión tras el fracaso del mismo4,23.
En nuestra serie, la supervivencia de los pacientes trasplantados tras el inicio de la diálisis fue del 93% el primer año y del 70% a los cinco años, datos similares a los reportados en la mayoría de las investigaciones publicadas19,22.
Las principales causas de muerte en nuestro estudio fueron la cardiovascular y la infecciosa. Estos hallazgos confirman que nuestros resultados son comparables a los descritos en trabajos previos tanto recientes24 como antiguos25 y ponen de manifiesto que las causas de mortalidad de estos pacientes no han cambiado de forma relevante en los últimos 15 años, señalando cuáles siguen siendo los principales retos en el ámbito de la morbimortalidad del paciente trasplantado que inicia diálisis.
Los factores de riesgo independientes que aumentaron la mortalidad en nuestro análisis fueron la edad, descrita en la mayoría de las series publicadas 17,19,24,25, la modalidad de HD respecto a la DP y el inicio de diálisis mediante un acceso no óptimo.
En nuestra investigación, la DP se ha asociado con una menor mortalidad con respecto a la HD. En la literatura, hay publicaciones en ambos sentidos, en la mayoría, la mortalidad es similar en ambas técnicas de diálisis cuando fracasa el injerto3–6 mientras que en otras, como el estudio de Perl et al7, la mortalidad varía según el tiempo en diálisis. En este trabajo, los autores describen que, tras el inicio de la diálisis cuando fracasa el injerto, la DP es superior en términos de supervivencia hasta el primer año, se iguala a la HD entre el primer y segundo año y, más allá de los dos años, la DP tendría mayor mortalidad que la HD. Según estos datos, la mejor supervivencia del grupo de DP en nuestra serie se podría explicar por la supervivencia media en la técnica de este grupo. Además, según estos hallazgos, se podría especular sobre la conveniencia de no demorar el paso a HD tras un año y medio para no empeorar la supervivencia del paciente.
El acceso no óptimo al inicio de la diálisis, tanto para HD como para DP, se comporta en nuestra serie, al igual que en otras24, como un factor de riesgo de muerte independiente, hecho relevante, ya que se trata de un factor de riesgo modificable y depende directamente de la coordinación entre el nefrólogo de trasplante y el de diálisis. Aunque en nuestro estudio, el porcentaje de pacientes que iniciaron HD mediante un catéter venoso central es inferior al de otros26,27, es conocido que el inicio de HD a través del catéter venoso central aumenta el riesgo de sepsis y favorece la infradiálisis. En DP, la utilización de un catéter sin el período de maduración adecuado aumenta la incidencia de fugas de líquido peritoneal, infecciones del orificio de salida del catéter y, consecuentemente, de peritonitis, todo ello limitando la posibilidad de alcanzar los objetivos de ultrafiltración (UF) y de dosis de diálisis (Kt/V)13.
Con todo ello, ante el deterioro irreversible de la función del injerto, la remisión del paciente a las consultas prediálisis debería hacerse de forma precoz para garantizar la creación de una FAVi o el implante de un catéter de DP. De esta manera, estaríamos asegurando un acceso maduro en el momento en el que el paciente deba iniciar la diálisis y evitaríamos gran número de complicaciones. La coordinación entre la unidad de trasplante y las diferentes áreas encargadas de la creación del acceso para diálisis resulta fundamental en este momento, como comentan Oppenheimer et al.28
La tasa global de ingresos hospitalarios en nuestra serie ha sido similar a la publicada en otras cohortes de pacientes22. El principal motivo de ingreso en el estudio, al igual que otras publicaciones29, fue la causa cardiovascular, seguida de la infecciosa. Los pacientes en DP presentaron una menor tasa de ingresos hospitalarios que los pacientes en HD, al igual que ha sido descrito en otras series de pacientes no trasplantados30. En el grupo de DP hubo un mayor porcentaje de ingresos por causa cardiovascular que en el grupo de HD, y estos últimos presentaron un mayor número de ingresos por intolerancia al injerto que el grupo de DP. En DP la mayor dependencia de la FRR para mantener una diálisis adecuada, la mayor dificultad para el mantenimiento de dicha FRR en el injerto trasplantado y el alto trasporte peritoneal que se ha descrito en estas personas31,32 podrían haber desempeñado un papel fundamental en la dificultad del manejo del volumen y justificar así la elevada tasa de ingresos por eventos cardiovasculares, sobre todo, insuficiencia cardiaca, respecto a los pacientes en HD.
El grupo de DP presentó una menor incidencia de intolerancia al injerto y un reducido tiempo hasta la aparición de la misma, pero la ausencia del análisis de los eventos competitivos en este apartado podría dificultar la interpretación de los datos. Pensamos que la menor incidencia de intolerancia al injerto en el grupo de DP podría estar relacionada con el mantenimiento de dosis reducidas de inmunosupresión, con la intención de preservar la FRR en estos pacientes33. Por el contrario, en HD, la mayor rapidez de pérdida de la diuresis residual y la menor dependencia de ella para una diálisis adecuada pudiera animar a una más rápida retirada de la inmunosupresión con el riesgo de intolerancia al injerto secundario. Desgraciadamente, no contamos con datos sobre el manejo de la inmunosupresión en nuestro trabajo para poder confirmar esta hipótesis.
En nuestra serie, al igual que en otras publicaciones34–36, la mitad de los pacientes que iniciaron diálisis tras el fracaso del injerto se incluyeron de nuevo en la lista de espera y el 15,4% recibieron un trasplante posterior. El tiempo medio hasta el re-trasplante fue de 26 ± 24 meses (mediana 22 meses), similar al que reportan Portolés y Marcén en sus publicaciones de pacientes trasplantados que inician diálisis22,37. En el análisis multivariante, la menor edad del paciente resultó ser la única variable que predijo el acceso a un nuevo trasplante, al igual que ocurre en otras series7. No contamos con datos referentes a factores inmunológicos como la tasa de sensibilización anti antígenos leucocitarios humanos (HLA) que pudieron influir de forma significativa en la posibilidad de retrasplante.
Una de las limitaciones fundamentales del estudio ha sido la diversa procedencia de los pacientes. El grupo de DP se obtuvo de diferentes hospitales, mientras que todos los sujetos del grupo de HD pertenecen a un solo centro hospitalario. Esta diversidad en los protocolos de actuación clínicos respecto a aspectos fundamentales como son el momento de inicio de diálisis, los criterios de ingreso, la gestión del síndrome de intolerancia al injerto o la disponibilidad de la DP podrían aumentar los sesgos de nuestro estudio. Otra de las limitaciones importantes ha sido la diferencia en la supervivencia de ambos grupos. La media del seguimiento del grupo de DP fue tan solo de 18 meses respecto a los 35 del grupo de HD. Por lo tanto, con los resultados de nuestro estudio podemos afirmar que la DP es beneficiosa sobre la HD el primer año y medio tras el inicio de la diálisis.
ConclusionesCon las limitaciones referidas anteriormente, este es el primer estudio a nivel nacional que ha demostrado que la DP comparada con la HD se asocia con una mejor supervivencia de los pacientes que inician diálisis tras el fracaso del injerto, así como una menor tasa de hospitalización durante el primer año y medio tras el inicio del procedimiento. Lo que nos debería hacer replantear la inercia actual de remitir a estos pacientes a HD sin considerar la DP. Necesitamos estudios prospectivos para confirmar este resultado, así como otros para conocer el papel que desempeña el mantenimiento de la inmunosupresión sobre la función renal residual en pacientes trasplantados tras el fracaso del injerto.
- •
Cuando fracasa el injerto renal y los pacientes deben volver a diálisis, no está clara cuál es la mejor técnica de diálisis.
- •
En nuestra serie, la DP se ha asoció a menor mortalidad y menor tasa de ingresos hospitalarios que la HD durante el primer año y medio en diálisis tras fracaso del injerto renal.
- •
Los factores de riesgo independientes que incrementaron la mortalidad tras el inicio de diálisis fueron, además de la modalidad de diálisis, la edad y el uso de un acceso no óptimo para diálisis.
- •
En toda la serie, la incidencia del síndrome de intolerancia del injerto fue de un 25%, siendo menor en los pacientes en DP.
Este trabajo no ha recibido ningún tipo de financiación.
C. Gómez Roldán y A. Ortega Cerrato (Hospital General Universitario de Albacete, Albacete, España); M.D. Albero (Hospital Virgen de los Lirios, Alcoy, Alicante, España); J. Pérez-Contreras y E. Muñoz de Bustillo (Hospital General Universitario de Alicante, Alicante, España); J.M. Graña (Hospital de la Ribera, Alcira, Valencia, España); A. Seores y A. Arlandis (Hospital General de Castellón, Castellón, España); C. Hernaiz (Hospital de Cuenca, Cuenca, España); E. Bosque (Hospital General de Elda, Elda, España); V. Mascarós y C. Climent (Hospital Francisco de Borja, Gandía, Valencia, España); M. Lanuza y A. Martínez (Hospital Virgen de la Arrixaca, Murcia, España); M. González (Hospital Clínico Universitario, Valencia, España); J.M. Escobedo, M. Montomoli y M. Giménez (Hospital General Universitario, Valencia, España); A. Soldevila y R. Devesa (Hospital Universitario La Fe, Valencia, España); J.C. Alonso (Hospital Luis Alcañiz, Játiva, Valencia, España); S. Beltrán Catalán y B. Vizcaíno Castillo (Hospital Universitario Dr. Peset, Valencia, España); E. Torregrosa (Hospital de Manises, Valencia, España); I. Millán y S. Ros (Hospital de Elche, Alicante, España); V. Ramos (Hospital de Denia, Alicante, Valencia); B. Diez (Hospital de Torrevieja, Alicante, España); D. Manzano (Hospital de Cartagena, Cartagena, Murcia) y V. Andronic (Hospital de Vinalpó).