En los últimos años se está reconociendo la importancia de las acciones extraesqueléticas de la actividad endocrina de la vitamina D y su profunda interacción con la ERC. Ello ha facilitado el que se pueda disponer de muchos compuestos de vitamina D, tanto nutricional, como activa, con importantes diferencias en su coste económico. En esta revisión se repasa la evidencia disponible sobre la utilidad de los distintos tipos de vitamina D, tanto nutricional como activa, en pacientes con enfermedad renal crónica, tanto en estadios 3-4 como en diálisis, con especial énfasis tanto en su utilidad para el control del hiperparatiroidismo como en su efecto sobre la morbimortalidad. También se analizan los estudios farmacoeconómicos que se han publicado y que comparan entre sí algunos metabolitos activos de la vitamina D. De esta revisión puede concluirse que en el momento actual no existe todavía una base científica suficiente como para preferir la utilización de una vitamina D activa respecto a otra. Mientras no disponga de más datos, el clínico debe seguir las recomendaciones de las guías de práctica clínica, matizadas por la experiencia adquirida con sus pacientes y siempre teniendo en cuenta las implicaciones económicas de sus decisiones terapéuticas.
During recent years, increasing recognition has been given to the endocrine action that vitamin D has on the extraskeletal system, and its deep involvement in CKD. This has meant that many vitamin D compounds (both nutritional and active) have been made available, with an important cost reduction. This review looks at the evidence available regarding the usefulness of different types of vitamin D (nutritional and active) for patients with stage 3-5 CKD and those undergoing dialysis. Emphasis is given to its usefulness to control hyperparathyroidism and its impact on morbidity and mortality. We also analysed pharmacoeconomic studies that have been published which compare active vitamin D metabolites. From this review, we are able to conclude that there is still not enough scientific evidence to be able to prefer one active vitamin D over another. In the meantime, doctors should follow the recommendations given in clinical practice guidelines, always taking into account their personal experience with patients. Furthermore, they must consider the economic impact that their treatment decisions may have.
INTRODUCCIÓN
Las alteraciones del metabolismo mineral en la enfermedad renal crónica (ERC), por su importancia y sus consecuencias clínicas, son objeto de constante referencias en las guías de práctica clínica, ensayos y estudios. Las alteraciones de la vitamina D ocupan el centro de los mecanismos fisiopatológicos responsables. Un mejor conocimiento de sus causas, consecuencias y posibles correcciones es importante a la hora de tomar decisiones en la práctica nefrológica diaria. Asimismo, un conocimiento del coste económico de estas decisiones puede ayudar a la sostenibilidad del tratamiento de la ERC en España. Éstos son los objetivos de este artículo.
FISIOPATOLOGÍA DEL DÉFICIT DE LA VITAMINA D EN LA ENFERMEDAD RENAL CRÓNICA
El especialista en nefrología ha de elegir sobre diferentes tipos de vitamina D. Ello requiere una comprensión básica sobre la fisiopatología del déficit de la vitamina D en la ERC. Desde hace décadas se sabe que la deficiencia de 1,25-dihidroxivitamina D3 (calcitriol o 1,25[OH)]2D3, el metabolito activo de la vitamina D3) en la ERC es consecuencia de la menor actividad de la enzima 1-α-hidroxilasa renal. Recientemente se ha documentado también la deficiencia de 25-hidroxivitamina D3 (calcidiol o 25[OH]D) en pacientes con ERC estadios 3-41,2 en hemodiálisis3 o diálisis peritoneal4, que puede contribuir aún más a la disminución de los niveles de calcitriol.
La vitamina D es sintetizada en la piel (figura 1a) por la conversión fotolítica del 7-dehidrocolesterol en provitamina D3 la cual, por isomerización termal, se convierte en vitamina D3, que es transportada por proteínas plasmáticas (DBP, Vitamin D Binding Protein) hasta el hígado5 donde, con la participación del citocromo CYP2R1, se produce la 25-hidroxilación que da lugar al 25(OH)D3 (calcidiol o hidroxicolecalciferol). El calcidiol se almacena en el hígado y de ahí, cuando se precisa, es liberado a sangre donde circula unido a la proteína que lo transporta hasta el riñón.
La segunda fase (figura 1b) en la bioactivación de la vitamina D tiene lugar en el túbulo proximal del riñón. Allí, por acción de la megalina (receptor de lipoproteínas de baja densidad facilitador de la endocitosis), se produce la endocitosis del complejo 25(OH)D3-DBP y por acción de la 1-α-hidroxilasa, se hidroxila en las mitocondrias a 1,25(OH)2D3 o calcitriol. El calcitriol es, a su vez, un potente ligando de los receptores de la vitamina D (VDR) y al unirse a ellos estimula nuevamente la expresión de megalina. Es, por tanto, un mecanismo feed-forward para la producción de calcitriol.
La 1-α-hidroxilasa está regulada por el calcio, bien directamente o a través de la PTH, y el fósforo (P), no por acción directa sino a través del FGF23 (fibroblast growth factor 23) que, junto al gen Klotho, tienen, además, acción fosfatúrica (figura 1b). El exceso de P y vitamina D estimula el FGF23 procedente del osteocito y, junto al gen Klotho disminuyen la expresión del gen CYP27b1, que codifica la sintesis de 1-α-hidroxilasa y, en consecuencia, suprime la síntesis de calcitriol. Esto conlleva la disminución de la absorción intestinal de P, de la reabsorción tubular renal de P, y aumenta la expresión del gen Cyp24 que codifica la 24 hidroxilasa, enzima que inactiva al calcitriol6,7, la cual a su vez reduce la expresión de Klotho. Finalmente, el binomio Klotho-FGF23 a través de CD4 tiene una acción directa sobre la pared vascular e induce disfunción endotelial.
El calcitriol no es solamente una hormona que circula en el organismo y que regula el metabolismo del calcio y del hueso, sino que tiene un efecto paracrino. En otros tejidos extrarrenales como mama, piel, próstata, nódulos linfáticos, colon, páncreas, médula espinal, cerebro o placenta, hay actividad del enzima 1-α-hidroxilasa y existen receptores de vitamina D; en dichos tejidos se puede producir calcitriol8 que da lugar a efectos locales, tanto autocrinos como paracrinos. Estas acciones biológicas del calcitriol/calcidiol y de sus análogos sintéticos son mediadas por su receptor VDR (Vitamin D Receptor) (figura 1c). El VDR activado actúa en combinación con el receptor del ácido retinoico, modificando la expresión genética al unirse al ADN en el núcleo celular. Recientemente, se ha postulado la existencia de un segundo mecanismo de acción; de hecho, la vía de la transcripción genética es lenta y no puede explicar algunas respuestas rápidas producidas tras la administración de la vitamina D9-12. Es posible que un VDR localizado en la membrana celular sea capaz de promover la activación de un segundo mensajero que determine los efectos celulares inmediatos. Los niveles reducidos de calcitriol pueden disminuir la actividad del VDR.
Bases fisiológicas de la morbimortalidad asociada al déficit de vitamina D
Como se ya ha mencionado anteriormente, el déficit de vitamina D afecta a numerosas funciones biológicas del organismo13-16 más allá de las acciones clásicas descritas; todas ellas están relacionadas con la morbimortalidad cardiovascular en los pacientes con ERC17.
Diferentes estudios han asociado el déficit de vitamina D con albuminuria como marcador de lesión renal18. También se ha demostrado la asociación entre el déficit de vitamina D y la hipertensión, resistencia a la insulina, diabetes y dislipemia19,20; por el contrario, los suplementos de vitamina D (ergocalciferol o colecalciferol) reducen la mortalidad en personas de la tercera edad institucionalizadas21.
Ello puede deberse, según se ha observado en modelos experimentales, a un efecto cardioprotector o renoprotector de la administración de vitamina D: inhibición del sistema renina-angiotensina (RAS), acción antiinflamatoria (sistémica y del intersticio renal) y reducción de la proteinuria. Este efecto beneficioso debe, no obstante, clarificarse puesto que, por ejemplo, trabajos experimentales con ratas nefrectomizadas han mostrado que, en la insuficiencia renal asociada con baja concentración de calcitriol, la administración de paricalcitol disminuye aún más la concentración de calcitriol y aumenta la fibrosis perivascular en el tejido cardíaco, con independencia de la calcemia, la fosfatemia o la concentración plasmática de PTH22.
La vitamina D podría tener efectos beneficiosos fundamentalmente gracias a su actividad antiinflamatoria y antiproliferativa, así como por su acción reguladora en la disfunción endotelial. El calcitriol es capaz de modular la expresión de más de 200 genes involucrados en la proliferación y diferenciación celular, apoptosis y angiogénesis. Además, el VDR es expresado en monocitos y macrófagos activados, células dendríticas, células T y B y se ha observado que la activación del VDR tiene efectos inmunosupresores e inmunoestimuladores9-11.
De sus acciones «no clásicas» depende la asociación que existe entre enfermedades no relacionadas con el metabolismo mineral y la carencia de vitamina D. Entre ellos, destacan la patogenia y la progresión de la hipertensión, las enfermedades cardiovasculares, la diabetes mellitus tipo 1, la psoriasis, la esclerosis múltiple, el cáncer de colon y el de próstata9. Además, por estar implicada en la regulación del crecimiento celular, su acción podría contribuir a prevenir la progresión tumoral por reducción de la angiogénesis e incremento de la diferenciación celular y apoptosis de las células cancerígenas.
Varios estudios de cohortes demuestran una asociación significativa entre el déficit de 25(OH)D3 (calcidiol) y eventos cardiovasculares. Dobnig, et al., en el estudio LURIC (Ludwigshafen Risk and Cardiovascular Health), siguieron durante 7,7 años a una cohorte de 3.258 personas con una media de edad de 65 años y observaron que la tasa de mortalidad fue del 22,6% (el 62,8% por enfermedad cardiovascular [ECV]) y que la concentración sérica de calcidiol y calcitriol mostró, cada una de ellas de forma independiente, una asociación inversa con la mortalidad cardiovascular, después de ajustar por edad y por comorbilidades23. Igualmente, entre los descendientes de la cohorte del clásico estudio Framingham, también se observó una asociación inversa entre ECV y concentración sérica de calcidiol24.
En resumen, la reducción de la concentración plasmática de PTH en el tratamiento del hiperparatiroidismo secundario de la ERC es sólo uno de los mecanismos con los que la vitamina D activa ayuda a frenar la progresión de la enfermedad. Otros efectos «no clásicos» de la vitamina D que contribuyen a la protección cardiovascular son la inhibición del eje renina-angiotensina, la disminución de la inflamación, tanto sistémica como renal o cardiovascular, y la reducción de la proteinuria25,26.
Sin embargo, se desconocen con exactitud los mecanismos mediante los cuales la vitamina D protege del riesgo cardiovascular y se necesitan más estudios para determinar la eficacia de las diferentes terapias.
FÁRMACOS. TERMINOLOGÍA Y ACCIONES
Aunque no existe una terminología unificada podríamos clasificar los tipos de vitamina D en los siguientes27:
Vitamina D nutricional o preprohormona
1. Ergocalciferol. Vitamina D2.
2. Colecalciferol. Vitamina D3.
Ambos carecen de 25-hidroxi (25 [OH]). Esta vitamina se denomina nutricional porque puede ser suplida por dietas ricas en vitamina D o suplementos orales de la misma.
Calcidiol o calcifediol (25 hidroxivitamina D; 25-hidroxicolecalciferol; 25[OH]D3)
Ésta es la forma más abundante en el organismo y es la que miden las diferentes pruebas de laboratorio debido a que los niveles son 1.000 veces superiores a los del calcitriol y tiene un tiempo de vida media superior (dos-tres semanas) que el calcitriol (cuatro-seis horas). La «insuficiencia» de vitamina D se define tradicionalmente, aunque sin claro consenso, como niveles de 25(OH)D3 inferiores a 30 ng/ml y la «deficiencia» como valores séricos inferiores a 10-15 ng/ml. Se estima que entre un 70 y un 80% de pacientes con ERC presentan un déficit de esta vitamina1,28.
Calcitriol (1,25-dihidroxicolecalciferol; 1,25[OH]2D3)
Esta forma es la vitamina D activa propiamente dicha. El calcitriol es aproximadamente 500-1.000 veces más activo que su precursor 25-hidroxicolecalciferol.
Activadores de los receptores de la vitamina D
1. Alfacalcidiol. Análogo de la vitamina D3.
2. Doxercalciferol. Análogo de la vitamina D2.
3. Falecalcitriol. Análogo de la vitamina D3.
4. Paricalcitol. Análogo de la vitamina D2.
5. Maxicalcitol. Análogo de la vitamina D3.
Los dos últimos activadores se conocen como «selectivos» para indicar un mayor efecto sobre el VDR de la paratiroides que sobre los del intestino y hueso, y se les atribuye un menor riesgo de hipercalcemia29.
EFICACIA DE LA INTERVENCIÓN FARMACOLÓGICA CON VITAMINA D EN LA ENFERMEDAD RENAL CRONICA
Recomendaciones de las Guías de la Sociedad Española de Nefrología-Kidney Disease. Improving Global Outcomes
La elevada prevalencia de déficit de vitamina D, tanto nutricional como activa en la ERC, junto al reconocimiento de la importancia de esta hormona en la fisiopatología de las alteraciones del metabolismo óseo-mineral de la ERC, han llevado a la realización de múltiples estudios observacionales y controlados con vitamina D en los distintos estadios de la ERC.
Las acciones extraesqueléticas de la vitamina D ya comentadas y la asociación del déficit de vitamina D con factores de riesgo vascular y con una mayor mortalidad ha acrecentado el interés en la utilización de estos compuestos. Sin embargo, existe una gran confusión sobre qué tipo de vitamina D emplear en la ERC (nutricional, activa o ambas) y, en el caso de la vitamina D activa, cuál de ellas utilizar. La presión de la industria farmacéutica que comercializa formas activas de vitamina D contribuye a esta confusión.
Las guías de práctica clínica, en concreto la Kidney Disease. Improving Global Outcomes (KDIGO) Guideline26 y las Recomendaciones de la Sociedad Española de Nefrología (S.E.N.)30 recientemente publicadas aconsejan:
En pacientes con ERC estadio 1-3:
1. Medir la concentración plasmática de 25(OH)D3 (calcidiol) y repetir las determinaciones en función de los valores basales y las intervenciones terapéuticas (grado de evidencia: 2C de la clasificación GRADE31).
2. Corregir el déficit de vitamina D con estrategias terapéuticas recomendadas para la población general. En las Recomendaciones de la S.E.N. se aconseja administrar la vitamina D en dosis de 200-800 U/día o 16.000 U de calcidiol en dosis única cada 15 o 30 días.
En pacientes con ERC Estadio 3-5 no en diálisis:
1. Es aconsejable corregir el déficit de vitamina D con vitamina D nutricional (no se define el nivel de evidencia).
2. Si la PTH plasmática supera los valores normales de forma persistente, se sugiere el tratamiento con preparados de vitamina D activa (grado de evidencia: 2C).
En pacientes con ERC en diálisis y PTH persistentemente elevada
1. Se sugiere el tratamiento con preparados de vitamina D activa, calcimiméticos o con una combinación de ambos para disminuir la PTH plasmática (grado de evidencia: 2B).
Estudios sobre la influencia de la vitamina D en la morbimortalidad de pacientes con enfermedad renal crónica
Sin embargo, la evidencia disponible sobre la influencia de la administración de vitamina D en la superviviencia de los pacientes con ERC es poco consistente y derivada de estudios observacionales; la mayoría de los estudios controlados realizados no tienen como objetivo primario valorar la supervivencia, sino valorar cambios en parámetros analíticos a corto o medio plazo. Tampoco hay, en el momento actual, evidencia que demuestre claramente la superioridad de una forma de vitamina D activa sobre otra.
En los últimos años se han publicado varias revisiones sistemáticas y metanálisis que analizan la utilidad de estos fármacos en la ERC. Los resultados de estas revisiones sistemáticas se resumen a continuación.
Vitamina D nutricional y alteraciones bioquímicas en la enfermedad renal crónica
En un reciente metanálisis32 de 17 estudios observacionales y cinco controlados sobre la utilidad de la vitamina D nutricional (ergocalciferol o colecalciferol) en pacientes con ERC se observó un descenso medio de la PTH plasmática de 41,7 pg/ml en los pacientes de los estudios observacionales, y de 31,7 pg/ml en los de los estudios controlados.
Sin embargo, se observó que entre los pacientes tratados con vitamina D nutricional los casos de hipercalcemia fueron más frecuentes en los estudios controlados (2% en los estudios observacionales y 3% en los estudios controlados), al igual que los casos de hiperfosforemia (0,8% en los estudios observacionales y 7% en los estudios controlados). En los estudios observacionales se observó un aumento del calcitriol plasmático en aquellos pacientes tratados con vitamina D.
Vitamina D activa y alteraciones bioquímicas en la enfermedad renal crónica
Aunque hay muchos estudios sobre este aspecto, los principales son dos revisiones Cochrane firmadas por los mismos autores y publicadas en el año 2009, en las que analizan la influencia de la vitamina D, tanto nutricional como activa, en los parámetros analíticos: la primera revisión incluye 16 estudios controlados en pacientes con ERC que no precisaban diálisis33; la segunda incluye 60 estudios controlados en pacientes en diálisis34.
Según los estudios analizados en estas revisiones Cochrane, el tratamiento con vitamina D activa en los pacientes con ERC no dializados redujo la PTH plasmática una media de 49,34 pg/ml y aumentó la frecuencia de pacientes con hipercalcemia, pero no con hiperfosforemia.
En los pacientes en diálisis, los datos son muy heterogéneos, si bien se concluye que la administración de vitamina D disminuyó la PTH sérica y aumentó la fosforemia. La frecuencia de hipercalcemia no alcanzó significación estadística, pero los autores consideran que podría ser clínicamente relevante.
Los datos existentes en el momento de realizar estas revisiones no permitieron determinar si los compuestos de más reciente comercialización fueron superiores a otros fármacos activos tradicionales como el alfacalcidol o el calcitriol. Sin embargo, en un estudio controlado muy reciente en el que se compara el alfacalcidol con el paricalcitol intravenosos en 80 pacientes en hemodiálisis, no hubo diferencias ni en la respuesta en términos de supresión de PTH, ni en la incidencia de hipercalcemia e hiperfosforemia, concluyéndose que los dos fármacos son igual de eficaces en el tratamiento del hiperparatiroidismo secundario35
Vitamina D nutricional y mortalidad en la enfermedad renal crónica
Aunque está bien documentado que el déficit de vitamina D se asocia con un mayor riesgo de mortalidad cardiovascular, no hay ningún estudio aleatorizado y bien diseñado que analice el efecto de la administración de vitamina D nutricional sobre la mortalidad de pacientes afectados de ERC.
Un reciente metanálisis36 de estudios observacionales y controlados sobre los efectos de suplementos de vitamina D (nutricional o activa) en todo tipo de sujetos (pacientes con ERC y población general), concluye que, si bien la evidencia es limitada, los suplementos de vitamina D a dosis altas o moderadas parecen disminuir el riesgo cardiovascular. Sin embargo, cuando el metanálisis se restringía a los estudios comparativos con vitamina D nutricional en población general, dicho beneficio dejaba de apreciarse.
En otra revisión sistemática reciente de la colaboración Cochrane37 se analiza la eficacia de diversas formas de vitamina D en la mortalidad de adultos sin ERC. Incluye 50 estudios controlados con más de 94.000 pacientes (edad media 74 años, 79% mujeres) y concluye que el tratamiento con colecalciferol (vitamina D3) durante dos años disminuyó el riesgo de mortalidad en un 6%. El ergocalciferol, el alfacalcidol o el calcitriol no tuvieron influencia en la mortalidad y estos dos últimos sí presentaron mayor riesgo de hipercalcemia.
No hay aún estudios que muestren consistentemente que estos tratamientos son capaces de frenar la progresión de la enfermedad renal o disminuir la mortalidad cardiovascular. Tampoco hay estudios que hayan demostrado superioridad de unas moléculas de vitamina D activas frente a otras. Se hace necesario, por tanto, disponer de evidencia clínica que permita responder a algunas cuestiones muy relevantes para los pacientes con ERC: ¿se reduce la morbimortalidad con el uso de la vitamina D nutricional o activa? ¿Debe normalizarse la concentración plasmática de calcidiol antes de administrar vitamina D activa? ¿Hay diferencias clínicamente relevantes entre los distintos tipos de vitamina D activa?
Vitamina D activa y mortalidad en la enfermedad renal crónica
Los estudios observacionales revisados en un trabajo que compara la vitamina D nutricional y activa38 indican que la administración de cualquier dosis o compuesto de vitamina D activa se asocia con una mayor supervivencia de los pacientes con ERC, precisen o no de diálisis. Sin embargo, las dos revisiones Cochrane mencionadas, que sólo incluyen ensayos clínicos controlados, no encuentran diferencias en la mortalidad de los pacientes tratados con vitamina D activa o con placebo, cualquiera que sea su estadio de ERC. Tampoco encuentran diferencias en la progresión de la ERC de los pacientes no en diálisis, ni en otras variables clínicas (fracturas, dolor óseo o necesidad de paratiroidectomía) de los pacientes con ERC (tanto dializados como no dializados).
IMPLICACIONES ECONÓMICAS DE LA UTILIZACIÓN DE LAS DISTINTAS MOLÉCULAS DE VITAMINA D
Conceptos generales
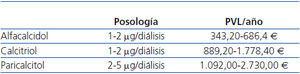
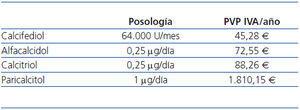
El clínico debe orientar la prescripción considerando que los presupuestos son limitados y, por consiguiente, debe sopesar los costes y los beneficios de su decisión: prescribir fármacos con ventajas no demostradas en la relación coste-efectividad va en detrimento de la equidad en la distribución de las prestaciones para otros pacientes. En el caso concreto de la vitamina D y sus análogos, la tabla 1 y la tabla 2 muestran el coste de estos productos en España y en el año 2011. Las diferencias económicas no tendrían importancia si a un mayor coste le correspondiera una mayor efectividad o una mayor utilidad (reducción en la mortalidad, en la frecuencia de hospitalización, en la mejora de la calidad de vida, etc.).
Los resultados del análisis de coste-efectividad (CEA) se expresan como la diferencia en costes dividida por las diferencias en la evolución de la morbimortalidad entre dos o más estrategias39. Los aspectos evolutivos pueden expresarse como años de vida ganados, QALYs (quality-adjusted life years) o resultados sobre aspectos clínicos o de laboratorio. La importancia del CEA es fundamentalmente ayudar a decidir sobre un tratamiento que es más efectivo y más caro que la alternativa.
Ya se ha mencionado anteriormente que el tratamiento inadecuado del hiperparatiroidismo se asocia con complicaciones cardiovasculares, óseas, inmunológicas, anemia, etc. El coste de las opciones terapéuticas se resume en la tabla 1 y en la tabla 2; la decisión puede significar una importante carga en el presupuesto, lo cual no debería ser un problema si la efectividad de la opción elegida es superior a la de los competidores. Lamentablemente no existen estudios que aclaren qué vitamina D mejora la supervivencia y la mayoría de los resultados de los estudios realizados están basados en la comparación de los cambios bioquímicos observados en marcadores arbitrariamente subrogados38.
Estudios con ergocalciferol o colecalciferol
Como ya se ha comentado, el reciente metanálisis de Kandula, et al.32 no aporta datos respecto a la utilidad de la vitamina D nutricional para reducir la frecuencia de eventos cardiovasculares y óseos. Tampoco hay evidencia de que los suplementos de vitamina D nutricional sean igual de eficaces que la vitamina D activa o los calcimiméticos para reducir el hiperparatiroidismo en pacientes con ERC.
Las guías de práctica clínica aconsejan suplementar con vitamina D nutricional la insuficiencia y la deficiencia de vitamina D. Aunque los criterios que se aplican a la población general no siempre son válidos para los pacientes con ERC, considerando el bajo coste de las formas nutricionales de vitamina D, su administración para normalizar la concentración plasmática de vitamina D parece coste-efectivo.
Estudios con activadores no selectivos y activadores selectivos del receptor de vitamina D
A la hora de decidir entre activadores del receptor de vitamina D y su impacto económico, el paricalcitol, activador selectivo, se destaca por su elevado precio.
Los estudios publicados no indican mayor eficacia del paricalcitol sobre el calcitriol para reducir la mortalidad y la hospitalización. No hay estudios prospectivos aleatorizados y sólo se han realizado dos estudios primarios no aleatorizados40,41 y cuatro estudios suplementarios tampoco aleatorizados42-45. Los estudios observacionales presentan numerosas limitaciones (ausencia de control sobre riesgos, diferencias en pérdidas para seguimiento, diferencias en la gravedad y en el estadio de la enfermedad) y, por tanto, no tienen el mismo nivel de evidencia científica que los estudios aleatorizados. Es, pues, necesario llevar a cabo estudios prospectivos aleatorizados. Respecto a la frecuencia de episodios de hipercalcemia y/o elevaciones del producto fosfocálcico, no parece haber diferencias significativas entre paricalcitol y calcitriol administrados por vía intravenosa46. Tampoco entre el paricalcitol y el alfacalcidol administrados por vía intravenosa35 No hay estudios comparativos entre la formulación oral del paricalcitol y los otros activadores de los receptores de vitamina D.
Los estudios que comparan el coste-efectividad del paricalcitol con activadores no selectivos no son concluyentes. En un estudio recientemente publicado se analiza el coste-efectividad del paricalcitol frente al alfacalcidol en una hipotética cohorte de pacientes con ERC estadios 3-5 con un modelo de análisis de decisión utilizando el modelo probabilístico de Markov47. Los autores concluyen que el paricalcitol se asocia con un incremento en la relación coste-efectividad de 12.840 dólares/QALY. Se trata, sin embargo, de un trabajo con muchas limitaciones: asume que las formulaciones parenterales son equivalentes a las orales; los datos de alfacalcidiol se equiparan con los de calcitriol; no hay datos que comparen paricalcitol oral con otros activadores VDR, y el modelo se basó únicamente en estudios observacionales. Además, tres de los cuatro autores son empleados de la empresa que comercializa el paricalcitol.
Hay otras dos evaluaciones económicas, una en Estados Unidos en la que se comparan paricalcitol y calcitriol intravenosos48 y otra en Alemania en la que se compara paricalcitol intravenoso con calcitriol oral y alfacalcidol intravenoso49. Ambos trabajos concluyen que paricalcitol tiene una mejor relación coste-efectividad. Los dos trabajos incluyen entre sus autores a empleados de la empresa que comercializa el paricalcitol. Además, el informe del grupo AWMSG (All Wales Medicine Strategy Group)50, así como las recomendaciones del Scottish Medicines Consortium51, no comparten estas conclusiones al considerar que la metodología de los análisis no es la adecuada, ya que se fundamentan en estudios observacionales no aleatorizados.
CONCLUSIONES Y RECOMENDACIONES FINALES
En los últimos años se está reconociendo la importancia de las acciones extraesqueléticas de la actividad endocrina de la vitamina D y su profunda interacción con la ERC. Ello ha facilitado que se pueda disponer de muchos compuestos de vitamina D, tanto nutricional como activa.
Sin embargo, y como e muestra en esta revisión, no existe todavía una base científica suficiente para preferir la utilización de una vitamina D activa respecto a otra. Mientras no disponga de más datos, el clínico debe seguir las recomendaciones de las guías de práctica clínica, matizadas por la experiencia adquirida con sus pacientes y siempre teniendo en cuenta las implicaciones económicas de sus decisiones terapéuticas.
Con estas premisas, los autores de esta revisión recomiendan:
1. En pacientes con insuficiencia o déficit de 25(OH)D: administrar vitamina D nutricional a las dosis recomendadas por las guías de práctica clínica.
2. En pacientes con hiperparatiroidismo secundario: tratar con vitamina D activa de acuerdo con las recomendaciones de las guías, teniendo en cuenta el coste: los fármacos más económicos serían de primera elección y los más costosos serían de segunda elección, cuando los efectos secundarios limitasen el empleo de los fármacos de primera elección.
3. La administración de vitamina D activa, excepto en su indicación para el hiperparatiroidismo secundario de la ERC, es cuestionable en el momento actual.
Puntos clave
1. El déficit de 25(OH)D es muy frecuente en la ERC y se asocia con una mayor morbimortalidad.
2. Si bien no hay evidencia clara sobre la eficacia de la corrección del déficit de calcidiol con vitamina D nutricional para reducir la morbimortalidad, la seguridad y el bajo coste de estos fármacos hacen aconsejable su utilización en pacientes con ERC e insuficiencia o deficiencia de vitamina D.
3. El tratamiento con compuestos de vitamina D es eficaz en el control del hiperparatiroidismo secundario de la ERC. El efecto es más importante y sostenido con vitamina D activa respecto a vitamina D.
4. No hay evidencia suficiente que muestre la superioridad de un compuesto de vitamina D activa respecto a otro y sí hay muchas diferencias en el coste económico.
5. Son necesarios más estudios clínicos que comparen los distintos compuestos de vitamina D con objetivos importantes desde el punto de vista clínico (mortalidad, progresión de la ERC, regresión de la hipertrofia ventricular izquierda).
6. No hay estudios que analicen los beneficios de la terapia combinada de vitamina D nutricional y activa en la ERC.
Agradecimientos
Los autores agradecen al Dr. Santiago Rosales y a la Dra. Victoria Raventós sus inestimables contribuciones al manuscrito.
Tabla 2. Coste de la vitamina D intravenosa
Figura 1.
Tabla 1. Coste de la vitamina D oral (PVP + IVA)