Desde los primeros casos descritos en China en diciembre del 2019 hasta ahora, el nuevo coronavirus SARS-CoV-2ha causado la muerte a más de 1.000.000 de personas en todo el mundo. Entre las manifestaciones ya conocidas asociadas a la infección están emergiendo otras menos frecuentes pero importantes por su potencial letalidad1,2. Presentamos 3 pacientes con enfermedad renal crónica (ERC) en tratamiento renal sustitutivo que han presentado un ictus en relación con la COVID-19. Entre el 10 de marzo y el 25 de abril del 2020 han ingresado en nuestro servicio 16 pacientes con TRS y SARS-CoV-2 positivo (uno de ellos en diálisis peritoneal [DP]). De los 16 pacientes, 3 (18,7%) han presentado un ictus, falleciendo uno de ellos.
Paciente 1. Varón de 85 años, con ERC secundaria a nefroangioesclerosis, en TRS desde 2014, inicialmente DP y desde el 2017 en HD; hipertenso, miocardiopatía dilatada no isquémica, enfermedad pulmonar obstructiva crónica severa, ictus aterotrombótico 15 días antes. Ingresa por neumonía unilateral moderada por SARS-CoV-2, recibiendo hidroxicloroquina y lopinavir/ritonavir según protocolo. El día +6 de ingreso, con adecuada evolución respiratoria, presenta un episodio de hemiparesia derecha y bajo nivel de consciencia que recupera horas después. Dado su ictus aterotrombótico previo con la misma clínica, se asume la misma localización y dado que el paciente solo es candidato a tratamiento conservador con antiagregación (que ya recibe) no se repite prueba de imagen. En el día +8 previo a la sesión de diálisis presenta un episodio idéntico, objetivándose deterioro respiratorio y analítico con importante aumento de PCR, mayor linfopenia y elevación de D-dímero. No se evidencia recuperación posterior, falleciendo en las siguientes 24 h. Nos planteamos si su primer accidente cerebrovascular fuera la presentación inicial de COVID-19 2semanas antes de la neumonía, en la línea de otras series publicadas3-5.
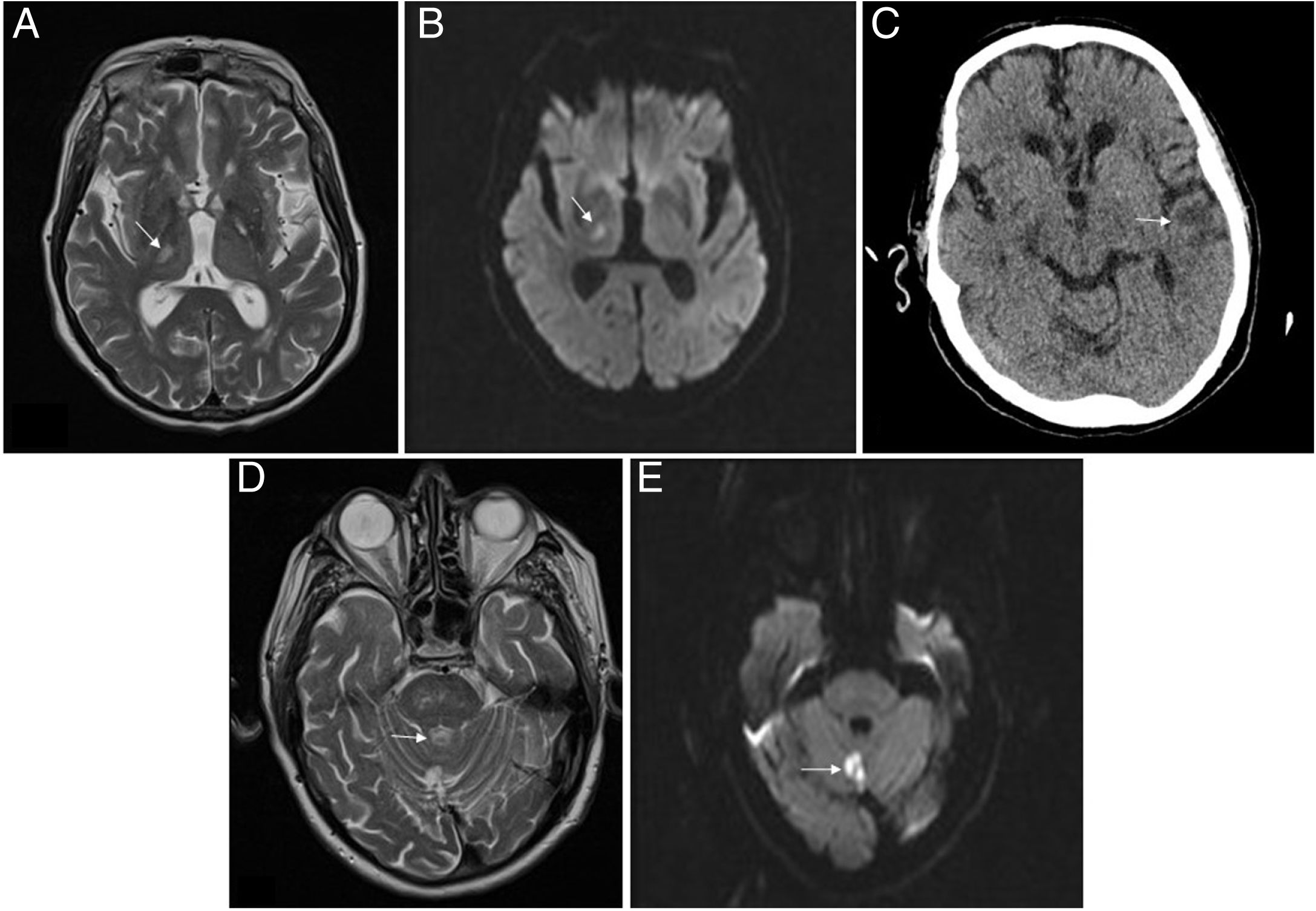
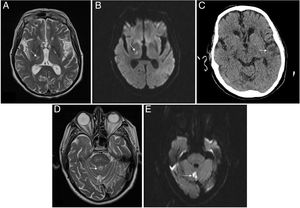
Paciente 2. Varón de 71 años, con ERC secundaria a nefropatía intersticial crónica por uropatía obstructiva (carcinoma urotelial de vejiga), en HD desde 2015, con múltiples problemas de acceso vascular, actualmente con permcath femoral. Hipertenso, carcinoma epidermoide de pulmón y disfunción moderada/severa del ventrículo izquierdo. Ingresa por diarrea, fiebre y neumonía bilateral leve por SARS-CoV-2. Recibe hidroxicloroquina 5 días y lopinavir/ritonavir 7 días. Buena evolución clínico-analítica, salvo por un aumento progresivo de D-dímero desde la finalización del tratamiento inmunomodulador, hasta mayor de 6 veces el control el día +9 de ingreso, por lo que según protocolo iniciamos heparina a 1mg/kg/día por alto riesgo trombótico. Días más tarde, el paciente es dado de alta manteniendo heparina durante los 15 días más. Ingresa 15 días tras suspensión de la heparina por déficit sensitivo hemicorporal izquierdo, objetivándose ictus subagudo lacunar talámico derecho sin evidencia de cardiopatía potencialmente embolígena ni ateromatosis carotídea (fig. 1). Se añade antiagregación y 11 días después vuelve a ingresar por un segundo ictus, esta vez en el territorio de la arteria cerebral media izquierda, con afasia no recuperada, permaneciendo ingresado en el momento de esta redacción.
Imágenes de Neurorradiología. A) RM del paciente 2. Lesión hiperintensa en secuencias T2 localizada en núcleos laterales del tálamo/brazo posterior de la cápsula interna derecha, compatible infarto lacunar. B) RM del paciente 2. Imagen de restricción en secuencias de difusión que confirma ictus de imagen previa de evolución aguda/subaguda. C) TAC del paciente 2. Hipodensidad córtico-subcortical en la región temporal izquierda compatible con lesión isquémica. D) RM del paciente 3. Lesión hiperintensa en secuencias T2 localizada en el vérmix cerebeloso compatible con infarto. E) RM del paciente 3. Imagen en secuencia de difusión que identifica un foco de alteración de la señal a nivel del vérmix cerebeloso, la cual restringe en mapa ADC, compatible con infarto agudo/subagudo en la localización descrita en T2 en la imagen previa.
Paciente 3. Varón de 80 años, monorreno funcional de etiología isquémica, en DP desde 2015, con isquemia crónica grado IIA en miembros inferiores y endarterectomía carotídea en 2011 por hallazgo incidental. Ingresa por neumonía bilateral moderada por SARS-CoV-2, tratándose con hidroxicloroquina 5 días y lopinavir/ritonavir 7 días. Presenta buena evolución, siendo dado de alta tras 15 días de ingreso y manteniendo heparina profiláctica durante 10 días más. A las 24h del alta presenta erupción de lesiones eritematosas papulosas en el tronco que respeta los miembros superiores y escasas en los miembros inferiores. Es valorado por dermatología que, tras biopsia, diagnostica exantema probablemente secundario a COVID-19. Tras 2 semanas de profilaxis antitrombótica, suspende la heparina, comenzando 5 días después con monoparesia brusca del miembro inferior derecho, siendo ingresado en Neurología, objetivándose, mediante resonancia magnética, infarto agudo en vérmix cerebeloso (fig. 1). Se realiza un ecocardiograma, sin evidencia de cardiopatía embolígena y estudio neurosonológico sin evidencia de estenosis intra-extracraneales. El paciente recupera la movilidad y permanece asintomático, siendo dado de alta (tabla 1).
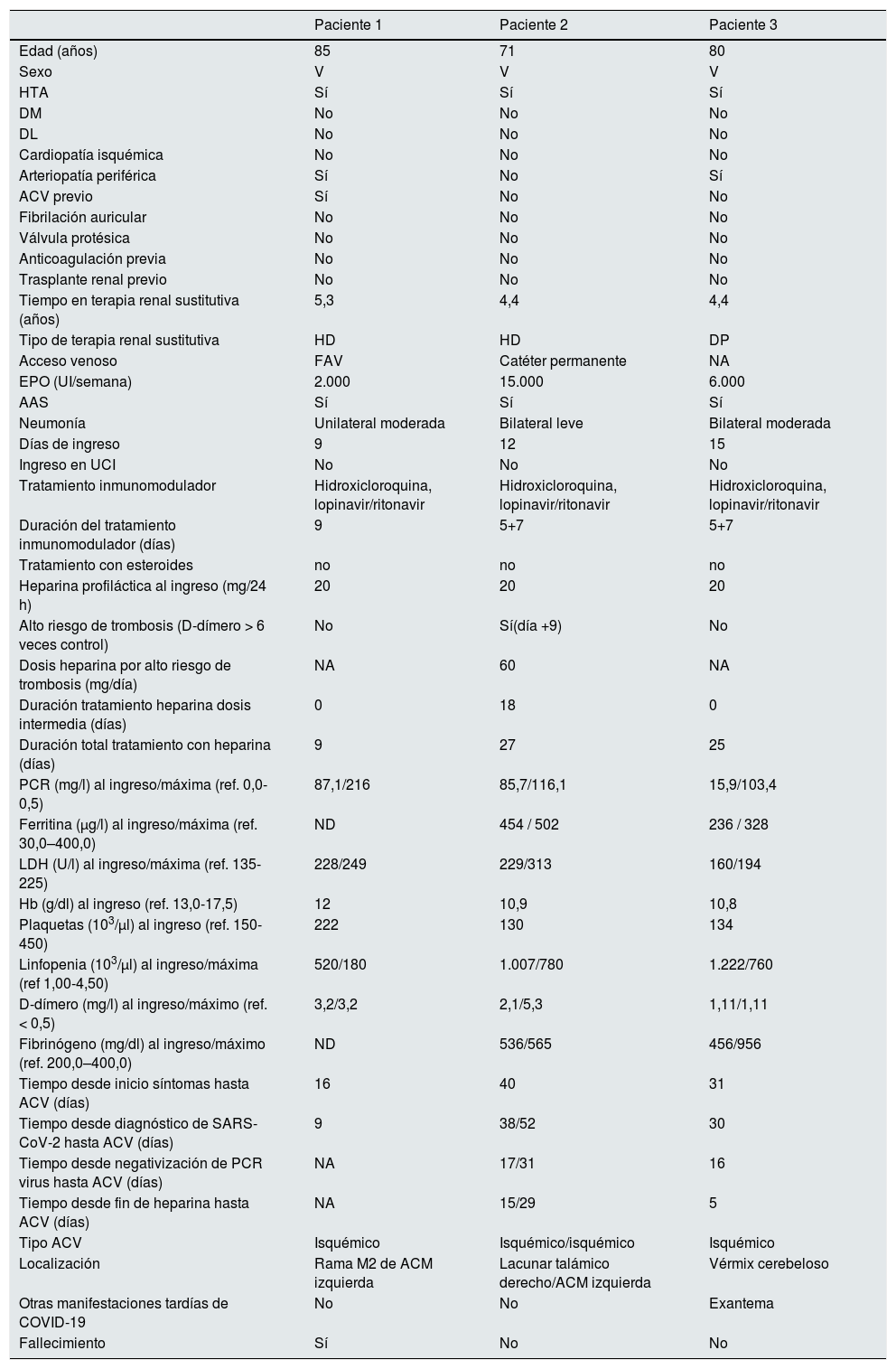
Datos demográficos, analíticos y clínicos
| Paciente 1 | Paciente 2 | Paciente 3 | |
|---|---|---|---|
| Edad (años) | 85 | 71 | 80 |
| Sexo | V | V | V |
| HTA | Sí | Sí | Sí |
| DM | No | No | No |
| DL | No | No | No |
| Cardiopatía isquémica | No | No | No |
| Arteriopatía periférica | Sí | No | Sí |
| ACV previo | Sí | No | No |
| Fibrilación auricular | No | No | No |
| Válvula protésica | No | No | No |
| Anticoagulación previa | No | No | No |
| Trasplante renal previo | No | No | No |
| Tiempo en terapia renal sustitutiva (años) | 5,3 | 4,4 | 4,4 |
| Tipo de terapia renal sustitutiva | HD | HD | DP |
| Acceso venoso | FAV | Catéter permanente | NA |
| EPO (UI/semana) | 2.000 | 15.000 | 6.000 |
| AAS | Sí | Sí | Sí |
| Neumonía | Unilateral moderada | Bilateral leve | Bilateral moderada |
| Días de ingreso | 9 | 12 | 15 |
| Ingreso en UCI | No | No | No |
| Tratamiento inmunomodulador | Hidroxicloroquina, lopinavir/ritonavir | Hidroxicloroquina, lopinavir/ritonavir | Hidroxicloroquina, lopinavir/ritonavir |
| Duración del tratamiento inmunomodulador (días) | 9 | 5+7 | 5+7 |
| Tratamiento con esteroides | no | no | no |
| Heparina profiláctica al ingreso (mg/24 h) | 20 | 20 | 20 |
| Alto riesgo de trombosis (D-dímero > 6 veces control) | No | Sí(día +9) | No |
| Dosis heparina por alto riesgo de trombosis (mg/día) | NA | 60 | NA |
| Duración tratamiento heparina dosis intermedia (días) | 0 | 18 | 0 |
| Duración total tratamiento con heparina (días) | 9 | 27 | 25 |
| PCR (mg/l) al ingreso/máxima (ref. 0,0-0,5) | 87,1/216 | 85,7/116,1 | 15,9/103,4 |
| Ferritina (μg/l) al ingreso/máxima (ref. 30,0–400,0) | ND | 454 / 502 | 236 / 328 |
| LDH (U/l) al ingreso/máxima (ref. 135-225) | 228/249 | 229/313 | 160/194 |
| Hb (g/dl) al ingreso (ref. 13,0-17,5) | 12 | 10,9 | 10,8 |
| Plaquetas (103/μl) al ingreso (ref. 150-450) | 222 | 130 | 134 |
| Linfopenia (103/μl) al ingreso/máxima (ref 1,00-4,50) | 520/180 | 1.007/780 | 1.222/760 |
| D-dímero (mg/l) al ingreso/máximo (ref. < 0,5) | 3,2/3,2 | 2,1/5,3 | 1,11/1,11 |
| Fibrinógeno (mg/dl) al ingreso/máximo (ref. 200,0–400,0) | ND | 536/565 | 456/956 |
| Tiempo desde inicio síntomas hasta ACV (días) | 16 | 40 | 31 |
| Tiempo desde diagnóstico de SARS-CoV-2 hasta ACV (días) | 9 | 38/52 | 30 |
| Tiempo desde negativización de PCR virus hasta ACV (días) | NA | 17/31 | 16 |
| Tiempo desde fin de heparina hasta ACV (días) | NA | 15/29 | 5 |
| Tipo ACV | Isquémico | Isquémico/isquémico | Isquémico |
| Localización | Rama M2 de ACM izquierda | Lacunar talámico derecho/ACM izquierda | Vérmix cerebeloso |
| Otras manifestaciones tardías de COVID-19 | No | No | Exantema |
| Fallecimiento | Sí | No | No |
5 + 7: 5 días de hidroxicloroquina y 7 de lopinavir/ritonavir; AAS: ácido acetilsalicílico; ACM: arteria cerebral media; ACV: accidente cerebrovascular; CoV-2: severe acute respiratory syndrome coronavirus 2; DL: dislipemia; DM: diabetes mellitus; DP: diálisis peritoneal; EPO: eritropoyetina; FAV: fístula arterio-venosa; HD: hemodiálisis; LDH: lactato deshidrogenasa; HTA: hipertensión arterial; NA: no aplica; ND: no disponible; PCR: Proteína C reactiva; SARS- UCI: Unidad de Cuidados Intensivos.
Aunque la incidencia concreta de ictus en pacientes con COVID-19 se desconoce, la literatura al respecto está creciendo de manera exponencial1. Según Mao et al.6, en una cohorte de 214 pacientes ingresados por SARS-CoV-2 el 5,7% presentaron ictus (en la fase final de la infección). Li et al.7 publicaron recientemente una incidencia del 5% (en fases tempranas de la infección) en pacientes con factores de riesgo como hipertensión, diabetes, enfermedad coronaria e ictus. La serie de Beyrouti et al.4 muestra 6 casos de ictus con COVID-19 moderada-severa que se presentan entre el día 0 y 24 tras el inicio de los síntomas. Lodigiani et al.8 recogen una cohorte de 388 pacientes hospitalizados por SARS-CoV-2, con una incidencia de ictus isquémico del 2,5%. Aunque los mecanismos fisiopatogénicos no están claros4, la hipoxia, el estado de hipercoagulabilidad3, la coagulación intravascular diseminada, la microangiopatía trombótica y la ocasional positivización de anticuerpos anticardiolipina y anticoagulante lúpico parecen ser los responsables9,10. No hay referencias en la literatura a la población en diálisis, por lo que esta es la primera publicación que lo recoge insinuando una probable mayor incidencia que en la población general.