Sr. Director:
Recientemente se ha publicado un caso de hipocalcemia posdenosumab en Nefrología1 y nos gustaría hacer una aportación sobre este tema. El denosumab es un anticuerpo monoclonal anti-RANKL (receptor activator of nuclear factor-κ B ligand) empleado en el tratamiento de la osteoporosis como agente antirresortivo. A diferencia de los bifosfonatos, el denosumab no parece nefrotóxico2 ni precisa ajuste de dosis en la insuficiencia renal por su perfil farmacocinético y farmacodinámico favorable1,3. Sin embargo, las alteraciones cualitativas del hueso de los pacientes con osteoporosis no son comparables con el amplio espectro de alteraciones en el remodelado óseo que acompaña a la enfermedad renal crónica (ERC)4. Por este motivo y en relación con las alteraciones del metabolismo mineral que produce el denosumab, se podría poner en duda su seguridad en esta población. Describimos una paciente con ERC avanzada con hipocalcemia e hiperparatiroidismo extremos tras la administración continuada de denosumab.
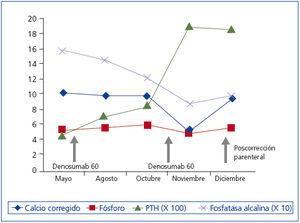
Se trata de una mujer de 75 años que consulta por temblor, espasmos musculares y parestesias en las extremidades. En los antecedentes personales destaca una ERC estadio 5 verosímilmente secundaria a nefroangioesclerosis y diabetes mellitus. Es alérgica a la penicilina y recibe tratamiento con insulina, doxazosina, nifedipino GITS, torasemida, ácido acetil salicílico, hierro oral, eritropoyetina, paricalcitol y calcifediol. Fue tratada, hasta 7 meses antes, con ácido alendrónico 70 mg, que se suspendió al iniciar denosumab 60 mg subcutáneo semestral. Su nefrólogo desconocía la prescripción de este fármaco. Entonces presentaba la siguiente analítica: creatinina 3,6 mg/dl, calcio total corregido 10,06 mg/dl, calcio iónico 5,1 mg/dl, fosfato 5,1 mg/dl, fosfatasa alcalina 157 U/l, bicarbonato 27,6 mmol/l, hormona paratiroidea (PTH) 436 pg/ml, 25 vitamina D 30,2 ng/ml. En la figura 1 se observa la evolución de los parámetros bioquímicos hasta la última analítica 14 días posdenosumab. No acudió a esta última revisión por no encontrarse bien. Seis días más tarde se comprueba en Urgencias: urea 154 mg/dl, creatinina 6 mg/dl, calcio total corregido 4,36 mg/dl, calcio iónico 2,4 mg/dl, fosfato 6,7 mg/dl, magnesio 1,3 mg/dl, fosfatasa alcalina 59 U/l, bicarbonato 18,6 mmol/l, PTH 1900 pg/ml. Electrocardiograma (ECG): QT corregido (QTc) 440 ms. Se inicia reposición de calcio oral e intravenoso, y calcitriol intravenoso con desaparición de la sintomatología. Tras 15 días de reposición parenteral, los parámetros analíticos se han normalizado (figura 1): ECG: QTc 402 ms. La PTH se mantiene en 1858 pg/ml.
Las recomendaciones para el uso del denosumab en la insuficiencia renal se basan en un ensayo clínico con un escaso número de enfermos, durante un período de seguimiento de tan solo 16 semanas y tras una única dosis del fármaco3. Además, los autores excluyen, en parte del estudio, los sujetos con niveles de 1,25 dihidroxivitamina D < 30 pg/ml, insuficiencia renal severa y PTH ≥ 110 pg/ml o insuficiencia renal y PTH ≥ 300 pg/ml. Aun así, presentaron hipocalcemia entre el 22-25 % de los casos con insuficiencia renal moderada-severa o en diálisis. Los autores recomiendan suplementos de calcio y vitamina D para su prevención. En otro ensayo clínico desarrollado durante 36 meses en mujeres posmenopáusicas con ERC y filtrado glomerular estimado > 15 ml/min, se excluyeron los casos de hipoparatiroidismo, hiperparatiroidismo, hipocalcemia o hipovitaminosis D; tampoco se monitorizaron los niveles de PTH durante el estudio2.
En los últimos meses se han seguido comunicando casos de hipocalcemia en nefropatías crónicas1,5-8. Son factores de riesgo para el desarrollo de hipocalcemia la no utilización previa de bifosfonatos y la insuficiencia renal8. Así, nuestra paciente quizá solo desarrolló hipocalcemia tras la segunda dosis al haber sido tratada previamente con alendronato.
El denosumab reduce el número de osteoclastos y la tasa de formación ósea. La hipocalcemia se relacionaría con el rápido depósito mineral de calcio en la nueva matriz ósea, que se comportaría de forma similar a un hueso hambriento posparatiroidectomía3. Sin embargo, como ocurría en este caso, la PTH no solo no está suprimida sino que estaba hiperestimulada. Además de la hipocalcemia súbita tras la segunda dosis de denosumab, los niveles de PTH se fueron incrementando progresivamente desde la primera dosis hasta valores muy elevados, a pesar de los aportes de vitamina D; también observamos un descenso de la fosfatasa alcalina. Para algunos expertos esta inhibición de la osteoclastogénesis podría favorecer una enfermedad ósea adinámica en la ERC4,5.
Se ha aconsejado la monitorización de la calcemia a los 8-14 días postratamiento7. Sin embargo, esto tampoco asegura su prevención7, ya que se desconoce cuándo se alcanza el nadir.
El denosumab puede producir efectos adversos potencialmente fatales a corto plazo, así como otros desconocidos, a más largo plazo, sobre el hueso de los pacientes con ERC. Por todo ello, algunos autores recomiendan no usarlo en la ERC4 o utilizarlo solo si previamente se ha hecho biopsia ósea6.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Evolución de los parámetros bioquímicos.