El síndrome de Alström (ALMS) es una muy rara enfermedad genética de herencia autosómica recesiva que puede afectar a varios órganos, entre ellos el riñón, y ser causa de insuficiencia renal terminal. Es considerado una ciliopatía por mutaciones en el gen ALMS1 (localizado en el cromosoma 2p13), y los primeros síntomas aparecen en la infancia1.
La esperanza de vida raramente excede los 50 años. La distrofia de fotorreceptores está presente en el 100% de los casos, llevando a una ceguera precoz. También puede haber pérdida de audición neurosensorial, obesidad troncular, diabetes mellitus tipo II (DM II), acantosis nigricans, hipertrigliceridemia que puede causar pancreatitis aguda, hipogonadismo, ovarios poliquísticos, hipotiroidismo, corta estatura, miocardiopatía dilatada, insuficiencia renal, fallo pulmonar, etc.1–3.
El diagnóstico del ALMS es confirmado con un test genético, aunque este suele ser frecuentemente clínico utilizando los criterios mayores y menores de Marshall específicos para la edad1,2, dado el elevado coste económico de este estudio y al limitado número de centros donde puede realizarse4.
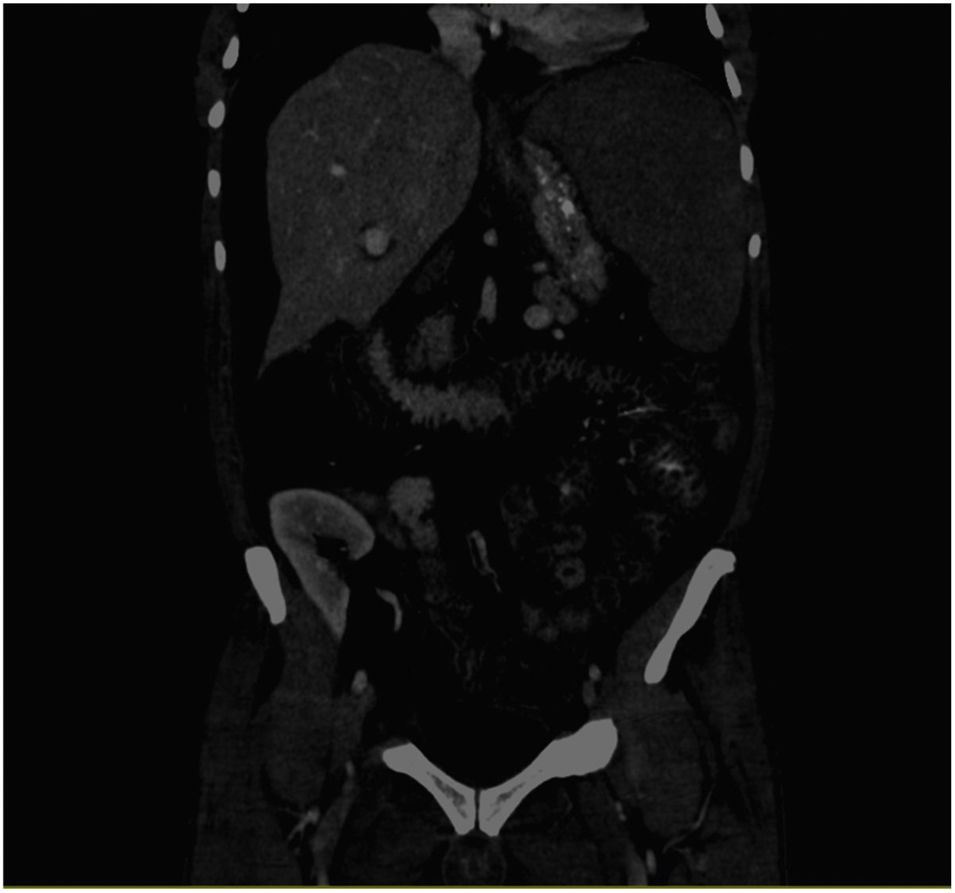
Presentamos el caso de un varón de 56 años afectado por el ALMS (un criterio mayor: retinitis pigmentaria y 4 criterios menores: DM II, insuficiencia renal crónica, hipogonadismo e hipertrigliceridemia. Otros datos de apoyo: alteraciones dentarias, cuello grueso y corto, hipertrofia de manos y rampas generalizadas) que inicia hemodiálisis en septiembre del 2017, y es trasplantado de riñón al cabo de un año. Se le administra triple terapia inmunosupresora con tacrolimus, micofenolato de mofetil y prednisona, siendo la función renal normal. No existían alteraciones cardíacas ni hepáticas en los estudios pretrasplante. En marzo del 2020 ingresa por dolor y distensión abdominal. La to mografía computarizada (TC) abdominal muestra esplenomegalia y edema de pared de asas de intestino delgado y colon que sugiere enteropatía por hipertensión portal y ascitis (fig. 1). En la analítica se observa un patrón de colestasis con aumento de las transaminasas y el análisis de líquido ascítico, cifras compatibles con trasudado. Se realiza un estudio hemodinámico hepático que evidencia un gradiente portosistémico de 6mmHg y la biopsia transyugular una leve hepatitis portal, de interfase y lobulillar, leve dilatación sinusoidal, focal proliferación ductular y fibrosis portal estrellada. Se le mantiene en ayunas con administración de nutrición parenteral y somatostatina intravenosa. No obstante, la evolución es tórpida, con empeoramiento clínico progresivo, presentando fiebre y profuso vómito en poso de café siendo exitus a los pocos días.
La afectación renal en el ALMS es lentamente progresivo y muy variable, pudiendo no estar relacionada con la DM II. Se manifiesta como una enfermedad túbulo-intersticial con fibrosis progresiva. En algunos pacientes el trasplante renal puede estar contraindicado por la presencia de importantes complicaciones como una severa miocardiopatía, obesidad mórbida, DM II incontrolada, etc.5. Marshall et al. sugieren el trasplante renal o reno-pancreático como tratamiento, pero existen muy pocos casos descritos en la literatura5,6.
Gathercole et al. han llevado a cabo uno de los mayores estudios sobre afectación hepática en el ALMS, concluyendo que existe un riesgo aumentado de hígado graso avanzado no alcohólico y fibrosis del tejido graso en estos enfermos7. La dramática evolución de nuestro paciente y la ausencia inicial de afectación hepática en los estudios convencionales pretrasplante (análisis, ecografía y TC abdominal), nos hace plantear que la elastografía de transición o FibroScan®, debería de realizarse rutinariamente en el ALMS. Ello nos permitiría valorar el grado de fibrosis hepática, así como la cuantificación de grasa hepática precozmente y hacer un seguimiento evolutivo de una manera no invasiva y rápida, pudiendo actuar antes del desarrollo de mayores complicaciones.