Sr. Director:
La hiperoxaluria primaria (HOP) es una alteración metabólica bastante infrecuente, con una incidencia anual de 0,11-0,26/100.000 niños nacidos y una prevalencia de 1-2,9/1.000.000 habitantes, aproximadamente1. En España existe un número relativamente elevado de casos a expensas de un aumento en la incidencia en Las Islas Canarias (específicamente en La Gomera)2. El diagnóstico suele hacerse de forma tardía, existiendo un promedio de 3,4 años desde el comienzo de los síntomas hasta el diagnóstico. Sólo el 30% de los casos son diagnosticados de forma precoz3. Esto conduce a que, en la mayoría de los casos, en el momento del diagnóstico definitivo los pacientes presenten depósitos universales de oxalato, incluyendo el sistema cardiovascular, que conducen inexorablemente a la muerte. La patogenia de la enfermedad viene dada por la existencia de un defecto enzimático situado en el perixosoma del hepatocito, que aumenta la conversión de glioxilato a oxalato poco soluble4. El gen afectado en la tipo I es el AGXT, que se encuentra situado en el cromosoma 2q36-37 y que corresponde a la enzima alanina-glioxilato aminotransferasa (proteína de 43 kDa)2, que necesita de la vitamina B6 (piridoxina) para su adecuado funcionamiento. Se han observado diferentes mutaciones en el gen de la AGXT que conllevan múltiples defectos, entre los que el más frecuente es la ausencia de actividad inmunorreactiva y catalítica de la proteína (42%)5. El único tratamiento realizado con éxito en estos pacientes consiste en el trasplante hepático o hepatorrenal que pueda suplir la actividad enzimática y función renal, respectivamente.
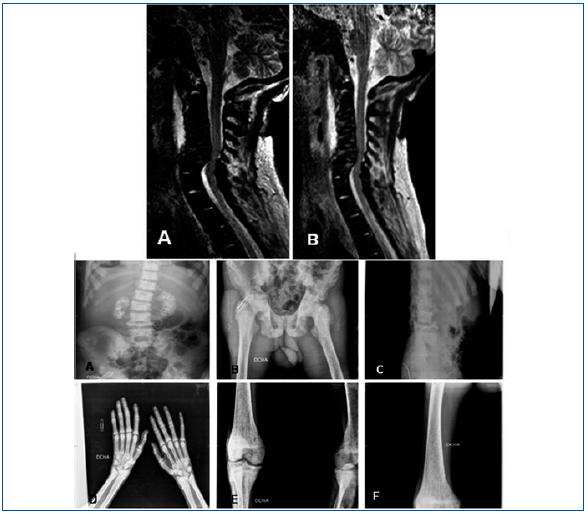
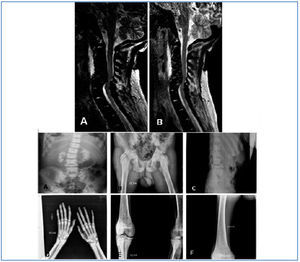
Hombre de 24 años de origen magrebí, con antecedentes personales de insuficiencia renal crónica (IRC) secundaria a nefrocalcinosis. Había presentado múltiples infecciones, dos abscesos en psoas derecho y unión esternoclavicular izquierda, aunque en ninguno de los dos casos se pudo identificar el germen etiológico. Ese mismo año presentó un accidente cerebrovascular isquémico talámico y perimesencefálico derecho. Ingresa en el hospital de su comunidad por cuadro de deterioro severo del estado general, fiebre recurrente y episodios reincidentes de artritis de hombro derecho por S. epidermidis y de articulación esternoclavicular izquierda por enterococo, ambos secundarios a bacteriemia por catéter permanente yugular derecho (previamente presentó trombosis de varios accesos vasculares). Durante el ingreso, que duró un año, surgieron innumerables complicaciones entre las que destacan: anemia severa de procesos crónicos, hemorragia digestiva alta, pericarditis urémica y neumonía con derrame pleural. En las últimas semanas de estancia en dicho hospital comienza con clínica de cervicalgia de localización izquierda, importante limitación funcional, fasciculaciones y fiebre con hemocultivos negativos. Se realizó resonancia magnética (figura 1) y con la sospecha de espondilodiscitis secundaria el paciente fue trasladado a nuestro centro para realización de laminectomía descompresiva.
En la exploración física realizada a su llegada destacaban deterioro del estado general y caquexia con atrofia muscular que le impedían caminar, hipotensión, taquicardia y febrícula. En la auscultación presentaba ritmo normal y un soplo pansistólico con hipoventilación en bases pulmonares. Se palpaba gran hepatoesplenomegalia no dolorosa. Aumento del tamaño de ambas rodillas y hombro derecho con visibles signos de inflamación.
En la analítica destacaban anemia (Hb: 8,3 g/dl), leucocitosis (18.900), PTH de 83 pg/ml y alteración de los parámetros inflamatorios y nutricionales (GGT: 544 U/l, FA: 531 U/l, albúmina: 0,7 g/dl y ferritina: 5,93 ng/ml PCR). Se realizó mapa óseo cuyas principales alteraciones pueden observarse en la figura 1 y que fueron informados como signos de hiperparatiroidismo secundarios muy avanzados. En la TAC cervical se detecto una importantecifosis a la altura de los cuerpos vertebrales C5-C6, alteración en la morfología de los mismos y disminución muy severa del diámetro antero-posterior que producía una importante compresión de la medula a dicho nivel, así como estenosis foraminal.
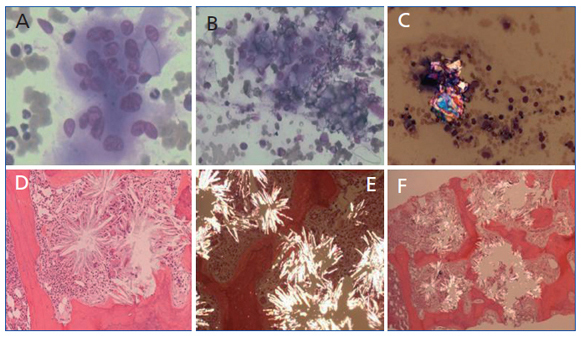
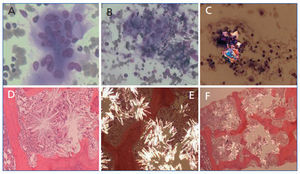
Se realizaron biopsia y aspirado de medula ósea que presentaba células gigantes multinucleadas pertenecientes a la serie macrofagomonocítica y que englobaban cristales de oxalato con birrefrigencia a la luz polarizada. En la médula ósea había sustitución del espacio medular por depósitos de cristales dispuestos concéntricamente, agrupándose en forma de estrella o roseta, que refringían bajo luz polarizada, con reacción periférica de células gigantes y destrucción de trabéculas óseas (figura 2). Con estos hallazgos el paciente fue diagnosticado de hiperoxaluria primaria. Se instauró tratamiento paliativo con vitamina B6 y diálisis de forma intensiva, pese a lo cual falleció 30 días después de su ingreso.
Este caso ilustra las consecuencias nefastas del diagnóstico tardío de esta infrecuente enfermedad que es mortal si no se instauran de forma precoz tratamientos agresivos. Una vez que el paciente presenta IRC las alternativas terapéuticas actuales son paliativas (trasplante renal) o curativas, aunque con una elevada morbilidad (trasplante combinado hígado-riñón)2.
En 1997 Hoppe encontró una frecuencia muy baja de HOP en la población en diálisis; el diagnóstico tardío se observó en el 42% de los pacientes y el 30% fueron diagnosticados cuando ya tenían una enfermedad renal terminal3.
Las manifestaciones más frecuentes y precoces de la enfermedad son la presencia de nefrocalcinosis (por formación de cristales de oxalato en el parénquima renal) y urolitiasis (al excretarse por el sistema pielocalicial). Las distintas formas de manifestación se agrupan según la edad de presentación. La forma infantil se caracteriza por IRC con oxalosis parenquimatosa masiva. En los niños algo más mayores, se presenta con síntomas de urolitiasis y en algunos casos obstrucción completa con fracaso renal agudo. En la edad adulta, cursa frecuentemente con enfermedad renal terminal6. Por desgracia, el diagnóstico de HOP fue tardío en nuestro paciente, lo que condujo a su muerte.
Un método sencillo para la detección de esta enfermedad puede ser la medición de la excreción urinaria de oxalato. En condiciones normales se suelen excretar 0,5 mmol/1,73 m2/día o 45 mg/1,73 m2/día; las personas afectadas de HOP presentan un importante incremento en la excreción urinaria de oxalato (> 1 mmol/1,73 m2/día o 90 mg/1,73 m2/día)6. Esta excreción es menos útil en pacientes con insuficiencia renal como en nuestro caso ya que el paciente presentaba IRC avanzada. En estos casos, el incremento de oxalato en plasma ayudaría a alcanzar un diagnóstico, junto con el depósito de oxalato cálcico en los tejidos7, si bien no está al alcance de todos los laboratorios. La biopsia hepática es la única prueba que confirma el diagnóstico definitivo de la HOP. Dependiendo del laboratorio, puede aportar información acerca de la existencia o no de proteína inmunorreactiva (Western blot), la localización subcelular (IF) e incluso el tipo de mutaciones (secuenciación)9.
En nuestro caso, el diagnóstico se realizó mediante la biopsia y el aspirado de médula ósea. Por regla general, los depósitos de oxalato aparecen en la fase terminal de la insuficiencia renal, evolucionando con mayor rapidez en hemodiálisis crónica. Estos depósitos de oxalato con reacción circundante inducen lesiones semejantes a las del hiperparatiroidismo secundario8 y anemia severa resistente a la EPO, como se ha descrito previamente10.
Por último, hay que incidir en la importancia de la detección de la enfermedad de forma precoz, ya que la efectividad del tratamiento depende de la rapidez en el diagnóstico de la misma. En efecto, un diagnóstico tardío conduce a IRC y depósito masivo de oxalato en órganos y tejidos. Hay que tenerlo presente en la población de riesgo, como son canarios y magrebíes. La población canaria con HOP no es magrebí es caucásica, pero al ser una isla se ha producido cruzamiento.
Figura 1.
Figura 2.