La hiperoxaluria primaria (HOP) se debe a un desorden metabólico hereditario autosómico recesivo, del metabolismo del glioxalato, que causa una producción excesiva de oxalato. El trastorno más frecuente y grave se debe al déficit enzimático de alanin:glioxalato aminotransferasa (HOP tipo I) específico en el peroxisoma hepático. Dado que el oxalato no se metaboliza en los humanos y se elimina por vía renal, el riñón es el primer órgano afectado, dando lugar a la aparición de litiasis de repetición, nefrocalcinosis e insuficiencia renal precoz. Con la progresión de la insuficiencia renal, especialmente en pacientes sometidos a hemodiálisis (HD), el oxalato cálcico se deposita masivamente en los tejidos, denominándose a esto último oxalosis. El diagnóstico se basa en los antecedentes familiares, la presencia de urolitiasis y/o nefrocalcinosis, hiperoxaluria, depósitos tisulares de oxalato formando granulomas en formas avanzadas, análisis molecular de ADN y análisis enzimático si procede. Se requiere una alta sospecha diagnóstica, por lo que, desafortunadamente, en muchos casos se diagnostica tras su recidiva en el trasplante renal. El manejo conservador de la enfermedad (alta ingesta líquida, piridoxina e inhibidores de la cristalización) debe ser precoz, para retrasar el daño renal. El tratamiento con diálisis es inefectivo para depurar el exceso de oxalatos. Tras el trasplante renal suele observarse una rápida aparición de los depósitos de oxalato en el injerto y los resultados de esta técnica, salvo excepciones, son desalentadores. El trasplante hepático anticipado, o simultáneo con el trasplante renal cuando ya existe daño irreversible de este órgano, es la opción terapéutica de elección para corregir la enfermedad de base y suprimir la sobreproducción de oxalatos. Dada la condición de enfermedad rara y su heterogeneidad genética y clínica, no es posible obtener evidencias a través de ensayos clínicos aleatorizados. Por lo tanto, las recomendaciones las establecen grupos de expertos apoyados en publicaciones de acreditado rigor científico. En este sentido, un grupo de expertos europeos (OxalEurope) ha elaborado unas recomendaciones diagnósticas y terapéuticas publicadas en 2012.
Primary hyperoxaluria (PH) occurs due to an autosomal recessive hereditary disorder of the metabolism of glyoxylate, which causes excessive oxalate production. The most frequent and serious disorder is due to enzyme deficit of alanine-glyoxylate aminotransferase (PH type I) specific to hepatic peroxisome. As oxalate is not metabolised in humans and is excreted through the kidneys, the kidney is the first organ affected, causing recurrent lithiasis, nephrocalcinosis and early renal failure. With advance of renal failure, particularly in patients on haemodialysis (HD), calcium oxalate is massively deposited in tissues, which is known as oxalosis. Diagnosis is based on family history, the presence of urolithiasis and/or nephrocalcinosis, hyperoxaluria, oxalate deposits in tissue forming granulomas, molecular analysis of DNA and enzyme analysis if applicable. High diagnostic suspicion is required; therefore, unfortunately, in many cases it is diagnosed after its recurrence following kidney transplantation. Conservative management of this disease (high liquid intake, pyridoxine and crystallisation inhibitors) needs to be adopted early in order to delay kidney damage. Treatment by dialysis is ineffective in treating excess oxalate. After the kidney transplant, we normally observe a rapid appearance of oxalate deposits in the graft and the results of this technique are discouraging, with very few exceptions. Pre-emptive liver transplantation, or simultaneous liver and kidney transplants when there is already irreversible damage to the kidney, is the treatment of choice to treat the underlying disease and suppress oxalate overproduction. Given its condition as a rare disease and its genetic and clinical heterogeneity, it is not possible to gain evidence through randomised clinical trials. As a result, the recommendations are established by groups of experts based on publications of renowned scientific rigour. In this regard, a group of European experts (OxalEurope) has drawn up recommendations for diagnosis and treatment, which were published in 2012.
INTRODUCCIÓN
La hiperoxaluria primaria (HOP) es un desorden metabólico hereditario autosómico recesivo del metabolismo del glioxalato, que cursa con una producción excesiva de oxalato. El trastorno más frecuente se debe al déficit enzimático de alanin:glioxalato aminotransferasa (HOP tipo I) específico en el peroxisoma hepático1-4. La incidencia de HOP es difícil de estimar, dado que muchos casos son reconocidos tardíamente o bien nunca son identificados. Tiene una prevalencia estimada de 1-3 por millón de población y una tasa de incidencia de aproximadamente 1:100 000 nacidos vivos5,6. Se han descrito tasas mayores en poblaciones históricamente aisladas, como en las Islas Canarias, por un efecto fundador7. Afecta a menos del 1 % de la población pediátrica con enfermedad renal terminal, siendo más frecuente en poblaciones donde la consanguinidad es mayor8.
METABOLISMO DEL ÁCIDO OXÁLICO
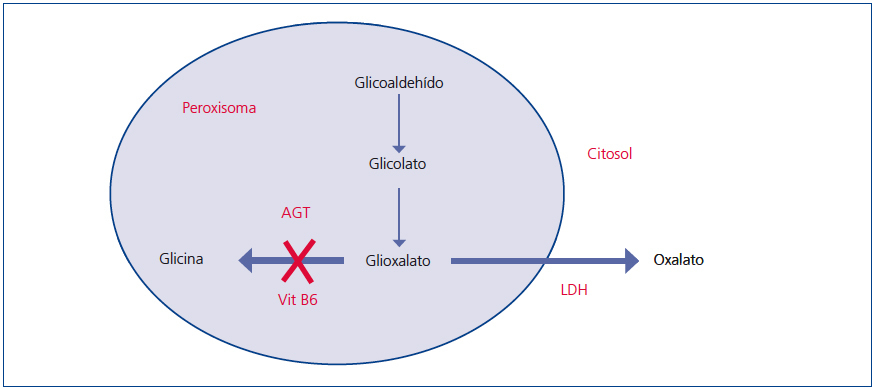
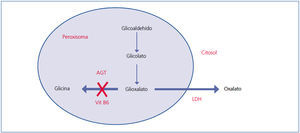
El oxalato es un ácido dicarboxílico (C2O4H2, peso molecular 90 Da) que proviene principalmente del metabolismo endógeno y solo una pequeña parte de la dieta. Se produce en el hígado a partir del glioxalato. Esta es una molécula generada en el metabolismo intermedio de la glicina, hidroxiprolina y glicolato. La detoxificación del glioxalato se realiza mayormente por la alanin-glioxalato amino transferasa (AGT) en el peroxisoma del hepatocito humano, convirtiendo el glioxalato en glicina. La vitamina B6 actúa como cofactor. En condiciones normales, solo parte del glioxalato es transformado en oxalato por la lactato dehidrogenasa (LDH)9 (figura 1). El oxalato no puede ser metabolizado por los mamíferos, no se liga a las proteínas y no se metaboliza. Es filtrado por el glomérulo y también secretado por el túbulo, eliminándose sin cambios por vía renal. La eliminación urinaria es normalmente inferior a 45 mg/día o 0,45 mmoles/l/1,73 m2 por día (mg se convierten a mmoles multiplicando por 0,01136)4,10,11.
Los defectos genéticos de las enzimas que metabolizan el glioxalato dan lugar a la sobreproducción hepática de oxalato, es decir, que estamos ante una enfermedad por exceso de producción. Se denomina HOP y el término de oxalosis se aplica a los depósitos tisulares.
CLASIFICACIÓN DE LOS ESTADOS HIPEROXALÚRICOS
La causa principal y más seria de hiperoxaluria son los defectos enzimáticos hereditarios, denominados HOP. En estos casos la excreción urinaria de oxalato es > 45 mg/día/1,73 m2 y con frecuencia > 801,12. Además, existen otras situaciones denominadas hiperoxalurias secundarias (HOS)13. Las causas de HOS son la ingesta abusiva de precursores del oxalato y el aumento de la absorción intestinal (hiperoxaluria entérica). En general, son formas menos graves (< 70 mg/dl) y no suelen desarrollar oxalosis sistémica. En la tabla 1 se describe la clasificación de estados hiperoxalúricos.
Hiperoxaluria primaria
Se trata de un desorden metabólico hereditario autosómico recesivo del metabolismo del glioxalato que resulta de una elevada producción hepática de oxalato2,14,15. Se han descrito tres tipos de trastornos moleculares. Los genes implicados son la alanin-glioxalato aminotransferasa (AGXT) para la HOP tipo 1 (HOP-I), que representa el 80 % de los pacientes que sufren HOP; la glioxalato reductasa/hidroxipiruvato reductasa (GRHPR) localizado en el cromosoma 10, para la HOP-II; y la 4-OH-2-oxoglutarato aldosala (HOGA1, también conocido como DHDPSL) localizado en el cromosoma 9, para la HOP-III16.
Hiperoxaluria primaria tipo I
La HOP-I es causada por el déficit de la AGT, enzima que cataliza la transaminación de L-alanina y glioxalato a piruvato y glicina. Se expresa específicamente en el hígado de los humanos y se localiza en el peroxisoma4,17-20. Su déficit produce incremento de glicolato y oxalato21. La clonación del AGXT cDNA y el conocimiento de su estructura tridimensional ha proporcionado información relevante sobre las funciones de la proteína y el efecto de los cambios en la secuencia de aminoácidos en la mayoría de las más de 150 mutaciones descritas de la HOP22-24.
Estas mutaciones dan lugar a distintas expresiones fenotípicas de la enfermedad por otros tantos mecanismos moleculares4. Se han descrito, básicamente, cuatro mecanismos distintos:
La investigación de los mecanismos moleculares, sin duda, derivará en el mejor conocimiento de las correlaciones genotipo-fenotípicas y en la investigación de nuevas opciones terapéuticas.
Hiperoxaluria primaria tipo II
La HOP-II o L-glycerico aciduria representa aproximadamente el 10 % de las HOP. El déficit de la enzima glioxalato/hidroxihipurato reductasa (GRHPR) induce un aumento de excreción urinaria de oxalato y L-glicerato. Estos pacientes sufren una elevación urinaria de oxalato más leve que en la HOP-I y son pocos los que desarrollan enfermedad renal terminal30.
Hiperoxaluria primaria tipo III
Ocurre en el 10 % de los casos de HOP; la mutación del gen HOGA1 produce el déficit de la enzima mitocondrial 4-hidroxi-2-oxoglutarato aldolasa que desdobla el 4-hidroxi-2-oxoglutarato en piruvato y glioxalato, que a su vez es transformado en oxalato por la LDH. Se presenta con un amplio rango de eliminación urinaria de oxalato, pero la progresión a enfermedad renal terminal no ha sido descrita16.
Hiperoxaluria secundaria
En la tabla 1 se resumen las causas de HOS.
Hiperoxaluria entérica
El oxalato proveniente de la dieta puede absorberse a lo largo de todo el tubo digestivo, tanto por difusión pasiva como por transporte activo. Todas las situaciones que producen malabsorción de sales biliares y ácidos grasos en el íleon pueden aumentar la absorción de oxalato31. Esto es debido a que al llegar al colon aumentan la permeabilidad de la mucosa colónica al oxalato, y además el calcio se une a los ácidos grasos, dejando oxalato libre y soluble, fácilmente absorbible32-36. En estudios experimentales también se ha demostrado que la acidificación del colon con lactulosa aumenta significativamente la excreción urinaria de oxalatos37.
De esta forma, las enfermedades inflamatorias intestinales que cursan con esteatorrea31,35 y las resecciones ileales amplias38-41 pueden desarrollar hiperoxaluria y litiasis, siempre que el colon esté intacto35. El aumento de prevalencia de litiasis renal en casos de fibrosis quística de páncreas, además de la hipocitraturia, se ha relacionado con el incremento de excreción renal de oxalato. De forma anecdótica, se han descrito casos de pérdida del injerto renal por oxalosis en pacientes trasplantados que desarrollaron esteatorrea secundaria a trastornos biliopancreáticos43.
Más recientemente, la hiperoxaluria y la nefrolitiasis han sido una complicación descrita en pacientes sometidos a cirugía bariátrica para el tratamiento de la obesidad mórbida44-46, requiriendo incluso diálisis crónica en dos casos46. Por tanto, es recomendable la vigilancia periódica de la oxaluria en el posoperatorio precoz y a largo plazo de estos pacientes.
Otro factor importante que puede influir en la absorción de oxalato es la descolonización colónica con bacterias metabolizadoras de oxalato, siendo el Oxalobacter formigenes el mejor estudiado (ver más adelante)47. La ausencia de estas bacterias produce hiperoxaluria por aumentar la absorción de oxalato. El empleo de antibióticos se ha postulado como un factor de su erradicación.
Ingesta abusiva de precursores
La ingestión intencional o accidental de etilenglicol, cuyo uso más frecuente es como anticongelante de motores, puede desarrollar crisis hiperoxalúricas graves48. La toxicidad del etilenglicol está relacionada con su biotransformación a ácido glicólico, causando acidosis normoclorémica grave, hiperoxaluria y oxalosis49,50.
El ácido ascórbico (vitamina C) es un precursor metabólico del oxalato51, habiéndose demostrado que su empleo abusivo puede inducir sobresaturación de oxalato cálcico y las complicaciones derivadas de su precipitación52-54.
PRESENTACIÓN CLÍNICA
Existe una considerable heterogeneidad en el patrón de presentación de la enfermedad y de su progresión a la insuficiencia renal55. Esta gran variabilidad clínica no se relaciona bien con las mutaciones del gen o con el grado de actividad enzimática residual. Además, hay factores inhibidores y promotores de la cristalización del oxalato que modulan el patrón genético favoreciendo su gran heterogeneidad clínica.
Las formas más graves aparecen en la HOP-I, habiéndose descrito formas infantiles que debutan en los primeros meses de vida y presentan una elevada mortalidad precoz. Las más comunes aparecen en torno a la segunda década de la vida y muchos pacientes se tratan como una litiasis recidivante, pasando desapercibido el diagnóstico durante años. De hecho, con frecuencia (30-60 %, según las series) el diagnóstico de HOP se realiza tras la recidiva de depósitos de oxalatos en el trasplante renal3,7,56,57. Esto es más desafortunado aún cuando se trata de un donante vivo, como ocurrió en un caso de nuestra serie de enfermos7. Existen variantes menos agresivas que se diagnostican en la edad adulta por la presencia de litiasis y/o nefrocalcinosis, que cursan con una supervivencia prolongada, aun en diálisis. Incluso hay pacientes de edad avanzada que no llegan a desarrollar enfermedad renal terminal2,3.
En los casos de HOP-II la enfermedad suele ser menos agresiva58 y solo una pequeña proporción de pacientes (aproximadamente el 20 %) desarrolla enfermedad renal terminal. Los casos de HOP-III son aún menos frecuentes (10 %) y más benignos, aunque la experiencia es más limitada en ellos16,59.
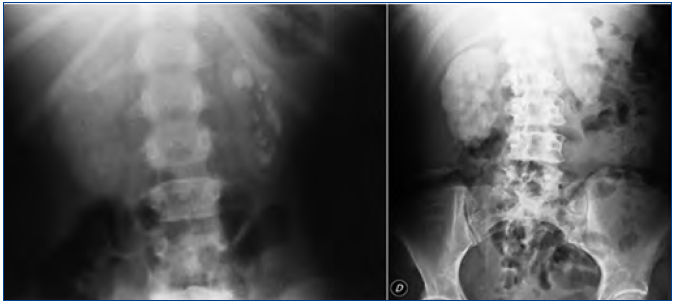
Las manifestaciones clínicas destacadas son nefrolitiasis recidivante, nefrocalcinosis, hematuria, infecciones urinarias e insuficiencia renal de rápida evolución. Conviene destacar que la nefrocalcinosis es característica y que aparece acompañando a la nefrolitiasis o bien de forma aislada (figura 2).
Aunque estamos ante una enfermedad con señas de identidad bien definidas, dada su rareza, lo habitual es que ante pacientes con nefrolitiasis de repetición el médico responsable investigue causas de HOS y las más comunes de nefrolitiasis. El diagnóstico diferencial debe apoyarse en las siguientes premisas:
- Interrogar y analizar las posibles causas de HOS: ingesta de precursores del glioxalato y enfermedades inflamatorias intestinales o resecciones intestinales amplias, incluida la cirugía bariátrica.
- Litiasis metabólicas: hipercalciuria (> 4 mg/kg/día sin hipercalcemia, o > 0,15 mg/dl filtrado glomerular [FG]); hipocitraturia (< 300 mg/24 horas, o < 0,17 mg/dl FG) e hiperuricosuria (> 750-800 mg/24 horas o > 0,45 mg/dl FG). No cursan con nefrocalcinosis ni desarrollan insuficiencia renal precoz.
- Estados hipercalcémicos: sarcoidosis, hiperparatiroidismo primario, hipervitaminosis D, síndrome leche-alcalinos. Pueden cursar con litiasis y nefrocalcinosis, pero obviamente su rasgo diferencial es la hipercalcemia, que no ocurre en la HOP.
- Acidosis renal tubular tipo 1: pueden desarrollar litiasis y nefrocalcinosis si cursan con hipercalciuria. No obstante, su seña de identidad es la acidosis metabólica hiperclorémica, la hipopotasemia y el desarrollo de insuficiencia renal es raro.
- Cistinuria: cristales hexagonales característicos en el sedimento, menos radiopacos, no desarrollan nefrocalcinosis y la presentación de enfermedad renal avanzada o terminal es rara.
Finalmente, basándonos en los datos clínicos, en la tabla 2 se describen las situaciones clínicas en que debe investigarse el diagnóstico de HOP, siempre en ausencia de datos que sugieran hiperoxaluria entérica o ingesta anómala de precursores.
Daño tisular en la hiperoxaluria primaria: oxalosis
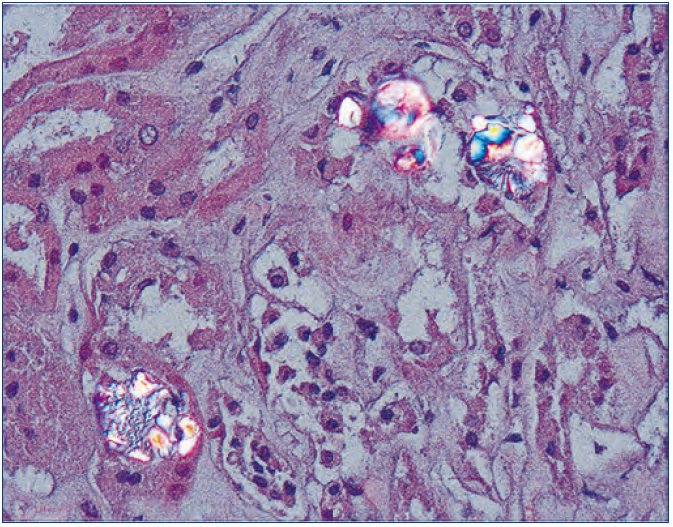
El riñón es el primer órgano afectado con agregados de oxalato cálcico en el espacio urinario (urolitiasis) y en el tejido renal (nefrocalcinosis) (figura 3), donde se desarrolla importante fibrosis intersticial e insuficiencia renal1,60,61. Una vez que el FG cae por debajo de 30-40 ml/min/1,73 m2, la eliminación urinaria no es capaz de mantener la oxalemia dentro de la normalidad (< 6 μmol/l) y puede superar el umbral de saturación de oxalato cálcico cuando los niveles son mayores de 30 μmol/l, produciéndose depósitos tisulares en forma de monohidrato y dihidrato62-64. A este fenómeno se lo denomina oxalosis y da origen a una importante respuesta inflamatoria en forma de granulomas alrededor de los cristales.
Se han identificado depósitos extrarrenales de oxalato cálcico en la mayoría de los tejidos y órganos, tales como retina, miocardio, vasos sanguíneos, piel, hueso y sistema nervioso3,61,62,65, si bien ocurren preferentemente donde la concentración de calcio es mayor. El desarrollo de cardiomiopatía y trastornos de conducción, vasculopatía con frecuentes necrosis distales66, retinopatía, sinovitis o enfermedad ósea de alto remodelado65 es una complicación tardía grave que conduce a una mortalidad precoz.
Una vez en hemodiálisis, los depósitos tisulares de oxalato progresan de forma espectacular, siendo el tejido óseo el órgano más afectado65,67. Los enfermos cursan con dolores óseos progresivos, invalidez y deformidades esqueléticas. En el examen radiológico, destaca el marcado incremento de la densidad ósea, el hueso pierde la trama ósea normal y se observan lesiones de alto remodelado, tipo osteítis fibrosa, pero de una gravedad inusual65,68.
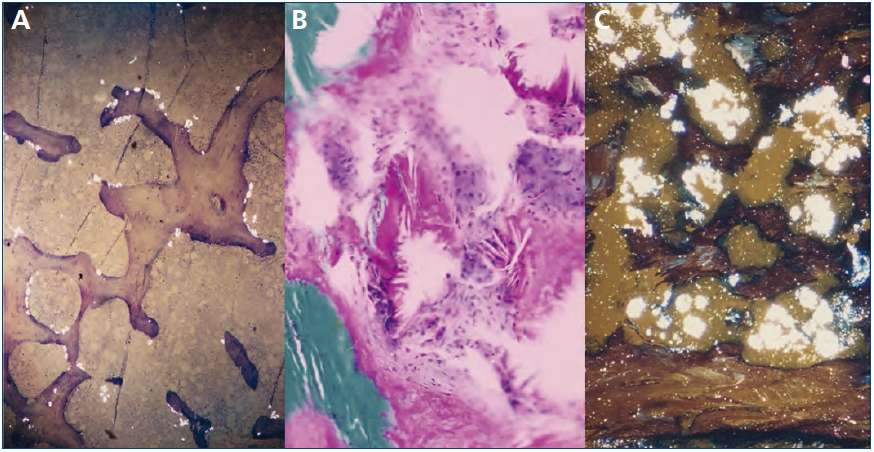
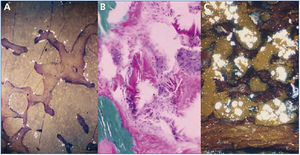
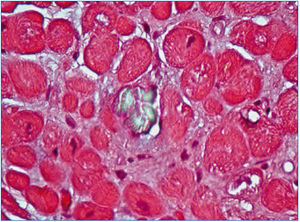
El estudio y seguimiento con biopsia ósea nos permitió conocer el punto de comienzo de la enfermedad ósea y seguir su progresión en hemodiálisis65. En la etapa prediálisis las manifestaciones clínicas o radiológicas de enfermedad ósea están ausentes, aunque pueden aparecer focos incipientes de oxalosis peritrabecular en el estudio histológico (figura 4 A). Este parece ser el sitio inicial de depósito, probablemente por ser la zona de mayor concentración de calcio. Al cabo de uno o dos años las lesiones evolucionan con inusitada gravedad. Existen evidencias de que la reacción celular al depósito de cristales es la que activa y acelera el remodelado óseo, simulando un hiperparatiroidismo. Las células gigantes multinucleadas que engloban los cristales pertenecen a la serie macrófago-monocítica, al igual que los osteoclastos. La acción de este grupo celular sobre las trabéculas óseas adyacentes a los granulomas pondría en marcha la resorción ósea. Por el normal acoplamiento osteoclasto-osteoblasto, estos se activan generando osteoide predominantemente no laminar. Los estudios dinámicos revelan una captación difusa de tetraciclinas en áreas de osteoide no laminar. Los cristales aparecen fundamentalmente en el espacio medular e invadiendo la superficie trabecular. Se agrupan en forma de estrella o roseta y a su alrededor se produce una reacción granulomatosa a cuerpo extraño con células gigantes multinucleadas, macrófagos, fibroblastos y fibrosis medular (figura 4 B). Al examen con luz polarizada, estos cristales son altamente refringentes, apareciendo fragmentados en subunidades (figura 4 C)65. Los niveles séricos de fosfatasa alcalina y parathormona suelen aparecer solo discretamente aumentados, en contraste con los casos del hiperparatiroidismo grave.
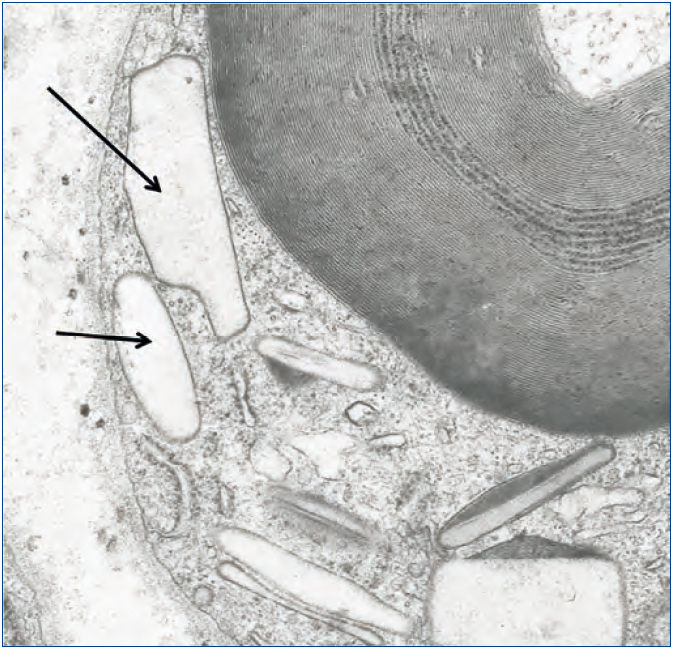
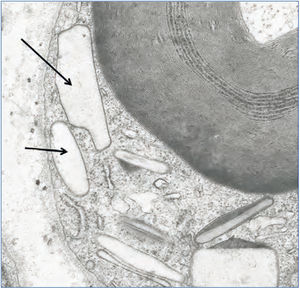
También hemos documentado depósitos de oxalato en otros tejidos. En un paciente con HOP y polineuropatía grave constatamos por microscopía electrónica depósitos de oxalato en las células de Schwann y en las vainas de mielina del nervio periférico a los pocos meses de comenzar a dializarse (figura 5). En otro paciente con patología cardíaca, el diagnóstico lo proporcionó la presencia de cristales de oxalato en biopsia subendocárdica (figura 6), que después fue confirmado con el análisis de ADN. En otros dos pacientes con HOP en hemodiálisis hemos observado una resistencia primaria y absoluta al tratamiento con eritropoyetina, a pesar del empleo de elevadas dosis de esta hormona. La oxalosis ósea grave produce una extensa ocupación de la médula ósea por tejido granulomatoso y fibrosis que afecta la eritropoyesis al desplazar el tejido hematopoyético69,70. Sin embargo, hay órganos como el hígado que no se han visto afectados, probablemente porque su concentración intracelular de calcio sea menor.
MÉTODOS DIAGNÓSTICOS
El diagnóstico precoz es crucial para prevenir la enfermedad renal terminal. Como apuntábamos previamente, una meticulosa historia familiar, junto a la determinación de oxaluria, es fundamental en casos de sospecha de HOP. La exploración del sedimento puede proporcionar información adicional con la presencia de cristales de oxalato cálcico monohidrato (whewellita, CaCO4.H2O) en forma de «pesa de gimnasio» y que debe diferenciarse de los típicos cristales romboidales de oxalato cálcico dihidrato71. Si la sospecha diagnóstica persiste, la determinación de glicolato en orina de 24 horas y la oxalemia pueden proporcionar información adicional.
Aunque los depósitos tisulares de oxalato suelen ser más tardíos, deben investigarse los efectos sobre el corazón (electrocardiograma y ecocardiograma), el fondo de ojo y el esqueleto55. La tomografía computarizada puede ser de gran ayuda para evaluar la extensión de las calcificaciones y los depósitos tisulares de oxalato.
El estudio histológico que demuestre la presencia de cristales de oxalato, especialmente en la biopsia renal, puede ser de utilidad en casos dudosos.
El análisis genético es obligado para confirmar el diagnóstico y tipificar la variante mutacional. Dado que solamente se requiere ADN de sangre periférica, el estudio de las mutaciones comunes se ha convertido en el siguiente escalón diagnóstico, una vez constatada la hiperoxaluria. La actividad enzimática de la AGT en tejido hepático puede servir de ayuda si el estudio genético no es esclarecedor72. El consejo genético y el diagnóstico prenatal mediante el análisis mutacional de los padres son recomendaciones pertinentes.
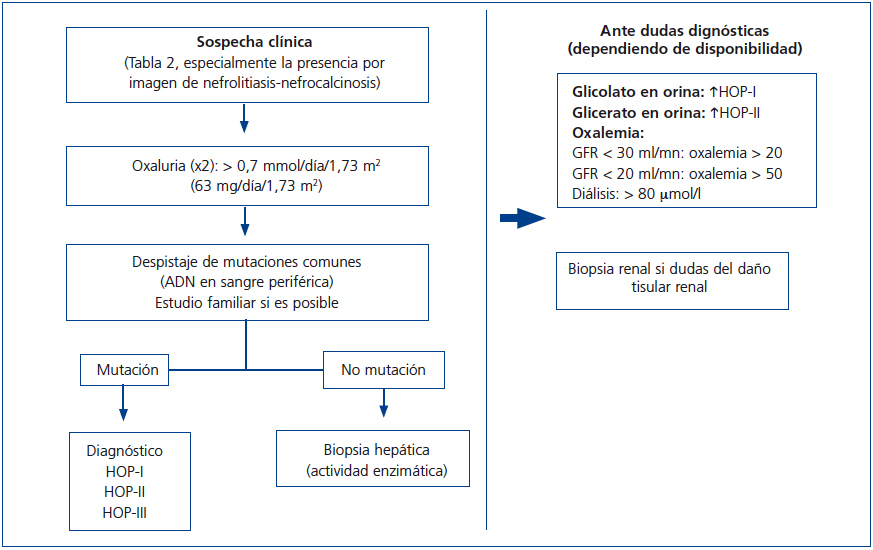
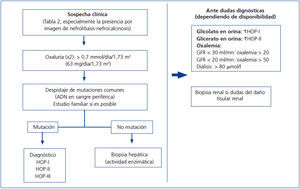
Recientemente ha sido publicado por las guías europeas un algoritmo para dirigir el diagnóstico de la HOP73. Por nuestra parte, en la figura 7 se expone un algoritmo diagnóstico orientativo, simplificado, que debe adecuarse a las circunstancias clínicas y demográficas individuales y a las disponibilidades del medio.
Métodos bioquímicos
La determinación urinaria de oxalato es el primer paso en el diagnóstico de HOP. Una oxaluria superior a 45 mg/día (> 0,5 mmol/1,73 m2/día) en, al menos, dos muestras de orina de 24 horas es característica de HOP, una vez que han sido excluidas causas de HOS1,12. Muestras superiores a 80-90 mg/día son muy sugerentes de HOP-I55.
La elevación de glicolato es propia de la HOP-I y, aunque tiene baja especificidad y sensibilidad diagnóstica, valores de glicolato urinario superiores a 45 mg/día (> 0,5 mmol/1,73 m2/día) son sugerentes de HOP-I12,55,74.
La elevación de niveles de L-glicerato es indicativa de HOP-II. La extrema rareza de las formas de HOP-II hace que la determinación de glicerato en orina solo pueda ser realizada en centros altamente especializados en el análisis de ácidos orgánicos75.
En lactantes y niños pequeños, donde la recogida de orina es difícil, una muestra aislada por la mañana puede ser orientativa. Estos resultados deben interpretarse conforme a los valores de referencia para la edad del paciente1,75,76.
Los valores séricos de oxalato permanecen en el rango de la normalidad hasta que el filtrado renal no cae por debajo de 45 ml/min aproximadamente. Dada la amplia variabilidad de valores, no se dispone de un umbral fiable para establecer el diagnóstico. Ante valores superiores a 50 µMol/l debe investigarse la enfermedad y valores superiores a 100 μMol/l son muy sugerentes de HOP55,62,76,77.
Diagnóstico histológico
La presencia de abundantes cristales de oxalato en la biopsia renal es indicativa de HOP, especialmente si aparecen en el intersticio, rodeados de una fuerte reacción inflamatoria en forma de granulomas de cuerpo extraño. No es infrecuente que estos depósitos aparezcan en un riñón trasplantado y den el diagnóstico de la enfermedad de base tardíamente7. En casos avanzados de pacientes en diálisis con imágenes de enfermedad ósea de alto remodelado, la biopsia ósea ha proporcionado el diagnóstico definitivo, mostrando las típicas reacciones granulomatosas rodeando los depósitos de oxalato7,65.
Análisis del ADN
El diagnóstico de HOP debe ser confirmado con el análisis del ADN del gen AGT (se conoce con el símbolo AGXT), que informa además sobre el tipo de mutación y polimorfismos que afectan al paciente18,20,23,78-80. Cuando nos enfrentamos a posibles mutaciones no comunes, es necesario el análisis genético de familiares directos. Dado que el análisis del ADN es un método no invasivo, se ha convertido en una exploración diagnóstica de primera línea ante la sospecha clínica y bioquímica de HOP, siendo utilizado además para el test prenatal y el diagnóstico de otros miembros de la familia, una vez conocida la mutación.
Diagnóstico enzimático
La biopsia hepática está indicada cuando no se encuentra la mutación en los genes AGXT, GRHPR o HOGA1 para excluir completamente las variantes conocidas de la HOP. Los niveles de actividad enzimática AGT en pacientes de HOP-I es bastante variable, sobre todo en los afectos de la mutación mistargeting, donde la AGT está presente en la mitocondria. En este caso el análisis inmunohistoquímico puede proporcionar la localización subcelular de la enzima81,82.
Diagnóstico prenatal
Dado que la AGT solo se expresa en el hígado, las determinaciones enzimáticas llevadas a cabo en el líquido amniótico no son útiles. Sin embargo, empleando el análisis de ADN en mujeres embarazadas y familiares se puede conocer el diagnóstico prenatal de las mutaciones más comunes83. Este procedimiento diagnóstico es el que más puede ganar al hacer posible el análisis del gen AGXT a partir de células del líquido amniótico o por biopsia de vellosidades coriales. Es previsible que estas técnicas moleculares se conviertan en el principal método diagnóstico de la HOP, al poder llevarse a cabo con ADN de cualquier célula del organismo y proporcionar información menos ambigua que la determinación de actividad enzimática en la biopsia hepática.
TRATAMIENTO
Medidas generales
El tratamiento inicial debe ser precoz y se dirige a disminuir la saturación urinaria de oxalato cálcico, aumentando la ingesta de líquidos y empleando inhibidores urinarios de la cristalización84. La ingesta de líquidos debe superar los 3 l/m2/día85 y el pH urinario debe mantenerse entre 6,2 y 6,8. Estas medidas generales son aplicables a todos los estados hiperoxalúricos y su eficacia dependerá de la magnitud del problema, por lo que en los casos de HOP severos suele ser muy limitada55.
Las pautas recomendadas de los inhibidores de la cristalización son las siguientes:
- Citrato potásico: forma complejos con el calcio, disminuyendo la precipitación de oxalato cálcico, y aumenta el pH urinario86. Se recomienda una dosis diaria de citrato potásico de 0,1-0,15 g/kg de peso12,55,86,87. En casos de insuficiencia renal el citrato potásico debe ser sustituido por citrato sódico88. Las tiazidas (en combinación con el citrato potásico) pueden ser un complemento útil para reducir la calciuria y aumentar el volumen urinario89.
- Ortofosfato: puede administrarse en dosis de 30-40 mg/kg/día90.
- Magnesio: es un conocido inhibidor de la mineralización y, además, reduce la absorción de oxalatos cuando se administra conjuntamente con los alimentos. La dosis recomendada91 es de 500 mg/día/m2.
El empleo de análogos de la vitamina D puede tener un efecto adverso en estos pacientes, al incrementar la absorción de calcio y, como consecuencia de ello, la sobresaturación de oxalato cálcico92.
Puede necesitarse un tubo de gastrostomía en lactantes y niños pequeños para alcanzar estos objetivos55.
Dieta
La reducción de la ingesta de oxalatos es poco útil en la HOP, dado que la fuente endógena de oxalato prevalece; sin embargo, puede resultar más útil en los casos de hiperoxaluria entérica. Los alimentos más ricos en oxalato son: frutos secos, ciruelas, chocolate, té, Coca-Cola, remolacha, fresas, etc.
No debe restringirse la ingesta cálcica, ya que a consecuencia de ello aumenta la absorción intestinal de oxalato93.
Ha de evitarse la ingesta excesiva de vitamina C, especialmente en pacientes en diálisis, ya que el ácido ascórbico puede metabolizarse directamente a oxalato cálcico52.
Enzimas degradadoras de oxalato
Si bien los mamíferos no pueden metabolizar el oxalato, otros seres vivos tienen enzimas como la oxalato oxidasa y la oxalato decarboxilasa, capaces de degradarlo y que podrían proporcionar una solución novedosa para prevenir la acumulación de oxalato en la HOP94,95. En este sentido, la colonización intestinal con Oxalobacter formigenes, bacteria que metaboliza el oxalato, ha mostrado resultados prometedores en modelos de ratas con HOP y en algún estudio piloto en pacientes47,96.
Para pacientes con alteración de la flora intestinal el uso de probióticos (alimentos con microorganismos vivos añadidos que permanecen activos en el intestino) puede resultar beneficioso. Estas bacterias utilizan el oxalato intestinal como fuente de energía y previenen su absorción. Se ha empleado una combinación de lactobacilos productores de ácido láctico en pacientes con hiperoxaluria entérica, tanto inflamatoria como secundaria a resecciones intestinales, demostrándose una reducción de la oxaluria y de la saturación oxalocálcica97,98. En modelos de ratas con dietas altas en oxalato, suplementos de Oxalobacter formigenes redujeron de forma significativa la oxaluria. También se ha observado que el Oxalobacter formigenes interactúa con la mucosa colónica favoreciendo la excreción/secreción de oxalato de la sangre al intestino99.
Piridoxina
La piridoxina (vitamina B6) es, tal vez, la única medida capaz de reducir de forma eficaz la producción de oxalato, pero solo aplicable a los casos de HOP-I. El pyridoxal 5 fosfato es una forma de vitamina B6 que actúa como cofactor de la AGT aumentando la transaminación del glioxalato (precursor del oxalato) a glicina. La dosis recomendada es de 5 mg/kg/día hasta un máximo de 20 mg/kg/día100. Sin embargo, la seguridad de estas dosis no es bien conocida y se han descrito casos de neuropatía sensorial, por lo que es recomendable no pasar de 1 g/día en adultos y corregir adecuadamente esta dosis para niños y lactantes. La respuesta se considera con un descenso de la oxaluria > 30 % después de un trimestre de tratamiento a máxima dosis2,3. Milliner et al.90 han comunicado la eficacia del tratamiento a largo plazo con ortofosfato y piridoxina, reduciendo la cristalización urinaria de oxalato cálcico en 25 pacientes con HOP y función renal conservada. El 75 % de los pacientes se mantenían sin diálisis a los 20 años de tratamiento, habiendo caído la función renal a un promedio de 1,4 ml/min/1,73 m2 por año. Desde la perspectiva molecular, hay un subgrupo de pacientes portadores de una o dos copias de G170Arg y Phe152Ile, cuya mutación produce un destino anómalo de la AGT a la mitocondria (mistargeting) y que ha demostrado una mejor respuesta a la piridoxina101-104.
Manejo quirúrgico de la urolitiasis
El manejo de la litiasis en la HOP tiene como peculiaridad la presencia concomitante habitual de nefrocalcinosis. El tratamiento con litotricia conlleva el riesgo de aplicar ondas de choque a áreas de nefrocalcinosis. Por ello el manejo endoluminal endoscópico suele ser de elección, mientras que la cirugía abierta es excepcional en este campo105,106.
Diálisis
Una vez que la insuficiencia renal está establecida, todas las medidas generales mencionadas suelen ser ineficaces y debe planificarse el tratamiento sustitutivo renal. La hemodiálisis y más aún la diálisis peritoneal han demostrado ser ineficaces para depurar el oxalato generado en la HOP107,108. El oxalato es una molécula pequeña, fácilmente filtrable, pero la cantidad de oxalato producida por el hígado en la HOP suele ser significativamente mayor (350-600 mg/dl diarios) que la capacidad de depuración de la diálisis convencional (80-180 mg/dl en adultos), resultando en un depósito diario de oxalato cálcico de 180-360 mg/día63,77,107-110. Idealmente, los niveles séricos deberían mantenerse por debajo de 30 µMol/l62. De estos trabajos se desprende que, para conseguir el balance de oxalato en hemodiálisis, las sesiones deberían prolongarse de 13 a 15 horas, lo que resulta impracticable. Por lo tanto, la diálisis debe ser empleada mientras el paciente se encuentra a la espera de un trasplante, aplicando protocolos de diálisis de alta eficacia e intensiva7,111.
Trasplante renal
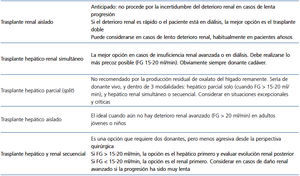
El empleo del trasplante renal aislado ha proporcionado resultados infaustos. Tras el implante, la recurrencia de la nefrocalcinosis es lo habitual, especialmente en casos de función renal retrasada o episodios de rechazo, por lo que debemos considerarlo como solución transitoria o de mantenimiento, mientras se planifica el trasplante hepático1,7,8,84,112,113. Con frecuencia el diagnóstico de HOP se ha realizado tras el trasplante renal, con la aparición de depósitos de oxalato y pérdida precoz del injerto por esta causa. Incluso estas situaciones se han documentado en casos desafortunados de donante vivo, donde no se había diagnosticado la HOP7.
Por lo tanto, dado el alto riesgo de desarrollo rápido de nefrocalcinosis, el trasplante renal aislado debería reservarse para formas más leves de HOP, con razonable buena respuesta a medidas conservadoras y vitamina B6. En estos casos, la insuficiencia renal aparece en edad más avanzada y progresa muy lentamente. El trasplante anticipado (en la etapa «prediálisis») es una decisión difícil, dada la incertidumbre de la velocidad de progresión del daño renal, siendo la mejor opción programarlo una vez iniciada la diálisis y tan precozmente como sea posible. La opción de un donante vivo está claramente desaconsejada ante el mal pronóstico del trasplante renal aislado, aunque puede considerarse ante situaciones excepcionales muy concretas.
La aparición de nefrocalcinosis en el injerto funcionante se debe a la rápida liberación de los depósitos sistémicos de oxalato cálcico. Por ello, es fundamental aplicar un protocolo agresivo pre y postrasplante inmediato, extremando el protocolo inmunosupresor, minimizando el tiempo de isquemia fría y manteniendo una diuresis fluida. Asimismo, debe suministrarse soporte dialítico precoz e intenso (diario) y añadir todas las medidas antilitogénicas descritas (piridoxina, inhibidores de la cristalización y diuréticos tiazídicos)7,114. Durante el seguimiento posterior es obligada la vigilancia periódica de la oxaluria y la potencial sobrecarga tisular de oxalato con medios diagnósticos de imagen.
Trasplante hepático y renal
Una vez que el diagnóstico de HOP es firme, el tratamiento prioritario y potencialmente curativo es el trasplante hepático7,115. Dado que lo habitual es estar ante un deterioro renal avanzado e irreversible, la indicación es el trasplante doble, hepático y renal1. El primer trasplante combinado hepático y renal efectuado con éxito para el tratamiento de la HOP fue publicado por Watts et al. en 1987116. Desde entonces un considerable número de publicaciones han puesto de manifiesto que el trasplante simultáneo hepático y renal es la opción terapéutica de elección en pacientes con daño renal avanzado, incluso en lactantes7,84,117-121. Datos obtenidos del Registro Europeo de Trasplante en HOP han demostrado una buena tasa de supervivencia del paciente: 80 % a los 5 años y 68 % a los 10 años119. Conviene resaltar que el trasplante debería programarse precozmente, con FG entre 15 y 30 ml/min/1,73 m2, para prevenir el depósito tisular de oxalatos.
También se han descrito otras alternativas de trasplante para situaciones especiales. La donación hepática parcial (split) de donante vivo conlleva riesgos al donante y la cantidad de hígado trasplantada puede ser insuficiente para prevenir la sobrecarga renal de oxalato del hígado remanente. Esta opción está actualmente desaconsejada, reservándose solamente para circunstancias excepcionales.
La alternativa de trasplante secuencial requiere dos donantes, pero es menos agresiva desde la perspectiva quirúrgica. Si el FG es mayor de 15-20 ml/min, la opción es el hepático primero y evaluar la evolución renal posterior. Si el FG es < 15-20 ml/min, la opción es el trasplante renal primero. Esta última puede considerarse en casos de daño renal avanzado, pero cuando la progresión ha sido muy lenta, habitualmente en enfermos mayores de 50-60 años.
Trasplante hepático anticipado
La rápida progresión de la oxalosis una vez que la insuficiencia renal se ha establecido indica que el trasplante hepático debería realizarse previo al desarrollo de esta, y así evitar la necesidad del doble trasplante. El trasplante hepático anticipado, es decir, antes de que haya un daño renal irreversible, debería ser la opción de elección en casos severos, si disponemos de un diagnóstico certero y precoz7,122-126. Esta alternativa habría de aplicarse con una función renal entre 20 y 50 ml/min115. Asimismo, basados en consideraciones previas sobre los niveles séricos de oxalato y su umbral de saturación, enfermos con oxalemias > 50 µmol/l si FG < 20 ml/min, o > 20 µmol/l si FG < 30 ml/min, deberían ser considerados candidatos potenciales para trasplante hepático62,64.
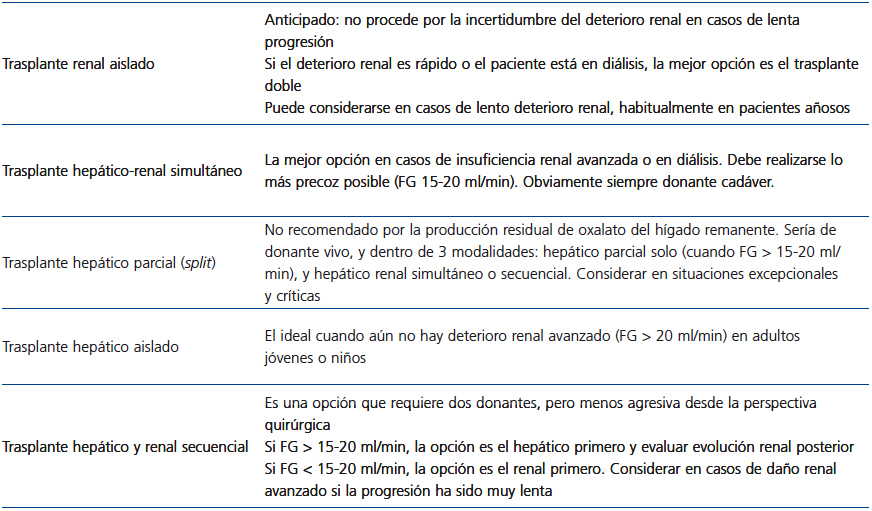
En la tabla 3 se resumen las modalidades de trasplante en la HOP y se sugieren las indicaciones potenciales.
Perspectivas de terapia molecular
Los recientes avances en los mecanismos moleculares de la enfermedad han hecho posible el desarrollo de modelos genéticos animales y la experimentación in vivo de vías terapéuticas eficaces y no invasivas32,127.
Terapia génica
Enfermedades hereditarias como la HOP podrían ser resueltas proporcionando la secuencia normal del gen a las células defectuosas. El problema radicaría en que los hepatocitos no alcanzados siguen generando oxalato que sobrecarga el riñón. El desarrollo de vectores virales con alto tropismo hepático y baja respuesta inmune puede contribuir a que la terapia génica sea una opción realista para la HOP en el futuro128.
«Chaperones» químicos y terapia de regulación de la «proteostasis»
El término «proteostasis» se emplea para definir la homeostasis de proteínas intracelulares. Por lo tanto, combina conceptos de plegamiento y estabilidad proteica, degradación, tráfico intracelular y expresión de los sistemas de regulación proteica. Esta compleja y altamente regulada red determina el destino intracelular de las proteínas129. Estudios recientes han demostrado que pequeños componentes orgánicos, denominados «chaperones», pueden estar implicados en las alteraciones del plegamiento de la proteína, en el destino mitocondrial incorrecto (mistargeting) y en los procesos de agregación y degradación de la AGT23,78,130, dando lugar a variantes de presentación de la HOP.
Trasplante celular
El trasplante hepático parcial ha fallado en proporcionar una suficiente reducción en la producción de oxalato como para prevenir la HOP-I119. Sin embargo, el trasplante de células hepáticas es una prometedora alternativa que está siendo explorada en defectos genéticos del metabolismo hepático, incluyendo la HOP-I131,132. El trasplante de hepatocitos es un procedimiento mínimamente invasivo, aunque el número de hepatocitos sanos inyectados en una única sesión no es suficiente para corregir una elevada producción de oxalato por parte de los hepatocitos nativos. En nuestros experimentos con modelos de ratones con HOP-I, calculamos que aproximadamente un 40 % de los hepatocitos necesitan ser transferidos para revertir el fenotipo hiperoxalúrico128.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Agradecimientos
Este trabajo ha recibido financiación de: PROYECTO FIS PI070963 (Instituto de Salud Carlos III, y Fondos FEDER), RedInRen RD12/0021/0008, y SAF2011-23933 (proyecto del MINECO). Un autor (A. Torres) es miembro de RedInRen (Red de Investigación Renal). Un autor (E Salido) es miembro de CIBERER (Centro de Investigación Biomedica en Red de Enfermedades Raras).
Tabla 1. Clasificación de los estados hiperoxalúricos.
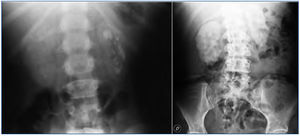
Figura 2. Litiasis renal múltiple y nefrocalcinosis en pacientes con hiperoxaluria primaria. Radiografía simple de abdomen.
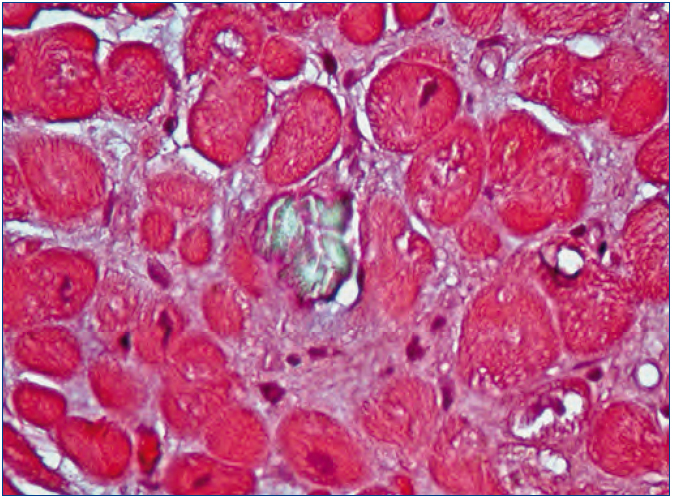
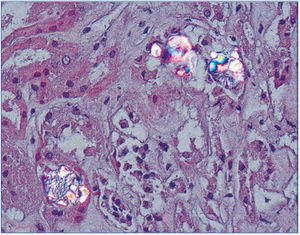
Figura 3. Depósitos de oxalato cálcico en el espacio urinario y en el tejido renal (HE, microscopía de polarización, 200X).
Figura 4. Oxalosis ósea.
Figura 5. Depósitos de oxalato en células de Schwann.
Figura 6. Depósitos de oxalato en tejido subendocárdico (HE, microscopía de polarización, 20X).
Figura 7. Algoritmo diagnóstico de la hiperoxaluria primaria.
Tabla 3. Modalidades de trasplante en la hiperoxaluria primaria y potenciales indicaciones.
Tabla 2. Parámetros clínicos ante los que debe investigarse el diagnóstico de hiperoxaluria primaria.
Figura 1. Clasificación de los estados hiperoxalúricos.