La infección por el virus de la hepatitis C (VHC) es considerada un factor que reduce la supervivencia del paciente y del injerto en trasplante renal (TR). La disponibilidad de los nuevos antivirales de acción directa (AAD), muy eficaces y con un excelente perfil de seguridad, está permitiendo erradicar el VHC de los pacientes con enfermedad renal, y ello supone un revolucionario cambio radical en la evolución natural de esta infección, hasta ahora sin un tratamiento eficaz y seguro por la contraindicación del interferón en los trasplantados renales.
La eficacia de algunos AAD para todos los genotipos, incluso en pacientes con insuficiencia renal, constituye una enorme contribución para erradicar el VHC en la población con TR al margen del genotipo, del grado de insuficiencia renal, de la progresión de la hepatopatía y de la existencia previa de tratamiento anti-VHC.
Todo ello está planteando, aunque con controversias, la posibilidad de utilizar riñones de donantes infectados VHC+ para trasplante en receptores no infectados y poder tratarse y curarse tras el TR precoz, aumentando así el pool total de riñones para TR.
Hepatitis C virus (HCV) infection is a factor that reduces the survival of the patient and the graft in renal transplant (RT). The availability of directly acting antivirals agents (DAAs), very effective and with an excellent safety profile, it allows eradicate HCV from patients with kidney disease, and this is a revolutionary radical change in the natural evolution of this infection, until now without effective and safe treatment for the contraindication use of interferon in kidney transplant patients.
The efficiency of some DAAs for all genotypes, even in patients with renal insufficiency constitutes a huge contribution to eradicate HCV in the RT population independently the genotype, severity of kidney failure, progression of liver disease and previous anti HCV therapy.
All this is raising, although with controversies, the possibility of use kidneys from infected HCV+ donors for transplant in uninfected receptors and can be treated successfully in the early post-TR, thus increasing the total “pool” of kidneys for RT.
La infección por el virus de la hepatitis C (VHC) es la principal causa de enfermedad hepática en el trasplante renal (TR) y comporta un riesgo aumentado de enfermedad hepática crónica, cirrosis y hepatocarcinoma1-5. Además, la infección por VHC es un factor independiente de riesgo para pérdida del injerto y muerte del paciente1,2,5. Sin embargo, la supervivencia de los pacientes VHC+ es significativamente mayor en los trasplantados comparado con los pacientes VHC+ en lista de espera1. Por tanto, el TR es el mejor tratamiento para los enfermos VHC ARN+ con insuficiencia renal crónica terminal (IRCT). También, el TR en pacientes VHC+ con riñones de donantes VHC+ ha demostrado ser eficaz y seguro a largo plazo5.
Desde 2014, los nuevos antivirales de acción directa (AAD) han conseguido la curación de la infección en casi el 100% de los casos con un esquema sin interferón (INF), por lo que la erradicación del VHC está cambiando la historia natural de esta infección6-8. Por tanto, es el momento de exponer la problemática de la infección por VHC en TR y detallar los datos más sobresalientes y actuales de los AAD.
Revisamos la relación entre la infección por VHC y el TR, el manejo de los pacientes en diálisis y trasplante en la era INF, los AAD y su impacto en los pacientes en lista de espera y con TR, y también las nuevas posibilidades de TR con riñones de donantes VHC+.
Hepatitis C y trasplante renalImpacto del trasplante renal en la infección por VHCEnfermedad hepática por la infección por VHCLos pacientes VHC+ tienen un riesgo aumentado de progresión a enfermedad hepática crónica, y aunque esta suele ser lenta y no ocurre en todos los pacientes1,9-14, existe un riesgo mayor de cirrosis y hepatocarcinoma comparado con los pacientes TR sin VHC.
Exceptuando la hepatitis fibrosante colestásica, en el 1,5% de los casos15 el curso inicial de la infección por VHC en el postrasplante es benigno, mientras que las alteraciones bioquímicas e histológicas aparecen a largo plazo1.
Se sabe que con el TR la inmunosupresión recibida se asocia a un aumento de la replicación viral y a la progresión de la fibrosis hepática. Según un estudio retrospectivo, la progresión anual de la actividad necroinflamatoria y de la fibrosis hepática valorada mediante biopsias hepáticas secuenciales (periodo de 7,1±4,0años) en 28pacientes TR VHC+ comparado con 28 pacientes VHC+ inmunocompetentes, fue significativamente mayor en los pacientes TR VHC+10. Durante el seguimiento, la evolución a cirrosis fue del 21,4% en los pacientes TR VHC+ frente al 3,6% en el grupo inmunocompetente, mientras que la mortalidad hepática fue significativamente mayor en los pacientes TR VHC+ (10 vs 0%, p<0,05)10.
Una mayor severidad de la hepatopatía en el momento del trasplante, la coinfección con el virus de la hepatitisB (VHB), un mayor tiempo de evolución del trasplante y el tratamiento con antilinfocitarios se han relacionado con el desarrollo de enfermedad hepática crónica1,3,16-18.
Influencia de la hepatitis C en el trasplante renalRechazo agudoSegún la literatura, el riesgo de rechazo agudo en los pacientes TR VHC+ es motivo de controversia1. Nuestro grupo ha reportado que la infección por VHC induce un estado de inmunodeficiencia basado en una reducción en el porcentaje de linfocitosThelper y una alteración en la respuesta proliferativa a mitógenos de los linfocitosT19. Estas alteraciones pueden explicar una incidencia disminuida de rechazo agudo que ha sido descrita por algunos autores. Así, Roth et al.14 han descrito una incidencia de rechazo agudo del 14,5% en los pacientes VHC+ con seguimiento durante 20años. En un estudio español que comparaba los pacientes TR VHC+ durante los periodos 1990-1994 vs 1998-2002, la tasa de rechazo agudo fue mayor en la última época (25% vs 20,6%, p=0,01), probablemente por el hecho que en el segundo periodo había un mayor número de retrasplantes y de hiperinmunizados19.
Infecciones secundariasLos pacientes TR VHC+ tienen una incidencia mayor de infecciones postoperatorias y de infecciones graves del sistema nervioso central, pulmonares y bacteriemia, que los TR VHC−1,2,20. De hecho, la infección es la segunda causa de muerte en estos pacientes, por delante de la hepatopatía21. Un estudio prospectivo y multicéntrico español realizado entre 2003 y 2005 no encontró diferencias entre los pacientes VHC+ frente a los VHC− en la incidencia media de infección, aunque los receptores VHC+ tuvieron una incidencia más alta de bacteriemia y de infecciones del tracto urinario. En este análisis, la presencia de la infección por VHC fue un factor de riesgo independiente únicamente para la bacteriemia22. Por otra parte, en un estudio retrospectivo de casos y controles nuestro grupo demostró que la infección por VHC es un factor de riesgo independiente para el desarrollo de tuberculosis post-TR23.
Neoplasias extrahepáticas postrasplanteEl registro de Australia y Nueva Zelanda ha reportado que las neoplasias representan la segunda causa de muerte en los pacientes VHC+, por delante de las causas hepáticas24. Aunque deben confirmarse por otros estudios, estos hallazgos sugieren que la infección por VHC puede jugar un papel en la patogénesis de la enfermedad proliferativa postrasplante y de otras enfermedades hematológicas, como el mieloma múltiple25-28. En este sentido, se ha demostrado un efecto directo de la infección por VHC en la carcinogénesis de las células linfoides29, así como el control del linfoma de Hodgkin después del tratamiento antiviral30. Por ello, se recomienda una estrecha vigilancia para descartar neoplasias en los trasplantados renales VHC+.
Diabetes de novo en el trasplante renal (NODAT)En un metaanálisis que incluía 30.099 pacientes con TR se constató un marcado incremento del riesgo de NODAT en los pacientes VHC+30. Además, la administración de tacrolimus en los pacientes VHC+ se asocia a un riesgo aumentado de NODAT31.
La resistencia a la insulina por la acción inhibitoria del virus en las vías regulatorias en el hígado, parece ser el mecanismo patogénico más aceptado para explicar la relación entre la infección por VHC y la NODAT.
Desde un punto de vista práctico, la actitud más racional puede ser disminuir las dosis de tacrolimus o aplicar estrategias eliminando los esteroides. De cualquier manera, el uso de fármacos que favorecen la NODAT debe ser balanceada para optimizar el tratamiento antirrechazo minimizando el riesgo de hiperglucemia1.
Enfermedad renal inducida por la infección por VHCGlomerulonefritis recurrentes y de novoLas lesiones glomerulares se han descrito en enfermos con infección por VHC en riñones nativos y riñones trasplantados32,33. Después del TR, se han descrito glomerulonefritis membranoproliferativa (GNMP) recurrente o de novo crioglobulinémica o no crioglobulinémica, glomerulonefritis membranosa (GNM), glomerulopatía aguda postrasplante, microangiopatía trombótica y glomerulopatía del trasplante (GNT)34-37. De hecho, la infección por VHC es un predictor del desarrollo de proteinuria en el TR38. El cuadro más frecuente es la GNMP, usualmente recurrente después de un re-trasplante, seguido de la GNM32,34.
La patogénesis de la GNMP y la GNM está basada en el depósito de inmunocomplejos que contienen ARN viral en los glomérulos, paradójicamente en enfermos inmunosuprimidos32,33.
Glomerulopatía del trasplanteUn estudio del grupo de Boston publicó los resultados de 25 pacientes con GNT diagnosticada por microscopia óptica, encontrando que existen tres etiologías que se solapan: el rechazo agudo humoral, la hepatitisC y la microangiopatía trombótica. Estos autores interpretaron que la GNT es un patrón de lesión histológica con diferente pronóstico e implicaciones terapéuticas39. Por lo tanto, la GNT no es sinónimo de rechazo crónico humoral, sino que otras etiologías pueden explicarla, como la infección por VHC. De hecho, nuestro grupo ha desarrollado un trabajo en pacientes GNT, diagnosticada por microscopio electrónico, demostrando que la infección por VHC es un factor de riesgo independiente para la GNT40. Además, los enfermos con GNT e infección por VHC perdieron el injerto más rápidamente que aquellos con GNT y VHC−. Si esta relación se explica por el riesgo inmunológico aumentado en los pacientes VHC+ o por la influencia directa del virus en el glomérulo, necesita ser aclarado.
Impacto de la infección por VHC en las figuras de supervivenciaSupervivencia del pacienteA pesar del peor pronóstico de los pacientes con infección activa por VHC, en los pacientes VHC+ el TR ofrece ventajas en la supervivencia respecto a los pacientes VHC+ en lista de espera para TR que siguen en diálisis41-45.
A pesar de las ventajas del TR frente a la diálisis, la supervivencia a largo plazo del paciente VHC+ tras el TR es significativamente inferior que la de los pacientes VHC−1,46-51. Un estudio español ha reportado una supervivencia de los pacientes VHC+ a 10años del 77,5% vs 84,5% en los VHC−46. En dos metaanálisis, Fabrizi et al.52 y Rostami et al.53 demostraron claramente que los pacientes VHC+ tienen un riesgo aumentado de muerte tras el TR. De forma consistente con las revisiones previas, todas las causas de mortalidad fueron significativamente más elevadas en los pacientes VHC+, siendo la enfermedad cardiovascular la más frecuente. De hecho, la infección por VHC fue un factor de riesgo para el desarrollo de arterioesclerosis54. Las otras causas de muerte fueron, por orden de frecuencia, infecciones, tumores y enfermedad hepática. El impacto de la infección por VHC en todas las causas de mortalidad ha sido explorado, mostrando una odds ratio para la mortalidad hepática y cardiovascular de 11,6 (IC95%: 5,54-24,4), p<0,0001, y 2,15 (IC95%: 1,58-2,91), p<0,001, respectivamente55.
La supervivencia del paciente VHC+ con trasplante combinado hepatorrenal (TCHR) es mayor que la observada en el trasplante secuencial «TH posterior a TR» o «TR posterior a TH»56. En los pacientes con coinfección por VHC y HIV, la infección por VHC es el mayor determinante de la supervivencia del paciente, sugiriendo que el tratamiento del VHC es prioritario en estos pacientes57.
Supervivencia del injertoVarios estudios, la mayoría retrospectivos, han demostrado que los pacientes VHC+ tras el TR muestran una supervivencia significativamente menor que los VHC−1,2,17,48-52. Los estudios españoles de la infección por VHC en el TR con la base de datos de la «Nefropatía Crónica del Injerto» demuestran que a 10años la supervivencia del injerto censurando la muerte fue del 69% en los VHC+ vs 79% en los VHC−46. En un metaanálisis, la presencia de anticuerpos anti-VHC mostró también un factor de riesgo independiente para la supervivencia del injerto44 (riesgo relativo 1,56 [IC95%: 1,35-1,80], p=0,019) en 4 de los 8 estudios incluidos en el análisis52. Este hallazgo ha sido confirmado en una revisión sistemática reciente en base a 18estudios observacionales53.
La proteinuria por FIAT, las glomerulonefritis asociadas al VHC, la GNT y la NODAT pueden contribuir a la disminución de la supervivencia del injerto. De acuerdo con ello, la viremia VHC se ha relacionado con mayor frecuencia de fibrosis y atrofia intersticial (FIAT) y una menor supervivencia del injerto de los VHC ARN+ en el momento del TR58,59.
La supervivencia del injerto en el TCHR es mejor que la obtenida con el TR después del TH o del TH tras el TR56. En los pacientes coinfectados VHC-HIV la supervivencia del injerto es más baja en comparación con los TR HIV+57.
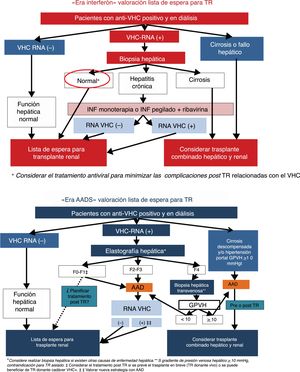
Manejo y tratamiento VHC en diálisis o trasplante renal en la etapa terapéutica basada en interferónManejo terapéutico del VHC en diálisis «era interferón»Hasta el año 2014, antes de la disponibilidad de los nuevos antivirales de acción directa (AAD), los esquemas de tratamiento frente al VHC en los pacientes con IRCT se han basado en INF±Rib60 (tabla 1).
Tratamientos frente al VHC aprobados en España
| Hasta agosto de 2014: |
| • Biterapia con interferón más ribavirina para los genotipos 1, 2, 3, 4, 5 y 6 |
| • Triple terapia (interferón pegilado, ribavirina y un inhibidor de la proteasa del VHC antiviral de acción directa de primera generación boceprevir (Victrelis®) o Telaprevir (Incivo®) solo para el genotipo 1 del VHC |
| Desde el día 1 de agosto de 2014 para genotipo 1 y 4: |
| Triple terapia con simeprevir (Olysio®) más interferón pegilado y ribavirina |
| En noviembre de 2014 la Agencia Española del Medicamento (AEMPS) publicó el informe de posicionamiento terapéutico de simeprevir (IPT) |
| En noviembre de 2014 la AEMPS publicó el IPT de sofosbuvir (Sovaldi®) |
| El 20 de febrero de 2015 la AEMPS publicó el IPT de daclatasvir (Daklinza®) |
| El 20 de marzo de 2015 la AEMPS publicó el IPT de: |
| • Ledipasvir/sofosbuvir (Harvoni®) |
| • Viekirax® (ombitasvir / paritaprevir / ritonavir) y Exviera® (dasabuvir) |
| El 3 de febrero 2017 la AEMPS publicó el IPT de: |
| • Elbasvir y grazoprevir (Zepatier®) |
| El 8 de junio 2017 la AEMPS publicó el IPT de: |
| • Sofosbuvir y velpatasvir (Epclusa®) |
| El 12 de marzo 2018 la AEMPS publicó el IPT de: |
| • Glecaprevir y pibrentasvir (Marivet®) |
| Aprobado por la FDA en julio 2017, pendiente de su aprobación en España: |
| • Sofosbuvir / velpatasvir / voxilaprevir (Vosevi®) |
Tal como se ha dicho, la infección por VHC en TR se asocia a una peor supervivencia del paciente e injerto a largo plazo respecto a los pacientes sin infección24, y dado el riesgo del INF a inducir disfunción del injerto renal61,62, hasta la disponibilidad de los recientes regímenes sin INF, las guías internacionales han recomendado tratar la infección por VHC antes de someterse a TR1,63.
A pesar de las recomendaciones de tratar la infección por VHC antes del TR, en la era interferón solo el 1% de los pacientes VHC ARN+ en hemodiálisis reportados en el estudio DOPPS recibieron tratamiento antiviral con INF, un porcentaje muy bajo probablemente en contexto de la mala tolerancia y la pobre eficacia de este antiviral64.
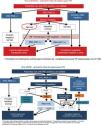
Las guías internacionales han recomendado que los pacientes con infección activa VHC deben ser evaluados para el grado de fibrosis, y hasta hace pocos años solo se disponía de la biopsia hepática para tal evaluación. De la misma manera, en los pacientes con cirrosis se debe determinar si existe hipertensión portal, y si se constata un gradiente de presión venosa hepática ≥10mmHg y/o la presencia de varices esofágicas, las guías de consenso lo han considerado como una contraindicación para TR aislado debiéndose en estos casos considerar la posibilidad de TCHR65 (fig. 1).
El tratamiento antiviral de los pacientes dializados con infección activa VHC en la era interferón ha consistido en INF-pegilado durante 48semanas para los genotipos1 y4, y durante 24semanas para los genotipos2 y3. Durante el tratamiento con INF los pacientes se excluían de lista de espera1, y una vez aclarado el virus tras finalizar la terapia se recomendaba esperar al menos 28días antes de recibir un TR1,66.
Un metaanálisis de 287 pacientes tratados con INF y Rib ha mostrado una respuesta viral sostenida (RVS) del 60%, con un 18% de abandonos del tratamiento por los efectos secundarios, especialmente anemia e infecciones67. Estos datos supusieron que en la etapa pre-AAD el INF-pegilado y Rib debería ser el tratamiento estándar en los enfermos en diálisis.
Los pacientes en los que no se conseguía aclarar el virus ARN con el tratamiento antiviral podían ser incluidos en la lista de espera para TR, dado que la expectativa de vida de los pacientes con replicación por VHC es superior si se trasplantan que si permanecen en diálisis41-44,68.
Tratamiento antiviral postrasplante renal «era interferón»Un metaanálisis de 16 estudios clínicos demostró que la RVS sumatoria fue del 34% y el abandono del tratamiento, del 32%67.
El efecto secundario más frecuente y grave del tratamiento con INF en los pacientes con TR fue la disfunción del injerto, generalmente como rechazo agudo corticorresistente, que requería la suspensión del tratamiento1,56,69.
Las guías KDIGO habían aconsejado en ese momento el uso de terapias con INF en la etapa de trasplante solo en los casos en que los beneficios de la terapia antiviral fueran superiores a los riesgos, como es el caso de la hepatitis fibrosante colestásica, la cirrosis de evolución rápida o la GNMP crioglobulinémica de novo o recurrente1.
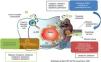
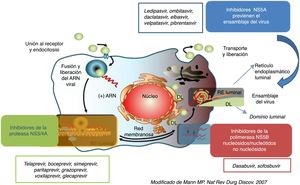
Antivirales de acción directa en el tratamiento del VHCEstrategias terapéuticas frente al VHC con AADEl gran avance en el conocimiento del ciclo vital del VHC y de las características estructurales de las proteínas de este virus ha facilitado el desarrollo de nuevos AAD que actúan de forma específica sobre el ciclo vital del VHC70 (fig. 2).
Según la fase del ciclo vital sobre la que actúa el AAD impidiendo la replicación del VHC, se clasifican en inhibidores de la proteasa (IP), inhibidores del complejo de replicación NS5A e inhibidores de la polimerasa NS5B71.
Desde el año 2014 se han comercializado los nuevos AAD60 (tabla 1), consiguiendo en la población general una RVS superior al 95%.
Los primeros AAD utilizados para el tratamiento del VHC fueron los IP NS3/4A telaprevir72 y boceprevir73, que se aprobaron para tratar el genotipo1 del VHC en al año 2011 en combinación con INF-pegilado y Rib8. Aunque la tasa de RVS alcanzaba el 75% de los casos, el coste, los efectos secundarios y la complejidad en su administración han limitado de manera sustancial las ventajas de estos antivirales.
El lanzamiento de la primera generación de IP NS3/4A ha servido de trampolín para el desarrollo de nuevos AAD, tales como los inhibidores de la polimerasa NS5B, los inhibidores del complejo de replicación viral NS5A y los IP de segunda generación con un perfil de eficacia y de seguridad muy mejorados7,8,74.
En 2013 en Estados Unidos y en febrero de 2014 en Europa se aprobaron tres nuevos AAD simeprevir (IP-NS3/NS4A), daclatasvir (Inhibidor-NS5A) y sofosbuvir (inhibidor polimerasa-NS5B). A partir de este momento, la disponibilidad de estos nuevos AAD ha permitido desarrollar diferentes estrategias terapéuticas sin INF con un buen perfil de seguridad y gran eficacia frente al VHC, hecho que ha supuesto un gran avance en el tratamiento del VHC, y en especial para los pacientes en los que el INF está contraindicado, como ocurre en TR.
El esquema antiviral revolucionario de esta inicial etapa terapéutica frente al VHC ha consistido en combinar 2 o 3 de estos nuevos fármacos por vía oral, con o sin Rib pero sin INF, durante 12-24semanas dependiendo de factores como el genotipo, el grado de fibrosis hepática, el antecedente previo de tratamiento anti-VHC y la función renal, consiguiendo una RVS del 90-100%, con un buen perfil de seguridad75,76.
La siguiente etapa en el desarrollo de nuevas estrategias frente al VHC a partir del año 2015 ha consistido en la utilización de combinaciones de AAD sin INF ni Rib a raíz de la aprobación de nuevas formulaciones60 (tabla 1).
La combinación fija de sofosbuvir (SOF) con ledipasvir (LDV) se aprobó por la FDA en octubre de 2014, y en España en marzo del 2015. En los últimos 3años han seguido incorporándose nuevos AAD, tales como elbasvir (EBR), glecaprevir (GLE), asunaprevir, paritaprevir (PTV), grazoprevir (GRA), pibrentasvir (PIB), velpatasvir (VEL), ritonavir (r), ombistavir (OBV), dasabuvir (DSV) y voxilaprevir (VOX)60,75 (tabla 1).
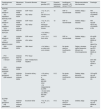
El rápido avance en la investigación en este campo ha permitido en la actualidad ampliar la cobertura terapéutica a todos los genotipos del VHC (pangenotipo), reducir la duración del tratamiento, mejorar el perfil de seguridad y minimizar interacciones farmacológicas77 (tabla 2).
Combinaciones recomendadas para el tratamiento frente al VHC (población general)
| Combinaciones anti-VHC | Mecanismo antiviral | Excreción fármaco | Eficacia genotipo (GT) | Duración tratamiento (semanas) | Insuficiencia renaleGF < 30 ml/min/1,73 m2 | Efectos secundarios más frecuentes | Posología |
|---|---|---|---|---|---|---|---|
| SOF/VEL | |||||||
| SOF sofosbuvir | Inhibidor NS5B | SOF→renal | →1a, 1b, 2, 4, 5, 6 | 12 | SOF no recomendado | Cefalea, fatiga y náuseas | 400 mg/100 mg una tableta al día |
| VEL velpatasvir | Inhibidor NS5A | VEL→biliar | Útil GT3 si no cirrosis | ||||
| SOF/VEL/VOX | |||||||
| SOF sofosbuvir | Inhibidor NS5B | SOF→renal | →1a, 1b, 2, 3, 4, 5, 6 | 12 | SOF no recomendado | Cefalea, fatiga y náuseas | 400 mg/100 mg/10 mg una tableta al día |
| VEL velpatasvir | Inhibidor NS5A | VEL→biliar | Indicación para GT3 con cirrosis | ||||
| VOX voxilaprevir | Inhibidor NS3-4A | VOX:Diarrea | |||||
| SOF/LDV | →1b. Naïve y no naïve | ||||||
| SOF sofosbuvir | Inhibidor NS5B | SOF→renal | →1a, 4, 5, 6. Solo naïve | 8-12 | SOF no recomendado | Cefalea, fatiga y náuseas | 40 mg/90 mg una tableta al día |
| LDV ledipasvir | Inhibidor NS5A | LDV→biliar | |||||
| OBV/PTVr+DSV | OBV/PTVr | ||||||
| OBV ombitasvir | Inhibidor NS5A | OBV→fecal | →1b. Naïve y no naïve (con o sin cirrosis) | 8-12 | No ajuste dosis en insuficiencia renal | Fatiga y náuseas: vigilar interacción ritonavir con inmunosupresores | 50 mg/75 mg/12,5 mg una tableta al día |
| PTV partaprevir | Inhibidor NS3-4A | PTV→fecal | + | ||||
| r ritonavir | Inhibidor CYP3A | DSV→metabolismo hepático | DSV 250 mg dos veces al día | ||||
| DSV dasabuvir | Inhibidor NS5B | ||||||
| GZR/EBR | |||||||
| GZR grazoprevir | Inhibidor NS3-4A | Excreción biliar y fecal | →1A naïve y no naïve | 8-12 | No ajuste dosis en insuficiencia renal | Cefalea, fatiga, elevación transaminasas | 100 mg/50 mg una tableta al día |
| EBR elbasvir | Inhibidor NS5A | si | |||||
| ARN < 800.000 UI/ml | |||||||
| →1b independiente de ARN | |||||||
| →4 solo naïve con ARN < 800.000 UI/ml | |||||||
| GLE/PIB | |||||||
| GLE glecaprevir | Inhibidor NS3-4ª | Excreción biliar | →1a, 1b, 2, 3, 4, 5, 6 | 8-12 | No ajuste dosis en insuficiencia renal | Cefalea, fatiga | 100 mg/40 mg una tableta al día |
| PIB pibrentrasvir | Inhibidor NS5A | ||||||
Naïve: no tratamiento antiviral previo; No naïve: pretratados con interferón, interferón pegilado, ribavirina + sofosbuvir.
En general, la tolerancia de los nuevos AAD es buena y con pocos efectos secundarios (tabla 2). Los antivirales, solos o combinados, tales como SOF, SOF/LDV, SOF/VEL, GRA/LDV y GLE/PIB, se asocian a fatiga y cefalea76. La cefalea, la diarrea y las náuseas han sido los efectos secundarios más frecuentes con SOF/VEL/VOX, aunque las manifestaciones gastrointestinales son superiores a las presentadas con la doble combinación SOF/VEL78.
Con los nuevos AAD en pautas sin INF, la tasa de curación del VHC es alcanzable en todos los genotipos, al margen de haber o no cirrosis; sin embargo, uno de los principales problemas es el riesgo de interacciones con otros fármacos, pudiendo dar lugar a la disminución de la eficacia clínica o a un aumento de la toxicidad.
Las interacciones más relevantes son las farmacocinéticas, principalmente por la enzima del citocromo P450 (CYP450). Las interacciones con la glicoproteína P (P-gp) y con la proteína de resistencia del cáncer de mama (BCRP) también tienen el potencial de afectar la biodisponibilidad del fármaco79,80. El ritonavir, potente inhibidor de la CYP3A4, si se coadministra con fármacos metabolizados por esta enzima puede resultar en un marcado incremento en las concentraciones plasmáticas. Por todo ello, antes de planificar el tratamiento antiviral es recomendable verificar la ficha técnica específica del fármaco para disponer de una descripción detallada de las interacciones con otros medicamentos.
La utilización de algunos inductores del CYP450 y de la P-gp está contraindicada en todos los regímenes por el riesgo de disminuir significativamente las concentraciones del AAD. Por otro lado, los regímenes que incluyen un IP NS3-4A, tal como PTV-r, GRA, GLE o VOX, no deben utilizarse en pacientes con cirrosis descompensada Child-PigB oC, por el riesgo de incremento de la concentración del IP en estos pacientes y la toxicidad relacionada78.
En referencia a la función renal, solo existen recomendaciones con el inhibidor de la polimerasa NS5B SOF, dado que su eliminación es fundamentalmente renal, de manera que no se recomienda cuando el filtrado glomerular estimado (FGe) es <30ml/min/1,73m2, salvo si no existen otras opciones terapéuticas, y si se emplea deberá utilizarse pero bajo una estrecha monitorización78.
Interacciones con fármacos inmunosupresoresLa potencial interacción de algunos AAD con fármacos inmunosupresores y, a consecuencia de ello, el riesgo de rechazo del órgano trasplantado es una de las principales preocupaciones con el uso de algunos antivirales en TR (tabla 3).
Ajustes de los inmunosupresores en tratamiento con AAD
| Antiviral | Azatioprina | Micofenolato | Ciclosporina | Tacrolimus | Sirolimus | Everolimus |
|---|---|---|---|---|---|---|
| Sofosbuvir (Sovaldi®)Simeprevir (Olysio®)Daclatasvir (Daklinza®)Sofosbuvir/ledipasvir (Harvoni®)Paritaprevir/ombitasvir/ritonavir (Viekirax®) y Dasabuvir (Exviera®)Sofosbuvir/velpatasvir (Epclupsa®)Sofosbuvir/velpatasvir/voxilaprevir (Vosevi®)Grazoprevir/elbasvir (Zepatier®)Glecaprevir/pibrentasvir (Marivet®) | −−−−−−−−− | −-−−−Monitorizar−−−− | −No dar−Monitorizar Monitorizar−No darNo darNo dar | −Monitorizar−Monitorizar Monitorizar−MonitorizarMonitorizarMonitorizar | −Monitorizar−MonitorizarMonitorizar−MonitorizarMonitorizarMmonitorizar | −Monitorizar−MonitorizarMonitorizar−MonitorizarMonitorizarMonitorizar |
−: no interacción clínica.
Monitorizar: potencial interacción que requiere ajuste de dosis o monitorización adicional.
La ciclosporina es un inhibidor de la OATP1B1/3, BCRP y P-gp, además de ser también un inhibidor del citocromo CYP3A, por lo que la administración conjunta con IP NSA3-4A altera la eliminación del antiviral con elevación de su concentración plasmática, no recomendándose el uso concomitante de ambos fármacos, mientras que la coadministración de simeprevir-tacrolimus produce pequeños aumentos en la exposición del IP NS3-4A y un pequeño descenso en los niveles de tacrolimus que hacen recomendable la monitorización estrecha de los niveles plasmáticos del inhibidor de la calcineurina81-85.
En las nuevas combinaciones que contienen un IP NS3-4A, GRA/EBR, GLE/PIB, SOF/LDV/VOX, aunque pueden detectarse cambios en la exposición y en los niveles plasmáticos de tacrolimus, no es preciso el ajuste de dosis pero sí necesario realizar una estrecha monitorización plasmática del inmunosupresor (ver ficha técnica específica)86-89. La interacción de estos fármacos con imTOR no ha sido bien estudiada, por lo que es necesaria la monitorización de los niveles plasmáticos de estos hasta que se disponga de más información.
Daclatasvir, SOF y la combinación fija SOF/LDV o SOF/ VEL pueden ser administrados de forma segura con los inhibidores de la calcineurina tacrolimus/everolimus y los imTOR sirolimus/everolimus90.
En lo que hace referencia a la combinación OMB/PTVr/DSV con los diferentes fármacos inmunosupresores, la fuerte inhibición del CYP3A4 y de la P-gp producida por ritonavir es la principal causa de la alta exposición a los inhibidores de la calcineurina y/o imTOR, según proceda, siendo necesario realizar una estrecha monitorización del inmunosupresor correspondiente81. En un estudio la dosis de ciclosporina se redujo a una quinta parte la dosis basal y el tacrolimus de 0,5mg/semanal a 0,2mg/48h para mantener unos niveles dentro del rango terapéutico91.
Se ha descrito que tras aclarar el VHC en pacientes trasplantados se constata una caída de los niveles plasmáticos del inhibidor de la calcineurina92,93, que se ha relacionado con la mejoría de la función hepática y el consiguiente aumento del metabolismo del inhibidor de la calcineurina94. Según Sawinsky et al.92, el 45% de los pacientes precisaron del aumento de la dosis de inhibidores de la calcineurina durante el tratamiento antiviral, manteniéndose esta dosis después de finalizado el tratamiento.
En resumen, la disponibilidad de los nuevos AAD en pautas libres de INF ofrece la posibilidad de tratar de manera eficaz a los pacientes TR infectados por VHC, hasta recientemente sin opciones terapéuticas. A pesar del adecuado perfil de seguridad de los AAD, la potencial interacción de estos fármacos con algunos inmunosupresores, así como la mejoría del funcionalismo hepático tras erradicar el VHC, obliga a la realización de una estrecha monitorización plasmática del inmunosupresor para minimizar el riesgo de rechazo, por lo que es esencial la colaboración hepatólogo-nefrólogo en el seguimiento de los pacientes.
Antivirales de acción directa y diálisisLa combinación OMB/PTVr/DSV para el genotipo1, según datos del estudio RUBY-1 en pacientes sin cirrosis con IRCT, la RVS fue del 90%95.
El ensayo clínico faseiii C-Surfer incluyó 122 pacientes con genotipo1 en estadio 4 y 5 de insuficiencia renal (6% cirróticos y 20% no naïve), que se trataron con la combinación oral GRA/EBR durante 12semanas. La respuesta conseguida excluyendo 6 pacientes con fracaso no virológico fue del 99,1%, y del 94,2% en el análisis completo96 (tabla 4).
Ensayos clínicos más relevantes basados en esquemas terapéuticos libres de interferón para el tratamiento del VHC en pacientes en diálisis o trasplantados renales
| Estudio | Status insuficiencia renal | Con o sin cirrosisGenotipo (GT) | Terapia | Duración (semanas) | Respuesta viral sostenida-RVS12 |
|---|---|---|---|---|---|
| C-SURFER (Roth et al.) | FG < 30 ml/min (75% diálisis) | Cirrosis y no cirrosis. GT 1 naïve y no naïve | GRA/EBR | 12 semanas | 99% (94%) |
| RUBY-1 (n = 20)(Pockros et al) | ERC estadio 54 (FG 15-30 ml/min/1,73 m2)ERC estadio 5 (FG < 15 ml/min/1,73 m2 o en diálisis) | GT1Sin cirrosis | PTVr-OBV-DSV | 12 semanas | 90% |
| Colombo et al.Fase II (n = 114) | TR con FG > 40 ml/ml/min/1,73 m2 | Con o sin cirrosisNaïve y no naïveGT1GT4 | LDV/SOF | 12-24 semanas | 100% |
| EXPEDITION-4 (n = 104) (Gane et al.) | ERC estadio 4-5 | GT1-6 naïve y no naïveGT1 (52%)GT2 (16%)GT3 (11%)GT4 (19%)GT5 o 6 (2%) | GLE/PIB | 12 semanas | 98,1% |
| MAGELLAN-2 (n = 100) (Reau et al.) | TR (n = 20) y TH (n = 80) | GT 1-6 naïve y no naïveGT3 solo naïveSin cirrosis | GLE/PIB | 12 semanas | 98% |
Naïve: no tratamiento antiviral previo; No naïve: pretratados con interferón, interferón pegilado, ribavirina + sofosbuvir
DSV: dasabuvir; ELB: elbasvir; GRA: grazoprevir; OBV: ombitasvir; PTVr: paritaprevir-ritonavir.
La combinación GLE/PIB ha sido evaluada en el ensayo Expedition-IV durante 12semanas en pacientes con genotipos del1 al6, en pacientes naïve o pretratados con INF, y en pacientes con insuficiencia renal estadio4 o5, consiguiendo una RVS del 98%97 (tabla 4).
En base a estos resultados, estas combinaciones han sido recomendadas regularmente para tratar el VHC en IRCT y en diálisis78,81.
Antivirales de acción directa y trasplante renalEstudios pioneros han demostrado unos resultados excelentes en el tratamiento del VHC en pacientes TR con regímenes con SOF92,93,98,99, consiguiendo una RVS a 12semanas del 100%.
En base a los datos del registro español de pacientes TR tratados con AAD, de 103 pacientes tratados con diferentes regímenes antivirales sin INF, la RVS12 fue del 98%98. Las combinaciones más utilizada fueron SOF/LDV (57%) y SOF/daclatasvir (17%), y el 41% de los pacientes recibieron Rib. Se requirió ajuste del inmunosupresor en el 55% de los pacientes. No se detectaron cambios significativos en la función renal y proteinuria antes y después del tratamiento, aunque en probable contexto de menor exposición al tratamiento inmunosupresor 3pacientes presentaron un rechazo agudo humoral98.
Un estudio multicéntrico aleatorizado faseii que incluía 114 pacientes TR con infección por genotipo1 y4 consiguió una RVS del 98% con la combinación SOF/LDV durante 12 o 24semanas86. El 18% de los pacientes precisaron ajuste en la dosis del inmunosupresor sin episodios de rechazo. Según ello, en pacientes con buena función renal el régimen basado con SOF ha resultado útil y seguro (tabla 4).
Para escoger la combinación adecuada de AAD después del TR es necesario tener en cuenta el grado de función renal, así como el genotipo del VHC77,78 (tablas 5 y 6).
Combinaciones recomendadas para tratamiento VHC en enfermedad renal
| Estadio Enfermedad Renal | GT1a | GT1b | GT2 | GT3 | GT4 | GT5 | GT6 |
|---|---|---|---|---|---|---|---|
| →GLE/PIB | →GLE/PIB | →GLE/PIB | →GLE/PIB | →GLE/PIB | →GLE/PIB | →GLE/PIB | |
| Si filtrado glomerular estimado <30/ml/min/1.73m2 y en pacientes en diálisis | 8-12 semanas→GZR/EBR12 semanas SiRNA 800000UI/ml (5.9Log10/ml) | 8-12 semanas→GZR/EBR12 semanas→OBV/PTVr+DSV12 semanas | 8-12 semanas | 8-12 semanas | 8-12 semanas→GZR/EBR12 semanas) si RNA≤800000UI/ml (5.9Log10/ml) | 8-12 semanas | 8-12 semanas |
| →SOF/LDV | →SOF/LDV | →SOF/VEL | →SOF/VEL | →SOF/LDV | →SOF/LDV | →SOF/LDV | |
| Trasplante renalCon filtrado glomerular estimado>30/ml/min/1.73m2----------------------------------Trasplante renalCon filtrado glomerular estimado<30/ml/min/1.73m2 | 8-12 semanas→SOF/VEL12 semanas----------------------→GLE/PIB12 semanas | 8-12 semanas→SOF/VEL12 semanas---------------------→GLE/PIB12 semanas | 12 semanas------------------→GLE/PIB8-12 semanas | 12 semanas----------------→GLE/PIB12 semanas | 8-12 semanas→SOF/VEL12 semanas---------------------→GLE/PIB12 semanas | 8-12 semanas→SOF/VEL12 semanas----------------→GLE/PIB12 semanas | 8-12 semanas→SOF/VEL12 semanas-----------------→GLE/PIB12 semanas |
Naïve: no tratamiento antiviral previo; No naïve: pretratados con interferón, interferón pegilado, ribavirina + SOF
DSV: dasabuvir; EBR: elbasvir; GLE: glecaprevir; GT: genotipo; GZR: grazoprevir; LDV: ledipasvir; OBV: ombitasvir; PIB: pibrentasvir; PTV: paritaprevir; r: ritonavir; SOF: sofosbuvir; VEL: velpatasvir; VHC: virus de la hepatitis C; VOX: voxilaprevir.
Recomendaciones para el tratamiento de la infección por VHC en los pacientes con, trasplante renal
| • Todos los pacientes trasplantados renales con infección activa VHC deben ser evaluados para recibir tratamiento antiviral |
| Régimen con AAD |
| El tratamiento con interferón deber ser eliminado |
| La elección del tratamiento se debe basar en el genotipo VHC, carga viral, interacción con fármacos, filtrado glomerular, grado de fibrosis hepática y comorbilidades |
| • Se debe realizar una evaluación pretratamiento de la interacción con fármacos entre el régimen con AAD y la medicación concomitante, incluyendo los fármacos inmunosupresores |
| • Deben elegirse los protocolos que han mostrado eficacia y seguridad de los regímenes basados en AAD en los enfermos con trasplante renal |
| • Durante y después del tratamiento con AAD deben monitorizarse |
| Los inhibidores de la calcineurina |
| La función renal |
| La proteinuria |
Modificada de KDIGO, 2018.
El estudio en faseii MAGELLAN-II incluyó 100 pacientes con genotipo1, 2, 3, 4, 5 o 6 sin cirrosis con TH (80%) o TR (20%), tratados durante 12semanas con GLE/PIB. Excepto para el genotipo3 (solo naïve), se incluyeron naïve y no naïve (pretratados con régimenes con INF, peg-INF, RBV±SOF), alcanzándose una RVS12 en el 98% de los pacientes87 (tabla 4).
Las recomendaciones para tratar el VHC en los pacientes con TR se detallan en la tabla 6. Durante y después de finalizar el tratamiento con AAD debe monitorizarse de forma estrecha los niveles del inhibidor de la calcineurina77,92,93, la función renal88 y la proteinuria, habiéndose reportado la presencia de hialinosis segmentaria y focal tras el tratamiento con AAD89.
Manejo de pacientes en lista de espera para trasplante renal con infección por VHC, «era AAD»El tratamiento recomendado antes o después del TR dependerá del tipo de donante, del tiempo en lista de espera para un determinado tipo de donante, de la posibilidad de utilizar órganos de donantes VHC+, del genotipo y del grado de fibrosis hepática77 (fig. 1).
Como ya se ha comentado previamente, todos los pacientes VHC candidatos a TR deben ser evaluados para descartar cirrosis utilizando la biopsia hepática o un método no invasivo para estratificar el grado de fibrosis hepática77,78. En los pacientes con cirrosis compensada sin hipertensión portal se puede valorar el TR aislado, mientras que el TCHR se recomienda en cirrosis descompensada y/o hipertensión portal severa.
Es importante considerar cuál es el momento óptimo para realizar el tratamiento antiviral en lista de espera para trasplante. Excepto en pacientes con cirrosis descompensada o con hipertensión portal significativa, si está previsto realizar pronto (plazo de 6meses aproximado) un TR de donante vivo puede programarse el tratamiento con AAD post-TR. Por el contrario, si el TR se planifica más allá de 24semanas hay que valorar el riesgo-beneficio de aplazar el tratamiento para después del trasplante77.
De la misma manera, en los pacientes en lista de espera para TR de donante cadáver puede diferirse el tratamiento antiviral para después del TR para tener la posibilidad de recibir un riñón de donante VHC+ y reducir el tiempo en lista de espera66, especialmente si el riesgo inmunológico es bajo y la posibilidad de ofertarse pronto un donante compatible es alta. No obstante, los pacientes sin posibilidad de ser trasplantados de donante VHC+, o en los que las posibilidades de que se les oferte pronto un injerto compatible es improbable, el tratamiento antiviral debe ser ofertado antes del TR.
Es importante considerar que en los pacientes que siguen virémicos mientras están en lista de espera debe realizarse una evaluación anual del grado de fibrosis hepática, y si hay evidencia de progresión de daño hepático deberá iniciarse el tratamiento antiviral.
El tipo de genotipo también puede influir para decidir cuál es el momento óptimo para realizar el tratamiento antiviral. Hasta ahora en pacientes en lista de espera para TR infectados por genotipo1 o genotipo4 el tratamiento antiviral se indica antes del TR con GRA/EBR o con OMB/PTVr/DSV para el genotipo1b, mientras que para genotipo no-1 o no-4 el tratamiento se pospone hasta después del TR, dado que los regímenes aprobados hasta la fecha se han basado en SOF. Con la reciente aprobación por la FDA de la combinación pangenotípica GLE/PIB, sin necesidad de ajuste en la insuficiencia renal, el tratamiento se podrá planificar en todos los casos antes del TR78 (tabla 5).
Los pacientes en lista de espera con cirrosis a pesar de haber negativizado el VHC deben ser evaluados cada 6meses con ultrasonidos para descartar la aparición de hepatocarcinoma96.
Coinfección por VHC y VHBEn coinfección por VHC y VHB, el nivel sérico de ADN-VHB a menudo es indetectable, siendo el VHC el principal agente causal de la actividad inflamatoria hepática, por lo que con el aclaramiento del VHC existe riesgo de reactivación del VHB.
Es esencial determinar el estado serológico para el VHB antes de iniciar el tratamiento frente al VHC y en los pacientes con coinfección por VHC-VHB debe iniciarse concomitantemente con la terapia anti-VHC, tratamiento frente al VHB con análogos nucleósidos/nucleótidos78. Si el HBsAg es positivo se debe realizar tratamiento específico frente al VHB durante 12semanas después de finalizado el tratamiento con AAD. Si el HBsAg es negativo pero el anti-core VHB es positivo, debe monitorizarse el ADN-VHB y HBsAg en caso de incrementar o no normalizarse las transaminasas (determinaciones mensuales) durante o después del tratamiento frente al VHC, e iniciar terapia anti-VHB en caso de detectarse HBsAg y/o ADN-VHB78.
Trasplante renal utilizando riñones de donantes con viremia VHCTrasplante renal con riñones de donante VHC+ en receptor VHC+Tras demostrarse que el trasplante de órganos puede transmitir el VHC100 hubo consenso general en afirmar que los riñones de donantes VHC+ no se deben trasplantar en pacientes VHC−101. Sin embargo, debido a la escasez de órganos se planteó la posibilidad de trasplantarlos en receptores VHC+102,103.
Las primeras experiencias en TR utilizando riñones de donantes VHC+ en receptores VHC+, en las que nuestro país fue pionero, demostraron que a corto plazo esta política era factible y segura103-106. Como consecuencia, las guías nacionales e internacionales recomendaron esta práctica para evitar la pérdida de órganos.
A pesar de estas recomendaciones, el TR utilizando riñones de donantes VHC+ en receptores VHC+ ha seguido y sigue siendo controvertido104-107. Los estudios americanos, la mayoría basados en estudios de registro, muestran un tiempo de espera para el TR más corto pero asociado con un pequeño incremento del riesgo de muerte, pérdida del injerto y enfermedad hepática severa, en comparación con los trasplantados que recibieron riñones VHC−108-111. Estos autores sugieren que la alta incidencia de NODAT en los receptores VHC+ puede explicar la disminución de la supervivencia del paciente. Sin embargo, la supervivencia de los pacientes que reciben riñones de donantes VHC+ es superior a la que obtienen los pacientes VHC+ que permanecen en lista de espera77,104-107.
El estudio cooperativo entre los hospitales 12 de Octubre de Madrid y Clínic de Barcelona, en TR a partir de donantes VHC+ en receptores VHC ARN+, reportó que la serología positiva del donante no es un factor de riesgo independiente para la enfermedad hepática ni para la supervivencia de injertos y pacientes a largo plazo21. Estos resultados han sido corroborados por estudios recientes, señalando además que el menor tiempo en lista de espera contribuye a mejorar la supervivencia del injerto (muerte censurada) comparado con los receptores VHC+ trasplantados con riñones de donantes VHC−112. Por tanto, las guías KDIGO siguen recomendando el trasplante con donantes VHC+ en receptores VHC ARN+77.
En los últimos años la incidencia y la prevalencia de la infección por VHC en diálisis han disminuido, por lo que la oferta de un riñón de donante VHC+ en ocasiones no puede ser utilizada por falta de receptor adecuado110, sugiriendo que se adopten medidas organizativas, incluyendo la oferta de estos riñones para TR anticipado109.
El éxito de las AAD ayudará a aumentar el uso de los riñones de donante VHC+, tal como se ha sugerido recientemente (fig. 1), proponiéndose trasplantar a los pacientes VHC+ con leve fibrosis con un riñón de donante VHC+ y tratarlos después del TR con los nuevos AAD4, de manera que se conseguiría acortar el tiempo en lista de espera de estos pacientes. Además, ya existen experiencias de receptores VHC+ de un riñón VHC+ que fueron tratados con AAD y consiguieron la erradicación del virus después del trasplante113.
En definitiva, el uso de riñones de donantes VHC+ en receptores VHC ARN+ es una política segura a largo plazo que ofrece una supervivencia del paciente mayor que la de los pacientes VHC+ que permanecen en lista de espera para TR. La disponibilidad de las AAD, instauradas post-TR, ayudará a incrementar el pool de donantes con el uso de los riñones VHC+ en receptores VHC+ en cualquier lugar del mundo. Sin embargo, el acceso al tratamiento antiviral de los pacientes con IRCT o en diálisis, en los países en que el tratamiento antiviral es/será casi universal, hará disminuir/desaparecer el número de posibles receptores VHC+, como está ocurriendo en España (datos no publicados).
Trasplante renal con riñones de donantes VHC+ en receptores VHC−: ¿es factible en la era de los nuevos antivirales?La lista de espera para TR va incrementándose cada año en la mayoría de los países, y el tiempo de espera para trasplante es demasiado largo. En este contexto, la pregunta que ha emergido en la comunidad trasplantadora es: «En la nueva era de los antivirales, el TR con riñones de donantes VHC+ en receptores VHC− ¿es factible y éticamente aceptable?»113,114.
Dos ensayos norteamericanos que utilizaron riñones de donantes VHC+ en receptores VHC− han sido los pioneros en evaluar la posibilidad y la seguridad de esta opción terapéutica115,116. El ensayo THINKER incluyó 10 pacientes VHC− que recibieron un riñón de donante VHC ARN+ genotipo1. El tratamiento antiviral grazoprevir/elbasvir fue administrado cuando se evidenció viremia, hecho que ocurrió alrededor del tercer día postrasplante. Todos se infectaron, y tras 12semanas de tratamiento todos mostraron una RVS115. De la misma manera, el ensayo EXPANDER incluyó 8pacientes utilizando la misma pauta, grazoprevir/elbasvir, en el preoperatorio y después del trasplante, y de nuevo todos los pacientes fueron infectados y todos tuvieron RVS tras 12semanas de tratamiento116. Completando y ampliando los datos publicados por Goldberg et al.115, Reese et al.117 acaban de publicar los resultados a 12meses en 20 pacientes VHC− después de recibir un injerto renal VHC ARN+ obteniendo una erradicación del virus a 12meses en el 100% de los casos. Un estudio reciente confiere además ventajas económicas a favor de utilizar riñones VHC ARN+ para TR a receptores VHC− en comparación con los pacientes VHC− en diálisis y en lista de espera para un TR de donante VHC−118.
La política de utilizar donantes VHC ARN+ en receptores VHC− ofrece la posibilidad de aumentar el pool de donantes para TR y así disminuir la lista de espera119. Sin embargo, a pesar de que ya se ha instaurado en los protocolos de algunos centros nacionales e internacionales, la experiencia es aún escasa.
De la misma manera que estas experiencias son prometedoras, la cautela es absolutamente necesaria para esta opción revolucionaria hasta que no dispongamos de más información. De hecho, la Conferencia de Consenso del VHC de la Sociedad Americana de Trasplante recomienda que el trasplante de órganos de donantes VHC+ en receptores VHC− debe ser realizado únicamente como un protocolo de investigación con un exhaustivo y riguroso consentimiento informado que debe ser autorizado por el comité ético de cada centro101.
FinanciaciónEl presente trabajo no ha recibido ninguna beca específica de agencias de los sectores público, comercial. Sin ánimo de lucro.
Conflicto de interesesNo se declaran conflictos de intereses.