El ácido micofenólico es generalmente bien tolerado y sus efectos adversos más notables son de carácter gastrointestinal (náuseas, vómitos, diarrea) y hematológicos (leucopenia, anemia y trombocitopenia). Existen 2 formas galénicas diferentes: como éster, el micofenolato de mofetilo (MMF), y como sal sódica, el micofenolato sódico (MFS). La formulación sódica, con absorción intestinal y no gástrica, se desarrolló para reducir la incidencia de los efectos adversos gastrointestinales.
Frente a la frecuente intolerancia digestiva, los casos publicados de afectación hepática son excepcionales, y casi siempre en relación con el micofenolato mofetil. Presentamos el que creemos segundo caso publicado de hepatitis aguda en relación con el micofenolato de sodio.
Mujer de 68 años, diagnosticada 7 años antes (noviembre-2011) de vasculitis PAN con serología MPO-ANCA que debutó con afectación pulmonar y renal. Fue tratada con esteroides y ciclofosfamida oral, con recuperación casi total de su función renal previa. Presentó un segundo brote un año y medio después (mayo-2013), nuevamente con hemorragia pulmonar y disfunción renal, que fue tratado otra vez con esteroides y bolus de ciclofosfamida, iniciando posteriormente tratamiento de mantenimiento con azatioprina. Tras el segundo brote persistió deterioro de función renal, que fue progresando hasta que al cabo de un año (octubre-2014) inicia diálisis peritoneal. Permanece en esta modalidad desde entonces, sin incidencias destacables durante tres años y medio. Se decidió suspender la azatioprina tras cumplir dos años de tratamiento dada la estabilidad de la paciente, y su situación ya en diálisis. Hasta que en junio 2018 presenta cuadro de astenia intensa, artralgias y tos irritativa, que en pocos días provoca hemoptisis.
En el estudio inicial, la analítica mostró hemograma normal, bioquímica acorde a su insuficiencia renal, ANCA de 34, PCR 68 y complemento normal. La radiología de tórax evidenció opacidades parenquimatosas seudonodulares bilaterales y multifocales, confirmadas en el TAC torácico, y altamente sugestivas de sangrado, que se confirmó mediante broncoscopia con lavado broncoalveolar.
Con la sospecha clínica de nuevo brote de su vasculitis se inició tratamiento con bolus de metilprednisolona, tras los cuales, y siendo ya evidente una mejoría clínica y radiológica, sigue con prednisona oral (60mg/día) a la que se asoció micofenolato de sodio (180mg/12h) como terapia complementaria. Tras 14 días de tratamiento con MFS, la paciente presenta cuadro de peritonitis por Enterococcus Faecium. Se decidió suspender el micofenolato, e iniciar tratamiento antibiótico con vancomicina intraperitoneal, durante 15 días, con respuesta y evolución favorable.
Tras un mes del inicio de tratamiento del brote vasculítico los valores de ANCA se negativizaron y los valores de PCR se normalizaron. Una vez resuelta la peritonitis, e iniciando ya la pauta de descenso de prednisona oral, se decide reintroducir el micofenolato de sodio en dosis menores (180mg/día).
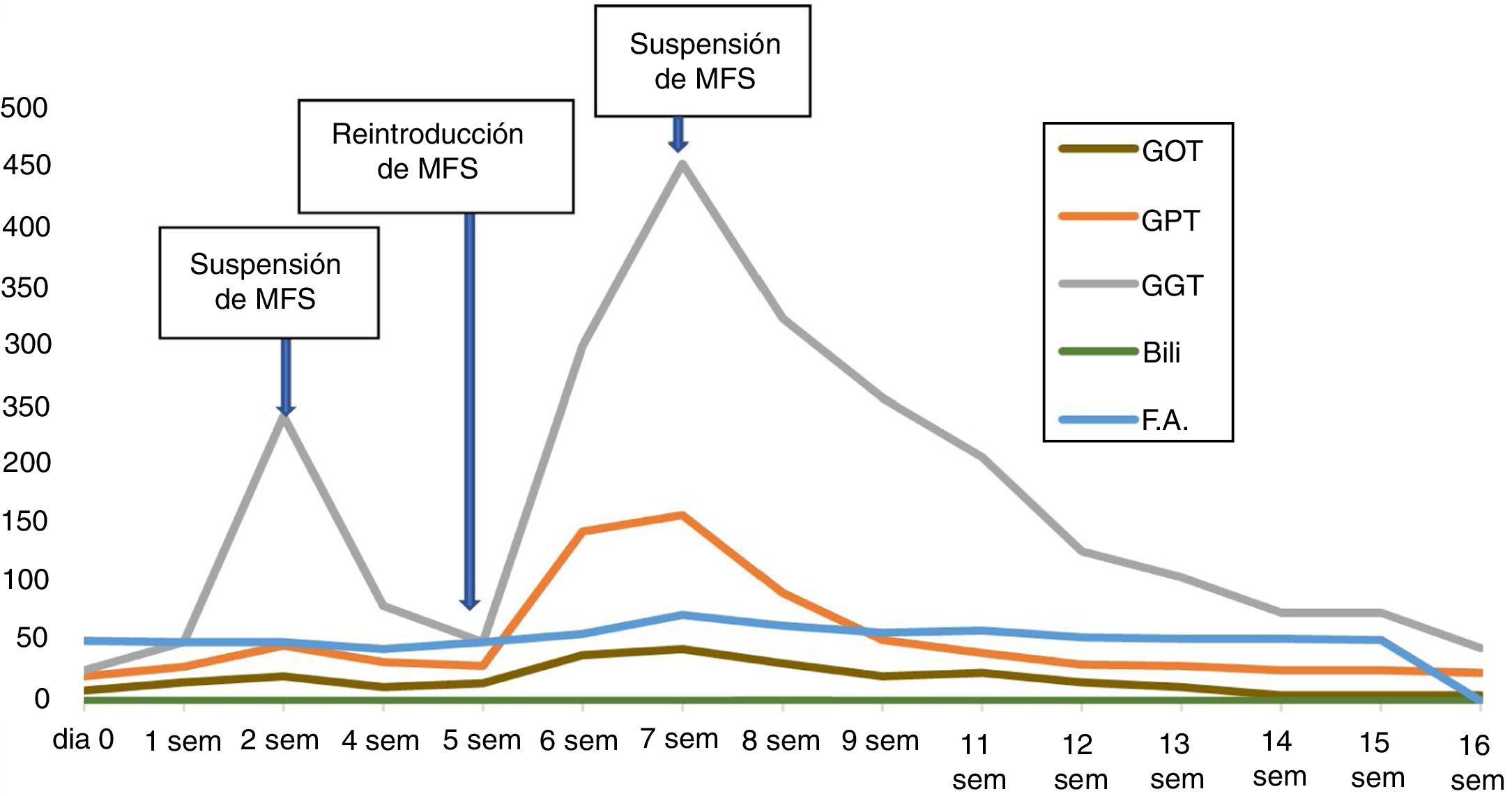
A los 15 días de reintroducir el MFS, un control muestra elevación de transaminasas (GOT 44, GPT 158 y GGT 455UI/l), con bilirrubina, albúmina y coagulación normales. La PCR era también normal. La paciente negaba ninguna sintomatología y no presentaba ictericia ni hepatomegalia. Repasando analíticas previas se constata que dicha elevación coincide con el reinicio de tratamiento con MFS. Y que esta alteración enzimática también estuvo presente, en menor grado (GOT 21, GPT 85 y GGT250 UI/l), antes de la suspensión temporal del fármaco debido a la peritonitis (fig. 1). Tras aquella suspensión, los valores de las transaminasas habían regresado a valores normales.
Ante estos hallazgos, se decide suspender nuevamente el MFS, y descartar otras causas de afectación hepática. La paciente no tenía antecedentes de enfermedad hepática o biliar, ni de abuso de alcohol o adicción a drogas, no tuvo exposición a virus hepáticos, ni realizó viajes exóticos. Tampoco había iniciado tratamiento con fármacos nuevos y negó ingesta de AINES. La serología vírica, incluidos virus hepáticos atípicos y CMV fue negativa, así como los anticuerpos antimitocondriales, anti-músculo liso, anti-KLM, anti-citosol hepático, y anti-SLA, antinucleares y anti-actina. Los ANCA seguían siendo negativos.
Un nuevo control analítico realizado dos semanas después de suspender el micofenolato mostró descenso de las transaminasas, que alcanzaron valores normales a las 16 semanas.
Pese al extenso número de pacientes tratados con ácido micofenólico, la afectación hepática se ha descrito muy excepcionalmente., siendo el micofenolato mofetil la forma galénica involucrada en casi todos los casos1–4. La elevación de transaminasas es ligera-moderada, asintomática, suele aparecer en el primer mes de terapia, con patrón hepatocelular o más raramente mixto (hepatocelular y colestásico). No suele acompañarse de datos inmunológicos o autoinmunes. y resuelve con la reducción de la dosis o suspensión del fármaco. El número de casos clínicamente aparentes y/o graves es mínimo5,6. El mecanismo del daño hepático es desconocido, y pudiera deberse a toxicidad o estímulo inmunogénico de alguno de los metabolitos1.
Revisando la literatura solo hemos encontrado un caso de hepatotoxicidad relacionado con el micofenolato sódico7, aunque aquel paciente padecía una hepatopatía por virus C que los autores creen que podría haber favorecido la toxicidad del MFS.
En nuestro caso la relación causal está apoyada por la relación temporal entre la administración de micofenolato sódico y la elevación de transaminasas en dos ocasiones, la ausencia de otros posibles agentes etiológicos y la recuperación tras la suspensión del fármaco.