Valorar la presión generada por una pinza ajustable en fístulas arteriovenosas (FAV) durante el proceso de hemostasia y compararla con la generada por la compresión manual. Evaluar las variaciones de la compresión manual durante el proceso de hemostasia.
MétodosSe analizaron los datos de 51 sesiones de hemodiálisis de 15 pacientes. Se utilizó la presión intraacceso como indicador indirecto de la presión generada por ambos métodos sobre la FAV. La misma se registró antes de retirar la aguja venosa (PBasal), tras retirar la aguja y colocar la pinza (P1), tras ajustar la pinza (P2), al comenzar el paciente a ejercer compresión manual (M0), a los 3min del inicio de la presión manual (M3) y a los 6min del inicio de la presión manual (M6).
ResultadosLa presión intraacceso fue menor al aplicar la pinza y ajustarla (P2) que al aplicar presión manual (M0), con una diferencia media de −9,43mmHg (variación −18,57%, IC95%: −14,09 a −4,77mmHg, p<0,001). La presión manual mostró una tendencia descendente durante el proceso de hemostasia (M3-M0: −8,82mmHg, p<0,001; M6-M0: −12,55mmHg, p<0,001).
ConclusiónLa compresión ejercida por una pinza ajustable es inferior o similar a la ejercida de forma manual por el paciente. Esta última muestra una intensidad decreciente durante el proceso de hemostasia. Estos datos sugieren que algunas de las premisas sobre las que se basan algunas de las recomendaciones presentes en las guías clínicas podrían ser imprecisas.
To evaluate the pressure generated by an adjustable hemostasis clamp on arteriovenous fistulas (AVF) during the hemostasis proccess, and compare it with the direct two-finger pressure applied by the patient. To evaluate the variations of the direct two-finger pressure along the hemostasis process.
MethodsWe analyzed data obtained in 51 hemodialysis procedures from 15 patients. AVF intra-access pressure was used as indirect indicator of the pressure generated by both methods. It was recorded before venous needle removal (PBasal), at clamp application (P1), after clamp adjustement by a nurse (P2), at the beginning of the direct two-finger pressure by the patient (M0), after 3min of two-finger pressure (M3) and after 6min of two-finger pressure (M6).
ResultsIntra-access pressure was lower with the adjusted clamp (P2) than with the direct two-finger pressure by the patient (M0) (variation of −18.57%, 95%CI: −14.09 to −4.77mmHg, P<.001). Intra-access pressure generated by the direct two-finger pressure method showed a decreasing trend along the hemostasis process (M3-M0: −8.82mmHg, P<.001; M6-M0: −12.55mmHg, P<.001).
ConclusionAn adjustable fistula arm clamp generates a lower pressure in AVF than the direct two-finger pressure applied by the patient. The latter showed a decreasing trend along the hemostasis process. These data suggest that some of the recommendations from clinical guidelines could be based on inaccurate premises.
- •
El uso de dispositivos de compresión en el proceso de hemostasia en fístulas arteriovenosas cuenta con una consideración negativa en las guías clínicas actuales.
- •
El método preferente de hemostasia es la compresión manual.
- •
Dicha recomendación está basada en opinión de expertos, pero no existen datos publicados al respecto que la respalden.
- •
Nuestros datos muestran que la presión aplicada manualmente por el paciente no es constante en el tiempo.
- •
Además, muestran que el uso de un dispositivo de compresión que permite ser ajustado por la enfermera ejerce una presión similar o inferior a la aplicada manualmente por el paciente.
- •
Nuestros resultados sugieren que algunas de las premisas que sostienen la recomendación de las guías clínicas actuales podrían ser imprecisas.
El proceso de retirada de las agujas tras una sesión de hemodiálisis en pacientes con fístulas arteriovenosas (FAV) es tan importante como el proceso de canulación. Una técnica adecuada protege la pared de la fístula de posibles lesiones y favorece una adecuada hemostasia1-3.
La aplicación de una compresión correcta sobre los puntos de punción favorece su cierre y disminuye el riesgo de complicaciones, como la aparición de hematomas, estenosis o trombosis1,4-6. La aparición de estas complicaciones dificulta posteriores punciones, limita el número de opciones para las mismas1,4 y, finalmente, puede dificultar el manejo de estos pacientes.
Para el proceso de hemostasia las principales guías clínicas recomiendan aplicar compresión con la punta de los dedos durante al menos 10min tras la retirada de las agujas, de forma constante y mantenida hasta lograr la hemostasia completa7-9.
El uso de dispositivos de compresión (pinzas, bandas) también está aceptado en algunas de esas guías2,7, mientras que otras prohíben o desaconsejan su uso1,4,8, argumentando que estos dispositivos podrían aplicar una presión excesiva, generar complicaciones y deteriorar la fístula. Esta recomendación está basada en el consenso de expertos, pero hasta donde sabemos, no hay estudios que aporten datos empíricos sobre qué método de hemostasia es más adecuado.
Pese a la consideración negativa del uso de dispositivos de compresión en FAV (especialmente en protésicas), estos son utilizados en la práctica clínica. Muestra de ello es la gran cantidad de dispositivos de este tipo disponibles en el mercado. Muchos de ellos presentan un sistema de regulación que permite ajustar la compresión ejercida que podría hacerlos aptos para su uso en FAV.
Sería de utilidad disponer de datos sobre la factibilidad y la seguridad del uso de este tipo de dispositivos en la práctica clínica, así como de su comparación con la compresión ejercida de forma manual. Los objetivos del presente estudio son: a)valorar la compresión ejercida con una pinza ajustable y compararla con la ejercida de forma manual, y b)valorar la intensidad y las variaciones de la presión que se ejerce de forma manual sobre la FAV durante el proceso de hemostasia.
MétodosEstudio descriptivo transversal que compara dos métodos de compresión en pacientes sometidos a hemodiálisis a través de FAV nativas o protésicas en el Servicio de Hemodiálisis del Complejo Asistencial de Segovia.
Muestra, muestreo y tamaño muestralLos pacientes incluidos en el estudio serán aquellos en tratamiento con hemodiálisis a través FAV en nuestra Unidad. Se excluirán los que presenten complicaciones en la FAV (hematoma subcutáneo, infección, trombosis), una situación que implique un aumento del riesgo de rotura vascular (según criterio facultativo), o aquellos con un grado insuficiente de madurez de la FAV.
La unidad muestral del estudio será la sesión de hemodiálisis, en la que se determinará la presión intraacceso en varias ocasiones según el protocolo descrito más adelante. En el estudio podrán utilizarse hasta 10 sesiones de hemodiálisis de un mismo paciente, que serán seleccionadas por muestreo aleatorio simple entre todas las sesiones recibidas por cada paciente durante la duración del estudio. Se excluirán los datos de las sesiones en las que la presencia de fibrina en el sistema pueda sesgar la lectura de presión intraacceso, así como los de aquellas en las que un movimiento o cambio de posición del paciente pueda alterar dichas lecturas.
Se ha estimado un tamaño muestral mínimo de 37 sesiones de hemodiálisis para estimar la diferencia de presiones entre la compresión manual y la ejercida por un dispositivo de compresión, considerando una desviación estándar de 15mmHg, una diferencia mínima a detectar de ±7mmHg, un error alfa de 0,05 y una potencia estadística del 20%.
Medición de la presión intraaccesoNuestra Unidad cuenta con 10 puestos de hemodiálisis, y para este estudio se utilizarán 4 monitores Gambro: Artis y Artis Physio, y una pinza de compresión Premifistola BL170 (Bellco, Mirandola, Italia), a la cual se le aplica una brida regulable que permite ajustar la compresión que se ejerce sobre la FAV. Todas las enfermeras que participaron en el estudio eran personal experto en la canulación de FAV, con más de 3años de experiencia en esta técnica.
Como indicador indirecto de la presión que se ejerce sobre el punto de punción se utilizará la presión intraacceso, que el monitor mide en la cámara venosa del sistema. Se tomará lectura de la misma en 6 ocasiones: antes de retirar la aguja venosa (Basal), tras retirar la aguja venosa y colocar la pinza (P1), al ajustar la pinza (P2), al comenzar a ejercer compresión manual (M0), a los 3min de comenzar a ejercer la presión manual (M3) y a los 6min de comenzar a ejercer la presión manual (M6).
Al finalizar la sesión de hemodiálisis se retornará la sangre del circuito extracorpóreo según el protocolo de la Unidad. Para obtener la lectura de presión en la cámara venosa, la línea venosa se conectará a la aguja arterial. Para que se corresponda con la presión intraacceso, se ajustará la altura de la cama del paciente y del cabecero para que coincidan al mismo nivel de la cámara venosa. De esta forma se eliminarán las diferencias asociadas al incremento de la presión hidrostática10,11.
Tras esto, se pinzará la línea que comunica la cámara venosa con el dializador, para evitar que los cambios de presión puedan disiparse por esta vía. Tras 30s de espera se registrará la lectura de presión, que será considerada como presión basal (Basal). A continuación, la enfermera retirará la aguja venosa, colocará el dispositivo de compresión y lo ajustará para lograr hemostasia sin interrumpir el flujo a través de la fístula. La presencia del thrill en puntos inmediatamente anterior y posterior indicará que el flujo es suficiente8. La enfermera que coloca y ajusta la pinza no tendrá acceso a la lectura de presión intraacceso, y será un segundo observador el que tome las lecturas de presión intraacceso al colocar la pinza (P1) y al ajustarla (P2).
Tras ello se retirará la pinza y el paciente comprimirá el orificio con el fin de ejercer hemostasia. En ese momento se tomará la lectura de la presión (M0), repitiéndose la lectura a los 3min (M3) y a los 6min (M6). De nuevo, la persona que ejerce presión no tendrá acceso a la lectura facilitada en la pantalla, que será registrada por un segundo observador. Tras la lectura en el minuto6 (M6) se continuará con el proceso habitual de desconexión del paciente.
La compresión manual será lo más constante y mantenida posible, suficiente para interrumpir el sangrado a nivel externo y subcutáneo, pero sin interrumpir el flujo de acceso a través de la fístula. La presión se ejercerá al menos durante 10min, hasta que se logre la hemostasia completa7. En nuestra unidad los pacientes son instruidos en la forma que deben comprimir tras retirar las agujas. En el caso de que el paciente no tenga capacidad cognitiva/funcional suficiente, dicha presión es ejercida por la enfermera.
VariablesCon los valores de presión intraacceso descritos previamente (Basal, P1, P2, M0, M3 y M6) se calcularán las diferencias de presión entre ellos. Además, se registrarán variables de tipo sociodemográfico y clínico, tales como el sexo y edad del paciente, el tipo (nativa o protésica), localización y edad de la fístula, la toma de tratamiento antiagregante, anticoagulante o estimulador de la eritropoyesis y parámetros como la urea, la hemoglobina y el valor Kt.
Se registrarán también las complicaciones que surjan en la zona de la fístula en las 48h siguientes al final de cada sesión de hemodiálisis atribuibles al proceso de hemostasia, tales como sangrado externo, hematoma subcutáneo, disminución marcada del flujo de acceso, infección, estenosis o pseudoaneurisma de nueva aparición, trombosis, rotura vascular, etc.
Análisis estadísticoPara el análisis de los datos se utilizará el software SPSS v.20.0.0 (IBM Corporation, ©2011, EE.UU.). En el análisis descriptivo de los resultados se utilizarán medias y desviaciones estándar para las variables cuantitativas y porcentajes para las cualitativas. Todas las pruebas de significación serán bilaterales y se considerará como estadísticamente significativo un valor de p<0,05. Para las estimaciones se facilitará un intervalo de confianza del 95% (IC95%). Se utilizará la prueba de Saphiro-Wilk para determinar si la distribución de los datos correspondientes a cada variable se ajusta a distribución normal.
Para la comparación de las diferencias de presión intraacceso (P2-M0, P2-Basal, M0-Basal, etc.) se utilizará la t de Student para muestras pareadas en el caso de que los datos muestren una distribución normal. En caso contrario se utilizará la prueba de Wilcoxon para muestras relacionadas.
ResultadosSe analizaron los datos recogidos en un total de 51 sesiones de hemodiálisis pertenecientes a 15 pacientes (edad media, 71,33±12,66años; 9 mujeres). El valor medio de urea previo a la sesión de hemodiálisis fue de 113,41mg/dl (rango 88-180mg/dl). El valor medio de Kt fue de 48,42±5,70l (rango 36-60l). Los pacientes presentaron un valor Kt por debajo del óptimo en 2 (3,9%) sesiones. El valor medio de hemoglobina previo a la sesión de hemodiálisis fue de 10,81±1,21g/dl (rango 9,60-13,20g/dl).
Durante el desarrollo del estudio 4 pacientes fueron retirados del mismo: uno por presentar una estenosis crítica en la anastomosis venosa y 3 por fallecimiento (uno por muerte súbita y 2 por presentar neoplasias avanzadas). Los motivos de retirada de estos 4 pacientes no estuvieron asociados al proceso de hemostasia en la FAV.
De los 15 pacientes incluidos, 2 (13,3%) tenían implantada una fístula protésica de Goretex, de la que se obtuvieron los datos de 9 (17,6%) de las 51 sesiones analizadas. Ambas fístulas tenían una ubicación húmero-axilar. Los 13 (86,6%) pacientes restantes tenían una fístula nativa, en la que se recogieron los datos de 42 (82,3%) sesiones. De estas 13 fístulas, 8 tenían una ubicación húmero-cefálica, 3 radio-cefálica y 2 húmero-basílica. La edad mediana [RI] de las fístulas fue de 592 [3.589] días.
En cuanto al tratamiento diario habitual, 6 pacientes estaban antiagregados con 100mg de ácido acetilsalicílico, 2 con 100mg de ácido acetilsalicílico y 75mg de clopidogrel y 2 estaban anticoagulados con 20mg de enoxaparina sódica. Todos los pacientes fueron anticoagulados con enoxaparina sódica al comenzar la sesión de hemodiálisis, con dosis comprendidas entre los 20 y los 80mg. Todos los pacientes incluidos recibían eritropoyetina como tratamiento de la anemia. Durante el desarrollo del estudio ninguno precisó transfusión de concentrados de hematíes. En todas las sesiones analizadas se utilizó como hemostático coadyuvante un apósito de gelatina absorbible (Surgispon®) para aplicar presión en la zona de punción, tanto con la pinza como con los dedos del paciente.
De las 79 sesiones de hemodiálisis incluidas inicialmente en el estudio, 2 (2,5%) fueron excluidas por el desarrollo de fibrina en el sistema que impidió la correcta lectura de la presión intraacceso y 26 (32,9%) por movimientos o cambios en la posición del paciente que afectaron a la fiabilidad de las lecturas. Por ello en el análisis final se consideraron los datos de 51 sesiones. En ninguna de ellas se detectaron complicaciones que pudieran estar asociadas al proceso de hemostasia.
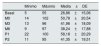
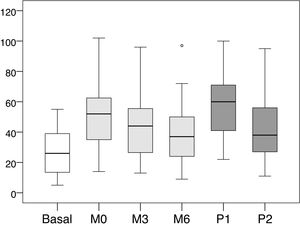
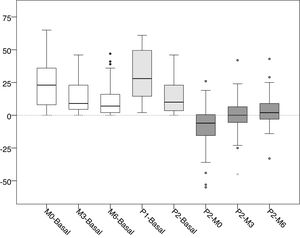
Los valores medios y las desviaciones estándar de la presión intraacceso en cada una de las lecturas realizadas se recogen en la tabla 1, y los valores medios de las diferencias entre cada una de las lecturas en la tabla 2. La distribución de dichos valores se muestra en las figuras 1 y 2.
Valores medios, mínimos y máximos de las lecturas de presión intraacceso (mmHg)
| Mínimo | Máximo | Media±DE | |
|---|---|---|---|
| Basal | 5 | 55 | 26,86±15,06 |
| M0 | 14 | 102 | 50,78±20,54 |
| M3 | 13 | 96 | 41,96±18,09 |
| M6 | 9 | 97 | 38,24±17,88 |
| P1 | 22 | 100 | 58,18±20,29 |
| P2 | 11 | 95 | 41,35±19,51 |
Basal: sin ejercer compresión sobre la fístula arteriovenosa; M0: al inicio de la compresión manual; M3: minuto3 de la compresión manual; M6: minuto6 de la compresión manual; P1: al colocar la pinza, sin ajustarla; P2: tras ajustar la compresión mediante el sistema regulable; DE: desviación estándar.
Valores de las diferencias de presión (mmHg)
| Valor | Media±DE | Var % | IC 95% | p |
|---|---|---|---|---|
| M0-Basal | 23,92±17,30 | +89,05 | 19,06 a 28,79 | <0,001 |
| M3-M0 | −8,82±10,44 | −17,36 | −11,76 a −5,89 | <0,001 |
| M6-M0 | −12,55±12,91 | −24,71 | −16,18 a −8,92 | <0,001 |
| P1-Basal | 31,31±18,33 | +116,56 | 26,16 a 36,47 | <0,001 |
| P2-Basal | 14,49±13,67 | +53,94 | 10,64 a 18,33 | <0,001 |
| P2-P1 | −16,82±14,55 | −28,91 | −20,91 a −12,73 | <0,001 |
| P1-M0 | 7,39±12,88 | +14,55 | 3,77 a 11,01 | <0,001 |
| P2-M0 | −9,43±16,57 | −18,57 | −14,09 a −4,77 | <0,001 |
| P2-M3 | −0,61±14,25 | −1,45 | −4,62 a 3,40 | 0,901 |
| P2-M6 | 3,12±12,32 | +8,15 | −0,35 a 6,58 | 0,102 |
Basal: sin ejercer compresión sobre la fístula arteriovenosa; M0: al inicio de la compresión manual; M3: minuto3 de la compresión manual; M6: minuto6 de la compresión manual; P1: al colocar la pinza, sin ajustarla; P2: tras ajustar la compresión mediante el sistema regulable; DE: desviación estándar; Var%: porcentaje de variación; IC95%: intervalo de confianza del 95% para la diferencia; p: significación estadística para la diferencia, según test de Wilcoxon para muestras relacionadas.
Distribución de los valores de presión intraacceso (mmHg).
Basal: sin ejercer compresión sobre la fístula arteriovenosa; M0: al inicio de la compresión manual; M3: minuto3 de la compresión manual; M6: minuto6 de la compresión manual; P1: al colocar la pinza, sin ajustarla; P2: tras ajustar la compresión mediante el sistema regulable.
Distribución de los valores de las diferencias de presión intraacceso (mmHg).
Basal: sin ejercer compresión sobre la fístula arteriovenosa; M0: al inicio de la compresión manual; M3: minuto3 de la compresión manual; M6: minuto6 de la compresión manual; P1: al colocar la pinza, sin ajustarla; P2: tras ajustar la compresión mediante el sistema regulable.
En blanco se muestran las diferencias entre la presión basal y la manual. En gris medio se muestran las diferencias entre la presión basal y la pinza ajustables. En gris oscuro se muestran las diferencias entre la pinza ajustable y la presión manual.
Al colocar la pinza para hacer hemostasia, y antes de ser ajustada por la enfermera (P1), el incremento de presión fue de +31,31mmHg (+116,56%, p<0,001) respecto a la presión basal. Posteriormente, tras ser ajustada por la enfermera (P2), dicha presión descendió −16,82mmHg (−28,91% respecto a P1, p<0,001). La presión en ese momento (P2) representó un incremento de +14,49mmHg (+53,94%, p<0,001) respecto a la presión basal.
El incremento de presión cuando se presiona por primera vez de forma manual el punto de punción (M0) es de +23,92mmHg (p<0,001), lo que representa un incremento de +89,05% respecto a la presión intraacceso basal. Desde ese momento la presión ejercida mostró una tendencia a la baja, con una disminución media de −8,82mmHg (−17,36%, p<0,001) a los 3min (M3) y de −12,55mmHg (−24,71%, p<0,001) a los 6min (M6).
Los valores tras el ajuste de la pinza por parte de la enfermera (P2) mostraron valores más bajos que los registrados con la presión manual del paciente en el minuto cero (M0), con una diferencia media de −9,43mmHg (−18,57%, p<0,001). En cambio, se observó que esos valores mostraron una tendencia a igualarse con M3 (−0,61mmHg, −1,45%, p=0,901) y M6 (+3,12mmHg, +8,1%, p=0,102), con una distribución de valores muy similar.
Ninguno de los pacientes incluidos en el estudio mostró complicaciones asociadas al proceso de hemostasia en las 48h posteriores a la punción de la fístula.
DiscusiónLos resultados de este estudio muestran que la compresión ejercida sobre FAV por un sistema de compresión ajustable es igual o inferior a la ejercida de forma manual por parte del paciente. Además, han mostrado que la presión manual que este aplica no es uniforme en el tiempo y muestra un patrón descendente a medida que transcurre el proceso de hemostasia.
Si bien estos resultados pueden parecer en cierto modo previsibles, era necesario que fueran sometidos a estudio debido a la ausencia de este tipo de datos en la literatura, y a su utilidad a la hora de determinar qué método de hemostasia sería más conveniente. De hecho, debido a esa falta de datos, las recomendaciones presentes en las guías clínicas actualmente solo se basan en el consenso de expertos.
Las recomendaciones asumen de forma teórica que la compresión manual es la más adecuada y segura, por ser moderada y constante en el tiempo2,12. No obstante, nuestros datos sugieren que la presión manual no es constante sino que va disminuyendo con el paso del tiempo, posiblemente por claudicación en el tono o por circunstancias que disminuyen la atención y la concentración del paciente. Una de las ventajas de los dispositivos de compresión sería que no se verían afectados por estos factores.
El uso de dispositivos de compresión en FAV tiene una consideración negativa en las guías, por lo que es desaconsejado en general, o permitido con restricciones en algunas situaciones1,2,8,13. Esto se basa en la premisa de que pueden ejercer una presión excesiva sobre la fístula, favorecer la aparición de complicaciones y acortar su supervivencia. En cualquier caso, como sugieren nuestros datos, esto parece no ser así en todos los dispositivos. El riesgo de que un dispositivo aplique una compresión inadecuada para lograr la hemostasia (por exceso o por defecto) solo es esperable en aquellos que no permiten el ajuste de la presión, o en los ajustables que no son supervisados adecuadamente.
Como muestran nuestros resultados, la presión que ejerce un dispositivo que sí permite su ajuste es similar o inferior a la ejercida de forma manual por el paciente. Esto pondría de manifiesto varias cosas: 1)que la premisa de la presión excesiva, asumida en las guías clínicas, no sería cierta en todos los dispositivos, solamente en los que no cuentan con un sistema que permita su ajuste; 2)la importancia de su utilización por personal entrenado, capaz de determinar cuál es la compresión adecuada en cada paciente y en cada sesión, y 3)la necesidad de que los dispositivos comercializados para este fin cuenten con un sistema que permita el ajuste de la compresión.
No obstante, pese a la utilidad de los datos aportados en este estudio, estos no permiten conocer el efecto del uso habitual de estos dispositivos en aspectos tan relevantes como la aparición de complicaciones y la supervivencia de la fístula. Estas son cuestiones deben ser abordadas en futuros ensayos clínicos, cuyos resultados aportarían las primeras evidencias sobre las que fundamentar las recomendaciones de las guías clínicas.
Aunque nuestros resultados no permiten aportar datos relativos a la seguridad del uso continuado de estos dispositivos, sí se ha observado la ausencia de complicaciones en el proceso de hemostasia que pudieran estar asociadas al mismo. Esto ha sido así incluso en los pacientes con una situación urémica más desfavorable, algo que ha sido asociado con un mayor riesgo de sangrado14.
Por último, hay que señalar que, aunque el método de compresión es un factor importante a la hora de determinar el éxito en el proceso de hemostasia, también depende de una correcta técnica de canulación. En ella la utilización del tipo de aguja más apropiada en cada paciente (longitud, calibre, fenestración)15, el uso de la técnica más adecuada16 o la realización de una punción ecodirigida cuando sea necesario17 pueden disminuir el riesgo de un proceso de hemostasia problemático y la aparición de complicaciones.
Nuestro estudio cuenta con algunas limitaciones. Si bien hemos utilizado un tamaño muestral suficiente para determinar la existencia de diferencias de presión entre ambos métodos, este estudio no ha evaluado la seguridad del uso habitual de los dispositivos ajustables y sus efectos en la vida útil de las fístulas, como ya hemos comentado. Además, el pequeño número de fístulas protésicas incluidas en el estudio no ha permitido analizar si los resultados obtenidos también serían aplicables a este tipo de fístulas. Por otra parte, solamente hemos evaluado uno de los múltiples dispositivos de compresión existentes en el mercado. Aunque pensamos que nuestras conclusiones podrían ser generalizables a cualquier dispositivo regulable, podrían existir diferencias según el tipo de sistema de regulación utilizado (banda continua18, banda discontinua19, vendaje20 o pinza21). Nosotros hemos evaluado un sistema de pinza, que podría presentar desventajas respecto a otros sistemas, como la posibilidad de su desplazamiento durante el proceso de hemostasia. A este respecto, sería interesante poder analizar el uso de los sistemas de banda de compresión, que podrían ser más eficaces a la hora de evitar este problema.
Para concluir, los resultados de este estudio han mostrado que la intensidad de la compresión manual sobre la FAV muestra una intensidad descendente a lo largo del proceso de hemostasia, y que la compresión ejercida por una pinza tras ser ajustada por la enfermera es inferior o similar a la ejercida de forma manual. Estos datos sugieren que las premisas en las que se basan algunas de las recomendaciones presentes en las guías clínicas podrían ser imprecisas, como que la compresión ejercida de forma manual es constante en el tiempo, o que todos los dispositivos ejercen una compresión excesiva sobre la fístula. No obstante, el papel del uso habitual de los dispositivos de compresión ajustables en la seguridad del paciente y en la supervivencia de la fístula son aspectos que aún deben evaluarse en futuros ensayos clínicos.
Conflicto de interesesNinguno.