La psoriasis es una enfermedad cutánea con afectación sistémica, cuyo daño tisular se considera inmunomediado y que en la actualidad se trata eficazmente con etanercept. El daño renal de esta patología no está completamente aclarado en la literatura. Presentamos un caso de glomerulonefritis membranosa con depósitos de C1q que posteriormente desarrolló psoriasis. En este artículo hacemos una revisión de la posible asociación entre estas patologías y la respuesta a esta molécula biológica.
Psoriasis is a cutaneous disease with systemic involvement. Tissue damage is considered to be immune-mediated, and etanercept currently provides effective treatment. Kidney injury arising from this condition has not yet been fully explained in the literature. We present a case of membranous nephropathy with C1q deposits followed by development of psoriasis. In this article we will review the possible association between these conditions and the response to this biological molecule.
INTRODUCCIÓN
Actualmente muchos autores consideran la psoriasis una enfermedad inmunomediada cuyo principal órgano diana es la piel. No hay consenso sobre si esta enfermedad afecta directamente al riñón, pero en la literatura se recogen varios casos de nefropatía asociada. Actualmente muchos autores consideran la psoriasis una enfermedad inmunomediada cuyo principal órgano diana es la piel. No hay consenso sobre si esta enfermedad afecta directamente al riñón, pero en la literatura se recogen varios casos de nefropatía asociada. El etanercept es un inhibidor del factor de necrosis tumoral alfa (TNF-α) que se usa para tratar ésta y otras patologías. Sin embargo, se han descrito casos de lesión renal asociada a este fármaco. A continuación presentamos el caso de un paciente con una glomerulonefritis membranosa (GNM) que posteriormente desarrolló psoriasis tratada con etanercept; coincidiendo con dicho tratamiento, se objetiva una remisión completa de su proteinuria.
CASO CLÍNICO
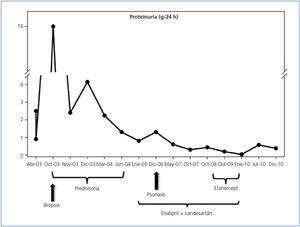
Paciente varón de 43 años, hipercolesterolémico tratado con estatinas, no hipertenso ni diabético. Fumador y bebedor ocasional. La historia nefrológica comienza en abril de 2003, cuando presentó un síndrome nefrótico clínico y analítico, en el contexto de una otitis media tratada con amoxicilina-clavulánico. Por remisión parcial espontánea del cuadro, con proteinuria residual en torno a 1 g/24 h, y dado que mantuvo una función renal normal en todo momento, se decidió no biopsiar y efectuar seguimiento en la consulta externa de Nefrología.
A partir de entonces, la proteinuria fue incrementándose progresivamente hasta 14 g/24 h, de tipo selectivo, sin alteraciones en los sedimentos urinarios. En el estudio inmunológico no se detectó la presencia de autoanticuerpos y mantuvo cifras de complemento normales en repetidos estudios a lo largo del seguimiento. Las serologías para virus hepatitis C, B y virus de la inmunodeficiencia humana fueron negativas. Con función renal normal, en octubre de 2003 se practicó una biopsia renal que mostró una GNM en estadio II. En la inmunofluorescencia se observaron depósitos granulares parietales intensos de IgG, C3 y C1q.
Se inició tratamiento con prednisona a dosis de 1 mg/kg/día y se consiguió una remisión parcial de la proteinuria hasta cifras de 1,3-0,5 g/24 h. El tratamiento se prolongó durante 8 meses, con descenso progresivo de los esteroides. En ese momento, se inició tratamiento antiproteinúrico con enalapril y candesartán, persistiendo una proteinuria en torno a 0,5 g/24 h.
En diciembre de 2006, se presentó en la consulta con lesiones eritematosas, descamativas en manos, pies y codos. Visto en Dermatología, se le diagnosticó de psoriasis. Dado el fracaso del tratamiento con acitretina, en abril de 2009 se decidió utilizar un anti TNF-a (etanercept) durante 9 meses, mejorando significativamente las lesiones cutáneas hasta su desaparición. Paralelamente, la proteinuria descendió hasta la remisión completa a los 6 meses de iniciado dicho tratamiento.
Permaneció en remisión completa de su cuadro glomerular durante 11 meses, con ausencia total de lesiones cutáneas, y en diciembre de 2010 reaparecieron de forma lenta y progresiva manifestaciones psoriásicas en la piel. En ese momento, se detectó nuevamente proteinuria de 0,5 g/24 h.
En la figura 1 se expone un resumen de la evolución del caso.
DISCUSIÓN
Este caso nos llevó a la revisión de tres puntos y de su interrelación:
Psoriasis y afectación renal
La psoriasis es una enfermedad principalmente dermatológica, con repercusión sistémica1. Se caracteriza por la infiltración cutánea de células T activadas y la proliferación de queratinocitos, células dendríticas y células de Langerhans, que tiene como consecuencia una alta concentración de TNF-α en las lesiones psoriásicas2. La disminución de la concentración de TNF-α intralesional y sanguínea por medio de agentes bloqueantes de esta citocina se asocia con mejoría clínica de esta enfermedad3.
La mayoría de las revisiones concluyen que el compromiso renal en la psoriasis es infrecuente, y podría relacionarse con afectación directa en forma de glomerulonefritis (principalmente GNM y nefropatía IgA), microalbuminuria o amiloidosis secundaria (en la literatura hay comunicados unos 20 casos de amiloidosis asociada1); o ser atribuible al tratamiento de la psoriasis con ciclosporina, metotrexate o ésteres de ácido fumárico1,2,4-9. En un artículo con 109 pacientes con psoriasis frente a 178 controles, se objetivó que los primeros tenían significativamente más albuminuria y peor aclaramiento de creatinina (110 vs. 109 ml/min) medido con la fórmula de Cockcroft-Gault. Sin embargo, el diseño y la discusión de este trabajo son muy cuestionables; entre otras cosas, los valores de creatinina sérica no presentan diferencias significativas entre sí10.
Según Zachariae, biopsias renales practicadas de forma incidental a psoriásicos eran normales4.
Con respecto a la función tubular, basándose en los niveles de beta 2-microglobulina en orina, estos pacientes mostraban niveles en el límite alto de la normalidad en dos estudios, por lo que se concluye que la función tubular está indemne en la psoriasis11,12.
En la serie de Szepietowki, la única anomalía renal que se detecta es microalbuminuria, presente en el 22% de los casos y en el 42% de los que tienen lesiones cutáneas severas13. Estos datos se podrían homologar con los recientes hallazgos publicados por Dervisoglu, que observa un 24% de pacientes con microalbuminuria en los que encuentra una correlación entre la proteinuria y el índice de actividad psoriásica14.Cecchi demostró la presencia de microalbuminuria significativa (valores > 20 μg/min) en 32 enfermos psoriásicos frente a un grupo control, correlacionándose con la extensión de las lesiones cutáneas15.
Hay varios casos descritos de nefropatía IgA asociada a psoriasis7,16. El 50% de los pacientes con psoriasis tienen niveles elevados de IgA17. Sin embargo, a la luz de los nuevos hallazgos sobre esta nefropatía, deberían intervenir otros factores para que se produzca daño glomerular.
Sakemi et al. describieron un caso similar al nuestro con GNM y síndrome nefrótico, que posteriormente desarrolló un cuadro de psoriasis. Dichos autores proponen la posibilidad de que el mecanismo inmunológico que asocia el lupus eritematoso sistémico (LES) o la artritis reumatoide con la GNM secundaria sea el mismo que en la psoriasis18.
Actualmente existen varios enfoques sobre la patogenia de la GNM. Uno de ellos postula que se produciría por inmunocomplejos (formados por IgG1 e IgG4 contra antígenos en el lado epitelial de la membrana basal glomerular y en los podocitos, asociados al complemento) que alterarían la permeabilidad de la barrera de filtración. En este daño contribuye la inmunidad celular con expresión incrementada de TNF-α en el glomérulo19-21 y altos niveles de TNF-α circulante22,23. Por este motivo, la inhibición de esta citocina se planteó como un objetivo terapéutico en esa patología20.
El rol del factor de necrosis tumoral alfa
El TNF-α es una citocina producida por muchas células con actividad inmunológica en respuesta a la inflamación24. Es la principal citocina proinflamatoria, aunque hay evidencia de que es también un inmunomodulador25,26.
El etanercept es un dímero formado por el receptor del factor de necrosis tumoral asociado a la porción Fc de la IgG1. Esta proteína recombinante humana inhibe competitivamente la unión del TNF-α a sus receptores TNFR1 (55 kDa) y TNFR2 (75 kDa)3,20.
El etanercept ha demostrado eficacia en el tratamiento de la psoriasis, la artritis reumatoide y la artritis juvenil idiopática3,27,28.
Sin embargo, debido a sus complejas interacciones con otros actores del sistema inmune, se ha observado que puede estimular la autoinmunidad. Esto se puso en evidencia en los casos publicados de aparición de nuevas patologías autoinmunes durante el tratamiento con este agente, como vasculitis ANCA positivas26 y síndromes lupus like29-33. En el LES se observó un papel importante del TNF-α en la producción de autoanticuerpos, ya que tiene diferentes efectos (y a veces contrapuestos) sobre linfocitos B, células dendríticas, linfocitos T y en el proceso de apoptosis. Estos efectos complejos explicarían la producción de anticuerpos antinucleares (anti-ADN, anti-ADNsd) y anticardiolipina que se observa durante el tratamiento con anti TNF-α26.
Pese a la importancia del TNF-α en la patogenia de la GNM ya mencionada, su inhibición con etanercept demostró una disminución del TNFR1 sin ninguna mejoría clínica significativa en un estudio piloto de Lionaki et al.20. Los autores concluyen que dicha ineficacia pudo ser producida por una insuficiente inhibición del TNF-α, provocada principalmente por una farmacocinética desconocida en el síndrome nefrótico20,34.
C1q y daño renal
Algo llamativo en nuestro caso es la presencia de depósitos intensos de C1q en los glomérulos.
El C1q es un factor del complemento muy importante para iniciar la activación de la vía clásica. Al unirse la porción Fc de los inmunocomplejos (principalmente IgG e IgM) con el C1q, se produce un cambio conformacional de la molécula que divide C4 y C2 en sus subfracciones, que, entre otras funciones, estimula la fagocitosis y aumenta la producción de citocinas (TNF-α e IFN-γ)35. A diferencia de la mayoría de las proteínas del complemento, es sintetizada por las células presentadoras de antígenos en vez del hepatocito36.
Los mecanismos por los que se encuentra C1q en las biopsias renales serían: 1) que vaya unido a la porción Fc de las Ig implantadas o de inmunocomplejos circulantes; 2) restos apoptóticos podrían captar C1q facilitando su aclaramiento; 3) el C1q podría unirse a la proteína C reactiva, amiloide o Ig atrapadas en el glomérulo; 4) unión directa del C1q en forma específica con células del parénquima renal; 5) atrapamiento pasivo, y 6) reacción cruzada con antígenos similares al C1q. De este modo se explica que cada vez que estamos frente a una nefropatía con intervención de la vía clásica del complemento se puedan observar depósitos de C1q en la biopsia35.
Sólo cuando los depósitos de C1q son predominantes en la biopsia renal se podría plantear el diagnóstico de nefropatía C1q, con sustratos histológicos tan variables que abarcan desde lesiones proliferativas diversas hasta nefropatías membranosas37,38.
Se ha publicado en la literatura la presencia de estos depósitos en la nefropatía IgM, el LES34,35, en la glomerulopatía del trasplante35,36,39-43, así como en muchas otras entidades tan diferentes como nefroangiesclerosis, nefropatías tubulointersticiales e incluso en dos riñones de donante sin ninguna alteración clínico-analítica (hasta un 19,4% en la serie de biopsias de Vizjak et al.37).
CONCLUSIONES
Por su desarrollo, nuestro caso plantea una posible relación entre daño renal y psoriasis, dada la evolución clínica, como una forma de GNM secundaria, que entra en remisión completa al mismo tiempo que la enfermedad cutánea y reaparece la proteinuria cuando se detectan nuevamente lesiones psoriásicas en la piel. No se puede excluir la participación de la suspensión de los inhibidores del eje renina-angiotensina-aldosterona en la reaparición de la proteinuria. Además, no es descartable una remisión espontánea de una forma idiopática de GNM. Dada la presencia de C1q también podría tratarse de una forma asociada a LES, pero no cumple criterios clínicos ni analíticos de dicha enfermedad sistémica en 9 años de seguimiento, sabiendo que la nefropatía membranosa puede preceder al LES en años. El diagnóstico de nefropatía C1q es improbable en nuestro caso, al no ser estos depósitos dominantes en la inmunofluorescencia.
No se han descrito hasta ahora beneficios terapéuticos directos del etanercept en las GNM, por lo que en este caso podría haber actuado a través del control de la enfermedad primaria.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Resumen de la evolución del caso expuesto y el tratamiento recibido