Sr. Director:
La glomerulonefritis extracapilar (GNE) se caracteriza por la presencia en plasma de autoanticuerpos o inmunocomplejos con capacidad patógena. Entre éstos se encuentran los anticuerpos antimembrana basal glomerulurar (Ac-anti-MBG), típicos de GNE tipo I y anticuerpos anticitoplasma de neutrófilos (ANCA), que se suelen presentar en la GNE tipo III1,2.
Existe una proporción sustancial de pacientes con GNE y doble positividad para ANCA y anti-MBG. Presentamos a un paciente con GNE tipo I con coexistencia plasmática de Ac-anti-MBG y ANCA-p, con severa afectación renal, que no respondió a triple terapia con plasmaféresis, corticoides y ciclofosfamida.
CASO CLÍNICO
Hombre de 62 años que es ingresado en nefrología tras consultar en urgencias por cuadro de malestar general asociado con vómitos biliosos y febrícula vespertina, en tratamiento con azitromicina. Recorte de diuresis en los últimos días, sin sintomatología miccional acompañante. No refiere la toma de AINE o de otros fármacos nefrotóxicos. Como antecedentes personales presentaba enfermedad pulmonar obstructiva crónica, síndrome de apnea obstructiva del sueño, otitis media crónica en seguimiento por otorrinolaringología y botulismo que requirió su ingreso en la UCI en el año 2007. No tenía antecedentes de hipertensión arterial, diabetes mellitus, dislipemia o cardiopatía conocida. En la exploración física presentaba un regular estado general, eupneico en reposo, consciente, orientado y colaborador, normohidratado y normoperfundido. La PA era de 143/95 mmHg, la FC de 75 lat/min, la temperatura de 36,5 ºC y la saturación de oxígeno del 97%. No presentaba lesiones en piel ni en mucosas.
Auscultación cardiopulmonar: tonos cardíacos rítmicos sin soplos audibles. Murmullo vesicular sin ruidos sobreañadidos. Abdomen: blando y depresible. No había signos de irritación peritoneal. No había masas ni organomegalias a la palpación. En las extremidades inferiores presentaba edemas con fóvea hasta la raíz de los miembros, sin signos de trombosis venosa profunda (TVP) ni de insuficiencia venosa crónica, con pulsos positivos. En la exploración neurológica se observaron pupilas isocóricas normorreactivas, pares craneales normales, y fuerza y sensibilidad conservadas por segmentos. No había signos de irritación meníngea.
La analítica al ingreso mostraba: hemoglobina 11 g/dl, hematocrito 34,7%, VCM 92 fl, leucocitos 9.000 (neutrófilos 85%, linfocitos 9,1%), plaquetas 213.000, glucosa 102 mg/dl, urea 265 mg/dl, creatinina 12,2 mg/dl, sodio 137 mEq/l, potasio 7 mEq/l, cloro 107 mEq/l, procalcitonina 0,92 mg/dl, proteínas 7 g/l, calcio 9,6 mg/dl, calcio corregido 9,8 mg/dl, PCR 272,8, bilirrubina total 0,6 mg/dl, AST 19 U/l, ALT 39 U/l, GGT 28 U/l, FA 61 U/l y amilasa 84. Sistemático de orina: proteínas 100 mg/dl, 300 hematíes, nitritos negativos, no leucocitaria. Radiografía de tórax, sin signos de condensación ni derrame, con mediastino normal. En la radiografía simple de abdomen presentaba meteorismo inespecífico.
Gasometría venosa: acidosis metabólica con pH 7,28, CO2 total 20 mmol/l, HCO3- 18,8 mmol/l, EB -7,5. ECG: ritmo sinusal a 75 lat/min, PR normal, QRS estrecho, sin alteraciones agudas de la repolarización. Ecografía abdominal: hígado y bazo sin alteraciones ecográficas. Riñón derecho aumentado de tamaño (15 cm), con pérdida de la diferenciación córtico-medular; no se observaba dilatación de la vía excretora. Riñón izquierdo hipoplásico (descrito en estudios previos). Renograma isotópico con 99mTc-MAG3: anulación funcional del riñón izquierdo. Nefropatía parenquimatosa severa del riñón derecho. Inmunología: IgG 795 mg/dl, IgA 123 mg/dl, IgM 25,1 mg/dl, C3 133 mg/dl, C4 normal, cadenas kappa 161 mg/dl, lambda normal.
Autoinmunidad: ANA, Ac-anti-ADN y ANCA-c negativos, ANCA-p 41U/ml y Ac-anti-MBG 287 U/ml. Proteinograma normal. Serología para VHB y VHC negativa.
Ante estos hallazgos clínicos y analíticos se decide realización de biopsia renal por lumbotomía abierta, dado que el paciente es monorreno funcional.
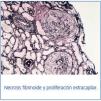
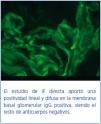
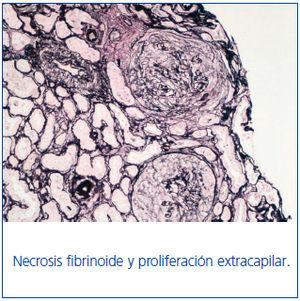
La anatomía patológica describe un total de 49 glomérulos, tres de ellos esclerosados; en el resto dominaba una extensa afectación de la estructura con necrosis fibrinoide y proliferación extracapilar celular y circunferencial en el 100% de los glomérulos. Los vasos de pequeño calibre presentaron, asimismo, vasculitis necrosante. El estudio de IF directa aportó una positividad lineal y difusa en la membrana basal glomerular con IgG positiva, siendo el resto de anticuerpos negativos. En resumen, presentaba glomerulonefritis extracapilar con intensa afectación del 100% de los glomérulos de la muestra e IF típica de glomerulonefritis extracapilar por Ac-anti-MBG (tipo I) (figura 1 y figura 2).
Desde el ingreso el paciente requirió terapia renal sustitutiva. Fue tratado con ciclofosfamida intravenosa a dosis de 1,5 mg/kg/día, metilprednisolona 500 mg/24 h durante 3 días y plasmaféresis (7 sesiones). La ciclofosfamida se suspendió por trombopenia. No hubo compromiso pulmonar en ningún momento durante la evolución.
En la actualidad el paciente permanece en programa de hemodiálisis mediante fístula arteriovenosa como acceso vascular.
DISCUSIÓN
El porcentaje de coexistencia sérica de ANCA-p y Ac-anti-MBG se ha cuantificado en diferentes series en torno al 25%1,3-5. Realmente el perfil clínico, el pronóstico y el rol fisiopatológico de cada anticuerpo de los pacientes con coexistencia sérica de ANCA-p y Ac-anti-MBG aún es materia de investigación. No está claro si la GN asociada con ANCA predispone al desarrollo de enfermedad por Ac-anti-MBG o si en el curso de una GN por Ac-anti-MBG se positivizan los ANCA.
Sin embargo, uno de los factores más relevantes a nuestro entender es que los estudios de IF no se describen de manera rutinaria en la bibliografía, por lo que no tenemos la certeza de que los casos de «doble positividad» se traten de GNE tipos III o I.
En la GNE tipo III ANCA+ se ha descrito la existencia de Ac-anti-MBG hasta en el 5% de los casos. Debido a la mayor frecuencia de esta enfermedad, la mayoría de los casos descritos se incluyen en este grupo. Algunos trabajos sugieren que la GN por ANCA es la que aparece primero, seguida de la enfermedad por Ac-anti-MBG1,3. En estos casos, se ha sugerido que existe una exposición de los antígenos de la membrana basal glomerular y el desarrollo de Ac-anti-MBG.
En la GNE tipo I se ha comunicado que hasta un 30% de los casos pueden asociarse con la existencia de ANCA. Debido a la menor frecuencia de esta enfermedad se han descrito menos casos4,5. La patogenia de esta entidad no se encuentra aclarada y parece que una alteración en la regulación inmunológica produce el desarrollo de ambos, ANCA-p y Ac-anti-MBG.
Además, se ha sugerido que los pacientes con ANCA y Ac-anti-MBG tienen, paradójicamente, mejor pronóstico6. No obstante, esto no se ha confirmado; incluso se afirma que la supervivencia renal en pacientes con doble positividad no es mejor que la de los que tienen únicamente Ac-anti-MBG1,3,8. En un estudio de Lindic et al.10, los pacientes con Ac-anti-MBG y ANCA y una creatinina al ingreso mayor de 5,6 mg/dl no recuperaron la función renal a pesar de tratamiento con prednisolona, ciclofosfamida e intercambio plasmático.
Nosotros presentamos un caso de GNE tipo I con IF positiva lineal y coexistencia sérica de Ac-anti-MBG y ANCA-p. Evidenciamos en nuestro paciente el mal pronóstico de la función renal en estos casos, quedando dependiente de hemodiálisis a pesar de tratamiento agresivo.
Figura 1. Técnica de plata.
Figura 2. Inmunofluorescencia.