El fitato o myo-inositol-1,2,3,4,5,6-hexakis dihidrogenofostato (InsP6) es un compuesto fosforado de origen natural que está presente en numerosos alimentos, principalmente en legumbres, cereales integrales y frutos secos. Los pacientes con enfermedad renal crónica (ERC) experimentan una mortalidad por enfermedad cardiovascular hasta 30veces mayor que la población en general. Las calcificaciones vasculares (CV) contribuyen directamente en la morbimortalidad general, y de forma especial en la ERC. Esta elevada mortalidad se debe, en parte, a la elevación en los niveles de fósforo en sangre. Por ello, el control de fósforo en la dieta es fundamental. El fósforo dietético puede clasificarse en función de su estructura en fósforo orgánico (origen vegetal y animal) e inorgánico (conservantes y aditivos). El fósforo de origen vegetal (legumbres y frutos secos), principalmente asociado a InsP6, es menos absorbible por el tracto gastrointestinal humano siendo la biodisponibilidad del fósforo procedente de estos alimentos muy baja. Datos recientes indican que la restricción impuesta de alimentos que contienen fosfatos vegetales puede comprometer el aporte adecuado de nutrientes que tienen un efecto beneficioso en la prevención de episodios cardiovasculares, como pueda ser la fibra o al propio InsP6 presente en frutos secos y legumbres. Estudios experimentales en animales y observacionales en humanos sugieren que el InsP6 puede prevenir la litiasis, las CV y proteger de la osteoporosis. En conclusión, creemos necesario realizar estudios prospectivos para elucidar los posibles beneficios y riesgos de una dieta rica en fitato (InP6) en la ERC o de su uso como fármaco intravenoso en pacientes en hemodiálisis.
Phytate, or myo-inositol 1,2,3,4,5,6-hexakis dihydrogen phosphate (InsP6), is a naturally occurring phosphorus compound that is present in many foods, mainly legumes, whole grains and nuts. Patients with chronic kidney disease (CKD) have cardiovascular disease mortality up to 30times higher than the general population. Vascular calcifications (VCs) directly contribute to overall morbidity and mortality, especially in CKD. In part, this high mortality is due to elevated levels of phosphorus in the blood. Therefore, control of dietary phosphorus is essential. Dietary phosphorus can be classified according to its structure in organic phosphorus (plant and animal) and inorganic (preservatives and additives). Plant-phosphorus (legumes and nuts), mainly associated with InsP6, is less absorbable by the human gastrointestinal tract as the bioavailability of phosphorous from plant-derived foods is very low. Recent data indicate that restriction of foods containing plant phosphates may compromise the adequate supply of nutrients that have a beneficial effect in preventing cardiovascular events, such as InsP6 or fibre found in legumes and nuts. Experimental studies in animals and observational studies in humans suggest that InsP6 can prevent lithiasis and VCs and protect from osteoporosis. In conclusion, we need prospective studies to elucidate the potential benefits and risks of phytate (InsP6) through the diet and as an intravenous drug in patients on haemodialysis.
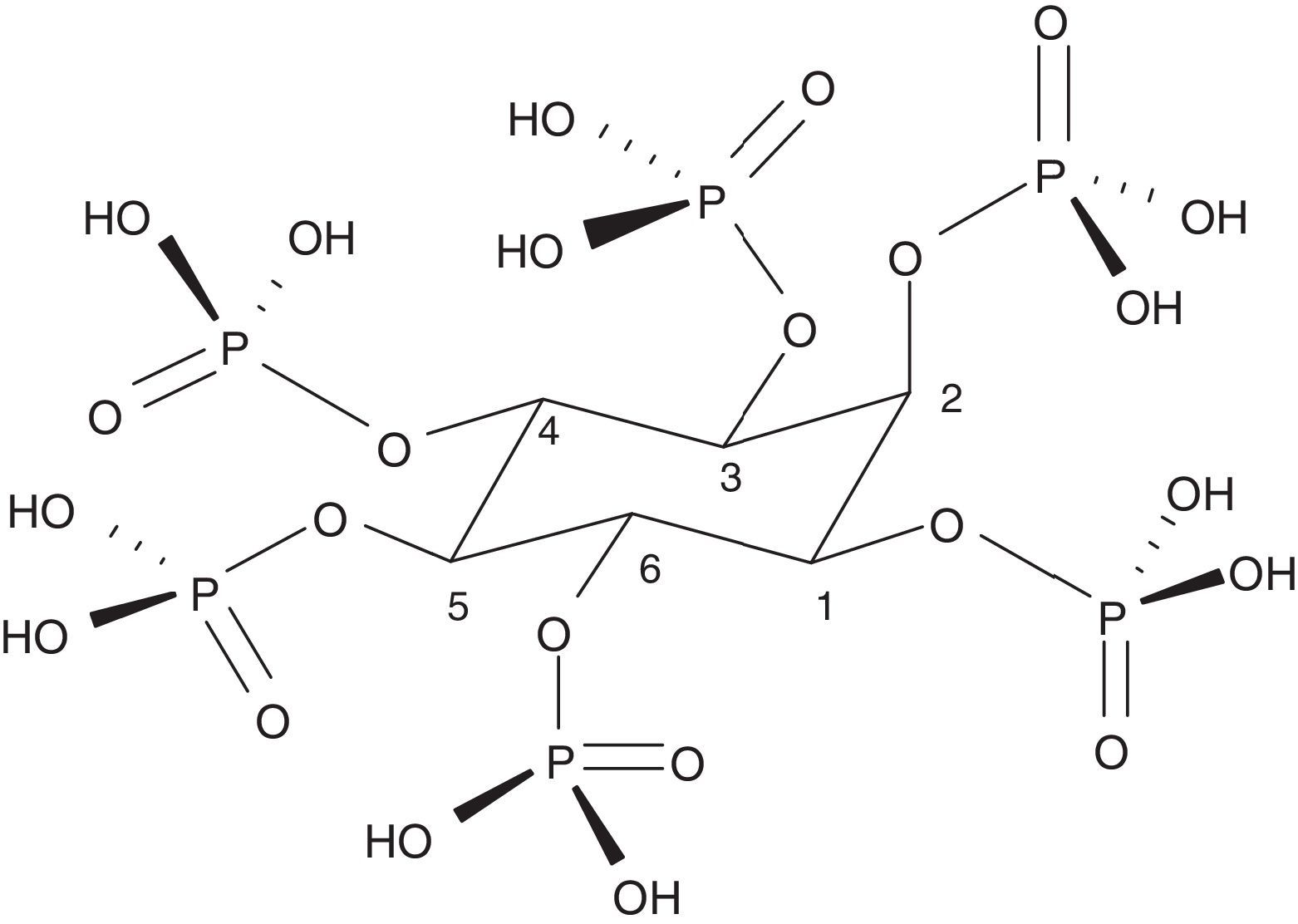
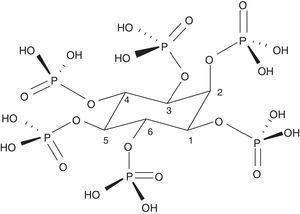
El fitato o myo-inositol-1,2,3,4,5,6-hexakis dihidrogenofostato (InsP6) es la base del ácido fítico (fig. 1). Es un componente natural ampliamente distribuido en el reino vegetal. Sirve como almacén de fosfato y minerales y contiene el 75% del total del fosfato de las semillas. La fuente principal de InsP6 está en los cereales integrales, legumbres, semillas y frutos secos. Estos elementos son muy importantes para la alimentación humana y constituyen del 40 al 60% de las calorías ingeridas en países desarrollados y en vías de desarrollo, respectivamente. En los cereales está localizado principalmente en las capas aleurónicas y en las legumbres en los cuerpos proteicos del endoesperma o el cotiledón. Durante la germinación, el InsP6 es hidrolizado permitiendo que el fosfato, el magnesio y el calcio estén disponibles para el desarrollo de la planta. Es, por tanto, la fuente principal del fosfato de origen vegetal. El InsP6 está presente predominantemente en alimentos no procesados, ya que puede ser degradado durante el procesado y aparecer cantidades variables de inositoles de fosfatos con menor cantidad de fosfatos (myo-inositol pentafosfato…)1. Algunos de ellos, como el inositol trifosfato (DL-Ins1,4,5 P3), son conocidos mensajeros intracelulares, lo cual nos indica la gran importancia que pueden tener estos compuestos en la biología humana. La cantidad de InsP6 que se consume es muy variable y depende mucho del tipo de dieta. En la dieta occidental puede variar de 0,3 a 2,6g al día, y a nivel mundial, de 0,180 a 4,569g al día2. En países en vías de desarrollo y en dietas exclusivamente vegetarianas el consumo puede ser muy importante; en cambio, en dietas con predominio de «comida basura» o con exceso de carne, propias de la dieta occidental, muy bajo1. La dieta mediterránea probablemente contiene una cantidad intermedia de InsP6 en la dieta (1g al día)3. Durante la manipulación doméstica de los alimentos (cocinado alrededor de 100°C) el InsP6 es bastante estable. Sin embargo, la manipulación industrial, en la que se usan condiciones más extremas o se incorporan fitasas, su degradación puede llegar a ser muy importante1.
Fosfato de la dietaEn los pacientes con enfermedad renal crónica (ERC) la hiperfosfatemia puede favorecer la enfermedad óseo-mineral secundaria (osteodistrofia renal), promover la calcificación vascular (CV), los episodios cardiovasculares y la mortalidad4. Por ello, el control del fósforo en la dieta es fundamental. La proteína dietética influye de forma considerable en el consumo de fósforo, dado que normalmente están asociados; no obstante, la relación fosfato/proteína es variable5. El fósforo dietético puede clasificarse en función de su estructura en fósforo orgánico (origen vegetal y animal) e inorgánico (conservantes y aditivos). Por lo general, del 40 al 60% del fósforo de origen animal se absorbe5, mientras que el fósforo de origen vegetal (legumbres y frutos secos), principalmente asociado a los InsP6, es menos absorbible por el tracto gastrointestinal humano5. Al llegar los alimentos al tubo digestivo, para que sea posible la absorción de los fosfatos que contiene el InsP6 es necesario que se produzcan mecanismos de hidrólisis que liberen el fosfato. Los humanos carecemos de fitasas endógenas, por lo que la presencia de fitasas en nuestro tubo digestivo dependerá de la ingesta de alimentos vegetales que contengan fitasas activas. La presencia de dichas fitasas depende del origen de los alimentos (naturales o procesados), ya que durante la preparación y cocción de los alimentos se inactivan, o de que se hayan introducido en la alimentación durante el proceso industrial (por ejemplo, en la fabricación de pan) precisamente para potenciar la hidrólisis del InsP6. Esta hidrólisis puede oscilar entre el 37 y el 66%, dependiendo principalmente de su presencia1. Por ello, en las dietas occidentales la escasa presencia de fitasas hace que apenas se degrade el InsP6 en el estómago o en el intestino delgado, no se libere el fosfato y, por tanto, la absorción de fosfato de origen vegetal sea baja. Por el contrario, se absorbe hasta el 100% del fósforo inorgánico de los alimentos procesados (como el queso y algunos refrescos como los de cola)6-8. Por lo tanto, durante el asesoramiento dietético de los pacientes con ERC no solo se debe tener en cuenta el contenido absoluto de fósforo en la dieta, sino también la estructura química estructura (fosfato inorgánico frente orgánico), el tipo (animal frente a vegetal) y la relación entre proteína y fósforo5,9. En un estudio se comparó la fosfatemia al inicio y a los 3meses de recibir consejo dietético para evitar los alimentos con aditivos de fósforo inorgánico frente a los que continuaron recibiendo la atención habitual. A los 3meses, la disminución de los niveles de fósforo en suero era mayor en el grupo de intervención que en el grupo control10. Otro estudio reciente compara 9 pacientes con ERC que recibían una dieta con proteína de origen vegetal o bien una dieta con proteína de origen animal; se observó que tras una semana la dieta vegetariana redujo más los niveles de fósforo y disminuyeron los niveles de FGF2311. Ante los datos citados anteriormente, no parece razonable restringir en pacientes con ERC el consumo de alimentos que contienen fosfato de origen vegetal (InsP6), como los frutos secos, legumbres y cereales integrales12-14. Este tipo de alimentos, a su vez, son ricos en fibra. De hecho, la dieta rica en fibra puede tener propiedades beneficiosas que durante mucho tiempo se puede haber privado a los pacientes con ERC, como se demuestra en varios estudios de cohortes15-21 o en el estudio PREDIMED22, que sugieren que un consumo moderado de frutos secos y alimentos ricos en fibra en pacientes con ERC o alto riesgo vascular podría tener un efecto protector relevante en la prevención de episodios cardiovasculares23.
Potenciales efectos deletéreos del InsP6El InsP6, por sus características químicas, tiene tendencia a reaccionar con cationes polivalentes como el calcio, el magnesio, el cinc y el hierro, entre otros, y esto podría interferir en la absorción de dichos minerales. De hecho, clásicamente el InsP6 había sido considerado un antinutriente por ese motivo24,25. Sin embargo, el papel beneficioso o deletéreo del InsP6 dependerá del contexto en el que nos movamos. La inhibición de la absorción de estos metales se verá contrabalanceada por la presencia de otros nutrientes como ácidos orgánicos, ácido ascórbico, productos de fermentación de los alimentos, etc., compitiendo con el ácido fítico para la unión a dichos minerales y elementos traza. Por ello, en el contexto de una dieta equilibrada en países desarrollados el efecto inhibitorio de dicha absorción es escaso y no hay evidencia de que en poblaciones bien nutridas el InsP6 tenga ningún efecto perjudicial26-30. Distinta es la situación en países en vías de desarrollo, con dietas principalmente vegetarianas muy pobres en carne, lácteos y otros nutrientes, donde sí es posible que la presencia tan elevada de InsP6 en la dieta contribuya a la malabsorción de calcio, magnesio, hierro y cinc. Por ello, en dichos países se fomenta el desarrollo de alimentos con menor contenido en InsP6, principalmente mediante la adición de fitasas de origen bacteriano31,32.
Efectos beneficiosos del InsP6Aparte de la importancia que puede tener en el balance de fosfato el origen del mismo, con un perfil más favorable para alimentos de origen vegetal, el InsP6 per se, en el contexto de una dieta equilibrada, puede tener efectos muy beneficiosos para la salud, principalmente por su capacidad de inhibición de las calcificaciones patológicas (litiasis, CV…), su efecto antioxidante y su potencial capacidad de prevención de ciertos cánceres. En condiciones de pH fisiológico (alrededor de 6-7), el InsP6 está intensamente cargado negativamente, y dado que no se han descubierto transportadores transcelulares de InsP6, el hecho de que el InsP6 atraviese la bicapa lipídica de las membranas celulares es improbable y, por tanto, su absorción intestinal quedaría restringida a un mecanismo pasivo por vía paracelular. Estudios relativamente recientes en humanos y ratas han podido constatar que el InsP6 intacto se absorbe en una pequeña proporción (<2%), y que su presencia en sangre y orina es totalmente dependiente de su aportación exógena, a día de hoy, solamente a través de la dieta1,33,34. El seguimiento de una dieta mediterránea tradicional supone un aporte diario de InsP6 de 1g aproximadamente3. Sin embargo, se ha observado que la absorción de fitato es saturable y que existen unos niveles plasmáticos máximos que no pueden ser superados por vía oral. No obstante, las concentraciones de InsP6 que se pueden alcanzar por vía oral pueden producir una protección basal natural frente a patologías relacionadas con la calcificación. El abandono de este tipo de dieta y la sustitución por patrones dietéticos en los que la presencia de fibra es muy escasa reduce mucho sus niveles. En unos 15-20días de una dieta sin InsP6 los niveles se reducen hasta cantidades prácticamente indetectables. Se ha podido demostrar que los niveles de InsP6 en orina son representativos del consumo de InsP6 en la dieta35. Algún autor aislado, sin embargo, duda de la presencia natural de InsP6 en orina y plasma, aunque las diferencias de opinión parecen derivadas de los métodos analíticos utilizados en su medición, que son complejos y que durante mucho tiempo han dificultado su estudio en matrices biológicas36-39.
Efecto antioxidanteLas propiedades antioxidantes del InsP6 son una de sus cualidades más importantes40,41. Se basan principalmente en su capacidad para formar complejos muy estables con hierro, que impiden su interacción con peróxido de hidrógeno y la formación de radicales hidroxilo. Su mecanismo de acción es distinto al de otros antioxidantes como el ácido ascórbico o beta caroteno, que actúan como scavengers. Aunque el efecto antioxidante en condiciones in vitro son claras, la evidencia in vivo es escasa, por lo que se requieren nuevos estudios para elucidar la importancia del efecto antioxidante del InsP61.
Actividad anticancerígenaSe ha demostrado el efecto beneficioso del InsP6 en varios tipos de cáncer (principalmente de colon, pero también de hígado, pulmón, mama, próstata, piel y tejidos blandos) en estudios en líneas celulares y algunos modelos animales, aunque su efecto terapéutico in vivo en humanos no ha sido demostrado42.
Papel del InsP6 como inhibidor de las calcificaciones vascularesLa cristalización patológica es un proceso que tiene lugar cuando se producen sólidos cristalinos indeseables bajo condiciones fisiológicas de los organismos. Cuando estos sólidos implican sales cálcicas, los denominamos calcificaciones. Ente ellas destacan la litiasis renal, los cálculos dentales, la condrocalcinosis, la calcinosis cutis y, finalmente, las CV1. En las CV está presente, al igual que en el hueso, un mineral de fosfato de calcio denominado hidroxiapatita (HAP). Las CV contribuyen directamente en la morbimortalidad general, y de forma especial en los pacientes con ERC4,43,44. Los pacientes en diálisis tienen puntuaciones en escalas de calcio de 2 a 5 veces superiores a sujetos de su edad con función renal normal45. La presencia de calcificaciones en la pared arterial se asocia con 3-4 veces mayor riesgo de enfermedad coronaria, ictus e insuficiencia cardiaca46. La calcifilaxis es una enfermedad poco frecuente pero devastadora, que puede llegar a afectar al 4% de los pacientes de hemodiálisis. Empieza con la calcificación de los vasos periféricos de pequeño tamaño y rápidamente se propaga. Es la forma más severa de CV en pacientes en diálisis y afecta solamente a la capa media del vaso. El curso natural lleva al desarrollo de úlceras necróticas muy dolorosas como consecuencia del proceso de CV. Presenta una mortalidad anual del 45-80%47. Todavía no hay tratamientos aprobados específicamente para esta indicación48.
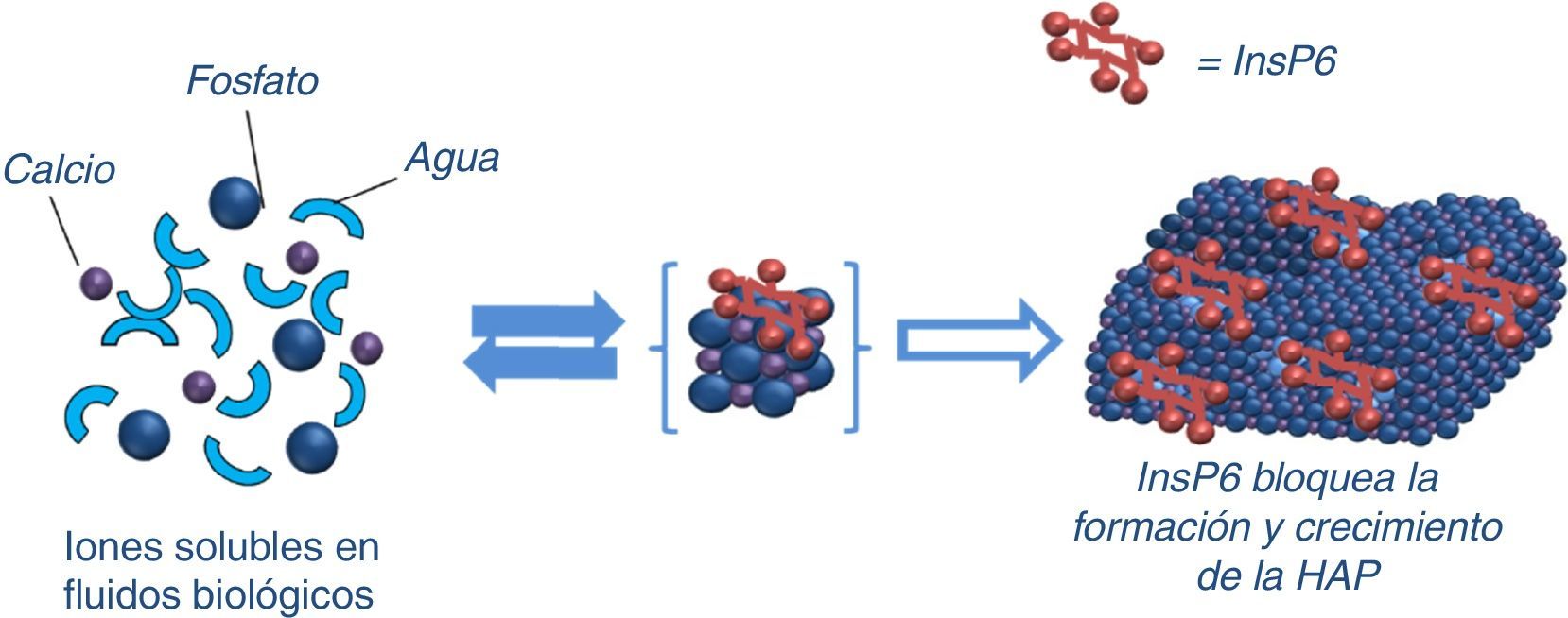
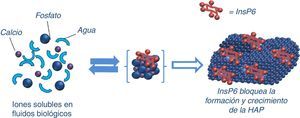
Los primeros estudios que se publicaron sobre inhibidores de la cristalización se remontan a los años sesenta, a cargo de Fleisch y Bliznakov49. El primero que se descubrió fue el pirofosfato inorgánico, que es un polifosfato natural producto de la degradación de muchas reacciones fisiológicas (derivado del AMP), presente en sangre y orina. La fosfatasa alcalina reduce sus niveles tanto plasmáticos como tisulares (por lo que un aumento de fosfatasa alcalina puede contribuir a aumentar las CV). Dado que por vía oral se hidroliza y el pirofosfato no podía ser utilizado por dicha vía, se desarrollaron los bisfosfonatos, que no pueden ser hidrolizados. Son resistentes al efecto de la fosfatasa alcalina50 y por eso pueden penetrar en el hueso. Los bisfosfonatos consisten en 2 grupos fosfonato unidos al mismo átomo de carbono y 2 cadenas laterales R, siendo normalmente una de ellas un grupo alcohol. Se ha descrito el posible papel de los bisfosfonatos en la prevención de CV51,52. Además de su efecto sobre la cristalización, también pueden tener un efecto inhibitorio de la resorción ósea por los osteoclastos; por tanto, son también útiles en el tratamiento de la osteoporosis. Uno de los inconvenientes a nivel óseo es precisamente su elevada vida media sobre la superficie del hueso, pudiendo provocar en pacientes con ERC una enfermedad ósea adinámica50. El InsP6 también actuaría como inhibidor de la cristalización de forma similar (fig. 2), pero según resultados de estudios experimentales, con una potencia mayor al pirofosfato y a los bisfosfonatos, como veremos más adelante. El mecanismo de acción puede ser tanto a nivel de la nucleación (adsorción en la superficie del núcleo) o durante el crecimiento o agregación de los cristales, retardando o impidiendo la cristalización de la sustancia sobresaturada. Sin embargo, en otras ocasiones, precisamente por la adsorción en las caras de los cristales, pueden dificultar su disolución (por lo tanto, la misma sustancia podría dificultar las CV y, a su vez, disminuir la destrucción ósea, protegiendo de la osteoporosis).
Los primeros estudios experimentales en ratas demostraron que el InsP6 dietético reduce de forma significativa las calcificaciones aórticas asociadas al envejecimiento. Se trataron ratas macho Wistar de 10 semanas y asignadas de forma aleatoria a 4 grupos de dietas, 2 de ellas ricas en InsP6 y otras 2 sin InsP6. A las 76semanas de edad todas las ratas fueron sacrificadas y se mineralizaron las aortas, corazones, riñones, hígados y fémures para su análisis químico. Las diferencias más importantes se encontraron en el contenido de calcio de la aorta. Los grupos con InsP6 presentaron niveles de calcio aproximadamente un 40% inferiores a los que siguieron dietas sin InsP653.
Se ha podido comprobar la capacidad del InsP6 para inhibir las CV en ratas sometidas a calcinosis por varios métodos. Mediante la provocación de hipertensión (con nicotina) e hipercalcemia (con vitaminaD a altas dosis) se indujeron calcificaciones en tejido renal de ratas Wistar que habían sido alimentadas por esa dieta sin InsP6. Los animales desarrollaron importantes depósitos de calcio en papilas renales, intersticio renal, túbulos renales y vasos. Las ratas que recibieron dicho tratamiento pero administradas con InsP6 por vía transdérmica no desarrollaron dichas calcificaciones54. En otro estudio de calcinosis por el mismo mecanismo se comprobó ese mismo efecto, esta vez en tejido vascular (aorta) y cardíaco, aplicando el InsP6 también por vía tópica55. Finalmente, el InsP6 transdérmico demostró su efectividad en otro modelo experimental de calcinosis cutis provocado mediante la inyección subcutánea de KMnO456. Usando ese mismo modelo experimental, se comprobó el efecto de dietas con InsP6 sódico al 1% o enriquecidas con germen de algarroba (rico en InsP6) frente a grupo control sin InsP6, y sin InsP6 pero tratadas con etidronato subcutáneo. Se pudo comprobar que solo las que tenían niveles adecuados de InsP6 tenían menos niveles de calcificaciones distróficas57. En otro modelo experimental, en 6 ratas macho Sprague-Dawley de cada grupo se indujo la calcinosis mediante el uso de dosis muy elevadas de vitaminaD (500.000IU/kg) a las 0, 24 y 48h. Un grupo recibió placebo, otro etidronato (0,825μmol × kg−1 × día−1) y otro InsP6 (0,825μmol × kg−1 × día−1). A las 96h de la inyección de vitaminaD las ratas fueron sacrificadas y se usaron sus aortas y corazones para valorar su contenido en calcio. Se comprobó que las ratas tratadas con InsP6 tenían menos calcificaciones aórticas que las tratadas con placebo, pero no las tratadas con etidronato58.
En otra serie de estudios más recientes, 40 ratas Sprague Dawley macho fueron divididas en 3 grupos, tratados respectivamente con 1mg/kg de SNF472 (una formulación intravenosa de InsP6), 15mg/kg de cinacalcet vía oral y 400mg/kg de tiosulfato sódico. Se indujo calcificación mediante la administración de 75.000UI/kg de vitaminaD3 a los 3 días de haber iniciado los tratamientos. Las ratas se sacrificaron a los 14días y se usaron las aortas y corazones para analizar el contenido en calcio. La administración intravenosa de SNF472 redujo las calcificaciones un 60% en aorta y un 68% en tejido miocárdico. El cinacalcet provocó una reducción estadísticamente significativa de la CV un 24%, no así el tiosulfato, por lo que la potencia del InsP6 intravenoso es superior a la de tiosulfato sódico o cinacalet59. En un estudio in vitro se demostró la gran afinidad del SNF472 sobre los cristales de hidroxiapatita60.
Estudios observacionales que relacionan el consumo de InsP6 con la disminución de las calcificaciones vasculares en humanosEn un estudio transversal se evaluó la relación entre niveles fisiológicos de InsP6 urinario (que representa el consumo de InsP6) y calcificaciones valvulares en sujetos añosos valoradas por ecocardiografía. Se dividió la población en terciles según sus niveles de InsP6. Los que presentaban mayores niveles de InsP6 tenían la válvula mitral menos calcificada y tenían menos frecuencia de diabetes e hipercolesterolemia. En el análisis multivariante, la edad, el fosfato en sangre, los leucocitos totales y el InsP6 urinario fueron factores independientes predictores de la presencia de calcificación de la válvula mitral. Además, hubo una correlación inversa entre los niveles de InsP6 y dichas calcificaciones61.
En un estudio transversal prospectivo que hemos realizado recientemente se evaluaron las calcificaciones de la aorta abdominal (CAA) mediante placa de abdomen simple lateral a 69 pacientes con ERC estadios2 y 3 de las consultas de nefrología. Se realizó una encuesta dietética para determinar el consumo de InsP6 en su dieta y los niveles de InsP6 en orina. Se dividió la población de estudio en 2 grupos basándose en si la puntuación de sus CAA estaba por encima o por debajo de la mediana (CAA de 6). Los pacientes sin calcificaciones eran más jóvenes, tenían menor presión de pulso, menor frecuencia de enfermedades cardiovasculares, mayor ingesta de InsP6 y mayor eliminación de InsP6 en orina. Entre los alimentos ricos en InsP6 valorados, se vio que el consumo de lentejas era mayor entre los pacientes con menos calcificaciones. En el análisis multivariante, la edad, la enfermedad cardiovascular previa y el InsP6 urinario (o el consumo de lentejas) estaban independientemente asociados a las CAA. Se especula que el resultado especialmente beneficioso de las lentejas se debía a que, de los alimentos ricos en InsP6, era el que más frecuentemente consumían esos pacientes62.
Papel del InsP6 en otras calcificaciones patológicasEl InsP6 ha demostrado su capacidad de inhibir la cristalización de oxalato cálcico y fosfato cálcico en orina, y su ingesta y sus niveles fisiológicos se han correlacionado con una menor incidencia y/o prevalencia de litiasis renal. Aunque no vamos a revisarlo en profundidad, hay publicada abundante bibliografía54,63-76. Diversos estudios experimentales en ratas han demostrado el potente efecto protector del InsP6 tanto en las calcificaciones del tejido intrapapilar como en la propia orina57. En un estudio en pacientes con litiasis de oxalato cálcico con factores litogénicos activos, estos disminuían tras 15días de una dieta rica en InsP676. Un estudio que evaluó la asociación entre factores dietéticos y riesgo de incidencia de litiasis renal sintomática en 96.245 mujeres durante 8años demostró que una ingesta elevada de InsP6 reducía la incidencia de litiasis renal77. La concentración salival de InsP6 se ha correlacionado inversamente con la incidencia de sialolitiasis78, y se ha demostrado su eficacia en ensayos clínicos en la prevención de la formación de sarro79.
Papel del InsP6 en la osteoporosisEl InsP6 podría tener un papel en la protección contra la osteoporosis. En un estudio en 157 mujeres posmenopáusicas controladas con densitometría se vio que las 70 pacientes que tenían niveles bajos de InsP6 en orina (relacionado con un consumo bajo en InsP6) tenían mayor pérdida de masa ósea en la espina lumbar en 12meses que las que lo tenían elevado80. En otro estudio se observó que las mujeres que consumían alimentos ricos en InsP6 más de 2 veces por semana tenían una densidad ósea por densitometría en calcáneo, columna lumbar y fémur mayor que las que lo hacían una vez por semana o ninguna81. Además de su posible efecto protector por un mecanismo físico-químico (adsorción en las caras de los cristales de HAP), dificultando su disolución, el InsP6 también podría presentar un efecto sobre las células óseas. En un estudio con cultivos de osteoblastos MC3T3-E1 se vio que el InsP6 inhibía la mineralización uniéndose a los cristales en formación a través de sus fosfatos cargados negativamente y mediante la inhibición de la expresión de osteopontina, pero sin embargo no afectaba a la expresión de otros marcadores de diferenciación osteoblástica como fosfatasa alcalina, sialoproteína y osteocalcina. Estos datos sugieren que el InsP6 puede regular la mineralización fisiológica del hueso actuando directamente a nivel extracelular y sirviendo de señal específica a nivel celular para la regulación de la expresión génica de osteopontina82. En un estudio in vitro sobre líneas celulares humanas (células mononucleares circulantes de sangre periférica y células RAW 264.7 osteoclasto-like) se vio que el InsP6 tiene capacidad selectiva de inhibir la osteoclastogénesis83. Podría por tanto haber diferencias significativas en cómo interacciona con el hueso el InsP6 con respecto a los bisfosfonatos50. Es posible que el InsP6 sí sea sensible a ser metabolizado por fosfatasas y que eso ofrezca una ventaja competitiva respecto a los bisfosfonatos, evitando su permanencia excesivamente prolongada sobre el hueso y suponiendo el justo equilibrio entre la inestabilidad del pirofosfato y la larga vida media biológica de los bisfosfonatos.
Uso del InsP6 como tratamiento en humanosUso del InsP6 como suplemento nutricionalExisten productos que se comercializan desde hace años como suplementos nutricionales, complementos vitamínicos o nutricéuticos, que contienen InsP6 en forma de fitina, que es su sal cálcica. Es un producto considerado como sustancia segura, denominada generally recognised as safe (GRAS) por la FDA, y está catalogada en Chemical Abstract
En España existen galletas enriquecidas con InsP6. Hay varios productos en cápsulas que contienen InsP6 junto a vitaminaA y cinc para la prevención de litiasis cálcicas. Recientemente se ha comercializado un producto que contiene InsP6 junto a metionina para acidificar la orina y proteger contra la litiasis fosfocálcica, que se desarrolla con pH en orina elevado. También se ha producido un colutorio para prevención del sarro.
Uso de InsP6 intravenoso como fármaco para pacientes en hemodiálisisActualmente no hay ninguna medicación aprobada para el tratamiento de las CV. SNF472 es una formulación intravenosa de InsP6 que se está desarrollando para 2 indicaciones: reducción de los episodios cardiovasculares en pacientes en diálisis y para el tratamiento de la calcifilaxis. Si bien la ingesta de InsP6 a través de la dieta puede dar lugar a niveles fisiológicos que otorguen una protección natural basal, la presencia de CV patológicas requiera una mayor exposición a InsP6 para su tratamiento. Con este objetivo se está desarrollando el SNF472. Ya se han realizado 2 ensayos clínicos de fasei en los que se ha demostrado su seguridad y tolerabilidad en voluntarios sanos y en pacientes en hemodiálisis a concentraciones suprafisiológicas84,85. Dado que la administración de InsP6 puede provocar una hipocalcemia a dosis elevadas, este efecto puede compensarse en pacientes en hemodiálisis mediante la administración prefiltro del SNF472. Se han realizado estudios de hemodiálisis in vitro que confirman ese dato y su escaso aclaramiento, permitiendo conseguir niveles terapéuticos mediante dicha infusión prefiltro86,87.
ConclusiónEn pacientes con ERC, el consumo de alimentos que contienen fosfatos vegetales (legumbres, frutos secos, fibra…) no solo incrementa menos los niveles de fósforo en sangre que los fosfatos de origen animal o inorgánico, sino que además pueden aportar elementos beneficiosos para la salud, entre los que destaca el aporte de fibra y de InsP6. Estudios experimentales en animales y observacionales en humanos sugieren que el InsP6 puede prevenir la litiasis, las CV y proteger de la osteoporosis. Además, puede tener efectos antioxidantes y anticancerígenos. Ya se utilizan actualmente con suplementos nutricionales para prevención de litiasis. Los resultados iniciales con el fármaco en desarrollo SNF472 resultan muy prometedores y apoyan la continuación de la investigación en esta línea para conseguir el primer fármaco con indicación en la prevención de las CV en pacientes en hemodiálisis y como tratamiento de la calcifilaxis.
Conceptos clave- •
En pacientes con enfermedad renal crónica (ERC), el consumo de alimentos vegetales que contienen fosfatos (legumbres, frutos secos…) incrementa menos los niveles de fósforo en sangre que los fosfatos de origen animal o los alimentos con aditivos de fosfato inorgánico, porque principalmente están en forma de fitato (InsP6), menos absorbible por el tracto gastrointestinal humano porque carecemos de fitasas endógenas.
- •
Los alimentos que contienen fosfatos de origen vegetal además pueden aportar elementos beneficiosos para la salud, entre los que destaca el aporte de fibra e InsP6.
- •
Estudios experimentales en animales y observacionales en humanos sugieren que el InsP6 puede prevenir la litiasis, las calcificaciones vasculares (CV) y proteger de la osteoporosis.
- •
Será necesario realizar nuevos estudios prospectivos para elucidar los posibles beneficios y riesgos de una dieta rica en InsP6 en pacientes con ERC.
- •
Los resultados iniciales con el fármaco en desarrollo SNF472 resultan muy prometedores y favorecen que se siga investigando para conseguir el primer fármaco con indicación en la prevención de las CV en pacientes en hemodiálisis o en el tratamiento de la calcifilaxis.
JP es cofundador y CEO de Laboratorios Sanifit, empresa que está desarrollando el SNF472. JP y FG son coinventores de la patente WO2010018278. El resto de autores declaran no tener conflicto de intereses.