La hiperuricemia y la gota son especialmente frecuentes en pacientes con enfermedad renal crónica (ERC) y en tratamiento con medicamentos diuréticos. La presencia de ERC puede limitar la prescripción y la eficacia de los distintos tratamientos farmacológicos para la gota, incluyendo los medicamentos reductores de la uricemia. Alopurinol y benzobromarona —limitada esta última a la prescripción por especialistas en Nefrología y Reumatología— son fármacos con eficacia clínica reconocida, si bien la ausencia de ensayos con las dosis máximas registradas restringe su aplicabilidad. Las limitaciones para el empleo de estos fármacos son más frecuentes en pacientes con ERC o comorbilidades. Por ello, la aparición de nuevas alternativas terapéuticas es siempre de interés para el clínico. Febuxostat es un medicamento no purínico, potente inhibidor selectivo de la xantino-oxidasa, que ha mostrado en ensayos en paciente con gota, frecuentemente grave y con cifras basales de uricemia muy elevadas, su eficacia para la consecución de niveles terapéuticos de uricemia de forma sostenida y a largo plazo en ensayos de extensión. Su farmacocinética es independiente de la función renal con las dosis registradas en España, no requiriendo corrección de dosis. No hay experiencia en pacientes con ERC avanzada (estadios 4-5, incluyendo diálisis y trasplante), pero su efectividad es igual o superior en pacientes con ERC leve-moderada (estadios 2-3) que con función renal normal.
INTRODUCCIÓN
La gota es una enfermedad frecuente; su prevalencia se estima entre el 0,5 y el 1% de la población adulta en países desarrollados1 y aumenta con la edad, llegando a superar el 3 y el 6% en mujeres y varones mayores de 65 años, respectivamente. La causa de este aumento de prevalencia con mayor edad se encuentra relacionada sobre todo con el incremento en esta población de dos factores: la enfermedad renal crónica (ERC) y el empleo de fármacos diuréticos2. La asociación entre gota y enfermedad renal es bidireccional. Por una parte, la gota aparece frecuentemente por hiperuricemia asociada a ERC o fármacos diuréticos. Por otra, el daño renal que se puede inducir por el empleo de antiinflamatorios no esteroides en dosis altas de forma reiterada para el tratamiento de los síntomas agudos o crónicos de la gota establece una intersección donde la Nefrología y la Reumatología pueden, y deben, colaborar en beneficio del paciente3, y muy especialmente en aquellos pacientes cuya complejidad clínica dificulta el abordaje diagnóstico y terapéutico.
El manejo del paciente con gota, en general, se ajusta escasamente a lo deseable en cuanto a un control adecuado de la uricemia, y esto sucede en especial con el paciente con ERC4. Aunque se ha observado que los nefrólogos se ciñen más a conseguir una diana terapéutica que otros especialistas —incluyendo los reumatólogos5—, el control adecuado de la uricemia no se alcanza en más de la mitad de los pacientes5,6, presumiblemente por una actitud terapéutica conservadora o por limitaciones en la disponibilidad de medidas terapéuticas adecuadas4.
El objetivo final del tratamiento de la gota es solubilizar y conseguir la desaparición de los depósitos de cristales de urato formados en los tejidos, que inducen tanto los episodios de inflamación aguda como la inflamación crónica responsable de las lesiones osteoarticulares7. Esto se consigue con un control progresivo y adecuado de la uricemia, manteniéndola por debajo de 6 mg/dl8 de forma estable y a largo plazo. En pacientes con extenso depósito de urato (poliarticulares o tofáceas), una diana de uricemia más baja puede ser deseable, ya que la velocidad con que desaparecen los depósitos subcutáneos y articulares de urato es inversamente proporcional a la uricemia media durante el tratamiento9,10. Además, el control de los síntomas —al revertir los depósitos de urato— evita la exposición reiterada e incluso crónica de los pacientes a medicamentos como los antiinflamatorios no esteroideos (AINE)11. De hecho, algunas recomendaciones publicadas ya consideran que la presencia de ERC o el tratamiento con diuréticos no sustituible indica iniciar tratamiento reductor de la uricemia al primer síntoma de gota12.
Sin duda, la coexistencia de ERC dificulta el manejo de la hiperuricemia en el paciente con gota, tema sobre el que se centra este artículo, y el advenimiento de alternativas terapéuticas que sean aplicables a pacientes con ERC son siempre bienvenidas13.
LIMITACIONES A LOS TRATAMIENTOS REDUCTORES DE URICEMIA EN PACIENTES CON ENFERMEDAD RENAL CRÓNICA
Los fármacos disponibles en España hasta 2011 con indicación para el tratamiento de la hiperuricemia eran alopurinol y benzobromarona, si bien rasburicasa podía prescribirse como medicamento especial con uso fuera de indicación aprobada. Otros fármacos, como fenofibrato, losartán o atorvastativa, muestran un discreto efecto uricosúrico que puede ser de interés como tratamiento adyuvante en pacientes en los que estén indicados por su comorbilidad asociada14.
Alopurinol es un profármaco de estructura purínica cuyo principal metabolito activo, oxipurinol, inhibe la isoforma reducida de la enzima xantina oxidasa (XO) y de manera no selectiva, ya que además inhibe otras enzimas del metabolismo de las purinas15. Es un medicamento eficaz, si bien presenta ciertas limitaciones inherentes a su aprobación hace medio siglo, cuando los ensayos clínicos eran, al menos en el formato actual, desconocidos. Por ello carecemos de datos de seguridad y eficacia en dosis altas a largo plazo. El único ensayo publicado con dosis de hasta 600 mg al día se realizó recientemente, pero sólo en 17 pacientes con función renal normal y una exposición de sólo 2 meses16.
Los expertos y las recomendaciones aconsejan corregir las dosis de alopurinol a la baja dependiendo del filtrado glomerular (FG) —contrariamente a lo que se indica en la ficha técnica, que desaconseja corregir las dosis de alopurinol empleando estimaciones del FG, por su supuesta inexactitud en pacientes con ERC17—, ya que la excreción de oxipurinol es mayoritariamente como fármaco activo y por la vía renal18. Alopurinol es la causa más frecuente de epidermólisis y síndrome de Stevens-Johnson en países desarrollados19, y una causa frecuente de síndrome DRESS (Drug Related Eosinophylia with Systemic Symptoms), que engloba al previamente conocido como síndrome de hipersensibilidad a alopurinol20. La aparición de toxicidad grave con alopurinol parece asociada a cierta susceptibilidad genética y a la presencia de ERC21, presumiblemente por el empleo de dosis convencionales iniciales, hasta cierto punto altas para el grado de FG.
La estrategia habitual de corrección de dosis se está considerando una actitud conservadora, prescribiéndose un máximo de 300 mg/día por cada dl de FG, y se asocia a un insuficiente control de la uricemia en la mayoría de los pacientes. Una estrategia de elevación lentamente progresiva desde dosis bajas22 parece favorecer la tolerabilidad, pudiendo alcanzarse dosis de entre 400 y 600 mg/día por dl de FG estimado sin aumento del riesgo de toxicidad23.
Aun empleando dosis más bajas inicialmente y con aumentos lentamente progresivos de la dosis, no es infrecuente observar una respuesta insuficiente de la uricemia alopurinol, sobre todo en los pacientes cuya uricemia basal es muy elevada24 y está muy alejada, por lo tanto, de la diana de uricemia terapéutica de la gota, al menos por debajo de 6 mg/dl para favorecer la disolución de los cristales de urato formados en los tejidos8.
Benzobromarona es un benzofurano halogenado que inhibe selectiva y potentemente el trasportador tubular hURAT125, induciendo una pérdida renal de ácido úrico que se asocia a una reducción de la uricemia. Aunque su eficacia se ha mostrado excelente en la práctica clínica en pacientes con ERC hasta estadio 424 y trasplante renal26, su empleo ha sido restringido por la Agencia Europea de Medicamentos (EMA) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) por el riesgo, aunque de muy infrecuente aparición, de toxicidad hepática grave. La Ficha Técnica (FT) actualizada en 2007 restringe su empleo como Medicamento de Uso Hospitalario a médicos especialistas en Nefrología y Reumatología y únicamente en pacientes con gota grave —tofácea o poliarticular— e hiperuricemia asociada a ERC o a trasplante renal en pacientes que muestren ineficacia o intolerancia con tratamiento con alopurinol27. Benzobromarona está contraindicada en pacientes con hiperproducción de ácido úrico, con FG < 20 ml/min o con antecedentes de litiasis28. Dado el riesgo, aunque infrecuente, de toxicidad hepática grave, en FT se recomienda que se realicen análisis de función hepática quincenalmente durante el primer año de seguimiento27. El riesgo de litiasis inducida en pacientes sin antecedentes es bajo en pacientes con excreción renal inadecuada de urato y estimación de la concentración de ácido úrico no disociado inferior a 20 mg/dl29.
En 2004, la AEMPS retiró las formas galénicas con asociación alopurinol-benzobromarona, quedando dicha asociación fuera de indicación aprobada.
FEBUXOSTAT, UNA NUEVA ALTERNATIVA
Febuxostat es un fármaco aprobado por la EMA y la FDA en 200830 y disponible para su prescripción en España desde 2011. Es un medicamento de estructura no purínica, que inhibe de forma potente y selectiva31 (no inhibe otras enzimas del metabolismo de las purinas o las pirimidinas) ambas isoformas32 (oxidada y reducida) de la XO, induciendo una intensa reducción de la uricemia de forma dependiente de la dosis33 en el rango de dosis aprobadas, que en la UE son 80 y 120 mg/día.
Febuxostat muestra una buena biodisponibilidad tras la administración por la vía oral34, que no se modifica con la ingesta de alimentos o antiácidos35. Su farmacocinética tampoco se ve influenciada de forma clínicamente significativa con la toma de AINE36 o hidroclorotiazida37. En sujetos con FG > 30 ml/min y dosis de 80 mg/día no se observan cambios significativos en su farmacocinética, por lo que no se requiere ajuste de dosis38, como tampoco se requiere en pacientes con disfunción hepática leve (Child-A)39.
La eficacia y la seguridad de febuxostat se han ensayado en un total de más de 4.000 pacientes con gota expuestos en un ensayo en fase II, tres ensayos en fase III (APEX [Febuxostat, Allopurinol and Placebo-Controlled Study in Gout Subjects], FACT [Febuxostat Versus Allopurinol Controlled Trial] y CONFIRMS [Efficacy and Safety of Oral Febuxostat in Participants With Gout]) y dos ensayos de extensión procedentes de los ensayos en fase III (FOCUS [Long-Term Safety of Febuxostat in Subjects With Gout] y EXCEL [Allopurinol Versus Febuxostat in Subjects Completing the Phase 3 Trials C02-009 or C02-010]). El ensayo en fase II, controlado con placebo y de un mes de duración, mostró que las dosis de 80 y 120 mg permitían el control adecuado de la uricemia (urato < 6 mg/dl) a entre el 75 y el 95% de los pacientes, respectivamente40.
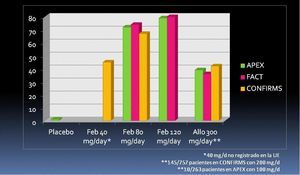
Los ensayos en fase III (APEX, FACT y CONFIRMS) fueron controlados con alopurinol 300 mg/día, si bien en pacientes con ERC se redujo la dosis de alopurinol. El ensayo FACT se diseñó con 52 semanas de duración e incluyó a 762 pacientes. La medida principal de desenlace fue muy restrictiva al definirse como la proporción de pacientes que en los tres últimos controles mensuales y consecutivos mostraban una uricemia por debajo de 6 mg/dl, lo que se observó en el 21, 53 y 62% de los pacientes aleatorizados a tomar alopurinol 300 mg/día, febuxostat 80 mg/día o febuxostat 120mg/día, respectivamente. Este ensayo mostraba la superioridad de las dos dosis de febuxostat frente a la de alopurinol.
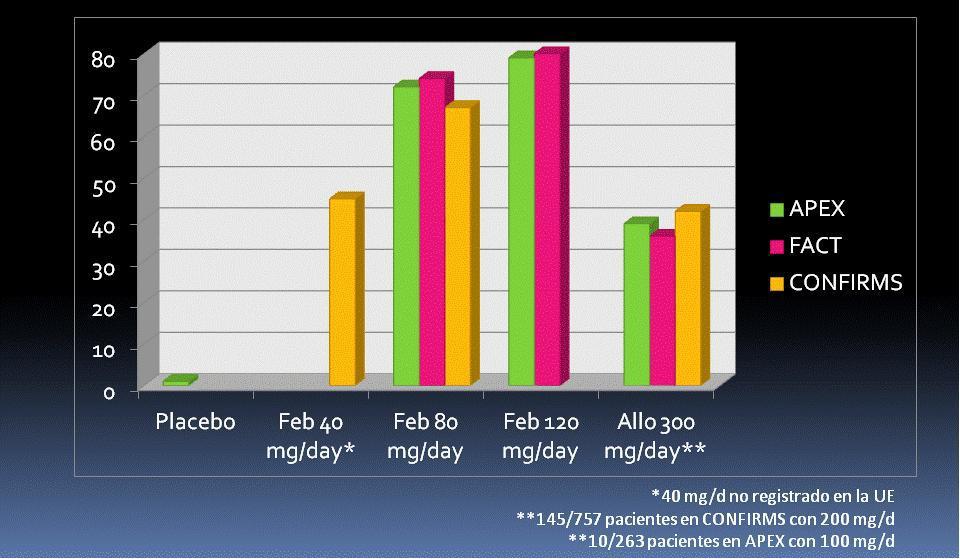
Estos resultados fueron similares en el ensayo APEX, de 28 semanas; incluyó a 1072 pacientes aleatorizados en una proporción 1:1:2:2:2 a placebo, febuxostat 240 mg/d, febuxostat 120 mg/d, febuxostat 80 mg/d y alopurinol 300 mg/d (salvo 10 pacientes con 100 mg/d por ERC)41. La medida de desenlace principal fue la misma que en el FACT, alcanzándose en la última visita, en el análisis por intención de tratar, una uricemia < 6 mg/dl en el 1, 92, 79, 72 y 39% de los pacientes aleatorizados a placebo, febuxostat 240 mg/d, febuxostat 120 mg/d, febuxostat 80 mg/d y alopurinol 300 mg/d, respectivamente. En ensayo CONFIRMS42, de 28 semanas de duración, se aleatorizaron 2269 pacientes a alopurinol 300 mg/d (145 pacientes con FG de 30-60 ml/min recibieron 200 mg/d), febuxostat 80 mg/d y febuxostat 40 mg/d. La dosis de febuxostat de 40 mg/día (no aprobada en la UE) mostró no ser inferior a alopurinol y la de 80 mg (la más baja aprobada en la UE), ser superior a alopurinol. Los porcentajes de respuesta mejoraron en todas las ramas de tratamiento cuando se analizaron los resultados de uricemia en la última visita (figura 1). Febuxostat se ha mostrado igualmente efectivo tanto en pacientes con excreción renal de ácido úrico normal como con excreción renal ineficiente, es decir, con independencia del mecanismo inductor de la hiperuricemia43, y es algo más efectivo en pacientes con ERC que con función renal normal44.
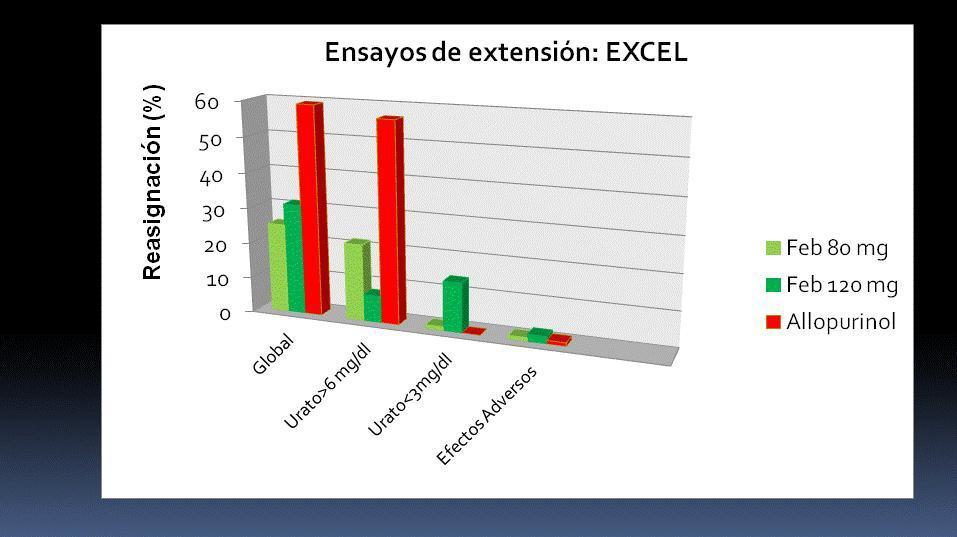
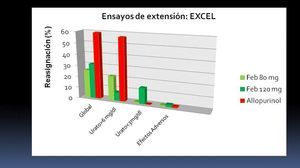
La eficacia de febuxostat y alopurinol se mantiene en el tiempo en los ensayos de extensión FOCUS45 y EXCEL46, de hasta 5 años de seguimiento. El diseño del ensayo EXCEL permitía el cambio de asignación de rama de tratamiento dependiendo del control de la uricemia, mostrando que la mayoría de los pacientes con febuxostat se mantuvieron en el tratamiento asignado por buen control de la uricemia, mientras que la mayoría de los pacientes con alopurinol debieron ser reasignados a febuxostat por insuficiente control de la uricemia. La causa más frecuente de reasignación de pacientes con febuxostat fue una uricemia baja (figura 2).
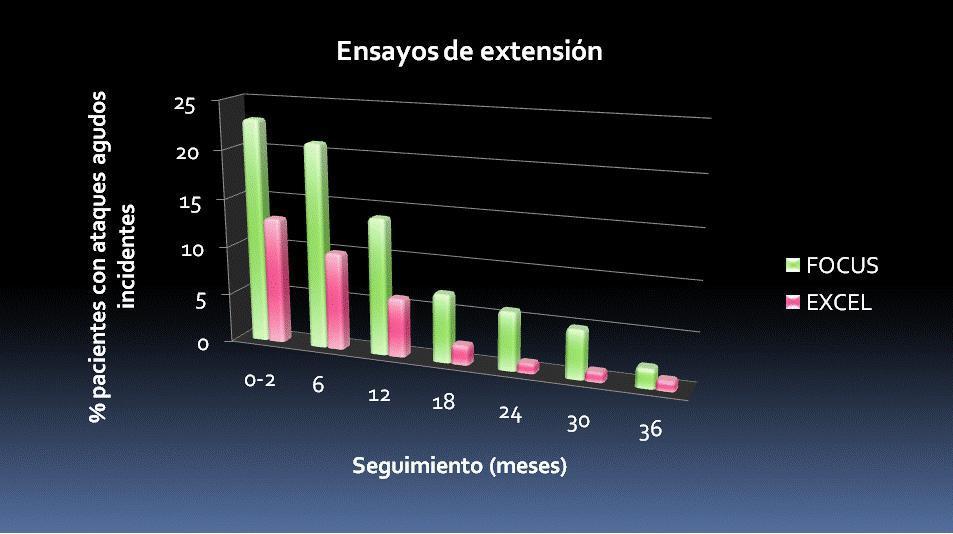
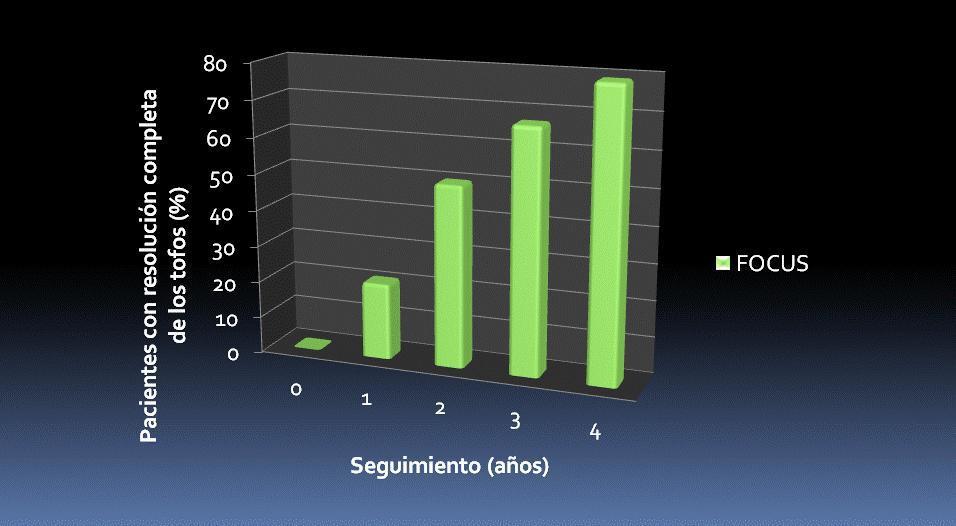
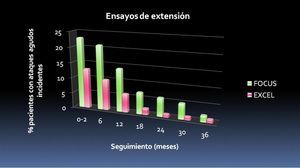
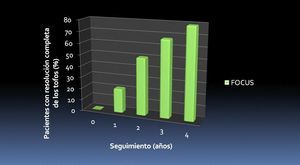
Ambos ensayos mostraron asimismo que el adecuado control de la uricemia (< 6 mg/dl) de forma persistente en el tiempo se asocia a una tendencia a la disminución del número de episodios agudos de inflamación (figura 3) y de los tofos subcutáneos (figura 4).
La tasa de efectos adversos no fue estadísticamente diferente en los pacientes asignados a febuxostat comparados con los asignados a alopurinol, si bien resultó numéricamente mayor con las dosis más altas de febuxostat. La incidencia de eventos vasculares APTC fue numérica, aunque no estadísticamente, diferente en los pacientes asignados a febuxostat. Los eventos adversos más frecuentes atribuibles a febuxostat fueron los ataques agudos de gota asociados a la intensa reducción de la uricemia y a una extensión de la prevención sólo en las 8 primeras semanas de los ensayos APEX y FACT, que no se observó en el ensayo CONFIRMS, en el que la prevención se prolongó a 6 meses, según práctica clínica habitual47. También fueron frecuentes las elevaciones, mayoritariamente transitorias, de los enzimas hepáticos. En algunos pacientes se observaron elevaciones de tirotropina sin impacto clínico. El perfil de seguridad no fue diferente en los ensayos de extensión respecto a los ensayos pivotales en fase III.
Siguiendo la FT europea30, febuxostat está indicado en el tratamiento de la hiperuricemia en pacientes en los que se ha producido depósito tisular de urato. Está aprobada en la UE en dosis iniciales de 80 mg una vez al día por la vía oral y dosis de 120 mg si con la dosis de 80 mg no se obtiene reducción suficiente de la uricemia en un tiempo no inferior a 2 semanas.
No se recomienda en pacientes en tratamiento concomitante con azatioprina o 6-mercaptopurina, por el riesgo de depresión grave del tejido de médula hematopoyética. Asimismo, no se recomienda, hasta disponer de datos de seguridad a más largo plazo, en pacientes con cardiopatía isquémica o insuficiencia cardíaca congestiva ni, por falta de datos disponibles de los ensayos de registro, en pacientes con ERC en estadio 4-5, incluyendo trasplante y diálisis, ni en pacientes con disfunción hepática moderada o grave. Se recomienda tomar precauciones en pacientes con antecedentes de patología tiroidea y en aquéllos en tratamiento con teofilina.
Febuxostat es un fármaco eficaz y efectivo en la reducción y el control adecuado de la uricemia cuando el objetivo es alcanzar el mínimo nivel de uricemia que permita la disolución de los cristales de urato, y una interesante opción de tratamiento en los pacientes con gota. Su intensa actividad reductora de la uricemia y su farmacocinética no dependiente de función renal lo hacen especialmente útil en los pacientes con ERC, en aquellos pacientes con uricemias basales más elevadas —en los que la consecución de la diana de uricemia requerirá dosis más elevadas de alopurinol— y en los casos con depósito de urato extenso13, en los que la consecución de uricemias más bajas se asocia a una más rápida disolución de los depósitos de cristales de urato en los tejidos.
Conceptos clave
1. La presencia de enfermedad renal crónica y el empleo de diuréticos contribuyen al desarrollo de hiperuricemia y gota, y pueden dificultar su tratamiento.
2. El objetivo del tratamiento de la gota es disolver los depósitos de urato presentes y evitar el desarrollo de formas graves de la enfermedad.
3. La consecución de niveles de uricemia de forma persistente inferiores a 6 mg/dl y a largo plazo consigue disolver los depósitos de urato y se asocia a la progresiva reducción y la desaparición de los episodios agudos de inflamación.
4. La presencia de enfermedad renal crónica es una de las principales limitaciones para el tratamiento de la hiperuricemia con alopurinol y benzobromarona.
5. Febuxostat es un fármaco muy eficaz en la reducción efectiva de la uricemia, con una farmacocinética que no requiere ajuste de dosis en pacientes con FG > 30 ml/min.
6. La seguridad de febuxostat no difiere de la de alopurinol en ensayos.
7. No se recomienda, en FT, su empleo en pacientes con enfermedad renal crónica en estadios 4-5 (incluyendo trasplante renal) por falta de experiencia.
Conflictos de interés
El autor declara los siguientes conflictos de interés: es ponente o asesor para Ardea, Menarini, Novartis, Savient. Financiación para investigación: Ministerio de Sanidad, Caiber, Asociación de Reumatólogos del Hospital de Cruces.
Ha participado como ponente en el simposium «Avances en el tratamiento de la gota en pacientes con insuficiencia renal», patrocinado por Menarini.
Figura 1. Porcentaje de pacientes con uricemia < 6 mg/dl. Análisis por IT, última visita
Figura 2. Pacientes reasignados y causas para cambiar el tratamiento
Figura 3. Descenso en los ataques agudos incidentes. Ensayos de extensión
Figura 4. Resolución de los tofos. Ensayos de extensión FOCUS