Cuando se produce un daño en un tejido adulto, el proceso de renovación celular continuada es crítico y crucial para la reparación del mismo y, en determinados órganos, se facilita por la presencia de células madre o progenitoras. El riñón, a diferencia de otros órganos como el hígado, es de regeneración lenta. Incluso ha sido considerado durante años como incapaz de regenerarse. Sin embargo, varios estudios han demostrado que existen posibles nichos de células madre renales en la papila renal, progenitores tubulares o progenitores renales CD24+CD133+ localizados en el polo urinario de la cápsula de Bowman. Estas células podrían participar teóricamente en la reparación de la lesión renal. Sin embargo, todavía no se ha demostrado de forma precisa cuál sería su papel ni cómo actuarían después del daño. Aún así, estas células madre renales podrían ser dianas terapéuticas para el remodelado del tejido renal dañado. Por otro lado, se ha postulado que las células madre derivadas de la médula ósea podrían participar en la regeneración renal, especialmente las de estirpe mesenquimal. Sin embargo, tampoco se conoce con exactitud el modo en que actuarían. Hay estudios que sugieren la existencia de fusión celular entre estas células y células residentes, otros apuntan a su diferenciación en células renales, mientras que otros sugieren una acción paracrina responsable del efecto reparador a través de la secreción de factores de crecimiento como HGF, VEGF y IGF-1. Todas estas moléculas secretadas proporcionarían un entorno regenerativo que limitaría el área del daño y que facilitaría la migración de las células madre.
Cell replenishment is critical for adult tissue repair after damage. In some organs this process is facilitated by stem cells. In contrast to the liver, the kidney has limited regeneration capacity and has even been considered over several years as not being able to regenerate itself. Nevertheless, there are several recent studies suggesting the presence of stem cells in the adult kidney. Stem cell renal niches have been identified in the renal papillae in animals as well as in the urinary pole of the Bowman’s capsule in humans (CD24+CD133+ stem cells). Although these cells may contribute to organ regeneration, how these cells exert this effect and their role after kidney injury is not known. Nevertheless, renal stem cells may be therapeutic targets for treatment of renal diseases. On the other hand, bone-marrow-derived stem cells may also contribute to renal repair, particularly mesenchymal stem cells. However, the mechanism for producing such effect has not been elucidated. Some studies suggest there is cell fusion between bone marrow and resident tubular cells; others suggest that bone marrow cells are able to differentiate in resident cells, while some authors propose bone marrow cells facilitate organ regeneration by a paracrine action; that is by secreting growth factors such as HGF, VEGF and IGF1. All these secreted molecules would provide a regenerative milieu able to constrain renal damage and to amplify stem cells migration to the damaged organ.
INTRODUCCIÓN
La incidencia y prevalencia de enfermedad renal crónica (ERC) continúa aumentando de tal modo que se considera una amenaza mundial para la salud pública1,2. Muchos enfermos con nefropatía crónica acaban desarrollando insuficiencia renal crónica terminal (IRCT), siendo la diabetes la causa más frecuente tanto en España como en la mayoría de países occidentales. La progresión de la enfermedad renal crónica hacia la pérdida de función y la esclerosis renal, aunque con diferente velocidad de progresión, aparece también en otras muchas nefropatías crónicas tanto glomerulares, intersticiales como vasculares. En el fondo se considera que, una vez perdida una cantidad suficiente de masa renal, las nefronas residuales sufren hipertensión intraglomerular, fenómeno que activa localmente, entre otros, el sistema renina-angiotensina-aldosterona (SRAA) induciendo TGF-beta1 y producción de matriz extracelular que acaba amplificando el fenómeno de pérdida de masa renal. Este concepto fisiopatológico, conocido como teoría de la hiperfiltración3, ha sido la base para testar en clínica la utilidad del bloqueo SRAA tanto en nefropatía diabética como en otras nefropatías crónicas. Sin embargo, a pesar del gran avance que han supuesto estos tratamientos (son capaces de reducir o estabilizar la pendiente de pérdida de función renal), el número de pacientes incidentes que requieren tratamiento sustitutivo renal, ya sea diálisis peritoneal, hemodiálisis o trasplante renal, continúa en aumento. En este contexto de escasez de tratamientos o estrategias capaces de inducir regresión de la nefropatía crónica, el estudio de los mecanismos de regeneración renal cobra un enorme interés4,5.
REGENERACIÓN RENAL
Cuando se produce un daño en un tejido adulto, el proceso de renovación celular continuada es crucial para su mantenimiento y, en determinados órganos, se consigue por la presencia de células madre/progenitoras. Las células madre permiten la renovación celular periódica o la regeneración cuando se produce algún daño tisular, tienen la capacidad de autorrenovación mediante divisiones mitóticas o de diferenciarse en los linajes celulares del órgano correspondiente. Además, algunas células madre adultas procedentes de la médula ósea son capaces de diferenciarse en más de un tipo celular (mesenquimales y hematopoyéticas). En general, las células madre adultas son una población celular que se mantiene por sí sola: son células quiescentes que, durante la regeneración del tejido, se dividen asimétricamente, por una parte, en células madre y, por otra, en células amplificadoras en tránsito (transit-amplifying cells) que proliferan, se diferencian y, finalmente, reconstituyen el tejido dañado6. Una de las maneras para identificar células madre en órganos sólidos es el marcaje con bromodeoxiuridina (BrdU). Las células quiescentes, que no se dividen, mantienen niveles altos de BrdU depositada en el genoma, mientras que las células que se dividen son células más diferenciadas que van diluyendo constantemente la BrdU depositada en su genoma a medida que van proliferando.
El riñón está considerado clásicamente como un órgano incapaz de regenerarse. Aun así, posee un cierto grado de regeneración que varía según la especie. Algunos peces cartilaginosos forman nefronas durante su vida adulta, aunque los mamíferos han perdido esta capacidad. De hecho, en humanos, no se forman nuevas nefronas después de 36 semanas de gestación7. El riñón es uno de los pocos órganos que sufre una transición de mesénquima a epitelio (MET) durante el desarrollo8. Este proceso está gobernado por factores de crecimiento tales como hepatocyte growth factor (HGF) y bone marrow protein-7 (BMP-7), entre muchos otros. Por tanto, el desarrollo renal en los mamíferos requiere de un proceso de conversión de las células del mesénquima metanéfrico en células epiteliales polarizadas9. Tal como ya hemos mencionado, cuando independientemente de la causa se produce un daño renal crónico lo suficientemente extenso, la función renal va empeorando de forma inexorable hasta llegar a la IRCT, sin que existan tratamientos capaces de revertir el proceso10. Uno de los procesos que intervienen en la progresión de las nefropatías es la transición de epitelio a mesénquima capaz de producir matriz extracelular. Precisamente, se trata del proceso inverso al que se produce durante el desarrollo fetal del riñón.
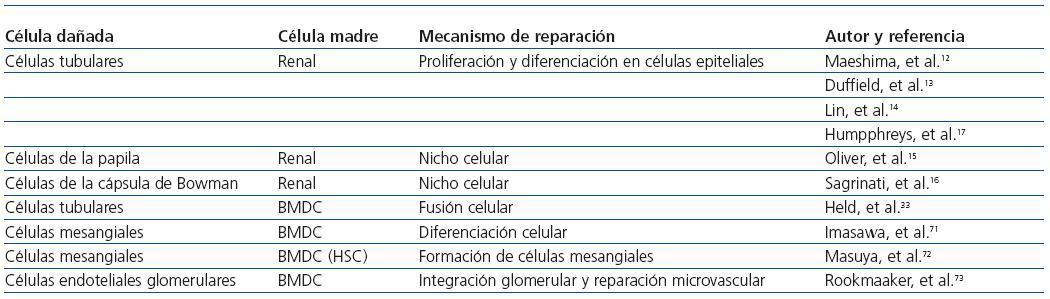
La regeneración renal podría abordarse a partir de diferentes estrategias, como la administración de factores de crecimiento capaces de revertir la transición de epitelio mesénquima e incluso a partir de la movilización o infusión de células madre endógenas (propias del riñón) o exógenas (derivadas de la médula ósea). Sin embargo, el reto resulta de enorme dificultad. El riñón tiene una arquitectura muy compleja, una gran heterogeneidad celular y es de renovación celular lenta. Contiene más de 24 tipos de células maduras distribuidas en compartimentos vasculares, intersticiales, glomerulares y tubulares8. Todo esto complica la búsqueda de células madre adultas11 capaces de reparar el riñón reemplazando las células dañadas. En cualquier caso, la regeneración renal requeriría de mecanismos muy precisos capaces de gobernar la reparación de cada uno de los compartimentos renales dañados. Se han realizado estudios que apoyan la presencia de células madre en el riñón adulto, evidenciando una función intrínseca para estas células. Sin embargo, no es tan clara la participación de las células madre derivadas de la médula ósea12-17 (tabla 1).
CÉLULAS MADRE Y REGENERACIÓN RENAL
Células madre renales
El riñón tiene una estructura muy compleja y un grado de regeneración muy bajo en comparación con otros órganos. Esto hace difícil estudiar la existencia de nichos de células madre renales e investigar su participación en la reparación del órgano. Superando estas dificultades con diferentes estrategias, se ha propuesto la existencia de algunos nichos de células madre en diferentes compartimentos renales. Maeshima, et al.12 describieron una población de progenitores tubulares con propiedades regenerativas, que proliferarían y se diferenciarían en células epiteliales durante la regeneración tubular. De hecho, se desconoce el origen de las células que reemplazan a las células epiteliales tubulares dañadas, pero algunos estudios sugieren que son de origen renal y que no provienen de la médula ósea13,14. Oliver, et al.15 identificaron la papila renal como nicho de células madre en el riñón adulto. Observaron un conjunto de células en la papila renal que retenían BrdU. Después de un daño isquémico, detectaron que estas células entraban en ciclo celular, desapareciendo de esta manera el marcaje con BrdU. Además, estas células eran capaces de formar esferas in vitro. Sin embargo, la localización en la papila renal genera dudas acerca de cómo estas células son capaces de repoblar los segmentos más proximales de la nefrona. En estudios recientes se ha identificado en humanos un subconjunto de progenitores renales CD24+CD133+ en la cápsula de Bowman16, en la porción próxima al polo tubular. Esta localización permitiría una reparación de las células epiteliales glomerulares y tubulares. Se ha descrito que las células progenitoras CD24+CD133+ tienen capacidad de diferenciación, proporcionando un mecanismo regenerativo para células epiteliales renales dañadas18,19. La existencia de estos progenitores epiteliales renales ofrece una posible explicación a la regresión de lesiones renales. El proceso de reparación del daño probablemente requiere de la capacidad de frenar la respuesta fibrótica, de manera que las células progenitoras deberían ser capaces de regenerar el tejido y, a la vez, eliminar la acumulación de matriz extracelular18. Esta última acción la podrían ejercer a través de su capacidad de secretar factores de crecimiento como comentaremos más adelante. En otro estudio, Appel, et al.20 postularon que, puesto que los podocitos no pueden regenerarse por sí mismos, las células epiteliales parietales glomerulares (que proliferan y están contiguas a los podocitos) migrarían al ovillo glomerular y se diferenciarían en podocitos. Aunque se han podido identificar varios nichos de células madre renales, todavía se desconoce cuál es su papel y en qué modo actúan en la reparación después de la lesión renal. Aun así, las células madre renales podrían ser dianas terapéuticas para la remodelación del tejido renal dañado21.
Células madre derivadas de la médula ósea
La médula ósea contiene diferentes tipos de células madre, incluyendo células madre hematopoyéticas (HSCs), células madre mesenquimales (MSCs) y células progenitoras endoteliales. Las HSCs expresan marcadores de superficie como Sca-1, c-kit, CD90 en ratón y CD34, CD133, CXCR4 y CD150 en humanos y pueden diferenciarse en cualquier tipo celular sanguíneo adulto. Las MSCs, además de crear un ambiente de soporte para las HSCs, son capaces de diferenciarse en varios tipos celulares de origen mesenquimal, como hueso, cartílago, músculo, neuronas, hepatocitos y tejido adiposo22-25. Tienen la propiedad de adherirse al plástico y expresan marcadores de superficie como CD90, CD73, CD105, CD44 y CD29. Estas células MSCs también expresan factores de crecimiento como VEGF, HGF y IGF-1, así como citoquinas antiapoptóticas. Se está investigando actualmente el papel de las células madre derivadas de la médula ósea en la regeneración del riñón después de un daño. La terapia celular es en este momento uno de los campos de mayor interés en biomedicina, de tal modo que la utilización de estas células multipotentes para restablecer la función de un órgano dañado ha generado una enorme expectación.
La técnica más utilizada para estudiar la plasticidad de las células de la médula ósea es el trasplante de médula ósea (TMO). Las células de médula ósea del receptor son sustituidas por las células de médula ósea del donante y, una vez establecido el quimerismo, las células procedentes del donante pueden ser identificadas a través de diferentes estrategias. Entre éstas destaca la identificación de cromosoma Y en un receptor femenino, la expresión de moléculas como beta-galactosidasa, luciferasa o enhanced green fluorescent protein (EGFP) o por el restablecimiento de una función en un modelo animal knockout26. Para comprobar el tipo celular (tubular, mesangial, etc.) al que han dado lugar las células derivadas de la médula ósea se suele utilizar el marcaje de proteínas específicas a través de inmunohistoquímica, inmunofluorescencia y análisis mediante microscopia confocal.
Un número importante de glomerulopatías se inicia por daño de los podocitos o pérdida del número de éstos. Los podocitos son células con interdigitaciones complejas que participan en la síntesis de componentes de la membrana basal glomerular (MBG), siendo el colágeno IV uno de los más importantes. Varios estudios han sugerido la integración de las células derivadas de la médula ósea como podocitos funcionales. Se han realizado estudios en modelos murinos con síndrome de Alport, que sufren mutaciones en el gen que codifica para la cadena alfa del colágeno IV, dando lugar a defectos en la MBG, proteinuria e insuficiencia renal. Prodromidi, et al.27 y Sugimoto, et al.28 observaron que las células derivadas de la médula ósea contribuían a la regeneración de podocitos en los glomérulos dañados, dando lugar a un restablecimiento de la expresión de la cadena alfa-3 del colágeno IV y a una disminución de la proteinuria. En un estudio publicado hace unos años en ratones, el TMO procedente de ratones diabéticos obesos db/db en ratones sanos no diabéticos transfería la nefropatía diabética a los receptores sin producirles hiperglucemia. Los autores postulaban que probablemente el glomérulo se repoblaba de células mesangiales y endoteliales del donante db/db y que éstas eran las responsables de la albuminuria y glomerulosclerosis que desarrollaban los receptores29.
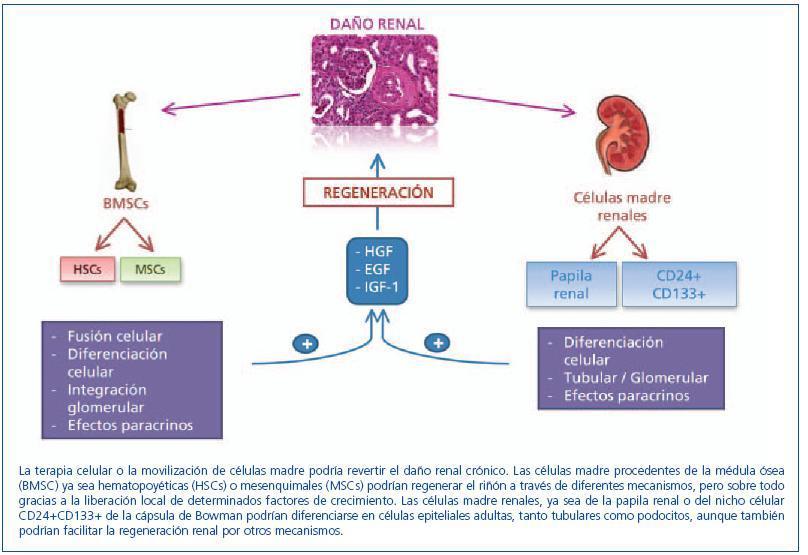
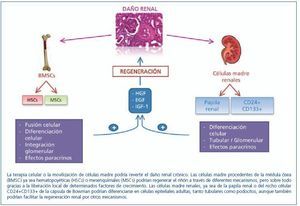
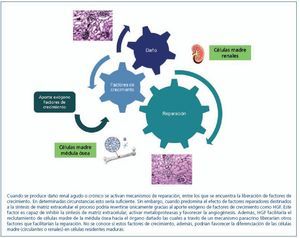
Por otro lado, hay autores que sugieren la participación de las células derivadas de la médula ósea en la regeneración del riñón fusionándose con las propias células renales. De hecho, se ha demostrado en el hígado que los hepatocitos generados después de un daño hepático se forman por fusión celular y no por diferenciación de las células madre hematopoyéticas30-32. Así, se postula también una posible fusión celular entre células madre provenientes de la médula ósea y células tubulares epiteliales. Held, et al.33 observaron que, después de un daño, las células epiteliales tubulares se generan por fusión de las células hematopoyéticas y las células tubulares proximales ya existentes y no por transdiferenciación. Sin embargo, esta cuestión sigue siendo muy controvertida, puesto que varios estudios apuntan a una acción paracrina/endocrina de las células madre endógenas en lugar de una repoblación directa de las nefronas dañadas34. En resumen, además del posible papel de las células madre endógenas (renales), otros estudios apoyan la diferenciación y/o fusión de las células derivadas de la médula ósea como precursores de las células renales dañadas (figura 1).
FACTORES DE CRECIMIENTO
Las células epiteliales tubulares que sobreviven al daño secretan factores de crecimiento que podrían interactuar con células residentes y células madre renales y extrarenales acelerando los mecanismos de reparación tubular. El epitelio tubular es relativamente quiescente y su estado replicativo es lento (lo que caracteriza, a la vez, a las células madre), pero, en cambio, tiene una gran capacidad de regeneración morfogénica tras una agresión tóxica o isquémica graves35. Aunque algunos estudios muestran cómo las células madre migran al tejido dañado36,37 la mayoría de autores no apoyaría una integración de estas células en los órganos lesionados. En este sentido, Duffield, et al.13,38 demostraron que la reparación renal es independiente de la participación de las células derivadas de la médula ósea, algo que también observaron Lin, et al.14. Por otro lado, Morigi, et al.39 demostraron cómo la infusión de células mesenquimales humanas derivadas de la médula ósea hacía disminuir el daño tubular proximal y mejoraba la función renal en un modelo murino. Se han realizado varios estudios que no han podido verificar la diferenciación de células madre en células epiteliales, pero se ha descrito que las células madre contribuyen en la recuperación renal. Se propuso entonces que la migración de las células facilita la regeneración solamente por efectos endocrinos/paracrinos40,41 y que son las propias células renales las que restablecen el epitelio tubular13,14,38,42.
Interacciones entre células madre, células residentes renales y factores de crecimiento
La interacción entre las células de origen mesenquimal y epitelial con factores de crecimiento es fundamental para la nefrogénesis y el mantenimiento de la integridad del órgano adulto43,44. Esta interacción recíproca entre célula mesenquimal-epitelial es un factor clave en la regeneración renal después de un daño.
Se han realizado estudios en modelos animales de daño renal agudo administrando factores de crecimiento como epidermal growth factor (EGF), hepatocyte growth factor (HGF) o insulin-like growth factor 1 (IGF-1), observando una reducción de la mortalidad debido a una restauración y normalización de la función renal45. De hecho, es bien conocido que las células epiteliales tubulares que sobreviven al daño secretan factores de crecimiento y citocinas involucradas en mecanismos de reparación renal. Por otro lado, parece probado que las MSC tienen efectos protectores, especialmente en modelos de daño renal agudo gracias a su capacidad de expresar factores de crecimiento como VEGF, HGF y IGF-1 que facilitarían la recuperación del daño renal46,47. Este sistema podría actuar de un modo autocrino (las propias células renales secretarían factores de crecimiento), paracrino (las células madre renales y las de médula ósea) y endocrino (factores circulantes solubles). Brevemente, repasaremos algunos de estos factores.
Glial cell line-derived neurotrophic growth factor (GDNF). Es un factor implicado en la organogénesis renal. La administración exógena de GDNF protegería contra el daño renal isquémico en un modelo murino y aceleraría los mecanismos de reparación. In vitro, GDNF induce la migración de MSC e inhibe la apoptosis de MSC48.
Epidermal growth factor (EGF). Es un factor que se sintetiza en el epitelio renal y aumenta después de un daño49. Ejerce diferentes acciones en varios tipos celulares, como la migración y la proliferación50,51. Se ha demostrado que EGF induce la proliferación celular y la migración de MSC in vitro52.
HGF. Es un heterodímero formado por una cadena α de 69 kDa y una cadena beta de 34 kDa53,54. La unión de HGF con su receptor c-Met induce la activación del dominio tirosin kinasa, dando lugar a actividades mitogénicas y angiogénicas en varios tipos celulares, preferentemente en células epiteliales y endoteliales55. Además, tiene efectos antiapoptóticos y antifibróticos. El efecto antiapoptótico está directamente relacionado con la vía de señalización fosfatidilinositol-3 kinasa-Akt56, mientras que el efecto antifibrótico está ligado a su acción antagonista sobre TGF beta-157. HGF modula el balance entre la síntesis y la degradación de matriz extracelular, incrementando la expresión de metalopreoteasas (MMP) y reduciendo la producción de inhibidores de MMP (TIMP). Además, HGF suprime el efecto de TGF beta-1 bloqueando la vía TGF beta/Smad58. HGF es capaz de contrarrestar la acción profibrótica de TGF beta-1 en diversas células renales por diferentes mecanismos, entre los que destacaría la inhibición de la transición epitelio-mesénquima. Además se sabe que TGF beta-1 y HGF inhiben su síntesis de manera recíproca59 y que HGF también disminuye la regulación de la expresión del receptor de TGF beta-1 in vivo. Algunos autores describieron una reducción de TGF beta-1 mediante un suplemento exógeno de HGF en varios modelos de daño crónico60-62. Resulta interesante destacar que HGF tiene también un efecto sobre las células derivadas de la médula ósea, atrayendo a las células madre al lugar del daño. Lo que se desconoce es si HGF posee un efecto movilizador y/o localizador de estas células63. En un estudio realizado en un modelo de daño hepático, Kollet, et al.64 demostraron el efecto de HGF sobre el reclutamiento de células hematopoyéticas en el hígado dañado. Cuando se producía un daño en el hígado (por irradiación o por inflamación), se producía un aumento en la expresión de SDF-1 y de la actividad de MMP-9, dando lugar al reclutamiento de progenitores hematopoyéticos mediados por SDF-1. En otro estudio realizado en un modelo murino de fibrosis hepática inducida por CCl465 se observó que HGF per se no aumentaba la expresión de MMP-9. El tratamiento con G-CSF se utiliza para promover el reclutamiento de células derivadas de la médula ósea. La sobreexpresión de HGF junto con el tratamiento con G-CSF aumentaba sinergísticamente MMP-9 en el hígado fibrótico a la vez que incrementaba el número de células derivadas de la médula ósea y de células hepáticas que expresaban MMP-9. Por otro lado, es bien conocido que la inhibición de la actividad de HGF da lugar a un empeoramiento de la reparación tisular57,66.
Vascular endothelial growth factor (VEGF). Es un factor que regula el crecimiento vascular tanto en tejidos normales como en tejidos dañados. Las células mesenquimales son capaces de secretar este factor67-69. La isquemia renal inhibe la expresión de VEGF mediante diversos mecanismos, desplazando el balance desde un ambiente proangiogénico a un ambiente antiangiogénico, inhibiendo por tanto la reparación renal. Las MSC expresan VEGF y podrían ejercer acciones paracrinas renoprotectoras que facilitarían la recuperación del daño renal agudo. Incluso se ha postulado que la administración de dosis elevadas de eritropoyetina en un modelo de lesión endotelial atenúa el daño mediante la liberación de VEGF70.
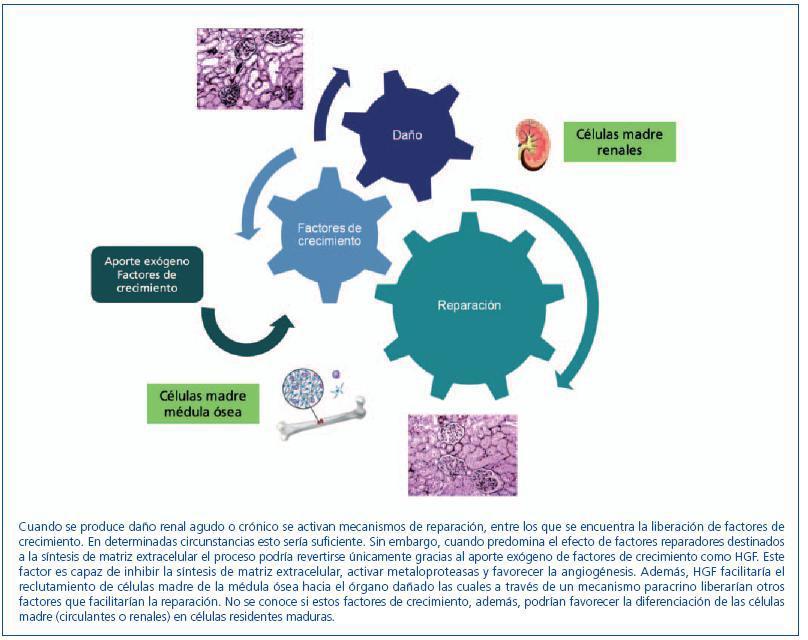
En resumen, determinados factores de crecimiento, muchos de ellos implicados en la embriogénesis renal, son capaces de inducir directamente cierto grado de reparación tisular, a la vez que podrían actuar sobre las células madre residentes facilitando su diferenciación e incluso favorecer el reclutamiento renal de células madre procedentes de la médula ósea que, directamente o a través de la secreción de los propios factores de crecimiento, contribuirían a la regeneración renal (figura 2).
CONCEPTOS CLAVE
La incidencia de ERC continúa aumentando y muchos pacientes acaban desarrollando IRCT a pesar de los avances en renoproteción. Debido a ello existe un enorme interés en el estudio de mecanismos de regeneración renal buscando futuras aplicaciones clínicas.
Se han descrito posibles nichos de células madre renales en la papila renal y en el polo urinario de la cápsula de Bowman y también se han observado células progenitoras tubulares. No se ha demostrado de forma fehaciente que células madre derivadas de la médula ósea se diferencien e integren in vivo como células renales adultas.
El nicho de células madre renales CD24+CD133+ localizado el polo urinario de la cápsula de Bowman en humanos podría contribuir a la regeneración tubular y podocitaria. La células madre prodecentes de la médula ósea teóricamente podrían diferenciarse en células endoteliales y mesangiales.
El proceso de reparación del daño se consigue primero frenando la respuesta fibrótica y después recuperando la arquitectura tisular del órgano. La administración de determinados factores de crecimiento, a la vez que actuar como antifibrótico, podría movilizar células madre renales y procedentes de la médula ósea. Estas células, directamente, fusionándose con células renales residentes, o por mecanismos paracrinos, facilitarían la regeneración renal.
AGRADECIMIENTOS
Esta investigación ha sido posible gracias a las becas ISCIII/FIS PI06/0582 y PS09/01630. María Flaquer es receptora de una beca predoctoral IDIBELL.
Tabla 1. Participación de las células madre endógenas (renales) o exógenas (derivadas de la medula ósea) en la regeneración del tejido renal
Figura 1. Células madre y regeneración renal
Figura 2. Factores de crecimiento y regeneración renal