Introducción: La plasmaféresis (PF) es una técnica de aféresis terapéutica utilizada en el tratamiento de diversas enfermedades renales y sistémicas con distintos grados de eficacia clínica demostrada. Objetivo: Analizar los resultados globales de la indicación de PF en el Hospital Universitario de Canarias, enfocados a resultados de su efectividad y seguridad en diversos grupos de enfermedades. Material y métodos: Se trata de un análisis descriptivo retrospectivo de una serie de casos que analiza los resultados de la indicación de PF desde el uno de enero de 2006 hasta el 31 de diciembre de 2009 en nuestro centro. Se revisaron las historias clínicas y se recogieron datos demográficas (sexo y edad), parámetros bioquímicos, enfermedad de base, volumen y tipo de reposición utilizado en la sesión de PF (albúmina humana al 5% y/o plasma fresco congelado), complicaciones asociadas con la técnica, días transcurridos desde la sospecha clínica diagnóstica hasta el inicio de la técnica de aféresis, número de sesiones de PF recibidas, mortalidad del paciente, grado de afectación renal y evolución de la función renal. Resultados: Estudiamos a 51 pacientes, de 50 ± 18 años, el 60% eran hombres, 331 sesiones de PF. Las enfermedades tratadas se agruparon como: 11 vasculitis, 15 inmunoactivaciones del trasplante renal, cinco síndromes hemolítico urémicos, siete casos de púrpura trombótica trombocitopénica o idiopática, dos inmunizaciones Rh fetal, dos enfermedades hematológicas y cuatro casos de enfermedades neurológicas, entre otras. La mortalidad global fue del 19,6 % (n = 10); en seis de los casos, secundaria a shock séptico y en el resto como resultado de la evolución de la enfermedad de base y uno por shock hemorrágico en el área de la biopsia renal. No hubo fallecimientos en el grupo de inmunoactivación del trasplante. En el grupo de vasculitis se produjeron tres fallecimientos (dos de ellos secundarios a un shock séptico). Nueve de los 10 pacientes que fallecieron lo hicieron dentro de los tres primeros meses tras el diagnóstico. De las 26 biopsias renales realizadas, las indicaciones más frecuentes fueron: vasculitis (23%), rechazos humorales (42%), rechazo humoral más toxicidad por anticalcineurínicos (12%) y síndrome hemolítico-urémico (8%), entre otros. Veinticuatro pacientes precisaron hemodiálisis al inicio del cuadro clínico, nueve de los 11 pacientes con vasculitis, cuatro de los cinco pacientes con síndrome hemolítico-urémico y cinco de los 15 pacientes con inmunoactivación del trasplante. Al final de la evolución, 14 de ellos permanecieron en programa de hemodiálisis. Concretamente, cinco de 11 pacientes con vasculitis, dos de 15 pacientes sometidos a trasplante y tres de cinco pacientes con síndrome hemolítico-urémico. De forma significativa, los pacientes que evolucionaron hacia enfermedad renal terminal en el grupo de las vasculitis eran de mayor edad y tenían una mayor creatinina en el comienzo de la enfermedad. En los pacientes sometidos a trasplante en quienes se monitorizaron anticuerpos anti-HLA de clases I o II medidos por luminex pre y post-PF se objetivó una media de descenso del título de anticuerpos en todos excepto en un caso; el descenso medio fue del 51 al 31%. En general, la técnica de PF transcurrió prácticamente libre de complicaciones. Se constataron cinco reacciones al plasma fresco (3%) de carácter leve-moderado (hormigueo peribucal y reacciones urticariformes) que requirieron premedicación con esteroides y no supusieron la interrupción del tratamiento. Conclusión: Teniendo en cuenta la gran variedad de enfermedades que pueden beneficiarse de la PF y el carácter esporádico de algunas de ellas, la publicación de la experiencia con esta modalidad terapéutica cobra gran importancia, ya que si incrementamos la descripción de series de casos por centros, podemos ayudar a ampliar el nivel de evidencia en términos de supervivencia y función renal en múltiples patologías infrecuentes. Nuestro estudio aporta una información útil y valiosa para la práctica clínica habitual y, sin duda, nos hace reflexionar sobre estrategias futuras que optimicen el pronóstico en nuestros enfermos.
Introduction: Plasmapheresis (PP) is a therapeutic apheresis technique used in the treatment of various renal and systemic diseases with varying degrees of proven clinical efficacy. Objective: To review our experience with PP at the Hospital Universitario de Canarias, focused on effectiveness and safety results in different disease groups. Material and methods: A retrospective-descriptive study of patients treated with PP from 01/01/2006 to 31/12/2009 at the hospital. We analysed medical histories and demographic data (sex, age), biochemical parameters, underlying disease, volume and type of replacement used in the PP sessions (5% human albumin and/or fresh frozen plasma), complications with the technique, delay in starting PP treatment after suspected clinical diagnosis, number of PP sessions received, patient mortality, degree of renal impairment and evolution of renal function. Results: There were 51 patients studied, aged 50±18 years, of whom 60% were male; 331 PP sessions were performed. The diseases treated were grouped as: 11 vasculitis, 15 transplant immune activation, 5 haemolytic-uraemic syndrome (HUS), 7 idiopathic or thrombotic thrombocytopaenic purpura, 2 foetal Rh immunisations, 2 haematological diseases, 4 neurological diseases, among others. Overall mortality was 19.6% (n=10): 6 cases secondary to septic shock and the rest as a result of the evolution of the underlying disease, with 1 due to haemorrhagic shock in the renal biopsy area. There were no deaths in the transplant immune activation group. In the vasculitis group, there were 3 deaths (2 secondary to septic shock). Of the 10 patients who died, 9 did so within the first three months after diagnosis. Of the 26 renal biopsies performed, the most frequent indications were: vasculitis (23%), humoral rejection (42%), humoral rejection with calcineurin-inhibitor toxicity (12%) and HUS (8%), among others. Haemodialysis (HD) was required by 24 patients at the start of clinical symptoms: 9 of the 11 patients with vasculitis, 4 of the 5 patients with HUS and 5 of the 15 patients with transplant immune activation. At the end of evolution, 14 of them remained on the HD programme: 5 of the 11 patients with vasculitis, 2 of the 15 transplant patients and 3 of the 5 HUS patients. Significantly, patients who developed end kiney disease (EKD) in the vasculitis group were older and had higher creatinine at the onset of the disease. The transplant patients were monitored for anti-HLA class I or II before and after PP; there was a mean decrease of antibody titres in all but one patient; with an average decrease of 51% to 31%. In general, the PP technique was virtually free of complications. There were only 5 (3%) mild-moderate reactions to fresh plasma (perioral tingling and urticarial reactions) requiring pre-medication with steroids, but which did not lead to discontinuation of the treatment. Conclusion: Taking into account the wide variety of diseases that can benefit from PP and the nature of some of them, publishing our experience with this therapeutic method is of great importance. By increasing the description of case series by centre, we can add survival and renal function evidence in many uncommon diseases. Our study provides useful information for clinical practice and has also led us to reflect on future strategies to optimise outcomes in our patients.
INTRODUCCIÓN
La plasmaféresis (PF) es una técnica de aféresis terapéutica que elimina, por transporte convectivo a través de una membrana semipermeable, sustancias de alto peso molecular del plasma (autoanticuerpos, complejos inmunes, cadenas ligeras, endotoxinas, crioglobulinas, lipoproteínas)1-3. Aunque el ámbito de indicación de la PF se extiende a un amplio rango de especialidades, en muchos hospitales se ha convertido en una subespecialidad dentro de la nefrología debido al dominio de las técnicas de depuración de la sangre por parte de los nefrólogos. Teniendo en cuenta el carácter esporádico de las enfermedades que pueden beneficiarse de la PF, la experiencia de esta técnica suele apoyarse en publicaciones de serie de casos o estudios no controlados, lo que impide alcanzar un nivel de evidencia sólido en términos de supervivencia y función renal. Por ello, la experiencia individual global, aunque suele ser limitada, cobra importancia en esta modalidad terapéutica.
Por todo ello, nos hemos propuesto analizar los resultados globales de la indicación de PF en el Hospital Universitario de Canarias, enfocados a resultados de efectividad y seguridad en diversos grupos de enfermedades.
MATERIAL Y METÓDOS
Se trata de un análisis retrospectivo de una serie de casos que analiza los resultados de la indicación de PF desde el uno de enero de 2006 hasta el 31 de diciembre de 2009 en nuestro centro. Se revisaron las historias clínicas y se recogieron datos demográficas (sexo y edad), parámetros bioquímicos, enfermedad de base, volumen y tipo de reposición utilizado en la sesión de PF (albúmina humana al 5% y/o plasma fresco congelado), complicaciones asociadas con la técnica, días transcurridos desde la sospecha clínica diagnóstica hasta el inicio de la técnica de aféresis, número de sesiones de PF recibidas, mortalidad del paciente, grado de afectación renal y evolución de la función renal.
Indicación de plasmaféresis
La indicación de PF y su pauta de aplicación se apoyó, fundamentalmente, en las Guías elaboradas y actualizadas periódicamente por la American Society for Apheresis (ASFA) y la American Association of Blood Banks (AABB). Brevemente, según la AABB2,3, las indicaciones se clasifican en cuatro categorías basadas en la eficacia clínica encontrada en la literatura1-3 y que resumimos de la sighuiente forma:
Categoría I. La PF está indicada como tratamiento de primera línea o coadyuvante de otros tratamientos iniciales en determinadas patologías. La eficacia se basa en ensayos clínicos o en una amplia base de la evidencia publicada, donde queda demostrada y aceptada su eficacia.
Categoría II. Se acepta como apoyo a otros tratamientos más establecidos en lugar de actuar como tratamiento de primera línea.
Categoría III. El uso de la aféresis terapéutica no está claramente basado en la evidencia científica. La experiencia es aún insuficiente para establecer su eficacia y la relación beneficios/riesgos no está aún claramente demostrada.
Categoría IV. Los estudios disponibles y contrastados han demostrado carecer de eficacia terapéutica.
Protocolo de plasmaféresis y aspectos técnicos
En cada sesión de PF el volumen extraído era de 1 a 1,5 veces el volumen plasmático, y el número total de sesiones dependía de la enfermedad de base y de la evolución clínica de cada paciente. Los pacientes que recibían plasma fresco como líquido de reposición recibían gluconato cálcico como profilaxis de hipocalcemia secundaria al citrato.
En el 22% de los pacientes se utilizó como acceso vascular la fístula arteriovenosa (pacientes con inmunoactivación pretrasplante y postrasplante renal). En el resto de los pacientes se canalizaron catéteres venosos centrales de alto flujo (1,67 ± 0,9 catéteres por paciente).
La elección del líquido de reposición empleado en nuestros pacientes fue variable, pero en los que presentaban sangrado, déficit generalizado de factores de coagulación, púrpura trombocitopénica trombótica (PTT) o síndrome hemolítico-urémico (SHU), el líquido de reposición indicado fue plasma fresco congelado1,4.
Para el análisis de resultados, agrupamos a los pacientes según el motivo de indicación de PF:
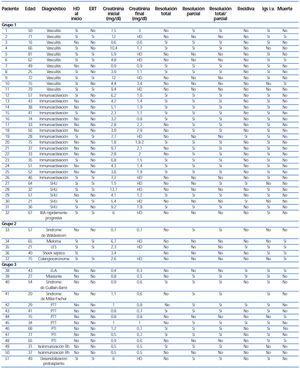
Grupo 1. Grupo de pacientes en los que se indicó PF para el mantenimiento de la función renal: vasculitis, inmunoactivación del trasplante renal, SHU, insuficiencia renal rápidamente progresiva. En este grupo se consideraba resolución total del cuadro si la creatinina disminuía por debajo de 2 mg/dl tras el tratamiento y respuesta parcial si la función renal quedaba con creatinina mayor de 2 mg/dl, pero sin necesidades de diálisis, y proteinuria mayor de 1,5 g en 24 horas.
Grupo 2. Grupo de pacientes en los que se indicó la PF por riesgo vital: enfermedades hematológicas, lupus eritematoso sistémico (LES), shock séptico o colangiocarcinoma.
Grupo 3. Grupo de pacientes en quienes se indicó PF para mejorar otros parámetros clínicos: enfermedades neurológicas, PTT o idiopática (PTI), inmunización Rh fetal o desensibilización del trasplante.
En estos dos últimos grupos se consideraba resolución parcial o total en función de la mejoría total o parcial de la clínica o bioquímica del paciente: así, en las enfermedades neurológicas el objetivo era la recuperación sin déficits neurológicos o mejoría sintomática rápida que permitiera resolver situaciones graves para la autonomía funcional del paciente; en el caso de la PTT, de la PTI o de anemias hemolíticas, la recuperación de los parámetros hematológicos, además de los clínicos; en el síndrome de hiperviscosidad, la resolución de las manifestaciones neurológicas, etc. En cada caso se comentará en particular la evolución individual de cada paciente.
Estudio estadístico
Al tratarse de un trabajo descriptivo de pacientes, sólo se aplicaron tests de estadística básica descriptiva, es decir, medias y frecuencias. El programa informático utilizado para el análisis estadístico fue el SPSS 13.0 software (SPSS Inc., Chicago, IL).
RESULTADOS
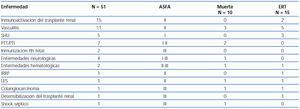
Cincuenta y un pacientes recibieron un total de 331 sesiones de PF, durante un período de cuatro años. El 60% eran hombres y la edad media fue de 50 ± 18 años. Las enfermedades tratadas se han agrupado según la sospecha diagnóstica inicial y se describen en la tabla 1. Como puede apreciarse, la mayoría de los diagnósticos iniciales se englobaban dentro de las vasculitis e inmunoactivación del trasplante, seguidas de PTT/PTI y SHU.
Tras obtener los diagnósticos definitivos, observamos que, de los 15 pacientes tratados por inmunoactivación del trasplante renal, 14 presentaron rechazo agudo mediado por anticuerpos en la biopsia del injerto. De los pacientes con vasculitis, la mitad de ellas fueron granulomatosis de Wegener o poliangeítis microscópica (PAM), y el resto, vasculitis seronegativas, así como un caso de LES asociado con PAM, un caso de síndrome de Goodpasture, un caso de síndrome renopulmonar y un caso de crioglobulinemia asociada con virus de la hepatitis C. De los cinco pacientes tratados por SHU, uno fue debido a rechazo agudo humoral del injerto, dos secundario a toxicidad por tacrolimus y los dos restantes fueron secundarios a mutación del factor H del complemento y a hipertensión arterial (HTA) maligna, respectivamente.
Del grupo inicial de las plaquetopenias, cuatro casos se debieron a PTT (un caso asociado con síndrome paraneoplásico por neoplasia gástrica) y tres, a PTI. Las enfermedades neurológicas incluían un caso de Guillain-Barré, una crisis miasteniforme, un caso de síndrome de Miller-Fisher y una esclerosis lateral amiotrófica, y las enfermedades hematológicas incluyeron un caso de mieloma con coagulopatía asociada y un caso de enfermedad de Waldeström.
De las 26 biopsias renales realizadas, las indicaciones más frecuentes fueron: vasculitis (23%), rechazos humorales (42%), rechazo humoral más toxicidad por anticalcineurínicos (12%) y SHU (8%), entre otros.
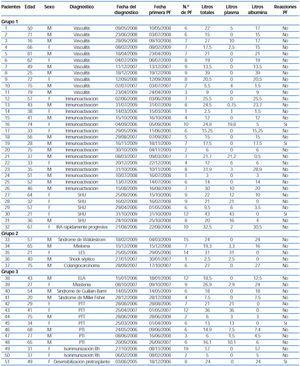
Se describe a continuación, por grupos diagnósticos, la evolución de los pacientes y de forma resumida en la tabla 2 y en la tabla 3.
Grupo 1
Vasculitis
1. Hombre de 50 años remitido desde La Palma por insuficiencia renal rápidamente progresiva (IRRP), con creatinina de 7,5 mg/dl con hallazgo de anticuerpos anticitoplasma de neutrófilo (ANCA) positivos. Presentaba clínica de un mes de evolución consistente en artralgias, mialgias, orinas espumosas y «de color té». Fue trasladado a nuestro centro, en el que nició hemodiálisis y se le realizó una biopsia renal con el hallazgo de gromerulonefritis (GMN) necrosante pauciinmune con semilunas frescas. Recibió tratamiento con bolos de esteroides y posteriormente prednisona oral a dosis de 1 mg/kg/día con descenso posterior y un bolo de ciclofosfamida (0,5 g/m2), para continuar con bolos mensuales en La Palma. Recibió, además, seis sesiones de PF con un volumen total removido de 22 litros, con reposición de 5 litros con plasma fresco congelado y 17 litros con PPL. Recibió una dosis de inmunoglobulinas al finalizar la última PF. No presentó reacciones adversas. Su evolución posterior fue favorable desde el punto de vista de la clínica sistémica y con recuperación parcial de la función renal.
2. Hombre de 71 años sin antecedentes clínicos de interés. El 23 de junio de 2008 acudió a urgencias por astenia, anorexia, distermia y coluria con analítica que mostraba creatinina de 12 mg/dl, proteinuria y sedimento con microhematuria. En las pruebas complementarias destacó el hallazgo de ANCA PR3 positivos en el límite alto. El día 30 de junio de 2008 se le realiza una biopsia renal en la que se observa GMN extracapilar pauciinmune con semilunas frescas. Recibió tratamiento con bolos de esteroides (500 mg/día, tres días) y posteriormente prednisona oral, cuatro bolos de ciclofosfamida (0,5 g/m2) y seis sesiones de PF (tres diarias, tres alternas), con reposición total con PPL e inmunoglobulinas post-PF (0,5 kg/m2) en las cuatro últimas PF. La clínica sistémica mejoró parcialmente, pero no la función renal, y el paciente fue mantenido en hemodiálisis. Como complicación presentó hemorragia y sangrado grave diferido un mes después del tratamiento por el punto de biopsia renal y falleció.
3. Hombre de 16 años de edad diagnosticado de LES con vasculitis asociada (anticuerpos antinucleares [ANA] 1/160, anti-ADN negativo, ANCA positivo, antimieloperoxidasa [anti-MPO] positivo) con glomerulopatía lúpica tipo IV diagnosticada por biopsia en diciembre de 2007. Había sido tratado con esteroides y bolos mensuales de ciclofosfamida. Ingresó en La Palma en abril de 2008 por hemorragia pulmonar tratada en su hospital de referencia con bolos de esteroides y ciclofosfamida intravenosa hasta ocho dosis (la última en septiembre de 2008). Ingresó en nuestro centro en septiembre de 2008 por anemización, astenia y elevación de la velocidad de sedimentación globular (VSG) tras administración del octavo bolo mensual de ciclofosfamida, con aparición en la radiografía de tórax de un infiltrado alveolar difuso en las bases pulmonares. En la tomografía computarizada (TC) torácica se evidenciaron áreas de neumonitis difusa bilateral «en vidrio esmerilado», probablemente secundarias a una hemorragia pulmonar previa. Se realizó broncofibroscopia, que confirmó la hemorragia pulmonar reciente (hemosiderófagos en el lavado broncoalveolar del 99%). Conjuntamente con los servicios de reumatología y de neumología, se decidió iniciar programa con PF (seis sesiones diarias) con reposición parcial con plasma fresco congelado por el antecedente de hemorragia pulmonar. No presentó reacciones adversas y en cinco ocasiones se coaguló el sistema de líneas. Tras la última PF recibió una dosis de inmunoglobulinas de 0,25 g/kg y una dosis de rituximab. La evolución clínica fue favorable con control de la hemorragia pulmonar. La función renal permaneció normal en todo momento. Tras el inicio de PF disminuyó el título de ANA de 1/160 hasta 1/40, así como el título de anti-MPO de 40 a 28,5 U/l. El complemento y la VSG se normalizaron. Posteriormente, el paciente recibió cuatro dosis de rituximab, con inicio posterior de micofenolato y mantenimiento con esteroides con estabilidad de la función renal, proteinuria de 1,8-2 g/24 horas, microhematuria persistente y normotensión.
4. Mujer de 66 años de edad que ingresó en febrero de 2009 en la unidad de vigilancia intensiva (UVI) por síndrome renopulmonar, con hemorragia pulmonar e insuficiencia renal aguda (IRA). Se sospechó la presencia de una enfermedad de Wegener con título de ANCA PR3 positivo. No se realizó biopsia renal por detectarse un nódulo en el polo inferior del riñón izquierdo. Recibió tratamiento con bolos de esteroides (3 g i.v.) y, posteriormente, prednisona oral a dosis de 1 mg/kg de peso con descenso posterior. Ciclofosfamida: cuatro bolos mensuales de 1 g y tratamiento de mantenimiento inicialmente con ácido micofenólico y posteriormente con azatioprina. Recibió, además, varias sesiones de PF (siete sesiones a días alternos) desde el 8 hasta el 20 de febrero de 2009. No presentó reacciones adversas. La respuesta fue favorable, con mejoría de la clínica sistémica y disminución progresiva de los títulos de ANCA. La función renal que inicialmente comenzó con creatinina de 10,4 mg/dl y oliguria, así como con necesidades de hemodiálisis, fue recuperándose lentamente, con salida de programa tres meses después. Desde junio de 2009 su creatinina es de 1,7 mg/dl, con microalbuminuria, los títulos de ANCA son negativos desde mayo de 2009 y recibe tratamiento de mantenimiento con prednisona y azatioprina.
5. Hombre de 81 años que ingresó el 18 de abril de 2009 por insuficiencia renal crónica reagudizada y neumonía. Su enfermedad de base era nefroangiosclerosis. Inicialmente se sospechó que el deterioro de la función renal estaba en relación con un cuadro de sepsis respiratoria, pero el estudio inmunológico evidenció títulos positivos de ANCA MPO positivos, por lo que se sospechó una grmerulonefritis rápidamente progresiva (GNRP) de grado III. El deterioro del estado respiratorio, junto con la anemización, hicieron sospechar la existencia de una hemorragia pulmonar, aunque la broncoscopia no fue concluyente. El paciente ingresó en la UVI desde el 23 hasta el 28 de abril de 2009 y recibió bolos de esteroides (500 mg/día, tres días) y posteriormente prednisona oral. También recibió dos bolos de ciclofosfamida (0,5 g/m2) y siete sesiones diarias de PF con reposición total con PPL. Recibió una dosis de inmunoglobulinas al finalizar la última PF. El paciente no presentó reacciones adversas y aunque la evolución clínica fue favorable con disminución de los títulos de ANCA desde 320 hasta 130 y 30 tras las PF, la evolución de la función renal no lo fue, quedando el paciente en programa de hemodiálisis.
6. Mujer de 62 años de edad en programa de hemodiálisis crónica desde mayo de 2008, con enfermedad de base no filiada (nunca se le realizó biopsia renal). Ingresó el 4 de julio de 2009 en la UVI por un cuadro de hemorragia pulmonar interpretado en el seno de una vasculitis seronegativa. Recibió un bolo de ciclofosfamida, esteroides y ocho sesiones de PF con reposición con PPL; la última sesión se llevó a cabo el 20 de julio de 2009. Recibió una dosis de inmunoglobulinas al finalizar la última PF. La evolución clínica no fue favorable y falleció dos meses después, el 6 de septiembre de 2009, por una asociación de múltiples complicaciones durante el ingreso, principalmente sepsis de origen respiratorio por neumonía asociada a la ventilación mecánica por Morganella morgagni y Klebsiella pneumoniae, a lo que se añadió en agosto una hemorragia digestiva secundaria a erosiones de mucosa en íleon, yeyuno y segunda porción duodenal, lesiones ulcerosas en el yeyuno y neoformación en la papila duodenal. Ante este último hallazgo, junto con hiperbilirrubinemia abrupta de hasta 15 mg/dl de predominio directo, un cuadro clínico de trombopenia persistente grave y refractaria al tratamiento que aunque inicialmente coincidió con las sesiones de PF y que posteriormente se mantuvo en el tiempo, se decide la limitación del esfuerzo terapéutico y seguimiento por parte de la unidad de cuidados paliativos hasta su fallecimiento.
7. Hombre de 49 años de edad, con antecedentes personales de interés de hepatopatía por virus de la hepatitis C, vasculitis leucocitoclástica secundaria a crioglobulinemia mixta en el contexto de infección por virus de hepatitis C en seguimiento por nuestro servicio, con proteinuria media menor de 1 gramo al día y microhematuria, con función renal normal. Ingresó en el servicio de reumatología en diciembre de 2007 por úlceras en los miembros inferiores de una semana de evolución, pérdida de peso y alteraciones neurológicas compatibles con reagudización de su enfermedad de base, por lo que recibió prednisona (1 mg/kg/día), nueve sesiones de PF con reposición con PPL y tratamiento compasivo con rituximab. Recibió una dosis de inmunoglobulinas al finalizar la última PF. No hubo complicaciones de la técnica. Se constató una clara mejoría de la clínica, especialmente de la clínica neurológica y de las lesiones de los miembros inferiores. En cuanto a la función renal, se realizó una biopsia renal con resultado de glomerulonefritis membranoproliferativa probablemente secundaria a VHC/crioglobulinemia. Su creatinina actual es de 0,9 mg/dl con una proteinuria en rango medio de 1 gramo en 24 horas.
8. Hombre de 25 años de edad con antecedentes de pólipos nasales intervenidos en la infancia. Acudió el 18 de diciembre de 2008 por IRRP. Previamente había presentado un cuadro de un mes de evolución consistente en artralgias, mialgias, odinofagia, lesiones cutáneas, orinas espumosas de «color té», distermia y aftas orales. En la analítica se objetivó IRA con creatinina de 4 mg/dl sin oliguria y proteinuria. En el sedimento urinario se observaba microhematuria y en el estudio inmunológico se detectaron ANCA PR3 positivos. La biopsia renal mostró el hallazgo de GMN necrosante con presencia de semilunas frescas. Fue diagnosticado de enfermedad de Wegener. Recibió tratamiento con bolos de metilprednisolona y posteriormente prednisona oral. Se le administró ciclofosfamida en bolos y posteriormente por vía oral durante un año. Además, recibió nueve sesiones de PF desde el 19 de diciembre de 2008 hasta el 8 de enero de 2009. Recibió una dosis de inmunoglobulinas al finalizar la última PF. No presentó reacciones adversas. La respuesta en cuanto a la clínica sistémica cursó con mejoría significativa. Los títulos de ANCA disminuyeron progresivamente hasta su negativización al año. En cuanto a la función renal, fue sometido a diálisis en dos ocasiones y al año la creatinina era de 1,1 mg/dl, sin proteinuria y sin microhematuria. El tratamiento de mantenimiento se realizó con prednisona y azatioprina.
9. Mujer de 72 años, sin antecedentes clínicos de interés, que ingresa en septiembre de 2006 por IRA, con creatinina de 12 mg/dl. Refería historia de más de un mes de evolución de macrohematuria, orinas espumosas, disnea, distermia y descenso de peso. Se le realizó una biopsia renal con hallazgo de GMN extracapilar y se detectaron anticuerpos antiMBG positivos. Recibió tratamiento con bolos de esteroides y posteriormente prednisona oral 1 mg/kg/día con descenso posterior. Además, recibió cuatro bolos de ciclofosfamida y posteriormente por vía oral y 10 sesiones de PF con reposición con albúmina humana al 5%. No presentó reacciones adversas. Recibió una dosis de inmunoglobulinas al finalizar la última PF. La clínica sistémica mejoró quedando asintomática al alta, los títulos de anticuerpos disminuyeron de 128 al ingreso a 16,3 U al alta. En cuanto a la función renal la evolución fue desfavorable quedando en hemodiálisis desde el inicio sin recuperación de aquélla.
10. Hombre de 75 años sin antecedentes personales relevantes. Ingresa en la UVI en julio de 2007 por un cuadro de hemorragia pulmonar e IRA oligúrica que precisó hemodiafiltración venovenosa continua. Los estudios inmunológicos fueron negativos. No se realizó biopsia renal inicialmente por las condiciones clínicas del paciente, pero recibió empíricamente dos sesiones de PF en las primeras 48 horas con reposición con plasma fresco congelado por el antecedente de hemorragia pulmonar. Se evidenció mejoría clínica inicial de la hemorragia pulmonar y recuperó diuresis con descenso de la creatinina, por lo que se suspendió la terapia renal sustitutiva, pero en la evolución posterior presentó un cuadro séptico secundario a una probable neumonía nosocomial, sin que llegara a aislarse microorganismo responsable, distrés respiratorio primario y fracaso multiorgánico (incluido nuevo deterioro del filtrado glomerular) que evolucionó desfavorablemente con su fallecimiento a los 10 días.
11. Hombre de 79 años, monorreno, que ingresa con IRA en abril de 2009, con hallazgo de ANCA PR3 positivos. Ante la sospecha inicial de GMNRP-III fue tratado con tres sesiones de PF, pero en las pruebas de imagen se constató trombosis de arteria renal, por lo que quedó en programa de hemodiálisis crónica. El hallazgo de ANCA PR3 positivos no se confirmó por técnica de ELISA.
En siete de los 11 casos de vasculitis (64%), se monitorizaron anticuerpos pre-PF y post-PF, y se constató la desaparición o el descenso de los anticuerpos en el 86% de los casos.
Inmunoactivación del trasplante renal
12. Mujer de 57 años de edad con poliquistosis renal como enfermedad de base, que recibe trasplante renal el 23 de mayo de 2008. Se trataba de una paciente que había sido sometida a un trasplante en el año 1991 y estaba hipersensibilizada, con tasa de anticuerpos anti-HLA de clase I del 95%. Recibió inducción con anticuerpos policlonales y evolucionó con función renal inmediata, pero a los 8 días presentó un rechazo agudo mediado por anticuerpos, por lo que recibió siete sesiones de PF (tres diarias y cuatro alternas), con reposición con PPL y administración de inmunoglobulinas intravenosas (250 mg/kg después de cada sesión y dosis final de de 1 g/kg). Dado que permaneció dependiente de hemodiálisis y en oligoanuria, se realizó una segunda biopsia en la que se objetivó un rechazo agudo celular IIA con tinción C4d+. Ante este hallazgo se administraron de nuevo bolos de metilprenisolona y se administraron dos dosis de rituximab de 700 mg. Recibía también como terapia inmunosupresora tacrolimus y micofenolato. Al alta quedó con creatinina de 1,6 mg/dl. Los anticuerpos linfocitotóxicos no se modificaron respecto a los previos al trasplante. Como posible complicación se objetivó sangrado digestivo de origen no claro una semana después de las PF.
13. Hombre de 43 años de edad con enfermedad de base vasculitis sistémica que recibió su tercer trasplante renal el 21 de julio de 2009. Los dos trasplantes previos los perdió por rechazo y tenía una tasa de anticuerpos por CDC del 54-94%. Recibió inducción con anticuerpos policlonales. A las dos semanas del trasplante renal sufrió un deterioro de la función renal, por lo que se realizó biopsia renal que mostró datos de rechazo agudo humoral con tinción C4D+ y presencia de anticuerpos anti-HLA donante específico positivos. Recibió tres bolos de metilprednisolona y ocho sesiones de PF (tres diarias y cinco alternas), con reposición con PPL. Recibió, además, inmunoglobulinas intravenosas con pauta similar a la reseñada en el caso anterior y dos dosis de rituximab. No presentó complicaciones relacionadas con la PF. La respuesta fue favorable, con disminución de la creatinina desde 4,2 hasta 1,4 mg/dl. Recibía también como terapia inmunosupresora tacrolimus y micofenolato.
14. Mujer de 38 años que recibe su primer trasplante renal el 28 de febrero de 2006; como enfermedad de base tenía glomerulonefritis crónica, era hipersensibilizada con una tasa de anticuerpos por CDC del 73-90% (antecedentes de varios abortos y transfusiones previos). Recibió inducción con anticuerpos policlonales. Evolucionó con función renal retrasada y se realizó biopsia renal que mostró rechazo agudo IIb-III con tinción C4D negativo. Dado que era hipersensibilizada se administraron empíricamente antes de conocer el resultado de la biopsia, tres bolos de metilprednisolona y se realizó una sesión de PF, además de ajustar niveles de tacrolimus y micofenolato. Recibió una dosis de inmunoglobulinas al finalizar la PF. La evolución posterior fue favorable y al alta la creatinina era de 1,9 mg/dl.
15. Hombre de 41 años que recibe trasplante renal el 6 de octubre de 2008. Como enfermedad de base tenía hialinosis segmentaria y focal. Había recibido un trasplante renal previamente en mayo de 2005 que perdió por trombosis, se le realizó trasplantectomía y no quedó sensibilizado. Recibió inducción con anticuerpos policlonales y evolucionó con función renal inmediata con descenso de creatinina hasta 1,8 mg/dl. El séptimo día postrasplante aumentó la creatinina hasta 2,3 mg/dl con disminución de diuresis. Se realizó biopsia renal y se objetivó rechazo agudo mediado por anticuerpos con C4d positivos; además, aparecieron anticuerpos donante específico positivos. Se realizaron cuatro sesiones de PF con reposición total con PPL y se administraron también inmunoglobulinas intravenosas tras las PF y dos dosis de rituximab. Como complicación presentó un hematoma subcapsular y abdominal. A la semana del tratamiento descendió la creatinina hasta 1,9 mg/dl y al alta era de 1,7 mg/dl.
16. Mujer de 74 años con enfermedad de base no filiada que fue sometida a trasplante el 30 de agosto de 2006. Había recibido trasplante renal previamente en el 2003 que perdió por trombosis inmediata. Quedó hipersensibilizada con anticuerpos anti-HLA del 56-38%. Recibió inducción con anticuerpos policlonales. Al quinto día postrasplante presentó deterioro agudo de la función renal con ascenso de la creatinina hasta 3,2 mg/dl. Se realizó biopsia renal que mostró rechazo agudo mediado por anticuerpos con C4d positivos y, además, aparecieron anticuerpos donante específico positivos circulantes. Se administraron tres bolos de metilprednisolona de 500 mg y se realizaron 10 sesiones de PF. La reposición fue principalmente con plasma fresco congelado y recibió, además, inmunoglobulinas intravenosas con pauta similar a la reseñada en los casos anteriores. Presentó alguna reacción post-PF inespecífica del tipo prurito resuelta con antihistamínicos. La función renal se recuperó y al alta la creatinina era de 0,8 mg/dl.
17. Mujer de 33 años de edad, que recibió su segundo trasplante renal en mayo de 2000 (su primer trasplante lo había perdido por rechazo hiperagudo). Ingresó en mayo de 2006 por deterioro de la función renal con ascenso de la creatinina desde 1,6 hasta 2,8 mg/dl. Se le realizó una biopsia del injerto que mostró rechazo agudo tardío mediado por anticuerpos con C4d positivos. Recibió tres bolos de metilprednisolona y seis sesiones de PF (tres seguidas y tres alternas), con reposición del volumen total con PPL. Recibió, además, inmunoglobulinas intravenosas con una pauta similar a la reseñada en los casos anteriores. No presentó complicaciones relacionadas con las PF y la función renal mejoró parcialmente con creatinina al alta de 2,2 mg/dl.
18. Hombre de 56 años cuya enfermedad de base era GMN mesangial IgA. Recibió su primer trasplante renal el uno de junio de 2007. Su creatinina al alta era de 2,5 mg/dl y recibió everolimus por antecedente de toxicidad por anticalcineurínicos. Ingresó en agosto de 2007 por deterioro del filtrado glomerular con ascenso de creatinina hasta 3,9 mg/dl. Se le realizó una biopsia renal en la que se objetivaron cambios borderline con tinción C4d positiva. No se objetivaron anticuerpos donante-específicos. Se convirtió su tratamiento inmunosupresor a tacrolimus, se administraron tres bolos de metilprednisolona y se le realizaron cinco sesiones de PF. La reposición del volumen total fue con PPL. Recibió también inmunoglobulinas intravenosas tras las PF. No presentó complicaciones tras éstas. Se constató una mejoría parcial, con descenso de la creatinina hasta 2,9 mg/dl.
19. Hombre de 28 años de edad con enfermedad de base HSF familiar. Fue sometido a trasplante en marzo de 2007. No había recibido trasplantes previos y no estaba sensibilizado. En el seguimiento se constata un mal cumplimiento terapéutico. Ingresa en noviembre de 2009 por deterioro de la función renal (creatinina de 7,7 frente a 1,5 mg/dl). Se realizó biopsia renal en la que se observó rechazo agudo celular IA con tinción C4d positiva y presencia de anticuerpos donante específicos anticlase II. Recibió bolos de metilprednisolona (500 mg en tres dosis) y seis sesiones de PF. La reposición del volumen total fue con PPL. Recibió, además, inmunoglobulinas. Presentó alguna reacción post-PF inespecífica del tipo prurito resuelta con antihistamínicos. La respuesta renal fue parcial, con descenso de la creatinina hasta 4,2 mg/dl. Posteriormente, se detectó un nuevo ascenso de creatinina, por lo que se decidió administrar timoglobulina (cuatro dosis por citopenias), sin respuesta. Se realizó entonces una segunda biopsia, constatándose persistencia del rechazo agudo mixto con componente celular y humoral. Se intentó tratamiento de rescate con inmunoglobulinas, pero la primera dosis fue mal tolerada por lo que no se continuó con el tratamiento. Se asumió como un injerto irrecuperable y el paciente reinició programa de hemodiálisis.
20. Hombre de 75 años de edad, sometido a trasplante en 1994. Su enfermedad de base era un síndrome de Alport. En octubre de 2009 presentó un deterioro agudo del filtrado glomerular con asenso de creatinina desde 1,3 hasta 1,8 mg/dl. Se realizó biopsia renal y se constató un rechazo agudo mediado por anticuerpos con C4d positivos y anticuerpos linfocitotóxicos positivos. Se realizaron sólo dos sesiones de PF dada la edad avanzada y la disfunción crónica del injerto. La reposición se hizo con PPL y recibió inmunoglobulinas intravenosas tras las PF. No presentó complicaciones con éstas. En la evolución no se objetivó descenso de la creatinina, pero sí negativización de los anticuerpos linfocitotóxicos y en la biopsia posterior se observó una mejoría de la histología (aunque permanecía C4d positiva residual). El injerto se mantuvo funcionante un año más hasta el fallecimiento del paciente por una neoplasia de próstata.
21. Hombre de 37 años de edad que recibió su tercer trasplante renal el 4 de marzo de 2007. El primer trasplante lo perdió en 1995 por rechazo agudo celular y se le realizó trasplantectomía. Su segundo trasplante le duró desde 1996 hasta 2003, perdido por nefropatía crónica del injerto; también se le realizó trasplantectomía. Era un paciente hipersensibilizado con una tasa de anticuerpos por CDC del 41-51%. Recibió inducción con OKT3. Al cuarto día postrasplante presentó deterioro agudo de la función renal y se realizó biopsia renal en la que se constató rechazo agudo compatible con rechazo agudo humoral y positividad de C4d en capilares peritubulares, por lo que recibió bolos de metilprednisolona y tratamiento con 10 sesiones de PF e inmunoglobulinas intravenosas. La reposición del volumen total fue principalmente con plasma fresco congelado (por antecedente de hemorragia del lecho quirúrgico que requirió transfusión de tres concentrados de hematíes y desmopresina intravenosa). No presentó complicaciones relacionadas con las PF. A partir del día 21 postrasplante comenzó a aumentar progresivamente la diuresis y a mejorar la función renal hasta el momento del alta: creatinina de 2,1 mg/dl. El perfil de anticuerpos linfocitotóxicos no mostró cambios respecto a la situación pretrasplante.
22. Mujer de 33 años de edad que recibió su segundo trasplante renal en mayo de 2006. Su primer trasplante (funcionante desde 1995 hasta 2005) lo perdió tras un shock hemorrágico por metrorragias. Enfermedad de base: nefropatía isquémica. Era una paciente hipersensibilizada con anticuerpos del 53%. En el postrasplante inmediato tuvo un rechazo agudo mediado por anticuerpos, curiosamente corticosensible. Ingresó en diciembre de 2006 por disfunción del injerto (creatinina de 2,8 frente a 1,4 mg/dl) en su centro de seguimiento. Se administraron bolos de metilprednisolona con respuesta parcial y la remitieron a nuestro centro para realización de biopsia renal y tratamiento. La biopsia mostró un rechazo mixto celular y humoral con tinción C4d positiva. Recibió cuatro sesiones de PF con reposición del 50% del volumen total con plasma fresco congelado y el resto con PPL. Recibió también inmunoglobulinas intravenosas y no presentó complicaciones secundarias a las PF. La función renal mejoró, con recuperación de la creatinina hasta 2 mg/dl.
23. Hombre de 35 años de edad, con enfermedad de base nefropatía intersticial por reflujo que recibió su segundo trasplante renal el 14 de octubre de 2006. Era un paciente sensibilizado con una tasa de anticuerpos anti-HLA del 30-38%. El primer trasplante lo perdió por necrosis tubular aguda no recuperada. Evolucionó con función renal retrasada y se constató un cambio del perfil de los anticuerpos linfocitotóxicos, por lo que se le realizó una biopsia renal, con el hallazgo de rechazo humoral con C4d positivos. Se decidió tratarlo con ocho sesiones de PF, con reposición del volumen total principalmente con PPL, e inmunoglobulinas intravenosas. No presentó complicaciones secundarias a las PF y la respuesta fue favorable, con aumento de la diuresis y disminución de la creatinina desde 6,8 hasta 2,5 mg/dl. En el seguimiento realizado en consulta disminuyó la creatinina hasta 1,5 mg/dl.
24. Hombre de 51 años de edad que fue sometido a trasplante el 3 de julio de 2008. Su enfermedad de base era nefropatía intersticial por nefrosis secundaria a vejiga neurógena por lesión medular. Evolucionó con función renal inmediata hasta el cuarto día postrasplante, en que aumentó la creatinina desde 2,3 hasta 4,3 mg/dl, junto con disminución de la diuresis. Se iniciaron bolos de esteroides y dos días después se realizó biopsia renal que mostró datos de rechazo agudo IIb con C4d positivos. Se indicó PF, pero sólo recibió una sesión por complicación hemorrágica con hematoma abdominal. Se administraron inmunoglobulinas intravenosas con buena respuesta, y la creatinina disminuyó hasta 1,4 mg/dl.
25. Hombre de 52 años de edad, sometido a trasplante el 4 de julio de 2006; su enfermedad de base era GMN crónica. Tenía una tasa de anticuerpos anti-HLA del 41-53%. Evolucionó las primeras 72 horas con función renal retrasada oligúrica, por lo que se realizó biopsia renal sin hallazgos histológicos concluyentes. Los anticuerpos linfocitotóxicos eran positivos, pero no donante-específicos; no obstante, dados los antecedentes inmunológicos, se sospechó un rechazo humoral y se iniciaron sesiones de PF, un total de seis. La reposición del volumen fue con PPL y recibió también inmunoglobulinas intravenosas. El paciente evolucionó favorablemente, con aumento de diuresis y descenso de creatinina hasta 1,9 mg/dl.
26. Hombre de 46 años de edad, con antecedentes de un primer trasplante renal en diciembre de 2006 perdido por trombosis vascular al cuarto día postrasplante. Se le realizó trasplantectomía. Segundo trasplante renal en agosto de 2009. Era un paciente hipersensibilizado con una tasa de anticuerpos por CDC del 48-91%. Recibió inducción con anticuerpos policlonales y evolucionó inicialmente con función renal inmediata hasta el quinto día postrasplante, en que presentó deterioro de la función renal con oligoanuria y datos de SHU, por lo que se realizó conversión a rapamicina. Posteriormente se confirmó por biopsia que estaba asociado con rechazo mediado por anticuerpos. Recibió bolos de metilprednisolona, siete sesiones de PF con reposición principalmente con PPL y una pequeña proporción con plasma fresco congelado e inmunoglobulinas intravenosas, así como una dosis de rituximab. Presentó como complicación una hemorragia del lecho quirúrgico con shock hemorrágico, por lo que se suspendieron las sesiones de PF y se realizó una trasplantectomía urgente.
Síndrome urémico-hemolítico
27. Mujer de 64 años de edad, hipertensa y con enfermedad de base glomerulonefritis membranoproliferativa. Recibió trasplante renal de cadáver el 22 de noviembre de 2005 de un donante expandido. Compatibilidad 1 A y 1DR; recibió inmunosupresión con basiliximab, tacrolimus, prednisona y micofenolato. Como incidencias postrasplante presentó shock hemorrágico que precisó la transfusión de tres concentrados de hematíes, tres unidades de plasma y un pool de plaquetas. Evolucionó con función renal retrasada, precisando tres sesiones de hemodiálisis, con aumento progresivo de diuresis y creatinina al alta de 1,2 mg/dl. Durante el seguimiento en consulta presentó proteinuria en rango nefrótico y microhematuria, por lo que se realizó biopsia renal que mostró datos de glomerulopatía del trasplante. El 25 de septiembre de 2006 se objetivó un aumento progresivo de la lacticodeshidrogenasa (LDH), junto con descenso de haptoglobina y anemización. Se redujo la dosis de tacrolimus y se aumentó la dosis de prednisona hasta 1 mg/kg/día. La biopsia renal mostró datos de microangiopatía trombótica y rechazo humoral. Por este motivo la paciente recibió inmunoglobulinas intravenosas y rituximab, pero no se obtuvo una respuesta clínica favorable. Se decidió finalmente iniciar programa de PF (nueve sesiones) a los 20 días del ingreso con reposición con plasma fresco congelado y albúmina. Las sesiones de PF hubo que suspenderlas al aparecer por bacteriemia por Staphylococcus aureus y Pseudomonas aeruginosa; no obstante, las plaquetas y la hemoglobina se normalizaron, pero al mes, en noviembre de 2006, la paciente ingresó nuevamente por deterioro de la función renal, con biopsia con datos de nefropatía crónica del injerto, con inicio de programa de hemodiálisis y embolización del injerto.
28. Mujer de 32 años de edad sin antecedentes personales de interés que ingresó en febrero de 2008 por un cuadro de dos semanas de evolución consistente en astenia, vómitos en número de 3-4 al día, junto con disnea paroxística nocturna y disnea a mínimos esfuerzos, oligoanuria, HTA grave y cefaleas frontoorbitales pulsátiles. Acudió a urgencias con taquipnea con saturación de oxígeno del 86% e infiltrado alveolointersticial bilateral en la radiografía de tórax, por lo que ingresó en la UVI. Se realizó fondo de ojo que mostró retinopatía hipertensiva de grado 3 (HTA maligna) y ecocardiografía transtorácica, en la que se evidenció una miocardiopatía hipertrófica. En la analítica realizada al ingreso se objetivó una anemia hemolítica microangiopática con esquistocitos en sangre periférica e insuficiencia renal, por lo que se inició hemodiálisis y nueve sesiones de PF con reposición con plasma fresco congelado y bolos de esteroides. Recibió una dosis de inmunoglobulinas al finalizar la última PF. La evolución fue buena con elevación y normalización de las cifras de plaquetas, mejoría de la anemia y normalización de la LDH. La biopsia renal mostró un 32% de glomérulos isquémicos con esclerosis, 20 arteriolas con hiperplasia concéntrica de la luz y focos de necrosis fibrinoide con microtrombos. La paciente no recuperó la función renal y quedó en programa de hemodiálisis.
29. Mujer de 57 años de edad con enfermedad de base poliquistosis renal, en hemodiálisis durante 53 meses. Fue sometida a trasplante el 21 de abril de 2006 de un donante de 54 años, con el que compartía 1B, 1DR y con biopsia renal óptima. Recibió inducción con timoglobulina, tacrolimus, metilprednisolona y micofenolato iniciado al quinto día del postoperatorio. Evolucionó incicialmente con función renal retrasada, precisando hemodiálisis, pero posteriormente hubo un aumento progresivo de la diuresis a partir del cuarto día. Al octavo día postrasplante sufrió deterioro de la función renal con recorte de diuresis y datos de anemia hemolítica microangiopática (haptoglobina disminuida, anemización y plaquetopenia, con elevación de LDH hasta 2.250 U/l). Se administraron bolos de metilprednisolona (500 mg en tres doisis), y se iniciaron seis sesiones de PF con reposición con plasma fresco congelado. Recibió inmunoglobulinas intravenosas. En la biopsia del injerto se observó microangiopatía trombótica con datos indicativos de nefrotoxicidad por anticalcineurínicos. Se cambió la inmunosupresión de tacrolimus a everolimus, con mejoría de la función renal. Las plaquetas y la hemoglobina se normalizaron tras las PF. El día 22 postrasplante presentó un nuevo deterioro de la función renal, coincidente con la retirada del tutor ureteral. Una ecografía objetivó aparición de colección periinjerto y una cistografía demostró fuga urinaria que se resolvió tras sondaje vesical y reposo. Al alta la paciente se fue con una creatinina de 1,2 mg/dl, con estabilización posterior a 0,9 mg/dl, sin microalbuminuria ni hematuria.
30. Mujer de 21 años de edad sin antecedentes personales de interés salvo toma de anticonceptivos orales cinco meses antes del ingreso. Acude a nuestro centro en octubre de 2010 por cuadro de cefaleas con ingestión de antiinflamatorios, astenia y anorexia, con datos analíticos de insuficiencia renal aguda, anemia, plaquetopenia, proteinuria y microhematuria. Se realizó biopsia renal con datos de microangiopatía trombótica de SHU. Se realizaron 12 sesiones de PF con reposición con plasma fresco congelado (con reacciones secundarias al plasma que precisaron antihistamínicos y esteroides) y se iniciaron esteroides a 1 mg/kg/día con pauta descendente posterior, con mejoría progresiva de la hemoglobina, plaquetas y normalización de la haptoglobina. Además, precisó hemodiálisis transitoria, con recuperación posterior de la función renal con creatinina al alta de 1,5 mg/dl. Se realizó estudio genético del SHU que mostró mutación heterocigota en el gen del factor H, factor de susceptibilidad genética del SHU. A los 3 meses tras el alta reingresa por deterioro de la función renal sin datos de hemólisis, pero sí con anemización y trombopenia. Se iniciaron PF diarias con reposición con plasma fresco congelado, pero sin recuperación completa de la función renal (creatinina de 2,4 mg/dl). Al mes del ingreso presentó una nueva sospecha de recidiva de SHU con anemización y plaquetopenia con leve deterioro de la función renal y LDH persistentemente elevada. Con el reinicio de las sesiones de PF se observó de nuevo una mejoría de la hemoglobina, de las plaquetas y de la haptoglobina, así como un descenso de la LDH, pero la función renal no mejoró, y la creatinina quedó en 3-3,4 mg/dl, con proteinuria media y microhematuria persistente. Ante los datos de actividad (LDH oscilante, con C3 bajo y haptoglobina baja) permaneció en programa de PF semanales hasta que en febrero de 2011 inició programa de hemodiálisis crónica. Como reacciones adversas ha presentado en las sesiones de PF prurito, exantema cutáneo y habones coincidentes con la infusión de plasma fresco congelado que ha requerido en ocasiones infusión con actocortina y antihistamínicos, así como reducción de la reposición con plasma y sustitución ésta con PPL.
31. Hombre de 36 años, con enfermedad de base hialinosis segmentaria y focal. Presentaba historia de un injerto previo en 1998 hasta 2006 perdido por nefropatía crónica con C4d positivo. Se le realizó trasplantectomía en 2007. No quedó sensibilizado y su tasa de anticuerpos por CDC era del 0%. Recibió su segundo trasplante renal en octubre de 2008. A las 36 horas postrasplante presentó deterioro de la función renal y recorte de diuresis con datos de anemia hemolítica, que fue interpretado como microangiopática probablemente secundaria a la administración de tacrolimus. Se reconvirtió a rapamicina y además se realizaron ocho sesiones de PF con reposición, principalmente con plasma fresco congelado. Se administraron inmunoglobulinas intravenosas. No hubo complicaciones en relación con la técnica. La evolución posterior fue favorable, con aumento de diuresis y normalización de LDH, bilirrubina y plaquetas. También se objetivó una mejoría de la función renal con descenso de la creatinina desde 9,2 hasta 5,6 mg/dl y se estabilizó. Por este motivo se realizó biopsia renal a los 5 días de terminada la última sesión de PF, que mostró rechazo agudo IIA con tinción C4d positivo débil. Se decidió entonces administrar bolos de esteroides (metilprednisolona 500 mg en tres dosis) y rituximab 375 mg/m2 (dos dosis), con posterior aumento de diuresis y descenso de creatinina hasta 1,9 mg/dl.
Insuficiencia renal rápidamente progresiva
32. Mujer de 67 años con antecedentes de HTA de larga evolución con artrosis y toma crónica de antiinflamatorios no esteroidos (AINE), que ingresa con fracaso renal agudo que requirió inicio de programa de hemodiálisis. Recibió tratamiento con bolos de esteroides ante la sospecha de glomerulonefritis rápidamente progresiva y se realizó biopsia renal compatible con glomerulonefritis extracapilar grave con anticuerpos antimembrana basal positivos, por lo que se inició ciclofosfamida oral y PF (siete sesiones consecutivas y cinco sesiones alternas), con reposición con plasma fresco congelado y PPL, y una dosis de inmunoglobulinas. Se produjo un descenso del título de anticuerpos de 128 a 14,6 U/l. La función renal no mejoró, y se mantuvo en programa de hemodiálisis crónica.
Grupo 2
Enfermedades hematológicas
33. Hombre de 57 años de edad con antecedentes personales de síndrome hipereosinofílico primario y macroglobulinemia de Wäldestrom, que ingresó en febrero de 2009 en el servicio de medicina interna por sospecha de miocarditis aguda (elevación de troponinas con cateterismo libre de lesiones coronarias), junto con clínica neurológica (agnosia visual, clonus rotuliano y aquíleo bilateral y Babinsky bilateral), con imágenes en la resonancia magnética (RM) cerebral compatibles con lesiones isquémicas agudas en la sustancia gris cortical de ambos lóbulos frontales, parietales y occipitales, núcleo talámico derecho y ambos hemisferios cerebelosos. Dado el antecedente de síndrome de Wäldestrom con sospecha de síndrome de hiperviscosidad, se iniciaron sesiones de PF (en total ocho sesiones), con descenso del componente IgM de 1.250 mg/dl hasta 273 mg/dl. Se realizó aspirado de médula ósea en el que se observaba médula hiperplásica con megacariocitos de aspecto displásico y linfoplasmocitosis con sobreexpresión de lambda e IgM. Clínicamente evolucionó de forma satisfactoria, con recuperación progresiva de la visión y normalización progresiva de la cifra de eosinófilos.
34. Hombre de 65 años de edad con antecedentes de HTA, hipoacusia bilateral, trombosis venosa profunda en miembro inferior derecho en tratamiento con anticoagulantes orales, osteonecrosis de mandíbula en septiembre de 2006 y herpes zóster lumbar en 2005. Había sido diagnosticado de mieloma múltiple de Bence-Jones en abril de 1999 con insuficiencia renal y osteopatía, y tratado con quimioterapia y trasplante de médula ósea en marzo del año 2000. Se mantuvo en remisión completa con cadenas ligeras y proteinuria de Bence-Jones negativa y función renal normal. Ingresó en diciembre de 2008 con cuadro de insuficiencia cardíaca izquierda, con bloqueo auriculoventricular completo (precisó marcapasos definitivo) e insuficiencia renal, quedando en programa de hemodiálisis crónica por progresión de la enfermedad hematológica con trombopenia de hasta 23.000/μl. Secundariamente a la paraproteína, se objetivó un trastorno de la coagulación con alargamiento de los tiempos de protrombina, tiempo parcial de tromboplastina activado (TTPA), trombina y reptilasa, con aparición de hematomas espontáneos con múltiples requerimientos transfusionales. Para evitar el efecto de la paraproteína se inició PF con reposición con PPL y plasma fresco congelado (siete sesiones en total), con normalización de la coagulación. Para controlar el componente monoclonal se administró un ciclo de ciclofosfamida y dexametasona, pero a la semana presentó leucemia de células plasmáticas que fue tratada con bortezomib, adriamizina y dexametasona. La evolución clínica fue desfavorable, con aparición de colangitis alitiásica, herpes zóster lumboabdominal derecho y candidiasis orofaríngea. El paciente falleció en febrero de 2009.
Lupus eritematoso sistémico
35. Mujer de 21 años de edad, con antecedentes personales de epilepsia en tratamiento con lamotrigina, portadora de bioprótesis valvular aórtica por endocarditis sobre válvula nativa desde el 2004, obesidad, infecciones urinarias de repetición y trombopenia de origen inmunológico desde la infancia estudiada por hematología y en tratamiento con esteroides. Ingresó en mayo de 2006 por un cuadro de insuficiencia respiratoria que precisó ventilación mecánica durante 14 días, IRA, anemia microcítica con trombopenia, aumento de LDH y descenso de haptoglobina. Se realizó biopsia renal que mostró datos de SHU. En las pruebas complementarias realizadas se detectaron anticoagulante lúpico, anticardiolipina y antifosfolípido positivos. La paciente ingresó en la UCI, donde se inició tratamiento con hemodiafiltración venovenosa continua, esteroides a dosis altas y PF, junto con dos tandas de inmunoglobulinas intravenosas. La función renal no mejoró, quedando la paciente al alta en programa de hemodiálisis crónica. Fue diagnosticada de síndrome antifosfolípido primario e inició tratamiento con dicumarínicos. Durante el seguimiento posterior en hemodiálisis la paciente presentó múltiples problemas de acceso vascular, con tendencia a trombopenia mantenida que dificultó la anticoagulación, manteniendo como único acceso vascular una vía central femoral izquierda, con múltiples episodios de infecciones. En agosto de 2008 ingresa en la UCI de nuevo por una reagudización de su enfermedad de base, con aparición de hemorragia pulmonar. Recibió tres sesiones de PF, bolos de metilprednisolona e inmunoglobulinas intravenosas (0,5 mg/kg, tres dosis) y dos dosis de rituximab, con lo que se logró el control de la enfermedad, pero en diciembre de 2008 ingresó de nuevo en la UCI por una endocarditis sobre válvula protésica aórtica con gran inestabilidad hemodinámica, que precisó aminas y antibioterapia de amplio espectro, con evolución tórpida y fallecimiento.
Shock séptico
36. Hombre de 40 años con trastorno ansioso-depresivo y fumador importante. Ingresa con deterioro del nivel de conciencia secundario a shock séptico de origen respiratorio con infiltrado pulmonar basal bilateral en la radiografía de tórax. La punción lumbar descartó la existencia de meningitis. Ingresó en la UCI porque precisó intubación orotraqueal y la administración de noradrenalina a altas dosis. Presentaba, además, anuria y fallo multiorgánico. Fue trasladado a la UVI, donde se procedió a hemodiafiltración venosa continua, y cobertura antibiótica de amplio espectro con meropenem, ciprofloxacino, linezolid y cobertura antifúngica con anfotericina. En el contexto de la sepsis, presentó coagulopatía de consumo, por lo que recibió inmunoglobulinas y una sesión de PF con reposición con plasma fresco congelado. De los seis hemocultivos extraídos, únicamente en un hubo crecimiento de S. epidermidis. En un frotis faríngeo se objetivó el crecimiento de enterococo. Los antígenos de Legionella y neumococo fueron negativos, así como la serología de neumonía atípica. La situación de fracaso multiorgánico se prolongó hasta que se produjo la parada cardiorrespiratoria a los 15 días del ingreso.
Colangiocarcinoma
37. Hombre de 75 años en programa de hemodiálisis crónica por nefropatía diabética. Presentaba un colangiocarcinoma en tratamiento paliativo con colocación de endoprótesis biliar con necesidad de múltiples recambios. Ingresó en septiembre de 2009 por un cuadro de colangitis, con refractariedad al tratamiento farmacológico del prurito, por lo que recibió seis sesiones de PF con reposición con albúmina. Como complicación del cuadro de colangitis, a pesar de la ampliación de la cobertura antibiótica con meropenem, teicoplanina y levofloxacino, presentó deterioro hemodinámico y coagulopatía de consumo secundaria a la sepsis que requirió transfusión de múltiples hemoderivados. En los hemocultivos se objetivó crecimiento de Corynebacterium species y estafilococo coagulasa negativo, y en el urocultivo creció Enterococcus faecalis, todos sensibles a la cobertura antibiótica pautada. Se añadió al tratamiento hidrocortisona, pero el paciente continuó con el deterioro hemodinámico y coagulopatía secundaria a la sepsis con empeoramiento clínico y fallecimiento.
Grupo 3
Enfermedades neurológicas
38. Hombre de 43 años, fumador, diagnosticado de neuropatía motora multifocal en oOctubre de 2005. Inicialmente fue tratado con inmunoglobulinas intravenosas sin respuesta clínica, por lo que se inició programa de PF (en total 12 sesiones con reposición con albúmina) y ciclofosfamida intravenosa mensual (1,5 g). Evolucionó desfavorablemente, con incapacidad para caminar y dependiente para las actividades de la vida diaria. A los seis meses después del tratamiento, el paciente ingresó en el servicio de neumología por cuadro de disnea grave y dificultad importante para la expulsión de secreciones. Se inició ventilación mecánica no invasiva con mala tolerancia, y falleció el 26 de noviembre de 2006. El diagnóstico era esclerosis lateral amiotrófica.
39. Mujer de 27 años de edad, diagnosticada de miastenia grave en 1995, con timectomía en 1998, en tratamiento con azatioprima, que ingresó en octubre de 2007 por empeoramiento de la sintomatología de su enfermedad (fatigabilidad generalizada progresiva, diplopía, ptosis palpebral, disfonía y disfagia). Se iniciaron nueve sesiones de PF con reposición con albúmina junto con inmunoglobulinas intravenosas a dosis de 5 g/kg/día durante 5 días y conversión a ciclosporina, con lo que revirtieron los síntomas. Al mes del alta, la paciente reingresó nuevamente por neurotoxicidad por ciclosporina por lo que hubo que suspenderla y mantenerla en monoterapia con prednisona oral. Se añadió un cuadro de hepatitis por citomegalovirus, que se trató con ganciclovir intravenoso y posteriormente valganclovir oral. La paciente durante su seguimiento ha precisado ingresos periódicos para infusión de inmunoglobulinas intravenosas de mantenimiento.
40. Hombre de 54 años de edad, con antecedentes personales de diabetes mellitus tipo 2 (DM2), dislipemia, cardiopatía isquémica coronaria y neoplasia vesical superficial recidivante intervenida. Ingresó en mayo de 2008 con un cuadro de debilidad de los miembros superiores e inferiores con predominio proximal, sin clínica sensitiva, presentando a las 24 horas tetraparesia flácida. El estudio etiológico descartó causa neoplásico, tumoral o paraneoplásica, autoinmune o infecciosa y fue diagnosticado de síndrome de Guillain-Barré. Recibió seis sesiones de PF con reposición con albúmina, con mejoría clínica evidente. Recibió dosis de inmunoglobulinas tras las PF.
41. Hombre de 20 años de edad, alérgico a la penicilina, que ingresa por en diciembre de 2008 por un cuadro de deterioro neurológico con somnolencia, ataxia de la marcha, disminución de reflejos osteotendinosos en los miembros superiores, diplopía bilateral, debilidad de los músculos faciales deglutorios, masticatorios y fonadores, con pruebas de imagen y punción lumbar normales. Se realizó estudio neurofisiológico con ausencia de respuesta sensitivo-motora en los miembros, con ausencia de movimientos voluntarios y de actividad denervativa aguda. En la cara presentaba respuesta motora con movimiento voluntario indicativo de polirradiculopatía desmielinizante con afectación de pares craneales. Se realizaron anticuerpos antigangliósidos que resultaron negativos. Ante la sospecha de síndrome de Miller-Fisher se inició PF, cuatro sesiones en total con reposición con albúmina, con mejoría clínica parcial. Recibió dosis de inmunoglobulinas tras las PF. Presentó pico febril con cultivos de orina, líquido cefalorraquídeo (LCR), hemocultivos y secreción bronquial negativos. El paciente solicitó traslado a su país de origen para seguimiento.
Púrpura trombocitopénica trombótica
42. Mujer de 29 años, que ingresó en el servicio de hematología en agosto de 2006 por anemia y trombopenia grave, y que fue diagnosticada de PTT. Recibió tratamiento con metilprednisolona, inmunoglobulinas intravenosas y siete sesiones de PF con reposición con plasma fresco congelado. La trombopenia mejoró significativamente, con un aumento de plaquetas desde 7.000 a 165.000/μl. La hemoglobina se normalizó y los esquistocitos en sangre periférica desaparecieron. Continuó con tratamiento con esteroides por vía oral hasta suspenderlos en noviembre de 2006. Presentó una recaída en agosto de 2008, por lo que recibió un nuevo ciclo de esteroides hasta octubre de 2008, pero la plaquetopenia se mantuvo hasta que finalmente se realizó esplenectomía en enero de 2009, con normalización posterior de las cifras de plaquetas.
43. Mujer de 41 años de edad obesa, fumadora y con antecedentes de lupus discoide. Ingresa en abril de 2007 con cuadro de deterioro del estado general con anemización hasta 6,3 g/dl de hemoglobina, esquistocitos en sangre periférica y plaquetopenia de 10.000/μl. Al ingreso se inició tratamiento con esteroides a dosis de 1 mg/kg/día, inmunoglobulinas intravenosas y recibió 12 sesiones de PF con reposición con plasma fresco congelado. Las cifras de hemoglobina y plaquetas se normalizaron tras las PF y los esteroides se fueron disminuyendo hasta su suspensión.
44. Hombre de 75 años de edad, ex-fumador, con diabetes mellitus insulinodependiente de más de 20 años de evolución, que ingresó en la UCI en junio de 2008 por un cuadro de deterioro del estado general, anorexia y astenia. Como antecedentes clínicos de interés presentaba una lesión en el área orbitaria del ojo izquierdo, con biopsia compatible con carcinoma anexial escleriforme. Se realizó TC de tórax y de abdomen en la que no se observaron lesiones tumorales. En la analítica realizada a su ingreso se constataron datos de anemia hemolítica con plaquetopenia de 92.000/μl. El frotis de sangre periférica mostró esquistocitosis y policromatofilia. Ante la sospecha de PTT se realizaron dos sesiones de PF con reposición con plasma fresco congelado. Se realizó endoscopia digestiva alta por presentar el paciente durante el ingreso melenas importantes y se encontró un adenocarcinoma ulceroso infiltrante en cuerpo y antro, con AMO con nidos celulares no hematológicos indicativos de metástasis. Dada la extensión de la enfermedad, se suspendieron las sesiones de PF y el paciente falleció a los 5 días del ingreso.
45. Mujer de 34 años de edad, con síndrome HELLP (hemólisis, enzimas hepáticas elevadas y recuento de plaquetas bajo) en un embarazo previo, migrañas y litiasis renal. En junio de 2003 ingresó por anemia hemolítica microangiopática y trombopenia durante la gestación, sin respuesta a esteroides ni a inmunoglobulinas, con síndrome HELLP que obligó a suspender la gestación. En mayo de 2006 presentó nuevo cuadro de trombopenia, con buena respuesta a esteroides que se suspendieron en junio de 2006. En marzo de 2009 inició un cuadro de diátesis hemorrágica con plaquetas de 94.000/μl y anemia hemolítica. Recibió esteroides a dosis de 1 mg/kg/día, inmunoglobulinas intravenosas y seis sesiones de PF con reposición con plasma fresco congelado, con normalización de las cifra de plaquetas y hemoglobina. Tuvo un episodio autolimitado de reacción cutánea generalizada tras la infusión de plasma que revirtió con esteroides. En mayo de 2009 presentó una nueva recaída y recibió varias sesiones de PF. Presentó posteriormente nueva recaída en julio y octubre de 2009, recibiendo un total de 19 sesiones de PF y cuatro dosis de rituximab. En noviembre de 2009 se realizó esplenectomía y en diciembre de 2009 recibió nuevamente PF, esteroides y vincristina. En febrero de 2010, presentó un nuevo brote de plaquetopenia que precisó ingreso e inicio de PF semanales. En marzo de 2010 inició tratamiento con ciclosporina A durante seis meses con plasmaféresis cada 10 días (última PF el 31 de marzo de 2010). Se suspendió la ciclosporina en noviembre de 2010 con mejoría de las plaquetas (>200.000/μl), sin datos de hemólisis a los cuatro meses de suspensión de la ciclosporina A.
Púrpura trombocitopénica idiopática
46. Hombre de 68 años, diagnosticado de PTI en abril de 2006 que ingresó el 24 de mayo de 2006 en el servicio de hematología por plaquetopenia grave. Recibió inicialmente inmunoglobulinas, rituximab y PF (primera sesión el 9 de junio de 2006, con un total de seis sesiones). Dado que no se produjo un aumento significativo de plaquetas (<15.000/μl), se realizó esplenectomía el 15 de junio de 2006, con normalización posterior de plaquetas y suspensión de esteroides. En la actualidad el paciente presenta plaquetas normales.
47. Hombre de 77 años, diabético, con cardiopatía isquémica coronaria y estenosis aórtica grave que fue intervendio en junio de 2006 de doble pontaje aortocoronario y sustitución valvular aórtica biológica. Ingresó en el servicio de hematología en junio de 2008 para estudio y tratamiento de plaquetopenia y anemia hemolítica, y fue diagnosticado de síndrome de Evans. Recibió dexametasona y gammaglobulina anti-D, a pesar de lo cual la plaquetopenia de 6.000/μl se mantuvo. Por este motivo, se iniciaron sesiones de PF, con buena respuesta y las plaquetas se elevaron desde 13.000 hasta 139.000/μl. Recibió tratamiento con prednisona a dosis de 30 mg inicialmente con descenso progresivo posterior hasta 2,5 mg, consiguiéndose estabilidad de las plaquetas en torno a 80.000/μl.
48. Hombre de 65 años, diagnosticado de PTI en junio de 2007, que recibió un ciclo de esteroides e inmunoglobulina anti-D sin respuesta. En agosto de 2007 se añadieron de forma ambulatoria inmunoglobulinas intravenosas y se aumentaron los esteroides. La respuesta fue moderada, con aumento de plaquetas hasta 119.000/μl. En el control realizado en septiembre de 2007 presentó equimosis diseminada junto con plaquetopenia, por lo que se inició nuevo ciclo de inmunoglobulinas intravenosas, esteroides y gammaglobulina anti-D, sin respuesta. Recibió, además, una dosis de rituximab y seis sesiones de PF con reposición con plasma fresco congelado entre septiembre y octubre, pero tampoco se obtuvo respuesta. Se añadió entonces un ciclo de rituximab, vincristina y ciclofosfamida y nueva dosis de inmunoglobulinas, pero desafortunadamente tampoco hubo buena respuesta. Dado el riesgo quirúrgico, se decidió embolización parcial de la arteria esplénica, y se consiguió una elevación progresiva de las cifras de plaquetas (hasta 49.000/μl). Se intentó de forma diferida la realización de una esplenectomía quirúrgica, pero se suspendió por sangrado profuso durante la intervención. Finalmente recibió un ciclo de tratamiento con danazol y azatioprina, pero las plaquetas continuaron en torno a 9.000/μl. Ingresó en la UCI por síndrome febril con insuficiencia respiratoria; en la TC de tórax se observaron consolidaciones parenquimatosas broncoalveolares en el lóbulo superior y en el medio. Los resultados de los hemocultivos, cultivo de punta de catéteres, baciloscopia de esputo y galactomanano fueron negativos. No se realizó fibroscopia por plaquetopenia. Recibió tratamiento antibiótico con meropenem, ceftazidima, metronidazol, amikacina, petamidina, caspofungina y voriconazol. La evolución clínica fue desfavorable, con fallo multiorgánico y fallecimiento en noviembre de 2007.
Desensibilización Rh fetal
49. Mujer de 31 años de edad con hipotiroidismo subclínico, en la tercera gestación con dos partos anteriores normales. A la semana 22 se le detectaron anticuerpos anti-kell positivos a título 1/256, que aumentaron en la semana 24 hasta 1/1024. Recibió 19 sesiones de PF con recambio con albúmina con descenso progresivo del título de anticuerpos. A las 32,5 semanas de gestación se decidió inducir maduración fetal y realización de cesárea con éxito.
50. Mujer de 37 años, con tercera gestación, que ingresó por isoinmunización Rh fetal (con titulación de anticuerpos 1/256), con ecografía fetal con ascitis y derrame pericárdico. Se realizaron dos sesiones de PF con reposición con albúmina. Posteriormente se realizó funiculocentesis con transfusión de 30 ml de sangre y se administró tratamiento con atosiban para inhibir las contracciones uterinas. A los seis días del ingreso, se constata la muerte del fetol, por lo que se indujo el parto.
Desensibilización del paciente hipersensibilizado para trasplante renal
51. Mujer de 50 años de edad, con enfermedad renal de base no filiada que llevaba cuatro años en hemodiálisis. La tasa de anticuerpos máxima y actual contra una gran variedad de antígenos anti-HLA-I era del 85-95%, tanto por CDC como por Luminex, y hacían altamente improbable el trasplante renal. Era una paciente politransfundida y no había tenido embarazos previos. Había recibido un trasplante renal en el año 2004 que perdió a los 4 meses por rechazo agudo vascular y trombosis vascular; se le realizó trasplantectomía ese mismo año. La paciente había recibido antes de su segundo trasplante un tratamiento de desensibilización consistente en dos sesiones de PF e inmunoglobulinas intravenosas (2 g/kg de peso) mensuales desde diciembre de 2006 hasta marzo de 2007 (ocho sesiones de PF en total). Como inicialmente no se objetivó una disminución clara de la tasa de anticuerpos, en julio de 2007 recibió dos dosis de rituximab, tres sesiones de PF más y, de nuevo, tres dosis mensuales de inmunoglobulinas intravenosas (2 g/kg de peso) hasta diciembre de 2007. Tras finalizar el tratamiento, aunque no se observó un descenso significativo en la tasa de anticuerpos, sí desaparecieron algunas especificidades anti-HLA, de manera que se realizó un informe minucioso con los antígenos de clase I permisibles para el trasplante renal. La paciente recibió un injerto renal de cadáver procedente de un donante de 34 años de edad en septiembre de 2008, y recibió el protocolo de tratamiento inmunosupresor consistente en tacrolimus, micofenolato mofetil, metilprednisolona y ATG, dos dosis de rituximab y PF en los días 3, 5 y 7 posteriores al trasplante, con infusión de inmunoglobulinas intravenosas a dosis de 0,5 g/kg de peso tras cada sesión y posteriormente un refuerzo de 1 g/kg en los días 10, 11 y 30 posteriores al trasplante. Evolucionó inicialmente con función renal inmediata y alcanzó una creatinina al alta de 0,7 mg/dl. No sufrió episodios de rechazo agudo en el postrasplante inmediato ni efectos secundarios inmediatos con la medicación. La PCR del virus BK al alta y en el seguimiento posterior ha sido negativa, así como la PCR de citomegalovirus y la serología IgM de HVS-1, HVS-2, varicela zóster y virus de Epstein-Barr (VEB). La función renal medida por cifras de creatinina a los 3, 6 y 9 meses ha sido excelente. El recuento CD19+ de poblaciones linfocitarias B durante el seguimiento fue de 0,3 ± 0,02%. En julio de 2009 sufre deterioro de función renal con elevación de creatinina hasta 2,3 mg/dl, en el contexto de introducción reciente de antagonistas de los receptores de la angiotensina (ARA II) y niveles de tacrolimus algo elevados. La biopsia no mostró datos de rechazo agudo, la tinción con C4d en capilares peritubulares fue negativa y se descartó nefropatía por virus BK virus. Se observaron datos de toxicidad tubular y vascular por anticalcineurínicos con depósitos hialinos moderados-graves en dos o más arteriolas. La función renal mejoró parcialmente hasta alcanzarse una creatinina de 1,6 mg/dl tras optimizar los niveles de anticalcineurínicos.
Evolución
La mortalidad global fue del 19,6 % (n = 10), en seis de los casos secundaria a shock séptico y en el resto como resultado de la evolución de la enfermedad de base y uno por shock hemorrágico en la zona de la biopsia renal. No hubo fallecimientos en el grupo de inmunoactivación del trasplante. En el grupo de vasculitis hubo tres fallcimientos (dos secundarios a shock séptico). Nueve de los 10 pacientes que fallecieron lo hicieron dentro de los tres primeros meses tras el diagnóstico.
Veinticuatro pacientes precisaron hemodiálisis al inicio del cuadro clínico, nueve de los 11 pacientes con vasculitis, cuatro de los cinco pacientes con SHU y cinco de los 15 pacientes con inmunoactivación del trasplante. Al final de la evolución, 14 de ellos permanecieron en programa de hemodiálisis. Concretamente, cinco de 11 de los pacientes con vasculitis, dos de los 15 pacientes sometidos a trasplante y tres de los cinco pacientes con SHU (tabla 1). Los casos como la paciente hipersensibilizada en programa de hemodiálisis y el caso del paciente con LES asociado con PAM ya estaban en programa de hemodiálisis. De forma significativa, los pacientes que evolucionaron hacia ERT en el grupo de las vasculitis tenían mayor edad y mayor creatinina al comienzo de la enfermedad. Lógicamente, la paciente de 62 años que ya estaba en programa de hemodiálisis no fue incluida (tabla 4).
En 25 casos con evidencia de anemia hemolítica se constató consumo de haptoglobina en nueve de 25 pacientes (36%), y se corrgió en dos de tres casos tras el tratamiento con PF. Asimismo, en 29 pacientes se solicitó extensión de sangre periférica y se detectaron esquistocitos en nueve pacientes (31%), que desparecieron tras el tratamiento con PF en todos los casos.
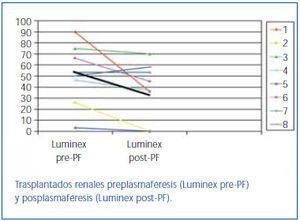
En los pacientes sometidos a trasplante en quienes se monitorizaron anticuerpos anti-HLA de clases I o II medidos por Luminex antes y después de la PF se objetivó una media de descenso del título de anticuerpos en todos menos en un paciente, y el descenso medio fue del 51 al 31% (figura 1).
Complicaciones relevantes
La técnica de PF transcurrió prácticamente libre de complicaciones. Se constataron cinco reacciones al plasma fresco (3%) de carácter leve-moderado (hormigueo peribucal y reacciones urticariformes) que requirieron premedicación con esteroides y no supusieron la interrupción del tratamiento. Sólo hubo una infección de catéter constatada. En un 20% de los pacientes se produjo una coagulación del circuito extracorpóreo, que fue más frecuente en los pacientes obesos (90 frente a 68 kg; p = 0,005) y en quienes se realizó una mayor reposición de volumen (25 frente a 16 litros; p = 0,01).
DISCUSIÓN
La indicación de la técnica de aféresis en general, y de PF en particular, es objeto de debate permanente. La falta de series amplias o de estudios controlados deja un amplio margen de incertidumbre a sus indicaciones y resultados. De ahí que la mayoría de los centros sigan empleando la PF de forma individualizada, dentro del ámbito clínico, no experimental, y como tratamiento de rescate en la mayoría de los casos. Son una excepción las entidades clínicas en las que la indicación de PF es de primera línea (criterio I de las recomendaciones de la ASFA)1-3.
En nuestro centro, las indicaciones para el uso de PF se establecieron de acuerdo con las recomendaciones de la American Associated Blood of Banks y la American Society of Apheresis1-3, como expusimos en la tabla 1. En efecto, pacientes con diagnóstico de síndrome de Guillain-Barré, PTT-SHU, vasculitis o activación inmunológica del trasplante, entre otros, fueron tratados con esta técnica de acuerdo con las mayores evidencias científicas previamente comunicadas en estas entidades5-10,13,16-20. En otros casos, el tratamiento fue más empírico ante la falta de conocimiento científico que lo respaldara11,12,14,15, 21.
Según nuestros conocimientos, no se han realizado estudios prospectivos controlados en los que se evalúen predictores de supervivencia global de los pacientes tratados con PF debido probablemente a la complejidad que supone un análisis de este tipo, especialmente por la heterogenicidad y complejidad de enfermedades susceptibles de recibir dicha técnica. En nuestro estudio, la mortalidad global fue del 19,6%, principalmente de causa infecciosa, seguida de la propia evolución de la enfermedad de base. La mortalidad en los casos de vasculitis (27%) en nuestra serie fue similar a la descrita en la bibliografía médica y confirma los beneficios de la PF en estas enfermedades7-8,22,23. En el caso de las vasculitis, dos de los tres fallecimientos fueron por causa infecciosa; es posible que el grado de afectación sistémica y la inmunosupresión administrada a estos pacientes contribuyera a estos resultados de mortalidad. De hecho, se ha descrito en estos pacientes que una mayor edad, el tiempo de retraso en el inicio de la PF, una dosis inadecuada de PF y el comienzo con fracaso renal y necesidad de diálisis son factores de riesgo independientes asociados con un peor pronóstico22-24, con lo que una aplicación adecuada y precoz de esta técnica puede mejorar el pronóstico a corto y medio plazo. Además, la presencia de IRA puede condicionar un mayor riesgo de infecciones graves y complicaciones hemorrágicas que puede ensombrecer el pronóstico.
El uso de inmunoglobulinas tras las sesiones de PF no está generalizado; futuros estudios aleatorizados en los que se comparen grupos que reciban o no inmunoglobulinas intravenosas tras el tratamiento con PF podrán aclarar si su uso es beneficioso en pacientes sometidos a tratamientos inmunosupresores agresivos, como puedan ser pacientes con vasculitis sistémicas. La infusión de inmunoglobulinas no sólo proporciona defensas sino que produce una serie de efectos sobre el sistema inmune que induce la evolución favorable de muchas enfermedades hacia su resolución por múltiples mecanismos como son: regulación de los autoanticuerpos y citoquinas por medio de los anticuerpos anticitoquinas o antiidiotipo presentes en la mezcla de inmunoglobulinas, inhibición de la unión de las fracciones de complemento a sus células diana, inhibición de la proliferación de células T y B, bloqueo de los receptores Fc de los macrófagos o bloqueo de los anticuerpos antimembrana de las células de Schwann y la mielina, entre otros25.
En los pacientes con SHU no se produjo ningún fallecimiento, si bien nuestra serie sólo recoge cinco casos. Antes del uso de las PF, en esta patología concreta, la tasa de mortalidad alcanzaba el 90% y tras la introducción de la PF en el tratamiento, ésta se redujo a un 20%8. Los agentes patógenos responsables de la mayoría de las enfermedades tratadas con PF tienen una distribución principalmente intravascular. La eficacia de una sesión de PF para una sustancia vendrá dada por su grado de distribución entre el espacio extravascular y el intravascular y también por el tiempo en el que los niveles de dicha sustancia se recuperen después de una sesión de PF1,3. En cuanto a la intensidad de los recambios plasmáticos, el análisis de series publicadas para el tratamiento del SHU indica que el volumen de recambio debe situarse alrededor de 1,5 veces el volumen plasmático del paciente (volumen de plasma infundido entre 50 y 60 ml/kg de peso del paciente) y que han de realizarse diariamente, hasta haber alcanzado la remisión. En la mayoría de los pacientes, la respuesta (medida por aumento en la cifra de plaquetas y hemoglobina, desaparición de síntomas neurológicos y normalización de los niveles de LDH y haptoglobina)7, resulta evidente dentro de los primeros cinco días de tratamiento, por lo que la ausencia de dicha respuesta en una semana constituiría un indicador de fallo de tratamiento. Sin embargo, la mejoría en la alteración de la función renal no suele objetivarse hasta pasadas varias semanas de tratamiento6,7. Las tasas de resolución oscilan entre un 50 y un 80%; estos resultados tan desiguales sugieren una importante variabilidad en la eficacia del tratamiento, y ponen de manifiesto que una proporción elevada de enfermos no responden a la PF. Tal variabilidad en la respuesta puede deberse a desigualdades en la intensidad con la que se aplica el recambio plasmático, en la rapidez con que se inicia éste, en el tipo de enfermedad (SHU idiopático por alteración genética o atípico), o en las características de los pacientes incluidos en cada serie. En relación con estos últimos aspectos, estudios recientes han identificado como factores de mal pronóstico el retraso en el inicio de la PF, la presencia de estupor o coma y el mayor grado de insuficiencia renal7,8.
La evolución de la función renal fue variable según la enfermedad de base de que se tratase; precisaron hemodiálisis al inicio de la enfermedad un 47% de los pacientes, principalmente los del grupo de vasculitis, SHU y trasplante renal. En el metanálisis realizado por Walters Giles, et al.23, la PF otorga un beneficio significativo a los pacientes con afectación renal por vasculitis, con reducción del número de pacientes que requieren diálisis a los 12 años. El estudio MEPEX26 pone en evidencia que en los enfermos con vasculitis y afección renal grave, la PF mejora el pronóstico de la función renal y la supervivencia y, de hecho, las guías de las que disponemos aconsejan la PF como tratamiento de primera línea para estos enfermos. En nuestro estudio, al final de la evolución, más de la mitad de los pacientes se liberaron de la hemodiálisis, quedando en programa de hemodiálisis el 45% de los pacientes con vasculitis, el 60% de los que presentaron SHU y el 13% de los pacientes sometidos a trasplante. Los factores que se asociaron con evolución hacia ERT en los enfermos con vasculitis fueron, de forma significativa, la creatinina en el inicio de la enfermedad y la edad del paciente.
Actualmente para el trasplante renal en los pacientes hipersensibilizados existan pocas opciones si no son sometidos previamente a tratamientos desensibilizantes o a terapias de inducción potentes. En este sentido, las inmunoglobulinas intravenosas a dosis altas han logrado reducir la tasa de anticuerpos circulantes pero, a pesar de su eficacia, en muchos pacientes se obtiene sólo una respuesta parcial y su efecto es variable entre individuos27. Otros investigadores han demostrado que la PF puede disminuir los anticuerpos circulantes28, pero, tras el cese de las sesiones, se produce un rebote importante en el título y, por tanto, se considera actualmente más una técnica complementaria al uso de las inmunoglobulinas para disminuir la tasa de anticuerpos. De igual forma, el rituximab también ha demostrado tener un efecto beneficioso combinado con inmunoglobulinas y PF en la reducción de los anticuerpos anti-HLA y en el tratamiento del rechazo mediado por anticuerpos27,29-31. En cualquier caso, la estrategia de combinar estas medidas pudiera representar la mejor elección terapéutica en estos enfermos, tanto para tratamiento desensibilizador como cuando se detecta un rechazo agudo mediado por anticuerpos. Queda conocer si estos buenos resultados se mantendrán a más largo plazo sin efectos secundarios indeseables, infecciosos o tumorales. Estudios longitudinales bien diseñados aclararán estos aspectos.
Ante la ausencia de evidencias científicas contundentes, nuestro estudio aporta una información muy útil y valiosa para la práctica clínica habitual y, sin duda, nos hace reflexionar sobre estrategias futuras que optimicen el pronóstico en nuestros enfermos. No debemos olvidarnos de que estamos ante una técnica costosa, no exenta de efectos adversos, que proporciona alentadoras expectativas de supervivencia (especialmente en casos desesperados), pero que el riesgo-beneficio, o coste-eficacia sigue siendo, mayormente, una incógnita. De hecho, la principal causa de mortalidad fue la infecciosa, seguida de la evolución de la enfermedad de base. Es decir, la primera puede ser una probable complicación de la enfermedad o la influencia adversa de la técnica y la segunda la falta de respuesta a ésta. Realmente, desconocemos si una mortalidad del 19% es excesiva, pero, en cualquier caso, las causas de muerte son un mensaje inequívoco de advertencia. Aclararlo va más allá de las posibilidades de nuestro análisis.
En resumen, teniendo en cuenta la gran variedad de enfermedades que pueden beneficiarse de la PF y el carácter esporádico de algunas de ellas, la publicación de la experiencia con esta modalidad terapéutica cobra gran importancia, ya que si incrementamos las publicaciones de serie de casos por centros podemos ayudar a ampliar el nivel de evidencia en términos de supervivencia y función renal en múltiples patologías infrecuentes.
Tabla 1. Clasificación de los pacientes por grupos de enfermedad según sospecha diagnóstica inicial. Criterio de indicación de plasmaféresis y evolución de los pacientes
Tabla 2. Características basales y resumen de las pautas de plasmaféresis de los pacientes por grupos diagnósticos
Tabla 3. Evolución de los pacientes por grupos diagnósticos
Tabla 4. Comparación entre los pacientes que evolucionaron a ERT frente a los que no lo hicieron en el grupo de las vasculitis
Figura 1. Evolución de los anticuerpos anti-HLA de clases I y II medidos por Luminex en los pacientes sometidos a trasplante renal.