La proteinuria es frecuente después del trasplante renal y afecta a más del 40% de los pacientes al año del mismo. En general, el nivel de proteinuria es bajo (<500 mg/día), pero incluso estos niveles se relacionan con una reducción significativa en la supervivencia del injerto y del paciente. Por este motivo es importante detectar la proteinuria rápidamente después del trasplante e investigar su causa. Al año del trasplante, la proteinuria se puede deber a múltiples causas, entre las que se incluyen enfermedad glomerular, efecto de anticuerpos anti-HLA de clase II, efecto de fármacos como los inhibidores de m-TOR, enfermedad túbulo-intersticial del injerto y discrepancia funcional importante entre el injerto y el receptor. La relación entre la proteinuria y la supervivencia del injerto probablemente sea la causa de la proteinuria. Los motivos de la relación entre la proteinuria y la supervivencia del paciente se desconocen, pero pueden deberse a una relación entre proteinuria y factores de riesgo cardiovascular tradicionales o a una relación entre la proteinuria, la función endotelial y la inflamación. El tratamiento de la proteinuria debe considerar tres aspectos: la causa de la proteinuria, la reducción inespecífica de la proteinuria, y la reducción del riesgo cardiovascular.
Proteinuria is common following kidney transplantation and affects more than 40% of kidney transplant patients per year. In general, the level of proteinuria is low (<500mg/day) but even those levels significantly reduce graft and patient survival. This is why it is of vital importance to detect proteinuria quickly following transplantation and to investigate its cause. During the same year of the transplant, proteinuria may be caused by multiple factors, including glomerular disease, effects of anti-HLA class II antibodies and drugs such as mTOR inhibitors, tubulointerstitial disease of the graft, and significant functional discrepancy between the graft and the recipient. The relationship between proteinuria and graft survival is likely to be due to the factors that cause proteinuria. It is unknown why proteinuria and patient survival are related, but it could be due to a relationship between proteinuria and traditional cardiovascular risk factors or a relationship between proteinuria, endothelial function and inflammation. To treat proteinuria, three aspects should be considered: the cause of proteinuria, the non-specific reduction of proteinuria, and the reduction of the cardiovascular risk.
INTRODUCCIÓN
La presencia de proteinuria es un hallazgo frecuente después del transplante renal, y afecta al 30-45% de los pacientes al año del mismo1. Tradicionalmente, la literatura sobre la proteinuria después del trasplante discutía el diagnóstico diferencial de proteinuria de alto nivel y su relación con la supervivencia del injerto del paciente2. En los últimos cinco años hemos aprendido que la proteinuria, a todos los niveles, es un marcador biológico importante que identifica injertos y pacientes con mal pronóstico. Estos estudios sugieren dos preguntas que trataremos de responder en esta revisión: ¿cuáles son las causas de proteinuria de bajo y de alto nivel después del trasplante? y ¿a qué se debe la relación entre la proteinuria y la reducción en la supervivencia tanto del injerto como del paciente?
PREVALENCIA
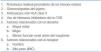
La prevalencia de proteinuria varía entre el 15 y el 45% en distintos estudios, y esta variación se debe principalmente a diferencias en el nivel de proteinuria usado para definir el valor considerado como anormal1 y en el momento en el que se ha determinado la proteinuria. Creemos que es importante diagnosticar la proteinuria durante los primeros meses después del trasplante, lo cual nos permite identificar a los injertos y a los pacientes con alto riesgo. Con este propósito mostramos en la figura 1 la prevalencia de proteinuria a un año del trasplante en receptores de riñones de donante vivo y de cadáver. Como se puede observar no hay diferencias significativas en la prevalencia ni en el nivel de proteinuria entre estos dos grupos. También se puede comprobar (figura 1) que generalmente la proteinuria postrasplante es de bajo nivel y, así, el 30% de los pacientes tienen entre 150 y 500 mg/día, aunque el 6,5% de los receptores en este grupo presentan una proteinuria de más de 1.500 mg/día.
Los datos sobre la prevalencia de albuminuria después del trasplante son más escasos. En estudios realizados en nuestro servicio, demostramos que la albuminuria es común y que afecta a la mayoría de los pacientes con proteinuria, incluso de bajo nivel. Por ejemplo, más del 80% de los pacientes con proteinuria entre 150 y 500 mg/día y el 100% de los pacientes con niveles más altos de proteinuria presentan albuminuria3. Entre los pacientes sin proteinuria aproximadamente un 15% tienen una albuminuria superior a 30 mg/día3.
CAUSAS DE PROTEINURIA
La proteinuria en el trasplante renal puede deberse a múltiples causas (tabla 1). Pacientes con proteinuria de alto nivel (>1.500 mg/día) frecuentemente tienen una glomerulopatía en el injerto (en el 80% de los casos)3. Sin embargo, en pacientes con niveles más bajos, establecer la causa de la proteinuria puede ser difícil. Consideraremos brevemente a continuación las distintas causas de proteinuria.
Proteinuria residual
La presencia de proteinuria, procedente de los riñones nativos, puede complicar la interpretación de la proteinuria detectada después del trasplante. Esto es común en los pacientes que reciben un trasplante renal anticipado o al poco tiempo de iniciar diálisis y, por lo tanto, con una significativa función renal y diuresis residual4. Resultados de dos estudios nos aportan guías prácticas para ayudar en la interpretación de la proteinuria en estos pacientes. En primer lugar, estos estudios demuestran que la proteinuria pretrasplante, incluso cuando es de rango nefrótico, disminuye abruptamente durante las primeras semanas tras recibir un trasplante renal normofuncionante4,5. Esta disminución probablemente se deba a la disminución del flujo sanguíneo que ocurre en los riñones nativos después de un trasplante, si el injerto tiene buena función5. Este último punto es importante porque, en nuestra experiencia, en receptores con pobre función inicial del injerto el flujo sanguíneo en los riñones nativos se mantiene y la proteinuria «nativa» persiste. Un segundo estudio nos ayuda en la interpretación de la proteinuria4. En primer lugar, en pacientes con injerto normofuncionante, la presencia de una proteinuria superior a 3.000 mg/día a las tres semanas postrasplante no debe atribuirse a los riñones nativos sino que indica la presencia de enfermedad glomerular en el injerto (probablemente una recurrencia de una glomerulopatía). En segundo lugar, una proteinuria superior a 1.500 mg/día al año del trasplante y/o un incremento en la proteinuria desde la tercera semana al año postrasplante en más de 500 mg/día indican una patología en el injerto. En tercer lugar, los riñones nativos pueden tener bajos niveles de proteinuria (menos de 500 mg/día) incluso un año después del trasplante, aunque es de esperar que dicha proteinuria disminuya con el paso del tiempo.
Enfermedades glomerulares del injerto
En un estudio previo hemos evaluado biopsias de protocolo en pacientes con proteinuria al año del trasplante3. Sólo el 9% de estos pacientes tenían una glomerulopatía. Sin embargo, entre los pacientes con niveles de proteinuria de más de 1.500 mg/día, el 80% tenían evidencia de enfermedad glomerular. Otros estudios apoyan estos resultados2. Debemos considerar tres tipos de glomerulopatía en el injerto: enfermedad recurrente, enfermedad de novo y glomerulopatía del trasplante.
En la tabla 2 se resumen la prevalencia y las consecuencias para el injerto de la recurrencia de las glomerulopatías más comunes. Destaca que en la mayoría de los estudios, el diagnóstico de recurrencia se ha basado en la presencia de proteinuria. La glomeruloesclerosis segmentaria y focal (GSF) es una enfermedad con un riesgo de recurrencia alto, que afecta aproximadamente al 30% de los pacientes. Estudios previos han identificado a subgrupos de pacientes con GSF que tiene un riesgo mucho más alto y que incluyen: pacientes diagnosticados antes de los 18 años, pacientes con progresión rápida (menos de tres años) de la enfermedad6 y, en particular, pacientes con historia de recurrencias en trasplantes previos. Aproximadamente el 50% de los pacientes con recurrencia de la GSF pierden el injerto. La nefropatía membranosa (NM) también se asocia con un riesgo alto de recurrencia. Estudios de biopsias de protocolo demostraron que la recurrencia histológica de la NM ocurre en general durante los primeros meses después del trasplante en un 40% de los casos y que, inicialmente, los cambios histológicos no causan proteinuria7. La nefropatía IgA recurre con frecuencia (>50%) después del trasplante, aunque generalmente los cambios histológicos son leves y consisten en la presencia de depósitos de IgA detectados por inmunofluorescencia y pequeños depósitos mesangiales detectados por microscopio electrónico, pero sin proliferación de células mesangiales ni manifestaciones clínicas. Es raro que la nefropatía IgA recurrente cause la pérdida del injerto, aunque hemos observado raros casos con un comportamiento clínico agresivo acompañado de alto nivel de proteinuria. La glomerulopatía mesangiocapilar (o membranoproliferativa, GNMP) ha adquirido gran interés últimamente debido a nuevos datos que nos permiten distinguir varios subtipos de esta enfermedad8,9. Desde el punto de vista de la recurrencia, distinguir entre estos tipos de GNMP tiene importantes consecuencias clínicas. Por ejemplo, en casos de GNMP asociada con proteínas monoclonales, la recurrencia de la enfermedad puede producirse rápidamente y tiene una presentación clínica agresiva10. También los pacientes con GNMP tipo I asociada con hipocomplementemia presentan un riesgo elevado de recurrencia10,11. En general, en pacientes con GNMP tipos I o II con hipocomplementemia se deben sospechar alteraciones de la activación del complemento9,12 y si éstas existen, el pronóstico después del trasplante es grave.
Estudios de biopsias de protocolo revelaron que, en muchos casos, la recurrencia de una glomerulopatía no se asocia con proteinuria7,10. Esto resulta de interés por varios motivos: en primer lugar, el diagnóstico histológico por biopsias de protocolo nos ofrece por primera vez información de cuándo ocurre la recurrencia y, también, por primera vez nos da información sobre los cambios histológicos que se producen durante las fases iniciales de estas enfermedades. En segundo lugar, es razonable pensar que el tratamiento de estas recurrencias en sus estadios iniciales será más efectivo que en estadios más avanzados. En tercero, debemos recordar que la proteinuria de bajo nivel puede ser la primera manifestación de una recurrencia de una glomerulopatía nativa, que puede tener implicaciones negativas para el injerto a largo plazo. Por tanto, es importante investigar a los pacientes con proteinuria de bajo nivel y seguirlos de cerca, mediante determinaciones periódicas y practicando una biopsia si se demuestra un aumento progresivo de la proteinuria.
En ciertos casos, el injerto desarrolla una glomerulopatía que no es recurrente, pero que tiene las características histológicas de una glomerulopatía del riñón nativo. Estas glomerulopatías generalmente se diagnostican más tarde que las recurrentes y pueden dar como resultado la pérdida del injerto13. Los tipos histológicos más comunes incluyen la GSF14, la NM y la mesangiocapilar. Son enfermedades infrecuentes, de etiología pobremente definida.
La glomerulopatía del trasplante (GT) ha sido reconocida durante muchos años como una enfermedad que se diagnostica generalmente varios años después del trasplante y que puede causar proteinuria de alto nivel, incluso de rango nefrótico15,16. En los últimos años hemos aprendido que esta enfermedad, en la mayoría de los casos, se debe al daño de los capilares producido por anticuerpos anti-HLA clase II17. El empleo de biopsias de protocolo y la capacidad de medir estos anticuerpos de forma efectiva han permitido que reconozcamos que, en muchos pacientes, la GT se desarrolla durante los primeros meses después del trasplante y que su presentación clínica frecuentemente consiste en pérdida progresiva de función del injerto con hipertensión severa y proteinuria de bajo nivel. El nivel de proteinuria es un índice pronóstico importante en estos pacientes13.
En estudios más recientes (presentados en el American Transplant Congress, ATC, 2011), hemos demostrado que la proteinuria es un marcador precoz del daño producido en los capilares glomerulares por anticuerpos anti-HLA II, antes de que las manifestaciones histológicas de GT fueran visibles. La presencia de proteinuria, entre todos los pacientes con anticuerpos anti-HLA II, identifica a un subgrupo de pacientes con alta incidencia de glomerulitis y alto riesgo de desarrollar GT en el futuro. Estudios realizados con microscopio electrónico demostraron que el daño en las células endoteliales del capilar glomerular precede a los cambios histológicos que consideramos diagnósticos de la GT18.
Proteinuria asociada con daño tubular e intersticial
Estudios publicados hace muchos años atribuían la proteinuria al «rechazo crónico del trasplante»15. En la mayoría de estos casos, la biopsia demostraba cambios de GT. Estudios de biopsias en pacientes con proteinuria3 demostraron que existe un subgrupo de pacientes con nefropatía crónica del trasplante (fibrosis intersticial y atrofia tubular19), sin enfermedad glomerular, pero con niveles bajos de proteinuria. Con frecuencia, estos pacientes presentan albuminuria3 y, por tanto, es posible que tengan una enfermedad glomerular oculta. Al mismo tiempo, el túbulo proximal reabsorbe grandes cantidades de albúmina20, con lo cual es posible que la proteinuria en estos pacientes se deba a daño tubular. Aunque no sabemos el origen de la proteinuria en estos pacientes, debemos mencionar que en estos casos la supervivencia del injerto es pobre3.
Proteinuria secundaria al uso de inhibidor del m-TOR
El uso de sirolimus o everolimus se ha asociado con la aparición de proteinuria en el trasplante renal en numerosos estudios1,21,22. Inicialmente, esta observación se produjo en pacientes con nefropatía crónica del injerto tras el cambio de inhibidores de la calcineurina (ICN) a sirolimus con la intención de preservar la función renal. Por esta razón se sugirió que la proteinuria asociada con el sirolimus era el resultado del efecto hemodinámico secundario al ICN. En este momento, la evidencia indica que inhibidores del m-TOR tienen efectos directos en la filtración de proteínas en el glomérulo y específicamente en el podocito. Letavernier, et al.23 demostraron que el sirolimus afecta a la síntesis de VEGF, que es esencial para la supervivencia del podocito y de las células endoteliales, así como para la señalización intracelular Akt, que es crítica para la diferenciación, adhesión y supervivencia de las células epiteliales. Estudios más recientes han demostrado una disminución de la expresión de proteínas constituyentes de la hendidura diafragmática, estructura esencial para la ultrafiltración selectiva del glomérulo24,25.
Estudios clínicos realizados indican que la presencia de proteinuria en un paciente tratado con sirolimus puede tener consecuencias negativas para el injerto. En estudios de conversión de ICN a sirolimus se detectó que específicamente en pacientes con proteinuria, la conversión a sirolimus tuvo efectos negativos sobre la supervivencia del injerto26. En casos aislados27 se ha detectado el desarrollo de GSF en injertos tratados con sirolimus. En particular, en pacientes con glomerulopatías incipientes (principalmente IgA recurrente), fármacos inhibidores del m-TOR pueden producir un aumento importante de la proteinuria y un deterioro de la función renal. Por el contrario, no existen evidencias claras de que el sirolimus perjudique al injerto en pacientes que mantienen un nivel bajo y estable de proteinuria (<500 mg/día). De todas formas, estos pacientes deben ser seguidos de cerca, midiendo la proteinuria periódicamente y, si ésta aumenta de forma progresiva, deberá considerarse la suspensión del inhibidor m-TOR.
Proteinuria relacionada con factores del donante y del receptor
Resulta interesante que entre todos los pacientes con proteinuria al año del trasplante el 51% tiene una causa clara; se incluyen glomerulopatía en la biopsia, sirolimus o anticuerpos anti-HLA clase II. Sin embargo, un 49% de los pacientes con proteinuria no presentan ninguno de estos factores. Esta observación nos hizo explorar otros factores que puedan estar relacionados con la proteinuria (tabla 3) (abstract presentado en ATC, 2011)1.
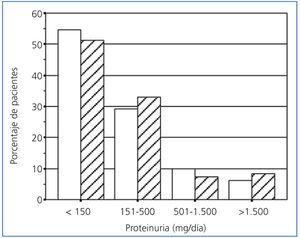
Es interesante considerar la relación entre la proteinuria y los factores demográficos del donante y del receptor3. La proteinuria es más común y más abundante en trasplantes de donantes más pequeños o con menos función (donantes mayores, donantes femeninos, donantes con función relativamente más baja) y en trasplantes de receptores más grandes (receptores hombres con un mayor índice de masa corporal [IMC]). Estos datos sugieren que la diferencia de tamaño/función entre el donante y el receptor condiciona, en parte, el riesgo de proteinuria. Fisiológicamente, es posible que esta diferencia de tamaño cause una hiperfiltración glomerular, lo cual puede producir proteinuria y deterioro progresivo de la función renal28,29. Un posible ejemplo de este modelo se expone en la figura 2, en la que destaca que el porcentaje de pacientes con proteinuria aumenta con la edad del donante. Al mismo tiempo, en cada grupo de donante definido por su edad el riesgo de proteinuria aumenta de manera progresiva cuanto más alto sea el peso del receptor.
RELACIÓN ENTRE LA PROTEINURIA Y LA SUPERVIVENCIA DEL INJERTO
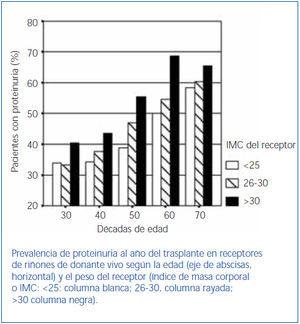
El interés sobre la proteinuria después del trasplante se debe, básicamente, a su relación con la supervivencia del injerto. En general, cuando el nivel de proteinuria aumenta, la supervivencia del injerto disminuye (figura 3). En esta figura destaca que el riesgo de pérdida del injerto aumenta progresivamente con el nivel de proteinuria y que dicho riesgo es notable incluso en pacientes que consideramos que presentan un nivel de proteinuria bajo (<500 mg/día). En estudios previos3 calculamos que, en comparación con injertos sin proteinuria, el riesgo de pérdida del injerto con niveles de proteinuria comprendidos entre 150 y 500 mg/día aumenta a 2,45 veces, a 6,07 veces en pacientes con proteinuria comprendida entre 501 y 1.500 mg/día y a 14,3 veces con niveles de proteinuria superiores a 1.500 mg/día.
¿A qué se debe está relación entre el nivel de proteinuria y la supervivencia del injerto? Nuestra propuesta es que la proteinuria es un indicador de una serie de agresiones que pueden afectar al injerto y que son éstas principalmente, y no la proteinuria, las que causan la pérdida del trasplante. Por ejemplo, es muy probable que en pacientes con altos niveles de proteinuria debido a enfermedad glomerular la glomerulopatía sea la causa principal de la pérdida del injerto. También es posible que en estos pacientes la presencia de altos niveles de proteinuria pueda producir daño intersticial al injerto30. Está mucho menos claro la razón por la cual los injertos con niveles bajos de proteinuria también tienen una supervivencia comprometida31,32 y es en este caso en el que, de nuevo, tenemos que considerar la causa de la proteinuria (tabla 1 y tabla 3). Bajos niveles de proteinuria pueden indicar: 1) los primeros estadios de recurrencia de una glomerulopatía; 2) el efecto de anticuerpos anti-HLA clase II, o 3) la existencia de una desproporción importante entre la función del injerto y las necesidades del receptor. En cada uno de estos casos la proteinuria está relacionada con una reducción de la supervivencia del injerto, pero el mecanismo de daño al injerto es distinto. Existen dos formas de proteinuria de bajo nivel, que probablemente no estén asociadas con un pronóstico desfavorable: proteinuria residual y proteinuria inducida por inhibidores del m-TOR. Incluso en estos casos, tenemos que tomar precauciones y seguir al paciente de cerca para confirmar que no aumenta durante el seguimiento. Si esto ocurre, podemos descartar la posibilidad de que la proteinuria sea residual4 y debemos buscar otras causas.
Para entender la relación entre la proteinuria y la supervivencia del injerto también debemos considerar que la presencia de proteinuria se asocia con otras características del donante, del receptor y del injerto3. Por ejemplo, la proteinuria se asocia con una menor función renal, y aunque es importante considerar esta relación, estadísticamente la relación entre la proteinuria y la supervivencia del injerto es independiente de la función del injerto3.
RELACIÓN ENTRE LA PROTEINURIA Y LA SUPERVIVENCIA DEL PACIENTE
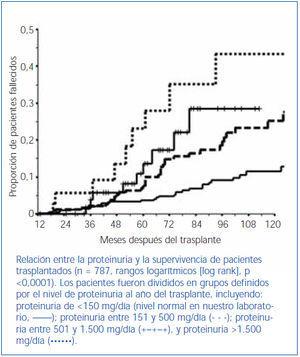
La proteinuria en el trasplante renal se asocia con una reducción en la supervivencia del paciente. Varios estudios ya publicados han demostrado esta relación33-35. Concretamente, otros estudios demostraron que pacientes con proteinuria tienen un aumento del riesgo cardiovascular de 2,45 veces si se comparan con pacientes sin proteinuria36. En estudios más recientes de nuestro grupo (abstract presentado en el ATC, 2011) confirmamos la relación entre un incremento progresivo en la proteinuria y una disminución en la supervivencia del paciente e iniciamos un estudio de los factores que pueden explicar o contribuir a esta relación (figura 4). En esta figura destaca que incluso niveles bajos de proteinuria, de menos de 500 mg/día, se asocian con una reducción importante en la supervivencia del paciente.
Debemos considerar tres tipos de factores para tratar de explicar la relación entre la proteinuria y la supervivencia del paciente: en primer lugar, es posible que los factores que causan la proteinuria también aumenten el riesgo del paciente. Un examen de estos factores (tabla 3) no sugiere que ésta sea una explicación plausible y, de hecho, en estudios preliminares no se ha encontrado una relación entre los factores relacionados con la proteinuria y la supervivencia del paciente. En segundo lugar, es posible que pacientes con proteinuria adquieran o tengan otros factores que pueden estar relacionados con la supervivencia del paciente3. Hemos ampliado estos estudios recientemente (ATC, 2011) y, en efecto, la proteinuria se relaciona con otros parámetros bioquímicos (lípidos elevados y albúmina y hemoglobina disminuidas), con la presión arterial y con la disminución de la función del injerto. Todas estas variables están relacionadas con la supervivencia del paciente. En tercer lugar, es bien conocido que, en la población general, la microalbuminuria está relacionada con una mayor mortalidad por todas causas, incluyendo causas cardiovasculares37,38. Esta relación generalmente se atribuye a una asociación entre albuminuria/proteinuria y alteraciones en la función endotelial y/o inflamación. Recientemente, en un estudio retrospectivo se observó que la microalbuminuria se relaciona con la supervivencia de trasplantados renales39. En este estudio lo que ha resultado ser sorprendente es que la albuminuria se relacionó no sólo con un aumento del riesgo cardiovascular sino también con un incremento en el riesgo de mortalidad por cáncer. La albuminuria es muy común después del trasplante, por tanto, es importante confirmar estas relaciones y estudiar los factores que puedan explicar los mecanismos que subyacen a la relación entre proteinuria y supervivencia del trasplantado renal.
TRATAMIENTO
El tratamiento de un paciente con proteinuria debe incluir tres aspectos: 1) tratamiento específico de la causa de la proteinuria; 2) reducción de la proteinuria usando tratamientos inespecíficos, y 3) tratamiento del riesgo cardiovascular. Con frecuencia el tratamiento de la proteinuria, particularmente de bajo nivel, se limita al control de la presión arterial o el empleo de inhibidores del enzima convertidor de la angiotensina (IECA), que pueden reducir la concentración de proteínas en la orina. Aunque estas maniobras probablemente sean útiles, en nuestra opinión es un error no tratar de investigar la posible causa de la proteinuria. Establecer dicha causa no sólo nos puede dar información pronóstica sobre el injerto, sino que también puede identificar el mecanismo de daño al injerto y nos puede abrir caminos para el tratamiento específico.
Tratamientos específicos
En esta revisión no podemos discutir en detalle todas las terapias que podemos usar para tratar las múltiples causas de proteinuria en el trasplante (tabla 1). En general, el tratamiento de las glomerulopatías recurrentes sigue las mismas pautas usadas en el tratamiento de estas enfermedades en el riñón nativo. Sin embargo, cuando tratamos estas enfermedades en el paciente trasplantado debemos considerar varios factores particulares:
1. El empleo de fármacos antirrechazo puede modificar el comportamiento de ciertas glomerulopatías en el injerto. Por ejemplo, si consideramos la baja prevalencia de recurrencia de enfermedades como el lupus eritematoso. Además, los fármacos antirrechazo pueden modificar los efectos de otros fármacos. Por ejemplo, se sabe que los anticuerpos anti-CD20 causan depleción de los linfocitos B durante un plazo mucho más amplio en pacientes trasplantados que en otros pacientes40,41. En nuestra experiencia, la ciclofosfamida puede usarse en el tratamiento de glomerulopatías agudas agresivas del injerto, pero debe evitarse su utilización al mismo tiempo que la azatioprina o el micofenolato, dado el alto riesgo de leucopenia.
2. Los pacientes que recibieron un trasplante obviamente tuvieron una glomerulopatía en el riñón nativo grave. Por tanto, es posible que en los pacientes trasplantados estas enfermedades puedan ser especialmente agresivas. Esto, por supuesto, no es aplicable a todos los pacientes y, por ejemplo, la recurrencia de la nefropatía IgA es, en general, leve. Sin embargo, otros estudios han sugerido que la agresividad de la enfermedad en el riñón nativo se reproduce en el injerto, por ejemplo en el caso de la GSF42. También hemos detectado una baja remisión espontánea de la NM en el injerto: entre 34 pacientes diagnosticados de NM recurrente por biopsias por protocolo y con manifestaciones clínicas mínimas, 33 han presentado un aumento progresivo de la proteinuria y, en aquellos casos con biopsias de seguimiento, un empeoramiento histológico de la nefropatía. Estas consideraciones tienen implicaciones para decidir cuándo hay que tratar al paciente con recurrencia.
3. En el injerto, las glomerulopatías pueden diagnosticarse en sus etapas iniciales porque en estos pacientes la proteinuria se mide periódicamente43. En nuestro servicio, el empleo de biopsias por protocolo nos permite diagnosticar estas enfermedades frecuentemente cuando no hay manifestaciones clínicas. Quizá por este motivo ciertos tratamientos son más efectivos en el injerto que en el riñón nativo. Por ejemplo, la plasmaféresis puede ser efectiva en el tratamiento de ciertos casos de GSF44 y de GNMP10,45. El diagnóstico precoz de estas enfermedades teóricamente puede mejorar su respuesta al tratamiento, como hemos visto, en el caso de la NM40.
En pacientes con proteinuria es útil medir el nivel de anticuerpos anti-HLA por varios motivos: 1) la mayoría de pacientes con glomerulopatía del trasplante tienen o han tenido anticuerpos anti-HLA clase II, con lo cual su presencia tiene valor diagnóstico; 2) la existencia de anticuerpos anti-HLA II y proteinuria es un índice precoz de daño capilar por anticuerpos y se asocia a una supervivencia del injerto reducida; 3) el nivel de anticuerpos anti-HLA clase II se relaciona con la supervivencia del injerto y esta relación es independiente de otros factores como marcadores en la biopsia (principalmente la presencia de C4d en los capilares) y marcadores bioquímicos (proteinuria y función renal)46; 4) la aparición de nuevos anticuerpos anti-HLA indica que la inmunosupresión no es efectiva, bien porque el paciente no está tomando su medicación regularmente, o bien porque las dosis indicadas no son suficientes; 5) en pacientes que desarrollan anticuerpos anti-HLA después del trasplante en ocasiones es posible suprimir el nivel de anticuerpos con dosis más altas de inmunosupresores y nuestra recomendación es aumentar la dosis de micofenolato y/o tacrolimus durante un período delimitado de aproximadamente seis meses, midiendo de forma periódica los niveles séricos de anticuerpos.
En pacientes que reciben inhibidores del m-TOR es fundamental monitorizar la proteinuria periódicamente y si ésta aumenta de forma significativa recomendamos dejar de administrar el fármaco. Sirolimus puede aumentar de forma espectacular la proteinuria debida a una glomerulopatía, incluso cuando ésta es leve. En nuestra experiencia, dejar de administrar esta medicación da como resultado una mejoría de la proteinuria en un período de pocos meses. En pacientes con alto nivel de proteinuria, el sirolimus puede producir fracaso renal agudo47. Por último, es importante mencionar que en pacientes con proteinuria un cambio de ICN a inhibidores del m-TOR puede ser perjudicial26.
Como comentamos anteriormente, hemos detectado que aproximadamente en un 50% de los pacientes la proteinuria del trasplante puede estar relacionada con factores del donante o del receptor indicativos de una discrepancia importante entre la capacidad funcional limitada del injerto para responder a las demandas del receptor. Posiblemente, en estos casos la proteinuria se debe a hipertensión glomerular e hiperfiltración glomerular y si éste es el caso, la inhibición del sistema renina-angiotensina (SRA) se debe considerar como un tratamiento específico de la causa de la proteinuria48.
Tratamiento inespecífico de la proteinuria en el trasplante renal
Basándonos en los resultados de estudios de control de la proteinuria en la enfermedad renal crónica, parece razonable recomendar las siguientes medidas inespecíficas en los pacientes sometidos a trasplante: 1) control de la presión arterial (presión arterial sistólica menor de 130 mmHg); 2) utilización de IECA y/o antagonistas de los receptores de la angiotensina II (ARAII) a la máxima dosis tolerada, incluso si no hay hipertensión; 3) control del perfil lipídico, preferiblemente con estatinas; 4) mantener un adecuado IMC; 5) restricción de proteínas en la dieta, y 6) abandono del tabaco49.
En primer lugar, debemos insistir en que, en pacientes con problemas renales no trasplantados, estas medidas disminuyen la progresión de la insuficiencia renal, pero, en general, no previenen su aparición50. Por tanto, debemos considerar estas medidas inespecíficas como tratamiento que debe añadirse al tratamiento específico. En segundo lugar, aunque la inhibición del SRA reduce la proteinuria del trasplante, no existe suficiente evidencia de que mejore la supervivencia del injerto. En tercero, es importante destacar que el uso de IECA o de ARAII en pacientes sometidos a trasplantes puede tener consecuencias negativas importantes; por ello deben tomarse precauciones especiales, entre las que se incluyen el empleo de dosis bajas y la monitorización de la creatinina, los electrolitos (potasio) y la hemoglobina durante las primeras semanas del tratamiento.
Una revisión sistemática51 de 21 estudios aleatorizados sobre la utilización de IECA y/o ARAII y en la que se incluían 1.549 pacientes trasplantados llegó a la conclusión de que estos fármacos producen una reducción clínicamente significativa de la proteinuria, pero también del hematocrito y de la tasa de filtración glomerular. En este estudio no se observaron diferencias significativas en el control de la presión arterial ni en la supervivencia del injerto. Sin embargo, los estudios incluidos en esta revisión tienen limitaciones debido al pequeño tamaño de la muestra, al reducido tiempo de seguimiento y al inicio del tratamiento en diferentes momentos después del trasplante. Un estudio prospectivo, aleatorizado, controlado y multicéntrico evaluó el efecto de un ARAII (candesartán) sobre la supervivencia del injerto y la morbimortalidad cardiovascular en 502 pacientes trasplantados renales52. Dicho estudio finalizó antes de lo previsto a causa de una tasa de eventos menor de lo esperado, pero se observó que los pacientes tratados con candesartán tuvieron un descenso significativo de la proteinuria y un mejor control de la presión arterial respecto a los pacientes que recibieron placebo. Dos estudios observacionales y retrospectivos trataron de esclarecer el efecto de la inhibición del SRA en la supervivencia del injerto, pero con resultados contradictorios. En el primero de ellos53, se observó un efecto beneficioso significativo sobre la supervivencia tanto del injerto como del paciente que fue independiente de la presencia de proteinuria. Por el contrario, el segundo de estos estudios54 concluyó que la inhibición del SRA no tiene efectos beneficiosos ni sobre la supervivencia del injerto ni sobre la del paciente, incluso en subgrupos de pacientes con alto riesgo cardiovascular. En resumen, con los datos de los que se dispone en la actualidad sería prematuro recomendar el tratamiento con IECA y/o ARAII con la finalidad de mejorar la supervivencia del injerto o del paciente en el trasplante renal, ya que este efecto todavía se desconoce.
Cardioprotección
La presencia de proteinuria, incluso de bajo nivel, identifica sobre todo a los pacientes con una reducida supervivencia, pero no sólo por un aumento del riesgo cardiovascular34,36. Actualmente no se conoce el mecanismo que causa este incremento del riesgo y no tenemos suficientes datos (como hemos visto en el anterior apartado) para concluir si la reducción de la proteinuria o el uso de inhibidores del SRA mejoran el pronóstico de estos pacientes. Sin embargo, es razonable intensificar las medidas cardioprotectoras en pacientes con proteinuria; entre dichas medidas deben incluirse las siguientes: control de la presión arterial (menos de 130 mmHg); empleo de estatinas manteniendo el nivel de colesterol LDL inferior a 100 mg/dl (menos de 80 mg/dl en pacientes de alto riesgo55); control estricto de la glucemia en pacientes con diabetes (medida discutible en función de estudios recientes56); evitar el uso de tabaco; uso de aspirina, y uso de betabloqueantes. Entre estas medidas, sólo tenemos prueba, basado en estudios prospectivos, controlados y aleatorizados, de que el empleo de estatinas es efectivo en pacientes trasplantados57.
CONCEPTOS CLAVE
1. La proteinuria después del trasplante es común y puede deberse a múltiples causas.
2. La proteinuria, incluso cuando es de bajo nivel (<500 mg/día), es un indicador sensible de una supervivencia reducida del injerto.
3. La reducción en la supervivencia del injerto con proteinuria probablemente se deba al mismo problema que causa la proteinuria. Por lo tanto, es fundamental el investigar la causa de proteinuria después del trasplante.
4. La proteinuria, incluso cuando es de bajo nivel (<500 mg/día), también está asociada con una reducción en la supervivencia del paciente principalmente por un aumento del riesgo cardiovascular.
5. El tratamiento de la proteinuria debe considerar tres aspectos: la causa, la reducción con medidas inespecíficas y la disminución del riesgo cardiovascular asociado a ella.
Tabla 2. Riesgo de recurrencia de glomerulopatías en el trasplante
Tabla 3. Factores relacionados con un aumento en la prevalencia y la intensidad de la proteinuria al año del trasplante
Tabla 1. Causas de proteinuria después del trasplante
Figura 1. Prevalencia de proteinuria en receptores de riñones de vivo (columnas blancas, n = 1.043) y en receptores de riñones de cadáver (columnas con rayas, n = 193) al año del trasplante.
Figura 2. Prevalencia de proteinuria al año del trasplante en receptores de riñones de donante vivo según la edad y el peso del receptor.
Figura 3. Relación entre la proteinuria y la supervivencia del injerto (excluyendo la muerte del paciente).
Figura 4. Relación entre la proteinuria y la supervivencia de pacientes trasplantados.