Antecedentes: El trasplante de órganos de donantes añosos en receptores de edad avanzada se ha incrementado en los últimos años. Esta situación plantea problemas específicos tanto en el órgano como en el receptor, y la pauta de inmunosupresión debe ser adaptada a ellos. Un estudio previo mostró buenos resultados iniciales en el trasplante renal de donante y receptor añosos (medias de edad: 64,4 y 61,3 años) con una inmunosupresión inicial de daclizumab, mofetil-micofenolato e introducción retrasada de tacrolimus a dosis bajas. En el presente estudio revisamos los resultados a largo plazo en ese mismo grupo de pacientes. Métodos: Estudio observacional, retrospectivo y multicéntrico a nivel nacional de la supervivencia y función renal de 126 pacientes incluidos en el estudio inicial (sobre 127 que alcanzaron el primer año con riñón funcionante, 123 tratados según protocolo). Obtuvimos datos del segundo al sexto año de: 120, 118, 113, 102 y 62 pacientes. Secundariamente se analizó la evolución de la función renal, aspectos clínicos relevantes y el perfil de seguridad. Resultados: A los 5 años, la mayoría de los casos continuaban con el esquema inmunosupresor inicial: 92% tacrolimus y 80% mofetil-micofenolato; 48% habían abandonado los esteroides y se introdujo un inhibidor de la señal de proliferación en 3%. La supervivencia del paciente y el órgano (censurada para muerte) a los 5 años resultó de 93,1 y 93,8%, respectivamente. La principal causa de muerte fue la neoplasia (en 7 de los 10 casos) y, de pérdida de injerto, la muerte con riñón funcionante. Las otras causas de muerte fueron 2 infartos agudos de miocardio y una hemorragia digestiva. La función renal se redujo significativa pero moderadamente a lo largo del tiempo (p < 0,001): la creatinina media en el conjunto de pacientes pasó de 1,60 ± 0,50 mg/dl al primer año a 1,63 ± 0,70 al cierre del estudio (p < 0,05); MDRD de 46,28 ± 15,64 ml/min al primer año a 45,69 ± 15,44 al cierre del estudio (p < 0,01). Sólo se registraron 2 rechazos agudos después del primer año. Se registraron 19 eventos cardiovasculares en 12 pacientes. Conclusiones: La pauta utilizada en nuestro estudio resulta útil y adecuada para parejas donante-receptor de mayor edad, como demuestran los buenos resultados en supervivencia a largo plazo, y el mantenimiento de una óptima función renal y un perfil de seguridad aceptables.
Background: Organ transplants in elderly recipients have increased over the past few years. This situation poses specific problems both in terms of organs and recipients; therefore, immunosuppressant regimens must be adapted accordingly. A previous study demonstrated good initial results in kidney transplant cases in which older donors and recipients (average ages of 64.4 years and 61.3 years) had received initial immunosuppressant therapy with daclizumab and mycophenolate mofetil as well as delayed introduction of reduced-dose tacrolimus. In this study we reviewed the long-term results in the same group of patients. Methods: An observational, retrospective multi-centre study carried out at a national level to determine survival rates and renal function in 126 patients included in the initial study (127 patients who survived the first year with a functioning graft, 123 treated according to protocol). We gathered data from the 2nd to the 6th year for 120, 118, 113, 102 and 62 patients, respectively. The evolution of renal function, relevant clinical data, and safety profiles were also analysed. Results: After five years, most patients continued with the initial immunosuppressant regimen: 92% tacrolimus and 80% mycophenolate mofetil; 48% had abandoned steroids and proliferation signal inhibitors had been introduced in 3%. Patient and graft survival (adjusted for patient death) after five years was 93.1% and 93.8%, respectively. The main cause of death was neoplasia (in 7 out of 10 cases) whilst graft loss was mainly due to death with a functioning graft. The other causes of death were 2 acute myocardial infarctions and a gastrointestinal haemorrhage. Renal function was moderately but significantly reduced with the passing of time (P<.001): average creatinine levels in the overall group of patients rose from 1.60±0.50mg/dl after the 1st year to 1.63±0.70mg/dl at the end of study. MDRD dropped from 46.28±15.64ml/min after the 1st year to 45.69±15.44ml/min at the end of study (P<.01). Only two acute rejections were observed after the 1st year. There were 19 cardiovascular events registered in 12 patients. Conclusions: The regimen used in our study was useful and appropriate for elderly donor-recipient pairs as demonstrated by the good long-term survival results, continued optimum renal function, and acceptable safety profile.
INTRODUCCIÓN
El aumento de la esperanza de vida en la población general y la ampliación de los programas de tratamiento sustitutivo de la enfermedad renal crónica está determinando un aumento en la edad de los pacientes tratados1. El trasplante renal (TR) es actualmente el tratamiento de elección en los pacientes con enfermedad renal crónica terminal adecuadamente seleccionados, pues mejora la supervivencia y la calidad de vida respecto a los que permanecen en diálisis, no solamente en individuos jóvenes, sino también en los de mayor edad2. Diferentes estudios han confirmado excelentes resultados en el trasplante de receptores añosos, con una supervivencia del paciente y el órgano al quinto año del TR del 70 y el 60%, respectivamente3. La suma de estos factores ha motivado la aceptación creciente de pacientes de edad avanzada en las listas de espera4.
La ampliación de los criterios de inclusión para TR enfrentada a una disponibilidad de órganos limitada ha impulsado el empleo de donantes cadáver de una edad cada vez más elevada, aun admitiendo que esos riñones presentan peores características3,5. Los cambios estructurales y funcionales asociados a la edad (glomeruloesclerosis, arteriohialinosis, reducción de la masa funcional del riñón y del filtrado glomerular) pueden hacer que estos órganos sean especialmente vulnerables a las agresiones que suponen el proceso de isquemia-reperfusión, al estar también reducidos, además, los mecanismos de reparación tisular. Todo ello aumenta el riesgo de aparición de retraso en la función del injerto y secundariamente de rechazo agudo5,6, y disminuye la supervivencia del injerto. Por otra parte, entre los receptores añosos, la principal causa de pérdida del injerto es la muerte del paciente con injerto funcionante (cercana al 50% frente al 15% en los más jóvenes), por lo que un órgano con menor duración esperada es más probable que cubra sus expectativas de supervivencia4,6. Todo ello justifica que los riñones de donante añoso tiendan a emplearse en receptores de edad avanzada7.
Los cambios fisiológicos que conllevan la edad avanzada suponen modificaciones en la absorción, distribución y metabolismo, que alteran la farmacocinética y farmacodinámica de los fármacos inmunosupresores, aumentando en frecuencia y gravedad la aparición de toxicidad8-10. Los inhibidores de la calcineurina (ICN) pueden empeorar la incidencia y duración del retraso de la función renal y aumentar el riesgo de nefrotoxicidad aguda al ser fármacos que inducen estrés oxidativo11,12. El uso prolongado de ICN a las dosis usuales contribuye al empeoramiento de la función renal y a la nefropatía crónica del injerto, que es la principal causa de pérdida tardía del injerto. Además empeora algunos de los más importantes factores de riesgo cardiovascular que ya se encuentran incrementados en este grupo de edad (hipertensión, diabetes mellitus y dislipemia), y aumenta el riesgo de desarrollar tumores13,14.
La mayoría de los estudios realizados sobre la inmunosupresión más adecuada en receptores de edad avanzada se basan, por tanto, en pautas con bajas dosis o incluso libres de ICN14-16, y se asocian en su mayoría a una inducción con anticuerpos, el uso de dosis plenas de mofetil-micofenolato (MMF) y/o inhibidores de la señal de proliferación (ISP)17.
En un estudio anterior realizado por nuestro grupo en 133 TR con donante y receptor añosos se demostró una buena tasa de supervivencia para el paciente y el órgano (a los 12 meses fue del 97,7% para el paciente; 96,1% para el injerto, y un 98,5% del injerto censurada para muerte), con una buena función renal y una reducida tasa de efectos secundarios, utilizando una pauta con daclizumab, MMF e introducción retrasada a dosis bajas de tacrolimus (TC)18. El 42,86% de los pacientes sufrieron retraso en la función inicial del injerto y el 13,5%, rechazo agudo. En el presente estudio revisamos los resultados a largo plazo en ese mismo grupo de pacientes.
PACIENTES Y MÉTODOS
El objetivo principal fue analizar la supervivencia a largo plazo de los pacientes. Secundariamente se analizó la evolución de la función renal, el número de pacientes que cambiaron el ICN y/o el antimetabolito, el perfil de seguridad relacionado con la presión arterial, el metabolismo de la glucosa y lipídico y, por último, la tasa de desarrollo de neoplasias.
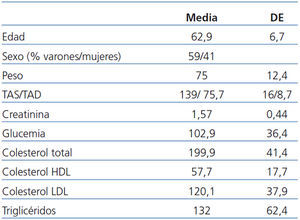
Para ello realizamos un estudio observacional, retrospectivo y multicéntrico, a nivel nacional, de la evolución de los pacientes que alcanzaron el año de seguimiento de los 133 que iniciaron el referido estudio18. Los criterios de selección del estudio original fueron una edad ≥ 50 años, un PRA < 25% en los 6 meses anteriores y ser receptores de un único órgano (riñón), procedente de un donante cadáver con edad ≥ 55 años, con un tiempo de isquemia fría inferior a 30 horas. El 64% de los donantes y el 60% de los receptores eran varones. La edad media de los receptores y de los donantes fue 61,3 ± 6,2 y 64,4 ± 5,3 años, respectivamente.
El tratamiento inmunosupresor inicial consistió en daclizumab en combinación con MMF, TC y esteroides. Los pacientes recibieron dos dosis de daclizumab de 1,0 mg/kg (máximo 100 mg): la primera dosis en el plazo de 6 horas antes de iniciar la cirugía del trasplante (día 0 del estudio) y la segunda dosis, el día 14.º. La dosis de MMF fue de 2 g diarios por vía oral (1 g cada 12 horas) hasta el día 45 del estudio, ajustándose luego al criterio clínico de cada centro. Respecto a TC, la dosis inicial fue de 0,1 mg/kg/día y se comenzó a administrar entre el 5.º y el 7.º día después del trasplante, en el caso de estabilización de la función renal (creatinina [Cr] menor a 3,0 mg/dl o aclaramiento de Cr > 30 ml/min) y nunca después de los 7 días postrasplante. La dosis se ajustó para alcanzar unos niveles valle entre 4 y 8 ng/ml. Por lo que respecta a los esteroides, se administró metilprednisolona 500 mg en el momento de la cirugía, reduciéndose la dosis de la siguiente manera: día 1: 125 mg por vía intravenosa/24 horas; días 2 a 14: 20 mg/24 horas; días 15 a 30: 15 mg/24 horas; días 31 a 90: 5 a 10 mg; y días 91 a 360: según la práctica de cada centro. Se recomendó tratamiento profiláctico de citomegalovirus y Pneumocistis jiroveci, de acuerdo con la pauta protocolizada de cada centro.
Para el análisis estadístico recogimos los siguientes datos al final de los años primero al sexto de seguimiento del TR: función renal (Cr plasmática, y filtrado glomerular mediante MDRD), analítica general, aparición de diabetes de novo postrasplante (definida por criterios de la American Diabetes Association [ADA]), neoplasias, rechazos agudos confirmados por biopsia, tensión arterial, dislipemia, tipo de inmunosupresión (fármacos, dosis y niveles plasmáticos de ICN, motivos de retirada si se produjo, y aparición de toxicidad), medicación concomitante utilizada (antihipertensivos, hipolipemiantes, antidiabéticos orales y/o insulinas, y eritropoyetina), la pérdida del injerto y/o muerte y causas de éstas.
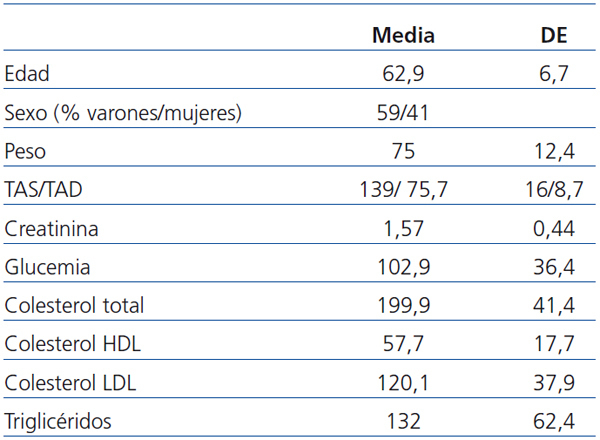
Del total de 133 pacientes que se incluyeron en el estudio original, 127 alcanzaron el primer año con el injerto funcionante, de los que 122 pudieron ser incluidos en el presente estudio al estar controlados por los centros participantes. Sus características generales se describen en la tabla 1. Se consiguió información de la evolución de los 122 casos, casi todos con un seguimiento de al menos 5 años; en el momento del estudio sólo 62 casos habían alcanzado los seis años de seguimiento.
ESTADÍSTICA
Para los análisis descriptivos e inferenciales de los datos, se utilizó el programa SPSS versión 11.0. Las tasas de supervivencia de órgano y paciente se calculan mediante curvas de supervivencia de Kaplan-Meier al año, 2, 3, 4, 5 y 6 años del trasplante. El resto de las variables se describieron mediante frecuencias absolutas y relativas en el caso de parámetros cualitativos y de media, desviación estándar, mediana y rango intercuartílico para los cuantitativos. Se analiza tanto el cambio de inmunosupresor como el de combinación de inmunosupresores entre los sucesivos años de seguimiento mediante las pruebas χ² de Pearson para variables cualitativas. Se consideró como estadísticamente significativa una p < 0,05. En los casos en que presentamos contrastes estadísticos entre distintas variables estudiadas en dos momentos diferentes (basal y al año postrasplante), se utilizó la prueba bilateral estadística t-test para muestras relacionadas.
RESULTADOS
El número de pacientes en seguimiento a lo largo del estudio fue de 120 al final del segundo año, 118 al tercero, 113 al cuarto y 102 al quinto; sólo 62 pacientes alcanzaron un seguimiento de 6 años. El objetivo principal del estudio, la supervivencia del paciente y del órgano (censurada para muerte) a los 5 años del TR resultó de 93,1 y 93,8%, respectivamente (se contabiliza la supervivencia de los 122 casos desde el momento del TR). Se produjeron un total de 10 fallecimientos durante el período de estudio. Las causas más frecuentes fueron las neoplasias (en 7 de los 10 casos); en concreto 2 linfomas, 2 tumores cerebrales, 2 adenocarcinomas de pulmón y 1 adenocarcinoma de colon; la mayoría de las neoplasias aparecieron entre el quinto y el sexto año pos-TR. Las otras causas de muerte fueron 2 infartos agudos de miocardio (al segundo y tercer año) y una hemorragia digestiva (en el tercer año). La principal causa de pérdida de injerto fue la muerte con riñón funcionante, siendo el resto de los fracasos atribuidos a nefropatía crónica del injerto (6 casos) o causa no especificada (2 casos).
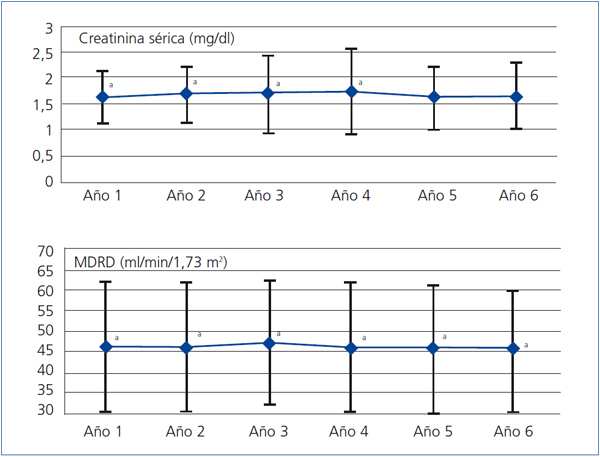
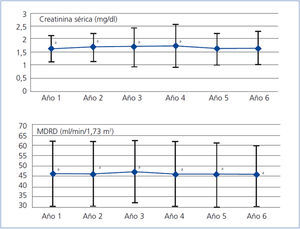
En el conjunto de pacientes la Cr media pasó de 1,60 ± 0,50 mg/dl al primer año a 1,63 ± 0,70 mg/dl al cierre del estudio (p < 0,05); el MDRD, de 46,28 ± 15,64 ml/min/1,73 m2 a 45,69 ± 15,44 ml/min/1,73 m2 (p < 0,001) (figura 1). Al quinto año de seguimiento la Cr media fue de 1,61 ± 0,60 mg/dl (p = 0,068) y el MDRD de 45,79 ± 15,25 ml/min/1,73 m2 (p < 0,01). En el análisis de medidas repetidas para el conjunto de los datos, la función renal (medida por la Cr o el MDRD) se redujo de forma significativa a lo largo del tiempo (p < 0,001), si bien lo hizo de una forma progresiva y moderada en términos absolutos. Estas comparaciones no tienen en cuenta el efecto de selección positiva de las pérdidas (tienden a sobrevivir más tiempo los casos con mejor función inicial). Así, analizando por separado los pacientes que alcanzaron el sexto año, la Cr media pasó de 1,49 ± 0,40 mg/dl al primer año a 1,69 ± 0,70 mg/dl al sexto año (p < 0,05); el MDRD pasó de 49,40 ± 14,54 ml/min/1,73 m2 de media al primer año a 48,62 ± 14,31 ml/min/1,73 m2 al sexto año, (p < 0,001). Este cambio, cuantitativamente algo mayor, sigue siendo poco relevante desde el punto de vista clínico.
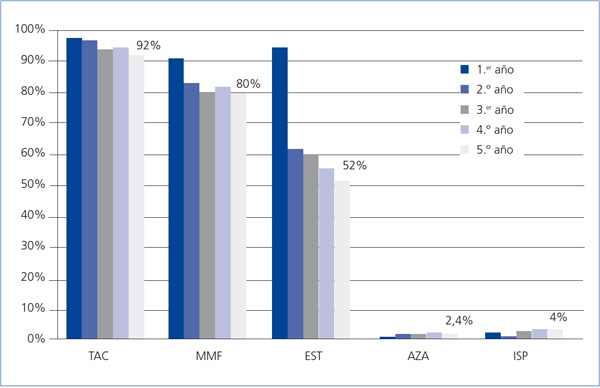
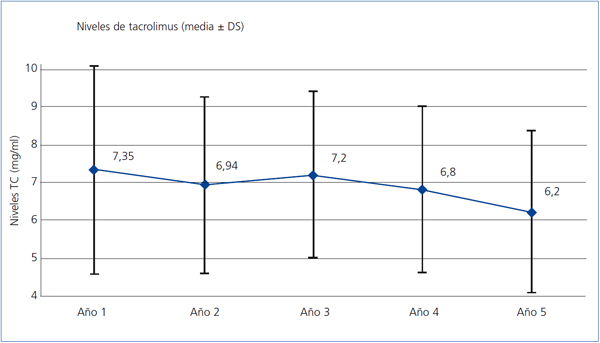
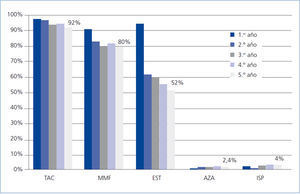
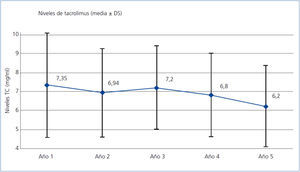
Sólo se registraron 2 casos de rechazo agudo después del primer año, ambos mediados por linfocito T y ambos en el segundo año, siendo el grado de severidad histológica de IA y IIA (clasificación de Banff), con buena respuesta al tratamiento mediante bolos de esteroides. El grado de seguimiento del protocolo de inmunosupresión asignado en el esquema inicial del estudio fue muy alto, de tal forma que a los 5 años un 92% de los pacientes continuaban en tratamiento con TC y un 80% seguían con MMF (figura 2). La causa más frecuente de retirada del MMF fue la intención de reducir la inmunosupresión, seguida de la toxicidad gastrointestinal y la toxicidad hematológica (leucopenia). La dosis media de TC fue reduciéndose progresivamente desde los 4,09 mg/día de media en los pacientes en seguimiento al final del primer año hasta los 2,95 mg/ día al quinto año, con una media de los niveles plasmáticos valle de 7,35 ng/ml y 6,2 respectivamente en esos momentos (figura 3). La dosis media de MMF se mantuvo bastante estable a partir del segundo año de seguimiento, siendo al quinto año de 997 mg/día. El 38% de los pacientes había abandonado el uso de esteroides al segundo año, y el 48%, al sexto año. Por otra parte, en un pequeño grupo se introdujo un ISP que al final del estudio suponía un 4% del total de pacientes. En otro pequeño grupo del 2,4% de los pacientes, se inició el uso de azatioprina, casi todos en el segundo año, manteniendo su uso hasta el final del estudio (figura 2).
A lo largo del seguimiento fue necesario incrementar la medicación concomitante para controlar mejor los factores de riesgo más frecuentemente asociados a este tipo de pacientes. Los fármacos antihipertensivos, que eran usados por un 76% de los pacientes al final del primer año, pasaron a ser utilizados por un 92,9% al final del quinto año; el uso de estatinas pasó del 32,6% de los pacientes al 63%; el de EPO, del 8,7 al 18,4%, y el de antidiabéticos orales y/o insulina, del 9,8 al 15,7%, siendo estas diferencias de empleo de fármacos estadísticamente significativa para todos los casos. Se produjeron un total de 19 eventos cardiovasculares en 12 pacientes a lo largo del estudio, consistentes en 3 casos de infarto agudo de miocardio (en 2 de ellos causó la muerte del paciente), 2 de accidente cerebrovascular y 14 de arteriopatía periférica. Un 14,3% de los pacientes sufrieron al menos una neoplasia (y un 4% más de una). Del total de neoplasias, las más frecuentes fueron las cutáneas (50%), mientras que el síndrome linfoproliferativo postrasplante supuso un 11%, y otros tumores sólidos, el 39%.
DISCUSIÓN
Una creciente proporción de la lista de espera de los programas de TR la forman pacientes de edad cada vez más elevada. Paralelamente, la edad media de los donantes se ha incrementado en los últimos años, con la consiguiente mayor patología cardiovascular asociada y con las características funcionales que suponen en el órgano. Esto hace que el trasplante de órganos de donantes añosos o con criterios expandidos en receptores de edad avanzada sea una práctica cada vez más frecuente. La idoneidad en la asignación de estos órganos a receptores mayores se ha demostrado en diversas series19,20.
Algunos autores han postulado una menor tasa de rechazo en los receptores de mayor edad como consecuencia de un sistema inmune del anciano menos activo o quiescente. Si bien los datos extraídos de las grandes series de la United Network for Organ Sharing (UNOS) parecían confirmar este hecho, otros autores, analizando series más recientes, no encuentran grandes diferencias en la incidencia de rechazo agudo ente grupos de receptores jóvenes o añosos21,22. Por otro lado, la menor reserva funcional inherente a una disminuida masa nefronal del donante añoso, y la peor capacidad de regeneración de los tejidos tras sufrir un rechazo, hace que el impacto negativo en la supervivencia del órgano respecto a los receptores jóvenes sea más acusada23.
En los receptores añosos encontramos una mayor tasa de comorbilidades asociadas, como son la enfermedad diverticular, las anomalías del tracto urinario, la patología cardiovascular y la diabetes, entre otras, así como una mayor incidencia de neoplasias21,24. Por tanto, tras la terapia inmunosupresora, el riesgo de sufrir infecciones graves y patología tumoral está incrementado, y la tasa de mortalidad secundaria a estos procesos es más elevada que en la población de receptores jóvenes25. Todos estos factores hacen necesaria la búsqueda de una pauta de inmunosupresión adaptada a esta combinación de características específicas de donante y receptor. Debe ser lo suficientemente eficaz para evitar la aparición de rechazo (tanto por la peor supervivencia del órgano a la que está asociado como por el mayor riesgo de infecciones que supone su tratamiento), pero que a la vez no implique una sobreinmunosupresión que incremente el número de infecciones y de tumores en receptores más susceptibles. Carecemos, sin embargo, de estudios multicéntricos prospectivos y de asignación aleatoria que analicen la cuestión en grandes series de pacientes. Con frecuencia, además, los receptores añosos se excluyen de los ensayos con nuevas pautas inmunosupresoras por la posibilidad de aparición de efectos secundarios asociados a una farmacocinética alterada que puedan dificultar la interpretación de los resultados. La necesidad de reducir la nefrotoxicidad asociada a los ICN, cuyo efecto puede estar incrementado al sumarse al daño de isquemia-reperfusión, con el objeto de preservar la mayor masa nefronal posible, hace de las pautas de minimización o retirada de ICN de especial interés en este grupo de receptores21,26.
La inducción con anticuerpos antilinfocitarios o anti-IL-2 es de gran utilidad para reducir la aparición de rechazo agudo. Debido al menor riesgo de aparición de infecciones graves o neoplasias que conlleva su uso, los antagonistas de los receptores de IL-2 (A-IL2) pueden ser preferibles a la timoglobulina en receptores de bajo riesgo inmunológico: se obtiene una tasa de rechazo agudo no muy distinta, con un mejor perfil de seguridad26,27.
Arbogast et al. han usado pautas sin ICN, basadas en el uso pleno de MMF ajustando dosis para mantener niveles valle de MMF de 2-6 µg/ml, e inducción con anticuerpos mono-policlonales), en receptores y donantes de edad muy parecida a la de nuestra serie: obtienen una supervivencia a los 5 años del 87,69%, y del órgano del 69,8% (censurada para muerte del paciente y pérdidas de causa no inmunológicas del 86,57%), aunque inferior a nuestra serie y con una tasa de rechazo agudo mucho más elevada (23,6%)15. Posteriores publicaciones de este mismo grupo encuentran resultados en esta misma línea e incluso con tasa de rechazo más elevada, lo que motivaba que al año un 46,3% de los pacientes tuviera en su tratamiento un ICN añadido. A pesar de la buena supervivencia alcanzada respecto a otras series con pautas que incluían ICN, las elevadas tasas de rechazo y de infección por citomegalovirus que encuentran (obligando a reducir MMF e introducir ICN o ISP) hace que sea discutible la idoneidad del uso de pautas inmunosupresoras sin ICN28,29.
En un ensayo controlado (estudio SENIOR), no se encontró ventaja a la introducción retrasada de TC (a los 7 días, con retirada completa de esteroides) frente al uso inmediato, respecto a frecuencia, duración del retraso funcional o a función renal a los 6 meses30. Señalemos que la duración del retraso funcional en donantes de más de 60 años en la rama con introducción retrasada fue de 19 días de media, muy superior a la encontrada en nuestro estudio (7 días, con 4 días de mediana); su frecuencia de rechazo agudo precoz fue también mucho más alta que en nuestra serie. En ensayos previos no se encontró tampoco ventaja en la introducción retrasada de TC con inducción con anticuerpos depletivos31 o de la ciclosporina32 respecto a la incidencia de retraso funcional. No obstante, las dosis y niveles iniciales de ICN empleados en estos ensayos eran los estándares y superiores al de nuestra pauta. Probablemente, la aparición de retraso en la función del injerto con necesidad de diálisis está determinada por factores previos al comienzo de la inmunosupresión (edad del donante, vasculopatía y causa de la muerte, condiciones durante la agonía, isquemia fría, etc.) y no pueda ser modificada por un retraso en la introducción de ICN. En cambio, podría ser más relevante el uso de dosis y niveles bajos (con o sin introducción retrasada) con vistas a acortar su duración. Los resultados del estudio Symphony33 avalan la eficacia y seguridad de un esquema inmunosupresor con dosis bajas iniciales de TC.
Solà et al. analizaron, en 72 pacientes mayores de 60 años, los resultados de una pauta basada en esteroides, MMF y TC, añadiendo timoglobulina y retrasando el inicio de TC (a 1 mg/kg/día, similar a nuestro estudio) en caso de que apareciera función retrasada del injerto (lo que ocurrió en el 48,6% los casos). Esta pauta les permite obtener una rápida resolución de la función retrasada del injerto (media de 3,9 días) y una tasa de rechazo del 12,5%. La supervivencia a los 3 años del paciente era del 90%, y del 87% en el caso del injerto (97% censurada para muerte del donante)34.
En nuestra experiencia, el uso de la pauta descrita nos permite obtener unos resultados muy satisfactorios en relación con la supervivencia de paciente y de órgano a medio plazo, incluso superiores a los de otras series29. Al igual que en estudios previos, la principal causa de pérdida de injerto fue la muerte del paciente, fundamentalmente por aparición de neoplasias. Ninguna de las muertes fue debida a procesos infecciosos. La tasa de rechazo agudo posterior al primer año fue pequeña, indicando un nivel aparentemente suficiente de inmunosupresión. La tendencia al empeoramiento de la función renal a lo largo del estudio es muy leve, manteniendo al quinto año cifras excelentes de Cr y filtrado calculado. El grado de seguimiento de la pauta inmunosupresora fue elevado, ya que la gran mayoría de los pacientes se mantienen en el esquema de TC y MMF previsto. Existe una clara tendencia a mantener niveles valle de TC en la parte alta del rango previsto en el protocolo en los primeros años de seguimiento, que se moderó a lo largo del estudio. Probablemente obedece a una inclinación conservadora cuando se aplican pautas de minimización, como se ha podido observar en grandes estudios como el Symphony33.
El diseño de nuestro estudio presenta algunas debilidades metodológicas, como su carácter retrospectivo y el hecho de carecer de grupo control con una pauta de inmunosupresión sin estrategia añadida de introducción tardía y minimizada de ICN, como ya expusimos en nuestro anterior trabajo. Serán necesarios estudios prospectivos y con mayor número de pacientes sin estas limitaciones para establecer, con un mayor grado de evidencia, la idoneidad de este tipo de pautas de inmunosupresión en el trasplante de órganos de donantes añosos o con criterios expandidos en receptores de edad avanzada.
En conclusión, creemos que la pauta utilizada en nuestro estudio de inducción con dos dosis de daclizumab, asociada a MMF e introducción tardía de TC a dosis bajas, resulta útil y adecuada para parejas donante-receptor de mayor edad, como demuestran los buenos resultados en supervivencia a largo plazo, y el mantenimiento de una óptima función renal y un perfil de seguridad aceptables.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características de los pacientes al primer año
Figura 1. Evolución de la función renal
Figura 2. Uso de inmunosupresores (% del total de pacientes) en cada año de evolución postrasplante
Figura 3. Evolución de los niveles plasmáticos valle de tacrolimus a lo largo del estudio