El virus de la hepatitis C (VHC) condiciona el pronóstico en pacientes con insuficiencia renal crónica avanzada (ERCA). Se ha descrito elevada prevalencia de infección por el VHC clásico y oculto en población en hemodiálisis1,2. Aunque estamos ante una nueva era en el tratamiento antiviral, aún no hay estudios que sostengan indicación de esta terapia en paciente con el VHC oculto. La población con ERCA que va a recibir inmunosupresión parece ser de riesgo para la replicación viral y, por lo tanto, llevaría a pensar en el tratamiento antiviral pre-inmunosupresión3, existiendo tan solo un caso publicado al respecto, pero sin enfermedad renal4. Se presenta la evolución del VHC oculto en 2 pacientes con ERCA que reciben terapia inmunodepresora. La medición del VHC oculto se ha realizado en la Fundación para el Estudio de las Hepatitis Virales, mediante ultracentrifugación en suero5 y PCR ultrasensible en células mononucleares de sangre periférica (CMSP) e hígado6. En los últimos años, se añade la técnica de detección de anticuerpo anti-VHC core de alta sensibilidad7.
Caso 1Mujer de 40 años, fumadora. Presenta lupus eritematoso sistémico, síndrome antifosfolípido, hipertensión, hiperparatiroidismo terciario, osteoporosis, hiperhomocisteinemia e hiperuricemia. En hemodiálisis desde 1990 (trasplante renal de 1991 a 1998). Tratamiento habitual: cinacalcet, hidróxido de aluminio, acetato cálcico, risedronato, ácido fólico, polivitamínico B1/6/12, omeprazol, alopurinol, carvedilol, hidroxicloroquina, acenocumarol, hierro y darbepoetina intradiálisis.
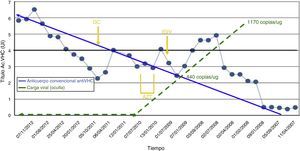
A partir de marzo de 2008 se objetivan resultados seriados «indeterminados» (ELISA, RIBA) para el VHC (positividad solo en la fracción NS3). Tras confirmaciones varias, y a pesar de transaminasemia normal y valorar reacción cruzada por enfermedad de base autoinmune, se decide plantear la posibilidad del VHC oculto, confirmándose en células mononucleares de sangre periférica (CMSP: 1.170copias/μg RNA total), e hígado. Se realiza biopsia hepática transyugular que muestra hepatitis crónica grado/estadio 0/0, y FibroScan® 6,3 KPa, APRI 0,81 y FORNS 7,59. No manifiesta posibilidad externa de contagio, realizándose PCR y serología viral al resto de pacientes de la unidad, así como al personal sanitario, sin detectar nuevos casos de infección clásica por el VHC. En febrero de 2009 recibe inmunoglobulina intravenosa IGIV (2g/kg) para desensibilización pretrasplante (finalmente no realizado por otros motivos), y azatioprina (AZT 50mg/d) y corticoterapia (GC 5mg/d) de junio a noviembre de 2009 por actividad lúpica, sin objetivarse aumento de carga viral intralinfocitaria, pero sí de la respuesta inmune (fig. 1). La GPT se elevó leve y transitoriamente en los meses de marzo y abril de 2009 con un máximo de 42UI/l.
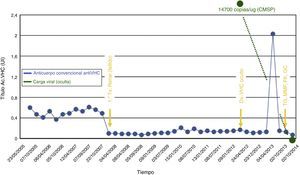
Caso 2Varón de 51 años. ERCA de etiología no filiada, hipertenso y en hemodiálisis desde 2005, con primer trasplante renal inmediatamente fallido por trombosis arterial no inmunológica en octubre de 2007, recibiendo en dicho ingreso transfusión de 2 unidades de hematíes. Aumento esporádico de transaminasas en 2009, hasta hacerse persistente desde diciembre de 2010 (cifra máxima 28/40UI/l GOT/GPT). Se diagnostica VHC oculto 14.700copias/μg RNA total en CMSP (RNA en suero por ultracentrifugación y anticuerpo anti-VHC core de alta sensibilidad, negativos). Ecografía y FibroScan® normales. No manifiesta posibilidad externa de contagio, realizándose PCR y serología viral al resto de pacientes de la unidad, así como al personal sanitario sin detectar nuevos casos de infección clásica por el VHC. Recibe segundo trasplante renal en octubre de 2013, tratándose con timoglobulina (TG), tacrolimus (FK), micofenolato (MMF) y corticoides. Tras 17 meses del trasplante, la carga viral en CMSP se halla indetectable, y persisten negativos el RNA por ultracentrifugación en suero y el anticuerpo anti-VHC core de alta sensibilidad (fig. 2).
Evolución anticuerpos anti-VHC convencional y carga viral VHC oculto. Dintel de laboratorio para positividad de anticuerpos anti-VHC (Ac. VHC): 4 UI.
CMSP: células mononucleares de sangre periférica; Dx: diagnóstico; FK: tacrolimus; GC: glucocorticoides; MMF: mofetil micofenolato; TG: timoglobulina; Tx: trasplante.
Se ha informado sobre la infectividad del VHC oculto8 y patogenicidad, pero aún no existe experiencia suficiente que justifique su erradicación. En la actualidad solo se han tratado casos en protocolos de investigación3.
Hay evidencia, aunque muy escasa, del comportamiento replicador de este virus ante estímulos inmunodepresores4, por lo que, ante pacientes hiperinmunizados que precisarían en el peritrasplante una inmunosupresión agresiva incluida la corticoterapia a largo plazo, queda en duda si deberíamos plantear terapia antiviral pre-trasplante.
Se presenta el segundo y tercer caso de la literatura de pacientes con VHC oculto que reciben terapia inmunosupresora, siendo los primeros descritos en ERCA. En el primer caso expuesto, tras AZT, la carga viral intralinfocitaria no solo no aumentó sino que descendió hasta hacerse indetectable, a la vez que ascendió el título de anticuerpos, pudiendo especular el sistema inmune de la paciente, aunque supuestamente debilitado, batió la viremia. En el segundo, la carga viral se negativiza, pero sin crear anticuerpos inmunitarios contra el virus (aunque se aprecia un ascenso en el nivel de anticuerpos, este es puntual y no alcanza dintel de laboratorio).
Con tan solo esta experiencia, no sabemos justificar la conducta observada del binomio inmunidad/virología. Quiroga et al. demostraron que el VHC oculto sí induce respuesta celular CD4+/CD8+ en pacientes inmunocompetentes aún sin detectarse anticuerpos específicos9, pero desconocemos su comportamiento en inmunodeprimidos, teniendo en cuenta además, los diferentes tipos y grados de inmunosupresión existentes, incluida la proporcionada por la uremia.
ConclusiónNo disponemos de evidencia suficiente que justifique el tratamiento antiviral en los pacientes con enfermedad renal crónica y VHC oculto, aún con perspectiva de recibir tratamiento inmunosupresor. Por todo ello, mantenemos actitud expectante en espera de más resultados.