La evaluación de los candidatos al trasplante renal incluye aspectos médicos, quirúrgicos, inmunológicos y psicosociales, con el objetivo de conocer los beneficios y riesgos del trasplante en cada paciente y, por tanto, su indicación. Las pruebas de cribado o detección precoz del cáncer son parte esencial de esta evaluación. A su vez, la detección precoz del cáncer debe ser un punto de especial atención en el seguimiento del paciente trasplantado, ya que el cáncer presenta en este subgrupo de pacientes un mayor riesgo y agresividad, y es una de sus principales causas de muerte. De la aplicación de las estrategias sistemáticas de detección precoz del cáncer se espera una reducción de la morbilidad y la mortalidad asociadas al cáncer; sin embargo, es probable que el rendimiento de las pruebas de detección precoz del cáncer, sus riesgos y sus beneficios, a través de los años de vida ganados, estén sustancialmente modificados en la población de pacientes antes y después de recibir un trasplante renal. Desafortunadamente, carecemos de estudios de diseño, metodología y calidad adecuados para elaborar recomendaciones de detección precoz del cáncer pre- y postrasplante basadas en un nivel suficiente de evidencia, por lo que hay que asumir en gran parte las recomendaciones establecidas para la población general. Existe una sólida evidencia del beneficio del cribado sistemático de la población general para el cáncer de colon, mama, y cérvix, mientras que en el cáncer de pulmón es aplicable solo a individuos de riesgo, y no se recomienda el cribado sistemático en el cáncer de próstata. Además de estos tumores, en la población pre- y postrasplante existen recomendaciones de cribado para el cáncer renal, cutáneo, anogenital, urotelial, hepatocelular y la enfermedad linfoproliferativa postrasplante.
También se aborda en esta revisión del Grupo Prometeo la delicada evaluación pretrasplante del paciente con antecedentes de un cáncer en remisión. En el momento actual, las recomendaciones de retraso en la indicación de trasplante renal en estos pacientes se hacen bajo varios presupuestos escasamente respaldados por la evidencia, y se desconoce el impacto global en la mortalidad que tienen estas recomendaciones sobre este grupo de pacientes. A juicio del Grupo Prometeo, las recomendaciones genéricas según el tipo y el estadio del tumor deben ser combinadas con un abordaje individualizado caso por caso, con la participación de un oncólogo. Del mismo modo, la exclusión definitiva de la posibilidad de trasplante debe formularse tras un examen individualizado de la estirpe y estadio tumorales, las posibilidades terapéuticas y el pronóstico global del paciente.
DETECCIÓN PRECOZ DEL CÁNCER ANTES Y DESPUÉS DEL TRASPLANTE RENAL
Introducción y conceptos generales
El trasplante renal es el tratamiento de elección en el paciente que precisa tratamiento renal sustitutivo y, por tanto, su indicación se debe plantear en todo paciente que alcanza fases avanzadas de enfermedad renal crónica (ERC). La evaluación de los candidatos al trasplante renal incluye aspectos médicos, quirúrgicos, inmunológicos y psicosociales, con el objetivo de conocer la indicación del procedimiento, así como una aproximación lo más detallada posible a los beneficios y riesgos del trasplante en cada paciente, que deberán ser trasladados a este para una toma informada de decisiones.
Las pruebas de cribado o detección precoz del cáncer (DPC) son parte esencial de esta evaluación por varias razones. El cáncer es una de las principales causas de muerte entre los pacientes trasplantados renales1,2; los pacientes trasplantados poseen un mayor riesgo de sufrir un cáncer y morir por cáncer que la población general3-5 y, además, el desarrollo de un cáncer tras el trasplante es un desafío terapéutico con peor pronóstico que en la población general6-8.
A la luz de estos argumentos, parecería lógico asumir que la DPC en el candidato a trasplante renal, o bien en el seguimiento del paciente trasplantado, debería conseguir una mejoría de los resultados en estas poblaciones. Sin embargo, se carece de pruebas sólidas para sostener esta afirmación. A pesar de la importancia crucial de esta patología en estas poblaciones, no hay estudios de diseño, metodología y calidad adecuados para elaborar recomendaciones basadas en un nivel suficiente de evidencia en todos estos aspectos9. En pacientes trasplantados de hígado, 2 estudios europeos de carácter retrospectivo han sido capaces de demostrar, en pacientes sometidos a programas intensivos de DPC, una tasa mayor de detección de tumores en estadios precoces, de detección global de cáncer y de mejorías de supervivencia global, y en uno de ellos de reducción en la mortalidad asociada a cáncer no cutáneo10,11. Desafortunadamente, estas experiencias no se han validado en estudios prospectivos.
Aspectos específicos de la detección precoz del cáncer en pacientes antes y después del trasplante renal
La DPC persigue el diagnóstico temprano del cáncer, en un estadio de la enfermedad en el que el tratamiento podría ser menos agresivo y se podrían esperar mejores tasas de curación reduciendo, por tanto, la morbilidad y la mortalidad del cáncer. Sin embargo, las estrategias de DPC se asocian invariablemente no solo a beneficios, sino también a riesgos en la población en la que se aplican. Es muy probable que el rendimiento de las pruebas de DPC, sus riesgos y sus beneficios, a través de los años de vida ganados, estén sustancialmente modificados en la población de pacientes antes y después de recibir un trasplante renal respecto a la población general.
En primer lugar hay que tener en cuenta que estas poblaciones están sometidas a riesgos competitivos de enfermedad y mortalidad, que limitan tanto la calidad de vida como la esperanza de vida de estas poblaciones y, por tanto, el beneficio esperado de la DPC2. Por otro lado, estos pacientes presentan un riesgo incrementado de cáncer, especialmente postrasplante, y, por tanto, cabría suponer un mejor rendimiento de las pruebas de DPC en una población con mayores tasas de cáncer. Desafortunadamente, carecemos de datos rigurosos en estas poblaciones de sensibilidad, especificidad o seguridad de la mayor parte de las pruebas de cribado del cáncer empleadas de forma habitual. Finalmente, hay que considerar que el comportamiento biológico del cáncer y la eficacia y seguridad del tratamiento oncológico en el paciente afectado de ERC avanzada o en diálisis, o en el trasplantado renal, podrían ser sustancialmente diferentes a los de la población general, por lo que estos serían modificadores relevantes de los beneficios y riesgos esperados de la DPC7.
Cabe esperar de las recomendaciones establecidas en población general un rendimiento comparable en los pacientes pre- o postrasplante en la medida en que más se ajusten a los siguientes factores: una mayor esperanza de vida, una menor comorbilidad y riesgos competitivos, un mayor riesgo de cáncer, tanto del paciente como el incremento de riesgo específico para determinada estirpe tumoral, un incremento de la agresividad de la neoplasia y, finalmente, una sensibilidad, especificidad y seguridad del test de cribado empleado similares a las de la población general12,13.
Estrategias y recomendaciones de la detección precoz del cáncer pretrasplante y postrasplante renales
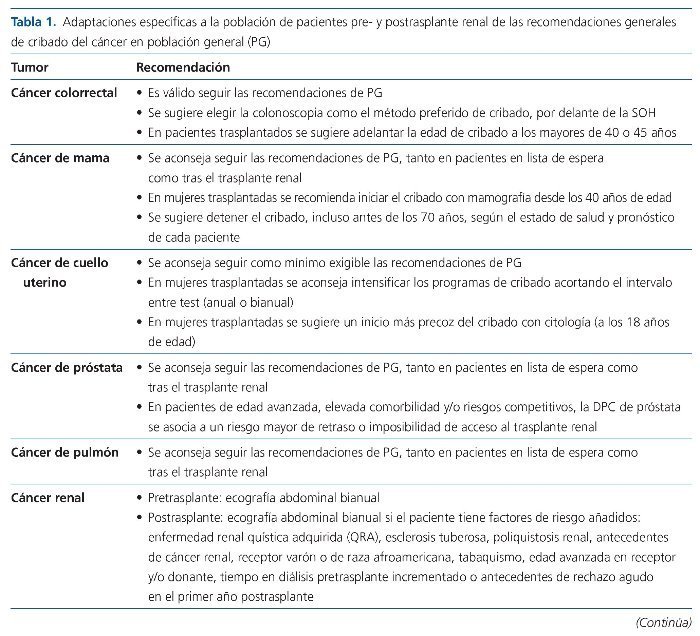
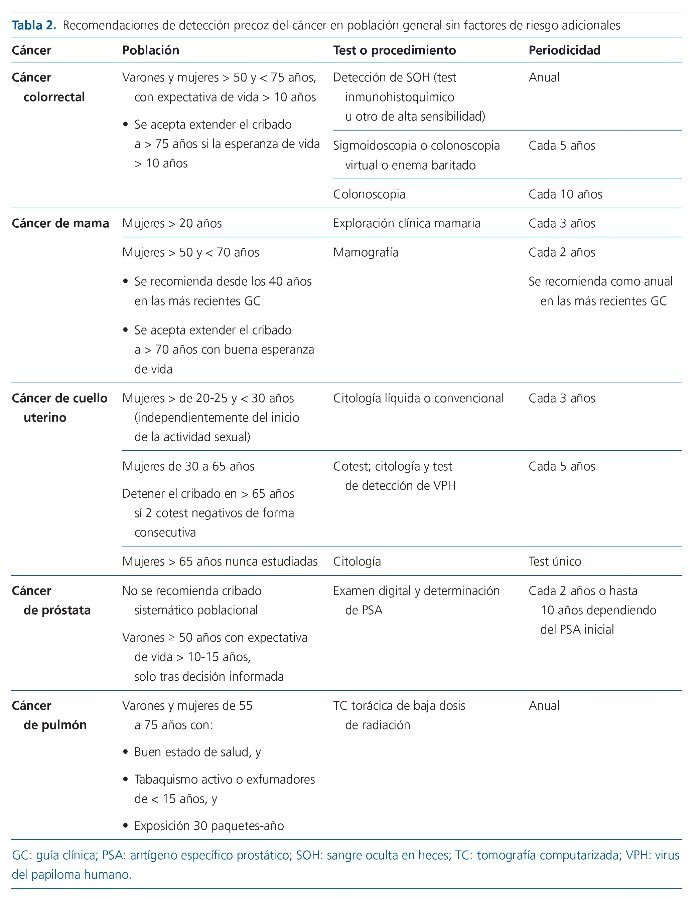
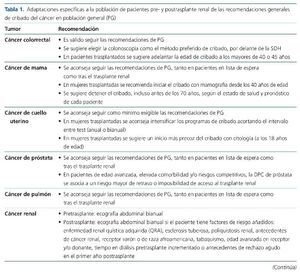
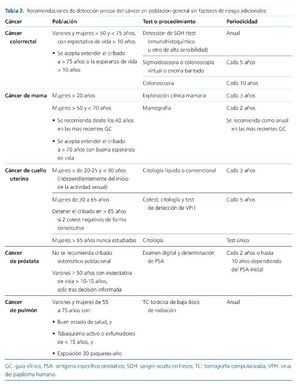
A pesar de la ausencia de una evidencia robusta, la prevalencia y gravedad del cáncer en los pacientes con ERC avanzada o en diálisis y postrasplante renal aconseja la adopción de diferentes estrategias de DPC (tabla 1). Ante la falta de protocolos específicamente validados en estos grupos específicos de pacientes, se sugiere el seguimiento de las recomendaciones de DPC elaboradas para la población general (tabla 2)14-17.
Frente a este principio general, es obvio que las recomendaciones de DPC deben individualizarse para cada paciente en función de sus antecedentes y circunstancias18. En general, cuanto mayor es la esperanza de vida del paciente, mayor es el riesgo de cáncer y menor el de sufrir consecuencias indeseables derivadas del cribado, mayor es la probabilidad de beneficio de la DPC y, por tanto, con más fortaleza puede justificarse.
Como primer paso y aun con todas las incertidumbres mencionadas, es necesario concienciar a los pacientes, y también al personal sanitario que los atiende, de la importancia del seguimiento de las recomendaciones de DPC aplicables a la población general. Los datos disponibles sugieren que el cumplimiento de los programas de DPC es muy inferior a lo recomendado, tanto en población afectada de ERC avanzada o en diálisis como en postrasplante19,20.
Cáncer colorrectal
El cáncer colorrectal (CCR) es el segundo tipo de cáncer más frecuente en mujeres (tras el de mama) y el tercero en varones, y en global es la primera causa de cáncer en la población general21. La mayoría de los tumores de colon son adenocarcinomas, que se originan a partir de la mucosa y se localizan principalmente en el colon izquierdo y distal. Aproximadamente, el 80% de los casos son esporádicos y un 20% tiene influencia genética; dentro de estos últimos, las 2 entidades más importantes son el síndrome de Lynch y la poliposis adenomatosa familiar. La presencia de un familiar afectado de CCR en primer grado duplica el riesgo o lo cuadruplica si el diagnóstico es antes de los 60 años21.
En población general existe una sólida evidencia del beneficio del cribado del CCR21,22. El inicio del cribado del CCR se sitúa a los 50 años de edad, y debe extenderse hasta los 75 años en pacientes con expectativa de vida superior a 10 años, aunque se acepta que la edad a la que se debe detener el cribado podría ampliarse en función del pronóstico vital del paciente. La estrategia aceptada es la detección de sangre oculta en heces (SOH) de forma anual, mediante test de alta sensibilidad (test inmunohistoquímico), o sigmoidoscopia o colonoscopia virtual o enema baritado cada 5 años, o colonoscopia cada 10 años. Los pacientes con síntomas sugestivos de CCR, antecedentes personales o familiares de primer grado de CCR de aparición temprana, enfermedad intestinal inflamatoria crónica, poliposis adenomatosa familiar o síndrome de Lynch requieren un abordaje distinto debido a su mayor riesgo21,22.
En cuanto a la población con ERC pretrasplante, diversos estudios retrospectivos y de un solo centro hallan una frecuencia de pólipos adenomatosos y lesiones cancerosas al menos similar a la de la población general23-25. En estos trabajos, la realización de la colonoscopia en estas poblaciones parece segura, con una tasa muy baja de complicaciones1; por otra parte, el rendimiento de la prueba no parece estar comprometido de forma significativa, aun teniendo en cuenta que el paciente con ERC 4-5 puede presentar dificultades en la preparación intestinal, un requerimiento clave en la obtención de una colonoscopia de calidad26. Desafortunadamente, estos datos no pueden extrapolarse a la población de pacientes en diálisis peritoneal, ya que en la mayor parte de estos estudios ha sido excluida o no ha sido adecuadamente representada y, por tanto, no se dispone de datos suficientes sobre el rendimiento ni la seguridad de la colonoscopia.
Postrasplante renal, el cáncer de colon es más frecuente que en población general, especialmente en menores de 50 años3,5,27,28, de modo que en esta población se refuerza la idea de que la detección precoz podría ser beneficiosa por encima de los riesgos, e incluso el cribado podría extenderse a la población trasplantada de 35-50 años16,29. La colonoscopia detecta una elevada prevalencia de lesiones avanzadas en población mayor 50 años, y su rendimiento y seguridad no parecen estar alterados respecto a población general30.
La mayor parte de los programas de cribado del CCR en población general aplican, de forma secuencial, la detección de SOH, y ante su positividad, la realización de colonoscopia. Este esquema podría ser menos válido en pacientes pre- y postrasplante renal. Incluso los modernos test de detección de SOH parecen presentar una menor especificidad en el paciente con ERC avanzada y en diálisis, debido a disfunción plaquetaria, tratamientos antiagregantes y anticoagulantes, angiodisplasia, etc., y también una menor sensibilidad25.
Postrasplante, el rendimiento de los test de detección de SOH parece similar al obtenido en población general; sin embargo, dado el peor pronóstico y gravedad del cáncer en esta población, cabe cuestionarse también si la colonoscopia no debería ser el método preferido de cribado en receptores de trasplante renal. En un estudio de calidad, que comparó el rendimiento del test inmunohistoquímico de SOH frente a la colonoscopia en 229 pacientes receptores de trasplante renal. El test de SOH mostró una pobre sensibilidad, pero razonable especificidad. Para detectar una lesión de CCR avanzado se precisaron 8 colonoscopias directas, o 3 colonoscopias tras un test IHSOH positivo. No obstante, en este último supuesto, un 69% de los CCR no se habría detectado30.
Desde un punto de vista de coste-eficacia y coste-utilidad, el grupo australiano liderado por Germanie Wong realizó un análisis según modelos probabilísticos de Markov del rendimiento de una estrategia de detección precoz de CCR mediante test inmunohistoquímico de SOH anual frente a la no realización de cribado, en una población virtual de 1.000 pacientes en diálisis, en lista de espera (LE) y postrasplante. Según este análisis, el cribado de CCR reduce la mortalidad por cáncer y es coste-eficaz en esta población, aunque el umbral de coste por año de vida ganado y ajustado a calidad de vida está por encima de lo usualmente aceptado. Es importante destacar que el cribado resulta tanto más ventajoso cuanto mejor es la esperanza de vida de la población estudiada y, por ello, está más claramente indicado en pacientes en LE y trasplantados, frente al colectivo global de pacientes en diálisis31. Una respuesta definitiva a todas estas incertidumbres podría estar disponible cuando se conozcan los resultados del estudio DETECT, específicamente diseñado para obtener datos sobre la eficacia y eficiencia del cribado del CCR32.
Como conclusión de todos los datos citados se acepta que tanto en pretrasplante como en postrasplante se sigan las recomendaciones de detección precoz del CCR formuladas para población general. Debido a las limitaciones de los métodos alternativos de cribado en cuanto a sensibilidad y especificidad, se sugiere la colonoscopia como el método preferido de cribado, especialmente en pacientes trasplantados renales. En estos últimos, dados el incremento de riesgo y la mayor agresividad de la enfermedad, podría estar justificado rebajar la edad de inicio del cribado del CCR a menores de 50 años, y se sugiere la aplicación del cribado desde los 40 o 45 años.
Cáncer de mama
El cáncer de mama es el cáncer más frecuente en mujeres de la población general; constituye la primera causa de muerte prematura por cáncer y, por tanto, de años de vida perdidos en este grupo poblacional33. Los programas de DPC de mama están fuertemente respaldados por la evidencia científica, aunque existen pequeñas diferencias en el diseño de dichos programas, relativas a la edad de inicio o la frecuencia de los test de cribado22,34.
Actualmente, en España se acepta de forma mayoritaria la utilización de la mamografía bianual junto a la exploración clínica, desde los 50 años de edad y hasta los 7034. Sin embargo, en diversas comunidades autónomas españolas y en otras guías internacionales se tiende a un inicio más precoz del cribado de cáncer de mama22,34. En concreto, las últimas guías de la American Cancer Society establecen el inicio del cribado mediante mamografía a los 40 años, que deberá realizarse de forma anual, sin establecerse un límite claro de edad para detener el cribado, sino que este límite estará fijado por las expectativas de vida de cada paciente. Con anterioridad a la edad de inicio de la mamografía periódica, se recomienda la exploración clínica mamaria cada 3 años, y desde los 20 años de edad22. Pacientes con alteraciones genéticas asociadas a un mayor riesgo de cáncer de mama (p. ej., mutación del gen BRCA2), historia familiar o historia de exposición a radiación ionizante (p. ej., radioterapia), entre otros, requieren un abordaje distinto debido a su mayor riesgo.
En los pacientes con ERC avanzada, en diálisis o tras el trasplante renal, la incidencia y riesgo del cáncer de mama son similares a los de la población general, aunque quizá la agresividad de la enfermedad sea mayor, especialmente en pacientes trasplantadas35. En cuanto al rendimiento de la mamografía, parece similar en pacientes candidatas al trasplante y trasplantadas frente al de la población general en mujeres de 40 a 50 y mayores de 50 años de edad, por lo que parecería razonable utilizar la misma estrategia de DPC36. Existen, sin embargo, dudas razonables respecto a si la DPC de cáncer de mama en estas poblaciones ofrece las mismas ventajas de supervivencia que en la población general. Diferentes trabajos no encuentran beneficios relevantes de supervivencia al aplicar mediante modelos probabilísticos una estrategia de DPC de mama mediante mamografía anual en mujeres de 50 a 59 años en diálisis, por lo que no se recomendaría el cribado en esta población37. Aun en ausencia de buenas estimaciones, el análisis cambia al mejorar las expectativas de supervivencia, mediante una reducción de la comorbilidad y de los riesgos competitivos, por lo que los resultados deberían ser diferentes en el segmento de mujeres en diálisis que son incluidas en LE, y aún más en pacientes trasplantadas con buen estado de salud y esperanza de vida38.
Por todo ello, y aun con las incertidumbres mencionadas, actualmente se aconseja el seguimiento de las recomendaciones de DPC de mama establecidas en la población general, tanto en pacientes en LE como tras el trasplante renal. Dada su mayor agresividad postrasplante, se sugiere la posibilidad de un inicio más precoz del cribado en mujeres trasplantadas, tal y como han establecido recientemente diversos programas de DPC de cáncer de mama en población general22. Se sugiere, por tanto, el cribado mediante mamografía desde los 40 años de edad en mujeres trasplantadas. Como ya se ha citado, no existe una edad límite a la que detener la DPC de mama, aunque actualmente la mayor parte de programas detienen su aplicación a los 70 años. Tanto pre- como postrasplante, se sugiere la posibilidad de individualizar esta decisión al estado de salud y pronóstico de cada paciente, lo que posiblemente resulte en una detención más precoz que en la población general del seguimiento mediante mamografía.
Cáncer de cuello uterino
El cáncer cervical o cáncer de cuello uterino (CCU) es la tercera neoplasia más frecuente en el mundo en las mujeres. El cribado de mujeres sanas mediante citología cervical ha demostrado claramente su eficacia, puesto que su aplicación de forma adecuada y sistemática en determinados países ha conseguido reducir en un 70-80% la incidencia y mortalidad por CCU. Este beneficio se debe a la detección de lesiones premalignas asintomáticas, cuyo diagnóstico y tratamiento evitan su progresión a carcinoma invasivo39. Por otra parte, múltiples estudios han aportado una sólida evidencia que confirma al virus del papiloma humano (VPH) como agente causal de la práctica totalidad de los casos de CCU y de sus lesiones precursoras, por lo que las pruebas de detección del VPH constituyen un marcador muy sensible y precoz del riesgo de cáncer o lesiones precursoras, especialmente en mujeres mayores de 30 años.
Actualmente, el cribado de CCU presenta cierta heterogeneidad en España y en el ámbito internacional34. En general se recomienda un inicio del cribado entre los 21 y 25 años de edad, incluso de forma independiente del inicio o no de las relaciones sexuales. Desde esa edad y hasta los 29 años se recomienda el cribado mediante citología líquida o convencional cada 3 años. A partir de los 30 y hasta los 65 años de edad se recomienda preferentemente el cribado mediante el denominado cotest, citología cervical y test de detección de VPH de forma simultánea cada 5 años. También se aceptaría, aunque con un grado menor de recomendación, la citología aislada, también cada 5 años. A partir de los 65 años se recomienda interrumpir el cribado si 3 citologías o 2 cotest son negativos de forma consecutiva, y en mujeres mayores de 65 años que nunca hayan sido estudiadas se recomienda la realización de una única citología22,39.
Existen escasas evidencias sobre el riesgo de CCU en mujeres con ERC pretrasplante, pero aparece ya un claro incremento de riesgo en población en diálisis, y está fuertemente demostrado que el cáncer de cérvix es más frecuente y agresivo en población trasplantada3-6. Cuando diversos trabajos han sometido a examen a mujeres con trasplante renal, la tasa de lesiones detectadas en la citología es unas 3 veces superior a la hallada en población general y la prevalencia de infección por el VPH es también mayor40.
Aunque no hay evidencias directas de los costes, riesgos y beneficios de las estrategias de cribado del CCU, los análisis de coste-eficacia y coste-eficiencia mediante modelos probabilísticos muestran un programa de DPC de cérvix mediante citología anual en una población de mujeres trasplantadas de 18 a 69 años de edad, el beneficio en supervivencia obtenido parece coste-efectivo y se obtiene una reducción de mortalidad específica por cáncer. De hecho, los datos de un mayor riesgo de enfermedad invasiva en población trasplantada renal aconsejan un inicio de los programas de DPC de cérvix con antelación a los 21 años, y se acercan a los 18 años de edad41. Pese a todas estas evidencias es muy llamativo que el porcentaje de mujeres trasplantadas que cumplen las recomendaciones del cribado del cáncer de cérvix es muy bajo40,42.
El Grupo Prometeo, como conclusión a estos datos, recomienda que en pacientes en LE y tras el trasplante renal se sigan, como mínimo, las directrices de DPC de cérvix establecidas en la población general. Dado el incremento de riesgo y agresividad del cáncer cervical en población trasplantada renal, se sugiere intensificar los programas de DPC cervical incrementando la periodicidad de los test de detección, que en condiciones habituales se harían cada 3 o 5 años, a una frecuencia anual o bianual. Por los mismos argumentos, se sugiere adelantar el inicio de los programas de DPC del cáncer de cérvix a los 18 años de edad en esta población.
Cáncer de próstata
En la población general, el cáncer de próstata es el cáncer no cutáneo más frecuente en varones por encima de los 70 años, con un peso creciente en términos de coste y morbimortalidad en sociedades con una proporción también creciente de población anciana43. Las estrategias sistemáticas de DPC de próstata en población general han sido y son una cuestión extremadamente controvertida y sujeta a diversos cambios, fundamentalmente debido a la dificultad en demostrar que las diversas estrategias propuestas se hayan traducido en beneficios de mortalidad que superen a los riesgos y costes potenciales del cribado43. Mientras que algunas guías sostienen que un número sustancial de pacientes con enfermedad agresiva no será detectado, otras guías prefieren evitar el sobrediagnóstico y el sobretratamiento con un beneficio inexistente o marginal de supervivencia22,44.
Actualmente, las últimas guías de la European Association of Urology no recomiendan una estrategia sistemática de cribado poblacional y sí evitar cualquier maniobra de diagnóstico precoz si la esperanza de vida es menor a 10 años. Como estrategia oportunista de DPC de próstata se recomienda, en varones mayores a 50 años y con una expectativa de vida superior a 10 o 15 años, la vigilancia activa solo tras información y decisión compartida con el paciente. En este grupo poblacional se aconsejaría el examen digital y la determinación del antígeno específico prostático (PSA) de forma bianual. Según el PSA inicial, en individuos sin riesgo adicional, la siguiente determinación de PSA podría posponerse a los 8-10 años44.
La identificación de los individuos que más podrían beneficiarse de un diagnóstico precoz es también importante para la toma de decisiones. Entre estos individuos se encontrarían varones mayores de 50 años, afroamericanos, con historia familiar de cáncer de próstata, o con determinación de PSA > 1 ng/ml a los 40 años, o > 2 ng/ml a los 60 años. Aproximadamente, un 50% de las lesiones detectadas no precisarán tratamiento. Desvincular la detección precoz de la decisión de tratamiento activo parece la mejor forma de obtener un beneficio del diagnóstico precoz evitando el sobretratamiento22,44.
El cáncer de próstata no muestra un incremento de riesgo en el paciente con ERC avanzada o trasplante renal, aunque el comportamiento es más agresivo en población inmunosuprimida3-6,45. Al igual que en población general, la DPC de próstata en el pre- o postrasplante es un terreno de controversia. Adicionalmente a las consideraciones ya mencionadas en población general sobre los riesgos del cribado, hay riesgos específicos para esta población, especialmente en pacientes afectados de ERC y en diálisis antes del trasplante renal. En este colectivo, el cribado se ha asociado a retrasos en la inclusión en LE por falsos positivos, a retraso en el trasplante hasta alcanzar un intervalo libre de enfermedad tras el tratamiento de un cáncer de próstata detectado en el cribado, e incluso a un menor acceso al trasplante debido a deterioros en el estado de salud asociados al aplazamiento del trasplante. Todo ello sabiendo que el impacto sobre la mortalidad a 5 años por el retraso en el acceso al trasplante puede ser mayor que el impacto del propio cáncer de próstata46.
Tras el análisis de todas estas consideraciones, el Grupo Prometeo recomienda seguir en la población afectada de ERC avanzada y en diálisis, para su acceso al trasplante renal, y posteriormente al trasplante, las mismas recomendaciones que en la población general. Previamente a la inclusión en LE o el acceso al trasplante, y especialmente en pacientes de edad avanzada, elevada comorbilidad y/o riesgos competitivos, se sugiere informar más exhaustivamente de los riesgos específicos asociados a las estrategias de DPC de próstata (retraso en el acceso y disminución de la probabilidad de trasplante), antes de proceder a cualquier maniobra de diagnóstico precoz.
Cáncer renal
No existe indicación de ninguna estrategia sistemática de DPC renal en población general. Sin embargo, el cáncer renal es mucho más frecuente en población en LE y trasplantada renal respecto a la población general, en parte debido a la existencia de un solapamiento epidemiológico y etiológico de ambas entidades3-6. Es muy llamativo el hecho de que se produce una distribución bimodal del cáncer renal postrasplante: un primer pico de incidencia en el primer año postrasplante, con un incremento de riesgo de hasta 10 veces respecto a población general, posiblemente reflejando la presencia de tumores no detectados en la evaluación pretrasplante, y un segundo pico en torno a 5 hasta 15 años postrasplante47.
Existen diversos factores de riesgo conocidos para el cáncer renal, como el tabaquismo, la obesidad, la hipertensión arterial, los factores genéticos, la exposición a diversos tóxicos y el consumo de analgésicos (incluyendo antiinflamatorios no esteroideos y acetaminofeno), la quistosis renal adquirida (QRA), la esclerosis tuberosa y los antecedentes de cáncer renal. Recientemente, la poliquistosis renal se ha identificado también como un factor de riesgo relevante para el cáncer renal, aunque existen evidencias contradictorias al respecto48. En la población postrasplante se han identificado además, y de forma específica, otros factores de riesgo añadidos: el tiempo en diálisis (independientemente de la QRA), la edad avanzada en receptor y donante, el sexo masculino, la raza afroamericana y los antecedentes de rechazo agudo durante el primer año postrasplante49,50.
Diversas guías clínicas recomiendan la DPC renal tanto pretrasplante, mediante ecografía anual, como postrasplante, mediante ecografía bianual14,16. No obstante, no existen evidencias de que estas estrategias reduzcan la mortalidad. Aplicando métodos de análisis de coste-eficacia mediante modelos probabilísticos, una estrategia de DPC del cáncer renal mediante ecografía bianual en una población de pacientes trasplantados no resulta coste-eficaz y reduce solo marginalmente la mortalidad específica por cáncer51, de modo que para diversos autores que específicamente han revisado este aspecto la DPC renal no puede recomendarse de forma sistemática19,51. Sin embargo, la selección de la población sobre la base de la presencia de factores de riesgo para cáncer renal, y especialmente por la presencia de quistes sobre los riñones nativos, podría cambiar favorablemente los resultados de este análisis50. De hecho, está claramente demostrado que los pacientes con quistes renales pretrasplante presentan una incidencia de cáncer renal postrasplante desproporcionadamente alta de forma precoz, y con incremento de la mortalidad del paciente49,50.
Como resultado de estos datos y su análisis, el Grupo Prometeo formula diversas pautas en la DPC renal. Se recomienda el cribado de la población pretrasplante mediante ecografía abdominal, que habría de repetirse con periodicidad bianual en caso de permanencia prolongada en diálisis. En la población postrasplante, actualmente no existen evidencias para recomendar la DPC renal mediante ecografía de periodicidad bianual en todos los pacientes trasplantados. Sin embargo, sí se recomienda dicha estrategia en los pacientes con factores de riesgo para cáncer renal, lo cual incluiría a un amplio porcentaje de la población trasplantada. Como factores de riesgo se considerarán especialmente:
• Enfermedad renal quística adquirida, esclerosis tuberosa y poliquistosis renal.
• Antecedentes de cáncer renal.
• Receptor varón o de raza afroamericana.
• Tabaquismo.
• Edad avanzada en receptor y/o donante.
• Tiempo en diálisis pretrasplante incrementado.
• Antecedentes de rechazo agudo en el primer año postrasplante.
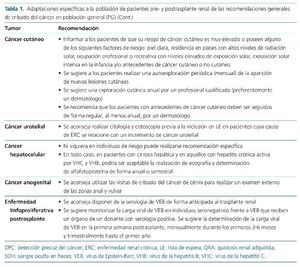
Enfermedad linfoproliferativa postrasplante
La enfermedad linfoproliferativa postrasplante (PLTD), con su amplio abanico de expresión clinicopatológica, es una entidad característica de la población trasplantada, en la que no se pueden establecer paralelismos con la población general. No se dispone de un test que permita la detección precoz de esta patología, pero sí se conocen diversos factores de riesgo. Aunque estrictamente no forma parte de la DPC, se considera que la evaluación de las estrategias de detección y seguimiento de marcadores de riesgo podría potencialmente facilitar un diagnóstico precoz de la enfermedad, reducir su mortalidad o impedir su desarrollo.
Los principales factores de riesgo identificados para el desarrollo de la PLTD son el grado de inmunosupresión y el estatus serológico para el virus de Epstein-Barr (VEB). Como factores de riesgo adicionales pueden tenerse en cuenta la raza caucásica y una menor edad al trasplante52,53. De entre todos ellos, el VEB emerge como uno de los factores más potentes para la predicción del riesgo de desarrollo de PLTD, aunque se debe recordar que el patrón de incidencia en el tiempo de la PLTD es bimodal, y los casos tardíos son frecuentemente negativos para el VEB54.
Dado el papel preponderante del VEB en la génesis de la PLTD, se ha especulado con que la monitorización de la replicación del VEB podría constituir un instrumento valioso, en términos de capacidad de predicción del desarrollo de PLTD, o de guía para cambios de abordaje del paciente que se traduzcan en una reducción de incidencia o severidad de la PLTD. Pese a ello, los datos disponibles sobre ello son limitados. Diversos estudios de carácter retrospectivo han sido capaces de demostrar que tanto la carga viral persistentemente elevada del VEB como el pico de la carga viral podrían seleccionar a los pacientes con mayor riesgo de desarrollo de recurrencia de PLTD55-57. Una vez detectados los individuos con riesgo incrementado, la modulación del tratamiento inmunosupresor, o incluso la administración de rituximab, podría evitar el desarrollo de PLTD58,59.
El Grupo Prometeo establece diversas consideraciones en relación con la PLTD. Se recomienda disponer de la serología de VEB de forma anticipada al trasplante renal. Se sugiere monitorizar la carga viral de VEB en individuos seronegativos frente a VEB que reciben un órgano de un donante con serología positiva. Se sugiere como calendario de monitorización la determinación de la carga viral de VEB la primera semana postrasplante, mensualmente durante los primeros 3-6 meses y trimestralmente hasta el primer año postrasplante. También se sugiere la monitorización tras un episodio de rechazo agudo tratado y tras un episodio de PLTD.
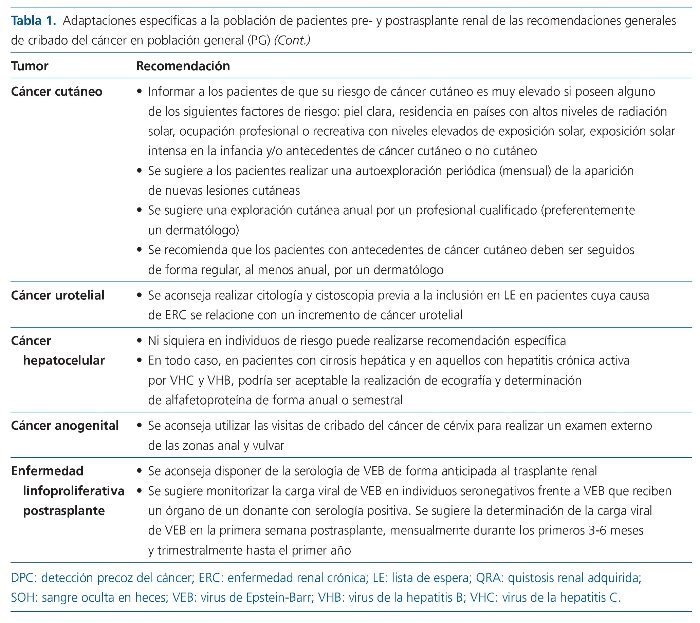
Cáncer cutáneo
El cáncer cutáneo es claramente el cáncer más frecuente en la población general, y del mismo modo es también el cáncer más frecuente en la población postrasplante, en la que presenta además un fuerte incremento de riesgo respecto a la población general. De una forma mucho más atenuada, la población de pacientes afectados de ERC avanzada o en diálisis presenta también un incremento de riesgo de cáncer cutáneo. En todos estos grupos de pacientes, los cánceres cutáneos más frecuentes son el carcinoma escamoso (CCE) seguido del carcinoma basocelular (CCB)3,60. Se han identificado diversos factores de riesgo para el CCE y CCB, entre los que cabe destacar: piel clara, residencia en países con altos niveles de radiación solar, ocupación profesional o recreativa con niveles elevados de exposición solar, exposición solar intensa en la infancia y/o antecedentes de cáncer cutáneo o no cutáneo60.
A pesar de su frecuencia, no existe en la actualidad ninguna estrategia recomendada de DPC en población general ni en diálisis22,61, mientras que diferentes guías clínicas proponen diversas medidas para la DPC cutáneo en población trasplantada14-16. En primer lugar, se expone la necesidad de informar a los pacientes de su riesgo global de cáncer cutáneo y de los factores de riesgo adicionales que puedan presentar, como una medida que incremente su conciencia del problema y que facilite el seguimiento de las recomendaciones y revisiones periódicas que posibilitan la prevención y DPC cutáneo. La autoexploración periódica de la aparición de lesiones cutáneas sospechosas es otra de las medidas que suele citarse en dichas guías clínicas. No existen pruebas que demuestren la eficacia de esta medida, pero se recomienda, dado su bajo coste y escasos perjuicios potenciales, aunque sin duda podría tener un impacto sobre la ansiedad relacionada con la enfermedad y, por tanto, en la calidad de vida del paciente.
Sí existe un claro posicionamiento para que el paciente se someta a revisiones periódicas con exploración cutánea, que debe ser realizada por un profesional cualificado. Esta recomendación, pese a su lógica aparente, no está basada en evidencias sólidas. Sí que las hay para afirmar que el rendimiento en la detección de lesiones tumorales cutáneas es muy inferior en el médico de atención primaria o en el médico de trasplante respecto al dermatólogo, a menos que haya recibido entrenamiento específico para ello62,63. Por ello se recomienda que, a menos que se disponga de un conocimiento específico y la experiencia suficiente, el paciente debe ser seguido con periodicidad por un dermatólogo. El cumplimiento de estas recomendaciones no es fácil, exige un esfuerzo asistencial significativo y la participación activa del paciente. Son necesarios programas específicos de DPC cutáneo y con la adecuada dotación asistencial para poder alcanzar las recomendaciones propuestas64,65.
Uno de los factores más potentes en la predicción del riesgo de desarrollar un cáncer cutáneo es el antecedente de un cáncer cutáneo. Tras el primer cáncer, el riesgo se incrementa de forma drástica, al igual que se acorta el tiempo hasta la aparición de una nueva lesión, y el fenómeno se repite para sucesivos tumores66. Por ello, los individuos con antecedentes de cáncer cutáneo deben ser seguidos con especial atención por un dermatólogo y con intervalos ajustados al riesgo de cada paciente, según el tipo de cáncer, el fenotipo cutáneo y el número de lesiones. Diversos trabajos han intentado establecer una guía de la periodicidad de seguimiento de estos pacientes, aunque se basan en datos retrospectivos que no pueden evaluar su eficacia60,66.
Así pues, como resumen de estas evidencias, se pueden establecer diversas recomendaciones en la DPC cutáneo en el paciente trasplantado, mientras que no existen datos que sustenten una recomendación en el paciente pretrasplante. En primer lugar, se recomienda informar a los pacientes de que su riesgo de cáncer cutáneo es muy elevado si poseen alguno de los siguientes factores de riesgo: piel clara, residencia en países con altos niveles de radiación solar, ocupación profesional o recreativa con niveles elevados de exposición solar, exposición solar intensa en la infancia y/o antecedentes de cáncer cutáneo o no cutáneo. Se sugiere a los pacientes realizar una autoexploración periódica (mensual) de la aparición de nuevas lesiones cutáneas. Se sugiere una exploración cutánea anual por parte de un profesional cualificado (preferentemente un dermatólogo). Se recomienda que los pacientes con antecedentes de cáncer cutáneo deben ser seguidos de forma regular, al menos anual, por un dermatólogo.
Cáncer de pulmón
El cáncer de pulmón es la primera causa de cáncer y de mortalidad por cáncer en varones, y la segunda causa de mortalidad por cáncer en mujeres67. Pese a ello, no se aplica en la mayor parte del mundo ningún programa de DPC en población general. Desde diciembre del 2013, en Estados Unidos se estableció por primera vez una recomendación para la DPC de pulmón en individuos de riesgo. Actualmente, las guías clínicas de la American Cancer Society recomiendan aplicar la DPC de pulmón en pacientes de 55 a 75 años, con un buen estado de salud, fumadores o exfumadores en los últimos 15 años, e historia de exposición superior o igual a 30 paquetes-año. En este grupo poblacional se recomienda el cribado mediante la realización anual de una tomografía computarizada (TC) torácica de baja dosis de radiación22.
En los pacientes trasplantados renales, el cáncer de pulmón presenta un riesgo incrementado y un pronóstico infausto, y es uno de los tumores sólidos más frecuentes5-7,68. Sin embargo, las diferentes guías dirigidas a esta población no establecen recomendaciones de cribado para esta estirpe tumoral14-16.
A la luz de los recientes cambios en las estrategias de DPC de pulmón en población general, y con los datos mencionados acerca del incremento de riesgo en población trasplantada, el Grupo de Trabajo Prometeo cree necesario implementar estas mismas recomendaciones en pacientes pre- y postrasplante, aunque hoy en día dicha recomendación puede quedar seriamente limitada por la disponibilidad en los diferentes dispositivos asistenciales de la TC de baja exposición. Se recomienda, por tanto, la realización en individuos de riesgo (pacientes de 55 a 75 años, con una razonable expectativa de vida, fumadores o exfumadores en los últimos 15 años e historia de exposición superior o igual a 30 paquetes-año) de una TC torácica de baja exposición en la evaluación pretrasplante, y seguir postrasplante con dicha prueba con la periodicidad recomendada para este grupo de riesgo en población general.
Otros cánceres
El cáncer urotelial carece de estrategia de cribado poblacional, pero se trata de una estirpe tumoral con un claro incremento de riesgo en población tanto pretrasplante como postraplante69. En algunas zonas geográficas constituye uno de los tumores más frecuentes de la población trasplantada, lo cual se relaciona con la distribución de sus principales factores de riesgo: el tabaquismo, la exposición ocupacional a diversos carcinógenos y el ácido aristolóquico, y su superposición con la etiología de ERC del paciente70. No existe ninguna evidencia que evalúe de forma adecuada el valor de una estrategia de DPC urotelial pre- o postrasplante. Pese a todo, y como acuerdo de expertos, algunas guías clínicas recomiendan realizar citología y cistoscopia previa a la inclusión en LE en pacientes cuya causa de ERC se relacione con un incremento de cáncer urotelial14.
El cáncer hepatocelular tampoco es contemplado en las estrategias de cribado poblacional sistemático, pero sí se han elaborado recomendaciones para determinados grupos de riesgo. En estos grupos se encuentran los pacientes con cirrosis hepática y aquellos con hepatitis crónica activa por VHC (virus de la hepatitis C) y VHB (virus de la heptatis B). En la actualidad no existe consenso acerca de cuál es la estrategia adecuada en estos grupos poblacionales. Algunas guías clínicas mantienen la conveniencia de someter a estos pacientes a una estrategia de DPC hepatocelular, mediante la realización de ecografía y determinación de alfafetoproteína, de forma anual o incluso semestral71.
El cáncer anogenital muestra, respecto a la población general, un fuerte incremento del riesgo en la población trasplantada e inmunosuprimida, mientras que este efecto no se demuestra en la población pretrasplante, ya sea con ERC avanzada o en diálisis3-6,39. Al igual que el cáncer cutáneo no melanoma y el cáncer de cérvix, muestra una estrecha relación patogénica con el VPH39. La ausencia de una estrategia de cribado poblacional hace que con frecuencia también sea descuidado en población trasplantada. Ante la falta de programas específicos de cribado, el abordaje más factible en la población trasplantada como estrategia recomendada en la DPC anogenital es utilizar las visitas de cribado del cáncer de cérvix para realizar un examen externo de la zona anal y vulvar14-16.
EVALUACIÓN PRETRASPLANTE DEL PACIENTE CON CÁNCER EN REMISIÓN
Indicación del trasplante renal en pacientes con cáncer en remisión
A lo largo de las últimas décadas, la edad y comorbilidad de los pacientes que acceden al trasplante renal no hace sino crecer, y con ello también se incrementa el número de pacientes con antecedentes de cáncer que son incluidos en LE de trasplante renal72.
La indicación de trasplante renal en un paciente con historia previa de cáncer es una decisión extremadamente compleja y sensible. En ella se enfrentan los conceptos de equidad, de beneficio individual y de eficiencia para la distribución de un recurso escaso, junto con las incertidumbres de los riesgos y beneficios asociados al trasplante renal en este grupo de pacientes. Hemos de tener en cuenta que la historia de un cáncer en remisión, ya sea un cáncer cutáneo o uno no cutáneo, incrementa el riesgo de mortalidad global, de mortalidad específica por cáncer y de cáncer de novo postrasplante72-74.
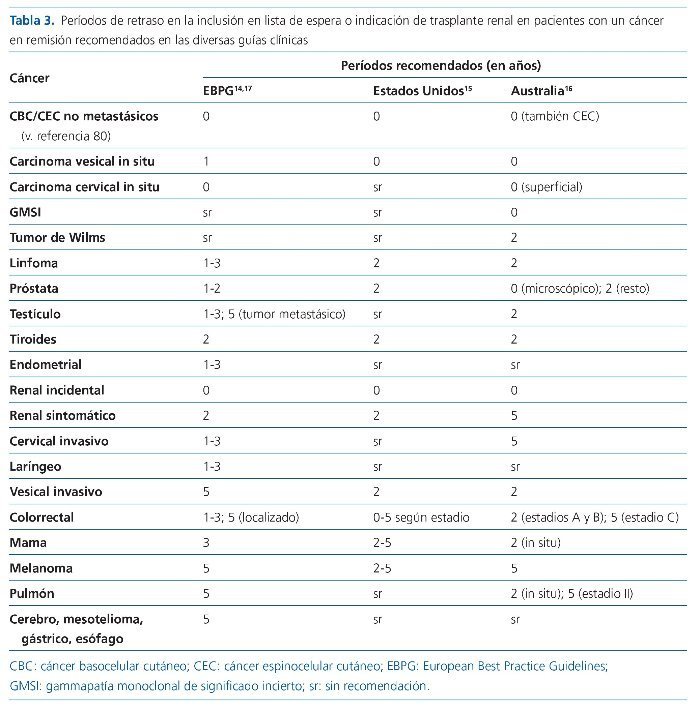
Hasta el momento actual, la indicación de trasplante renal en un paciente con historia previa de cáncer se hace bajo varios presupuestos escasamente respaldados77. Por una parte, un mayor intervalo de tiempo entre el tratamiento de un cáncer y la realización del trasplante renal se relaciona con una menor probabilidad de recurrencia de dicha neoplasia; por otra, se asume que la inmunosupresión altera de forma invariable el riesgo de recurrencia y el pronóstico de una neoplasia en remisión14-17. Este último principio se basa en evidencias muy débiles. Hay que tener en cuenta que los datos sobre las tasas de recurrencia de cáncer postrasplante y, consecuentemente, las recomendaciones del retraso en la inclusión en LE se basan en datos provenientes de registros; de entre ellos, el que proporciona mayor volumen de datos es el Cincinnati Transplant Tumor Registry. Pese al enorme valor de estos datos, su naturaleza de registro retrospectivo y de cumplimiento no sistemático los expone a deficiencias metodológicas importantes y diversos sesgos. Además, en ellos, muchos tipos tumorales poseen un número insuficiente de casos, que imposibilita hacer recomendaciones específicas. Y, por último y muy importante, los casos son correspondientes a una época histórica no comparable con la actual, tanto en la metodología diagnóstica, la estadificación, las opciones terapéuticas y el pronóstico de la neoplasia, como en las recomendaciones de cribado de la población y en las prácticas de inmunosupresión en trasplante renal76,77.
Hemos de tener en cuenta, además, que el potencial beneficio del retraso en la indicación y realización del trasplante debe ser contrapesado con el perjuicio probado sobre la supervivencia del paciente que ejerce un mayor período de estancia en diálisis pretrasplante renal. De hecho, en la actualidad desconocemos el impacto global en la mortalidad que tienen estas recomendaciones sobre este grupo de pacientes.
Análisis de las actuales recomendaciones
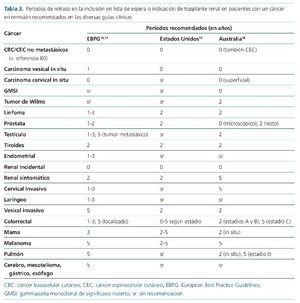
El abordaje más habitual en las diferentes guías disponibles es la elaboración de recomendaciones sobre el período durante el cual debe posponerse la inclusión en LE y/o el trasplante desde el tratamiento curativo de un cáncer15,16. Estas recomendaciones se adaptan al tipo y la estadificación del tumor, aunque de forma muy genérica (tabla 3).
Como criterio general para decidir la inclusión se establece el objetivo de un 80% de probabilidad de supervivencia a 5 años, sin que exista un análisis sobre la bondad de este objetivo más allá del acuerdo de expertos15. En el caso de las neoplasias cutáneas, existen recomendaciones recientes y detalladas para el tipo y estadio de tumor elaboradas bajo el acuerdo de expertos por el ITSCC (International Transplant Skin Cancer Collaborative)78.
En la revisión más reciente de las guías europeas de trasplante se hace énfasis en un enfoque ligeramente diferente. En ellas se recomienda la utilización de estas recomendaciones de forma puramente orientativa, para establecer el período de espera necesario en cada paciente tras un abordaje individualizado, en el que debe participar un grupo multidisciplinar liderado por el equipo de trasplante con la asistencia de un oncólogo14,17.
Finalmente, siguiendo el criterio ya mencionado, según diversas guías, algunos tipos tumorales merecen la exclusión definitiva del paciente de la indicación del trasplante renal debido a una desproporcionada posibilidad de re currencia, o sencillamente porque se trata de un cáncer no curado. Entre estos tipos tumorales se menciona el mieloma múltiple, el cáncer de mama avanzado (estadio III), el CCR avanzado (estadio D) y, por supuesto, cualquier cáncer no tratado o controlado15. Este concepto precisa revisión, puesto que, como ya se ha mencionado con anterioridad, las herramientas terapéuticas, diagnósticas y el pronóstico del cáncer han cambiado de forma radical en las 2 últimas décadas.
Recomendaciones del Grupo Prometeo
Podríamos concluir que, a criterio del Grupo, el abordaje actual más acertado sobre el período en que debe posponerse la indicación de trasplante en un paciente con un antecedente tumoral es que las recomendaciones genéricas según el tipo y estadio del tumor deben ser combinadas con un abordaje individualizado caso por caso, con la participación de un oncólogo, teniendo en cuenta el estadio en el paciente y el pronóstico actual del tumor en la población general. Se sugiere que el umbral mínimo del pronóstico de supervivencia exigido para cada tumor también deberá individualizarse en función de la edad, la comorbilidad y los riesgos competitivos de cada paciente.
Del mismo modo, la exclusión definitiva de la posibilidad de trasplante debe formularse tras un examen individualizado de cada caso teniendo en cuenta la estirpe y estadio tumoral, las posibilidades terapéuticas y el pronóstico global del paciente.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia:
Álex Gutiérrez-Dalmau
Servicio de Nefrología. Hospital Universitario Miguel Servet. Zaragoza.
agutierrezd@salud.aragon.es