INTRODUCCIÓN
La importancia del cáncer en el trasplante renal (TR) viene determinada por su impacto en la supervivencia del paciente y es la segunda causa de muerte a largo plazo (> 20 años postrasplante) en pacientes con TR1.
Globalmente, la incidencia acumulada de neoplasia de novo postrasplante es de un 9-10% a 10 años2 y entre un 10-27% a 20 años, excluyendo el cáncer de piel no melanoma (CPNM)3 (nivel de evidencia alto).
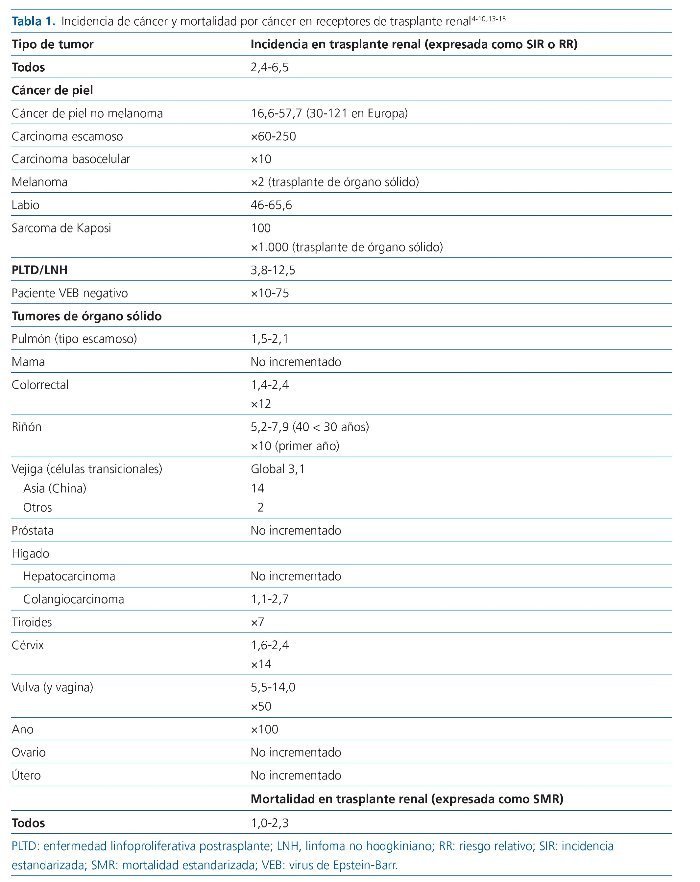
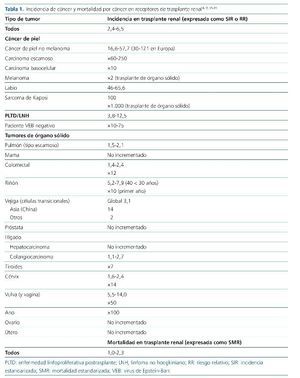
En general, el cáncer entre los pacientes con TR es más frecuente que en la población general, con una incidencia estandarizada (SIR [standardized incidence ratio]) de cáncer (en cualquier localización, incluyendo en algunos registros los CPNM) de 1,9 a 6,54-10 (nivel de evidencia alto). La SIR también es más alta si se compara a los pacientes con TR con los pacientes con enfermedad renal crónica (ERC) en diálisis que permanecen en lista de espera, concretamente la de CPNM, linfoma no hodgkiniano (LNH) y cáncer renal11 (nivel de evidencia moderado).
No obstante, la SIR depende de la población estudiada y en los registros europeos es algo más baja que en los estadounidenses: entre 1,5-2 para órgano sólido y 30-100 para CPNM6,7. Los tumores más frecuentes son los CPNM seguidos de los renales y de las vías urinarias (nivel de evidencia alto), excepto en algunos registros en los que destacan los síndromes linfoproliferativos8.
Por otro lado, el riesgo de presentar una segunda neoplasia en la población trasplantada es también más frecuente que en la población general12 (nivel de evidencia bajo).
Además de una mayor incidencia, el cáncer en el paciente trasplantado tiene también un peor pronóstico. La mortalidad estandarizada (SMR [standardized mortality ratio]) con la población general de un paciente trasplantado con cáncer es de 1 a 2,310,13-15 (nivel de evidencia alto), siendo más relevante en pacientes más jóvenes (< 50 años = 4,3) en comparación con los > 50 años = 1,2. En algunas neoplasias como el LNH o el cáncer de riñón propio, la SMR es significativamente mayor (14,1 y 9,6, respectivamente)15 (tabla 1).
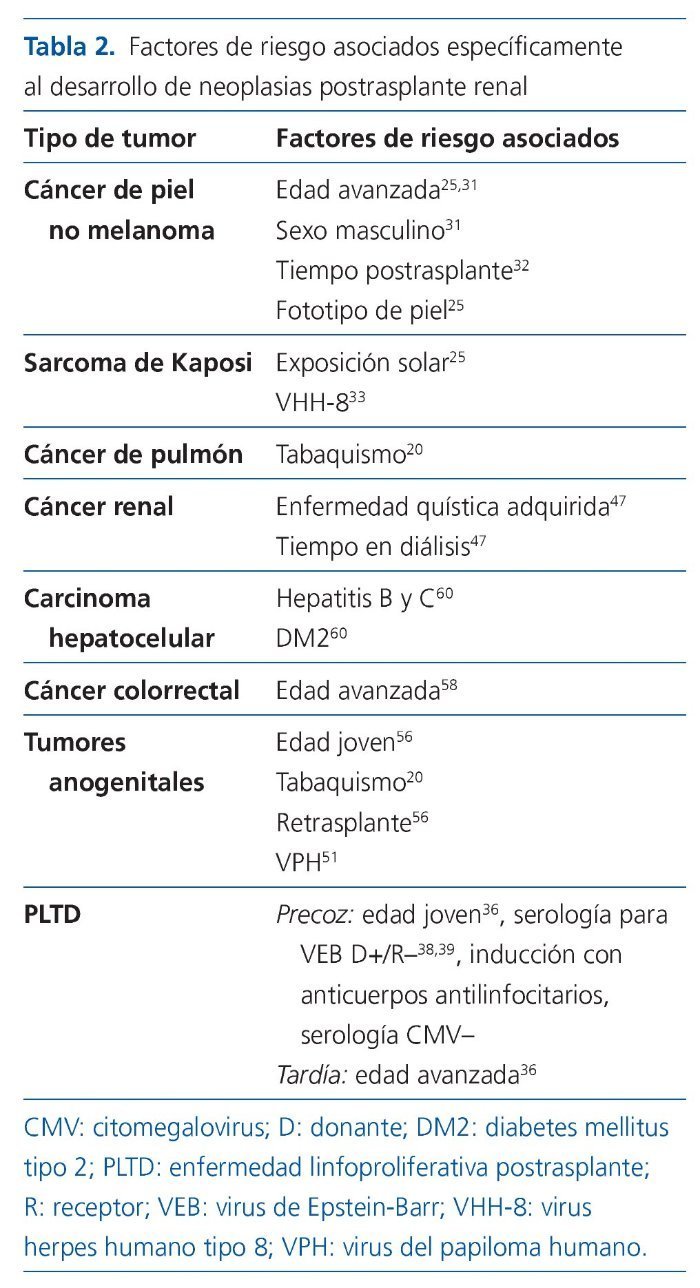
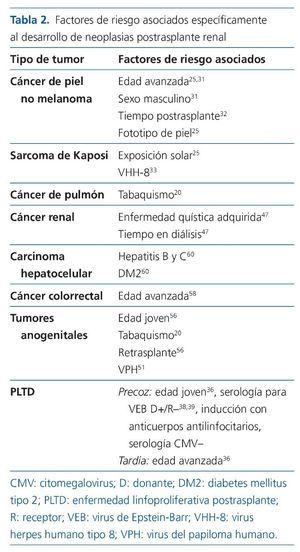
El factor de riesgo fundamental para el desarrollo de neoplasias en los pacientes con TR es la inmunosupresión16 (nivel de evidencia alto). La inmunosupresión puede facilitar la carcinogénesis mediante la disminución de los mecanismos implicados en la inmunovigilancia o mediante daño directo del ADN. Otros factores de riesgo generales son la edad y el sexo masculino5, la enfermedad renal de base, el tipo de trasplante (donante fallecido y expandido peor que donante vivo)17, haber presentado un cáncer pretrasplante18, la raza19 o el consumo de tabaco20 (nivel de evidencia alto); aunque los distintos registros y la bibliografía relacionada con este aspecto son más heterogéneos dependiendo del tipo de tumor (tabla 2).
El objetivo de este documento de consenso es establecer la epidemiología del cáncer pos-TR —así como los factores de riesgo implicados en su desarrollo— con el fin de plantear estrategias de prevención primaria en esta población.
EPIDEMIOLOGÍA DE LOS DISTINTOS TIPOS DE CÁNCER POSTRASPLANTE RENAL
Cáncer de piel
El CPNM es el tumor más frecuente y normalmente el primero detectado entre los pacientes con TR (nivel de evidencia alto). A los 20 años postrasplante, más del 50% ha tenido uno o más tumores de piel3. Sin embargo, la SIR de los tumores de piel varía según el registro y su calidad, la población estudiada, la zona geográfica, etc. En población europea se describe una SIR de 30 a 12121-23, con diferentes incidencias acumuladas según países. En población española, 2 estudios han descrito la incidencia de CPNM tras el TR, siendo de un 48% a 10 años en un estudio con seguimiento prospectivo24 y de un 25% a 20 años en otro retrospectivo25. El tiempo medio hasta la aparición del primer CPNM se sitúa entre 3 y 5 años postrasplante.
Dentro del CPNM, el carcinoma escamoso es mucho más frecuente que el basocelular, con un riesgo tras el TR que se multiplica por 60-250 en el primero y por 10 en el segundo26. Además, una vez diagnosticado un primer carcinoma escamoso cutáneo, el riesgo de aparición de un siguiente en los 5 años posteriores es muy elevado (hasta de un 80%)7.
El riesgo de cáncer de labio, relacionado con tumores de piel y exposición solar, también está aumentado en población trasplantada4,7.
Mucho más graves, aunque menos frecuentes que los CPNM, son los tumores de piel de tipo melanoma. El riesgo de melanoma se multiplica por 2 tras el trasplante de órgano sólido27, y además se ha demostrado que en pacientes trasplantados es más agresivo y cursa con mayor mortalidad (HR: 4,2, incluso a igual estadio Breslow) comparado con la población general27-30 (nivel de evidencia moderado).
En cuanto a factores de riesgo relacionados específicamente con el cáncer de piel, la edad avanzada, el sexo masculino, el fototipo de piel y la exposición solar se han asociado con su desarrollo de una manera consistente31,32 (nivel de evidencia alto). El tiempo postrasplante es asimismo un factor determinante, ya que es equivalente a la duración del tratamiento inmunosupresor32.
El sarcoma de Kaposi, un tumor raramente diagnosticado entre pacientes inmunocompetentes, tiene un riesgo multiplicado por mil en población trasplantada. Suele detectarse en el postrasplante precoz (dentro de los 2 primeros años) y a menudo se presenta con afectación cutánea, aunque la visceral es también frecuente. Su etiopatogenia está ligada al virus herpes humano tipo 8 (VHH-8)33,34.
Enfermedad linfoproliferativa postrasplante
La enfermedad linfoproliferativa postrasplante (PLTD) es la segunda o tercera (según la serie) neoplasia más frecuente entre pacientes trasplantados4-10. Según la clasificación de la World Health Organization de 2008 incluye 4 categorías: lesiones precoces, PLTD polimórfica, PLTD monomórfica (linfomas T y B), y el linfoma de Hodgkin (LH) tipo PLTD. La más común es el linfoma B de células grandes que corresponde a la categoría PLTD monomórfica35.
Su incidencia tiene una distribución bimodal; la PLTD precoz sucede durante el primer año postrasplante, se asocia a seronegatividad para el virus de Epstein-Barr (VEB) y citomegalovirus (CMV) y es más frecuente en jóvenes de raza caucásica; la PLTD tardía aparece tras el quinto año y es más frecuente en ancianos36 (nivel de evidencia alto). En nuestro medio se han publicado pocos registros sobre la incidencia de PLTD, aunque la incidencia reportada es baja37 (nivel de evidencia bajo).
Los pacientes seronegativos que reciben un riñón de un donante seropositivo para VEB tienen un riesgo multiplicado por 2-3 de desarrollar la enfermedad en comparación con los que reciben un injerto de donante negativo para VEB38,39 (nivel de evidencia alto). Además, el riesgo de PLTD es mayor si se recibe un injerto de donante fallecido comparado con donante vivo38.
Dentro de la PLTD, el LNH es más frecuente que el LH (nivel de evidencia moderado) y es más frecuente en el doble trasplante renopancreático que en el TR aislado (nivel de evidencia alto). La SIR para linfoma de células B en trasplante de órgano sólido es de 1240 y para linfoma de Burkitt, de 2341 (nivel de evidencia moderado). Sin embargo, aunque el LNH es más frecuente entre pacientes con TR que en población general, su incidencia es la más baja en relación con todos los trasplantes de órgano sólido (nivel de evidencia alto).
La supervivencia de la PLTD en el TR oscila entre el 51 y el 67% en el primer año tras el diagnóstico y entre el 39 y el 60% a los 5 años42,43. Los factores asociados a un peor pronóstico son el deterioro de la función renal al diagnóstico, la PLTD precoz, la PLTD de células T y el tratamiento con timoglobulina44.
Tumores de órgano sólido
Cáncer renal/de vías urinarias
El tumor de órgano sólido más frecuente pos-TR es el cáncer renal. Su incidencia tiene una distribución bimodal, con 2 picos establecidos; es frecuente desde el primer año pos-TR —cuando el riesgo se multiplica por 10 con respecto a la población general, probablemente en relación con cáncer no detectado en quistes renales en situación de pretrasplante— y reaparece a los 4-15 años postrasplante5. La SIR global es de 5 a 84,5,7 y es especialmente elevada en población más joven (nivel de evidencia alto). El tipo de cáncer renal más frecuente en el paciente trasplantado es el tipo papilar y de células claras45 (nivel de evidencia bajo). Además se ha demostrado que el cáncer renal es más frecuente en riñones propios que en el injerto renal46 (nivel de evidencia alto).
El tiempo en diálisis y la enfermedad quística adquirida se han descrito como factores de riesgo específicos del cáncer renal. Ambos hechos están relacionados y un 60-80% de los pacientes con más de 4 años en diálisis presentan enfermedad quística adquirida en sus propios riñones47 (nivel de evidencia alto).
El cáncer de urotelio (que puede incluir desde los riñones hasta la vejiga) es menos frecuente en nuestro medio. Sin embargo, es más frecuente en pacientes asiáticos y se ha asociado con consumo de hierbas chinas48 (nivel de evidencia moderado).
La SIR de cáncer de vejiga es de 2-349,50. Nuevamente la población asiática tiene una incidencia más elevada, con una SIR que llega a 14. El tipo más frecuente es el carcinoma de células transicionales (nivel de evidencia alto).
Tumores anogenitales
Entre los tumores anogenitales se incluye el cáncer de cérvix, vulva, vagina y pene, así como el cáncer anal. Son más frecuentes entre pacientes con TR en comparación con la población general (SIR, 1,6-14) y el riesgo de cáncer de vulva y de ano es muy alto (nivel de evidencia alto). Todos ellos se han relacionado con infección por virus del papiloma humano (VPH), con un posible incremento de su potencial carcinogénico en el seno del tratamiento inmunosupresor51. En general, la población con ERC —tanto en diálisis como trasplantada— tiene un mayor riesgo de tumores asociados al VPH52 (nivel de evidencia moderado). En concreto, los pacientes trasplantados tienen un riesgo multiplicado por 14 de cáncer de cérvix; por 50 de cáncer de vulva, y por 100 de cáncer anal (más frecuente en mujeres53). Un estudio norteamericano realizado en trasplantados de órgano sólido incluidos en el Transplant Cancer Match Study mostró que el cáncer más frecuente asociado al VPH fue el vulvar (SIR, 20,3), seguido del de pene (SIR, 18,6), el anal (SIR, 11,6) y el vaginal (SIR, 10,6)54. La incidencia de cáncer invasivo de cuello uterino, sin embargo, es más baja entre los pacientes con TR, reflejo probable del programa de cribado. El tiempo hasta el diagnóstico es de 2,6-5,7 años postrasplante.
La asociación de estos tumores con la presencia de infección por VPH se ha documentado hasta en un 92% de los casos55. Otro factor de riesgo importante para el cáncer de cérvix en TR es la edad joven56 (nivel de evidencia alto).
Otros tumores de órgano sólido
Tumores cuya incidencia está incrementada en pacientes con trasplante renal. El cáncer de pulmón es el tumor de órgano sólido más frecuente en pacientes con TR y la incidencia alcanza su pico a los 5 años postrasplante5. La SIR es de 1,5-2, fundamentalmente a expensas del carcinoma escamoso, que es el tipo más frecuente por encima del adenocarcinoma57 (nivel de evidencia alto). A pesar de tener una frecuencia mayor, la supervivencia de los pacientes con TR y cáncer de pulmón (no de célula pequeña), comparada con la de la población general y ajustada por riesgos competitivos, no es peor57 (nivel de evidencia moderado). El factor de riesgo específico del cáncer de pulmón, el tabaco, es también un factor de riesgo en pacientes con TR20 (nivel de evidencia alto).
La incidencia de carcinoma colorrectal está aumentada en población trasplantada renal (SIR, 1,4-2,4). Un estudio prospectivo identificó un riesgo 12 veces superior en pacientes con TR que en población general ajustada por edad y sexo58. La edad y el tiempo postrasplante fueron factores de riesgo identificados. Más recientemente, se ha publicado un estudio en el que el riesgo de carcinoma colorrectal postrasplante de órgano sólido está incrementado y es frecuente el origen proximal. Sin embargo, la incidencia en TR con régimen inmunosupresor basado en tacrolimusmicofenolato no se encontró incrementada59 (nivel de evidencia alto).
Por otro lado, la incidencia de colangiocarcinoma también se ha visto aumentada en población trasplantada renal (SIR, 2,1)60 (nivel de evidencia moderado).
El riesgo de cáncer papilar de tiroides se multiplica por 7 en pacientes con TR en comparación con población general, con una mediana de aparición a los 72 meses postrasplante61 (nivel de evidencia alto).
Tumores cuya incidencia no está incrementada en pacientes con trasplante renal. En general, la incidencia de cáncer de mama,ovario y útero no está incrementada entre receptoras de TR. Asimismo, tampoco se ha encontrado un aumento de la incidencia de cáncer de próstata en pacientes con TR en comparación con la población general4,5,7,62 (nivel de evidencia alto).
En cuanto al hepatocarcinoma, su incidencia no está incrementada globalmente entre pacientes con TR5, aunque aquellos pacientes con hepatitis B y C sí tienen una mayor incidencia (SIR, 6,5 y 3,4, respectivamente)63 (nivel de evidencia alto). La diabetes mellitus también se ha asociado específicamente a mayor riesgo de hepatocarcinoma postrasplante60.
FACTORES DE RIESGO DE CÁNCER POSTRASPLANTE RENAL
Generales
Hay factores de riesgo para el desarrollo de una neoplasia postrasplante que son comunes a cualquier tipo de tumor y se han descrito en la bibliografía de manera homogénea. Muchos de ellos son factores de riesgo de cáncer en población general, como la edad (a mayor edad, mayor riesgo), el sexo masculino, el tabaquismo o el nivel de radiación2,6-8,25. Otros son específicos de los pacientes que presentan insuficiencia renal crónica y reciben un TR, como el tiempo en diálisis previo al trasplante64, el tipo de donante del que procede el injerto (de menor a mayor riesgo sería: donante vivo < donante fallecido < donante fallecido con criterio expandido)17, el grado de inmunosupresión global y el tiempo postrasplante2 (nivel de evidencia alto). Se han llevado a cabo trabajos de registros en los que el haber padecido una neoplasia pretrasplante no supone un factor de riesgo para su recurrencia postrasplante, el desarrollo de un nuevo cáncer o un peor pronóstico vital del paciente13. Sin embargo, un metaanálisis reciente confirma que los pacientes con historia de cáncer pretrasplante tienen más riesgo de mortalidad por todas las causas, de mortalidad por cáncer y de desarrollar cáncer postrasplante18.
Por otro lado, entre los pacientes que se trasplantan existe un riesgo de transmisión de cáncer por parte del donante. Aunque es difícil establecer su incidencia exacta, parece que este riesgo es muy bajo (0,05%)65,66 (nivel de evidencia bajo).
En cuanto a la etiología de base de la ERC, se ha descrito que los pacientes con enfermedad poliquística tienen un riesgo de cáncer aumentado con respecto a la población general67, aunque más bajo con respecto a otros pacientes con TR con otras etiologías de base68 (nivel de evidencia moderado).
Otros factores de riesgo más inusuales se han relacionado también con el desarrollo de cáncer postrasplante. Por ejemplo, en un trabajo del CTS (Collaborative Transplant Study) se evidenció que la toma de inhibidores de la enzima de conversión de la angiotensina II y/o antagonistas del receptor de la angiotensina II se asociaba al desarrollo de neoplasias intratorácicas y respiratorias en pacientes fumadores69 (nivel de evidencia bajo).
Raciales
En un trabajo reciente se analizaron los datos del Transplant Cancer Match Study con el objetivo de establecer si el riesgo de cáncer postrasplante difería entre razas o etnias. Se detectó que la PLTD era más frecuente en los pacientes de raza caucásica; el cáncer renal, en los de raza negra o hispana y el cáncer de próstata, en los de raza negra (igual que sucede en la población general)19 (nivel de evidencia moderado).
Virus
Diversos virus se han relacionado con el desarrollo de cáncer en pacientes trasplantados. Algunos de ellos son menos característicos de la población trasplantada y también son frecuentes en la población general, como los virus de la hepatitis B y C, que se asocian al desarrollo de hepatocarcinoma60 (nivel de evidencia alto).
El VEB desempeña un papel fundamental, aunque no imprescindible, en el desarrollo de la PLTD42. La primoinfección por VEB (también la reactivación) desencadena una potente respuesta inmune. Los linfocitos T citotóxicos son necesarios para controlar la proliferación del virus. Cuando se controla la primoinfección, el VEB permanece de por vida en los linfocitos B y puede transmitirse de donantes VEB+ a receptores VEB– a través de estas células B infectadas en el injerto, así como también puede reactivarse en receptores VEB+ en el seno de la inmunosupresión que reciben tras el trasplante. La infección progresa debido a la incapacidad por parte de los linfocitos T citotóxicos de controlar la replicación viral70. Normalmente, la primoinfección suele ocurrir durante los primeros 3-6 meses postrasplante. Aunque no está clara la patogénesis del desarrollo de PLTD por parte del VEB, se sabe que los pacientes con serología de riesgo para primoinfección por VEB (donante+/receptor–) tienen más riesgo de desarrollar una PLTD (sobre todo precoz)38,39 (nivel de evidencia alto).
El CMV también se ha asociado al desarrollo de PLTD, sobre todo la primoinfección en receptores previamente seronegativos44,71 (nivel de evidencia moderado). Su impacto en el desarrollo de otras neoplasias es más controvertido72,73 (nivel de evidencia alto).
Otros virus asociados al desarrollo de distintos tipos de tumores pos-TR son el VPH con el carcinoma anogenital54,55 (nivel de evidencia alto); el VHH-8 con el sarcoma de Kaposi33,34 (nivel de evidencia alto), y el virus BK con tumores uroteliales74 (nivel de evidencia moderado).
Genéticos e inmunológicos
Diversos polimorfismos genéticos se han relacionado con el riesgo de presentar cáncer pos-TR75,76 (nivel de evidencia bajo). Por otro lado, se han descrito factores inmunológicos como la hipersensibilización (PRA > 80%)77, las disidentidades HLA con el donante y antígenos HLA específicos del receptor78 o características del inmunofenotipado del receptor79,80, que también se han relacionado con el desarrollo de cáncer postrasplante (nivel de evidencia bajo).
Inmunosupresión de inducción
Como ya se ha comentado, el principal factor por el que los pacientes trasplantados tienen más riesgo de desarrollar cáncer que la población general es la inmunosupresión que reciben. De hecho, la inmunosupresión recibida antes del trasplante ya se asocia a un mayor riesgo de presentar cáncer en el postrasplante81 (nivel de evidencia alto). En este capítulo se analiza el impacto de la inmunosupresión de inducción en el riesgo posterior de tumores, dejando la inmunosupresión de mantenimiento para el capítulo de prevención del cáncer postrasplante.
El uso de anticuerpos monoclonales anti-CD25 no se ha relacionado con un mayor riesgo de cáncer postrasplante82 (nivel de evidencia alto).
Clásicamente se ha asociado el uso de los anticuerpos antilinfocitarios con un mayor riesgo de cáncer postrasplante, y especialmente de PLTD83,84. En épocas más recientes, y con dosis menores, esta asociación podría ser menor85-87 (nivel de evidencia alto).
En una reciente revisión, el uso de belatacept no se asoció a mayor riesgo de PLTD, aunque hay que tener en cuenta que es un fármaco contraindicado en receptores VEB negativos88 (nivel de evidencia moderado).
CONCLUSIONES
El desarrollo de cáncer tras el TR es un fenómeno frecuente y que condiciona la supervivencia del paciente. Existen tumores cuya incidencia está claramente aumentada con respecto a la población general; son aquellos cuya aparición y agresividad está íntimamente ligada a la inmunosupresión. Para tratar de reducir esa incidencia es imprescindible la correcta identificación de los factores de riesgo de cada paciente, el despistaje adecuado de los diferentes tipos de tumores y la individualización de la inmunosupresión.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia:
María José Pérez Sáez
Servicio de Nefrología. Hospital del Mar. Barcelona.
mjoseperezsaez@gmail.com