La nefropatía IgA es la enfermedad glomerular más frecuente y heterogénea.
Hay estrategias histológicas y clínicas para determinar la progresión a ESRD.
Valoramos el significado pronóstico de la clasificación de Oxford/MEST-C y la calculadora de progresión de la NIgA (IgANPC) en nuestra población y relacionamos ambas herramientas.
Material y métodosRealizamos un estudio retrospectivo de biopsias NIgA de 1990 hasta 2015. Se realizó el MEST de las biopsias y se calculó el riesgo de progresión con IgANPC. Se relaciona con la evolución clínica.
ResultadosSe analizaron 48 biopsias, 83% varones de 45 años de media.
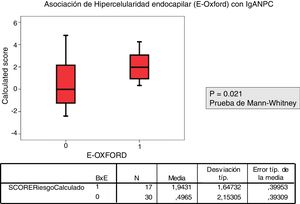
La correlación entre el MEST-C y el IgANPC score a la biopsia mostró una concordancia entre pacientes con un score IgANPC alto y E1 (p = 0,021).
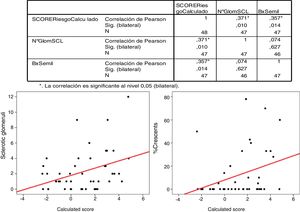
La correlación de Pearson para el porcentaje de semilunas y el IgAPC es estadísticamente significativo (p = 0,014) con r: 0,357.
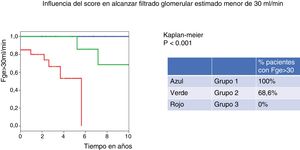
El 100% de los pacientes clasificados en el grupo 1 de IgANPC mantienen un FGe> 30ml/min a 10 años, mientras que ninguno de los del grupo 3 presenta un FGe> 30ml/min a 10 años (p = 0,001).
La comparación de log rank para variables del MEST-C score presenta resultados estadísticamente significativos entre E (0,036) y S (0,022), y el tiempo a FGe <30ml/min.
También se observa una relación estadísticamente significativa entre T1 y FGe <30ml/min.
El análisis multivariante con la regresión de Cox para IgANPC y FGe<30ml/min muestra una fuerte correlación (p = 0,016) entre el grupo de riesgo y FGe <30ml/min.
ConclusiónIgANP predice el tiempo hasta FGe <30ml/min y añade información independiente del MEST.
La clasificación de MEST-C score y el IgANPC score son útiles e independientes para la predicción pronóstica; queda validar su uso en la población general.
IgA nephropathy (IgAN) is the most common and heterogeneous glomerular nephropathy. Several strategies have been used to determine the risk of progression to ESRD. We evaluate the prognostic significance and correlate the IgAN progression calculator (IgANPC) and the Oxford/MEST-C score in our population.
Material and methodsWe performed a retrospective study of biopsied patients with diagnosis of IgA nephropathy from 1990 to 2015. We classified the biopsies using MEST-C score and we correlated the score to clinical evolution. We also calculated the risk of progression with the online IgANPC at the time of the biopsy.
ResultsWe analysed 48 biopsies, 83% of which were men with a mean age of 45 years at the time of the biopsy.
Patients with a biopsy E1 according to MEST-C score had a higher IgANPC score than those with E0 (P=.021).
The Pearson's correlation for the percentage of crescents and the IgANPC risk score was statistically significant (P=.014) with r=0.357.
The percentage of patients with eGFR above 30 ml/min at 10 years was 100% for the low-risk group (group 1 of IgANPC), and 0% for the high-risk group (group 3), log rank P=0.001.
The log rank comparison for variables of the MEST-C score, presented statistically significant results between E (0.036) and S (0.022) and the eGFR time<30 ml/min.
A statistically significant relationship was also observed between T1 and eGFR<30 ml/min.
The multivariate Cox regression analysis for IgANPC and eGFR<30 ml/min demonstrated a strong correlation (P=.016) between the risk group and eGFR <30 ml/min.
ConclusionIn our study population, the IgANPC predicts the time to eGFR<30 ml/min, and adds information independent of the MEST.
The MEST-C classification and IgANPC are useful and independent ÿolos for prognostic prediction, but more studies are needed to validate its use in the general population.
La glomerulonefritis por IgA, descrita por primera por Berger y Hinglais en 19681, inicialmente se describe como una enfermedad glomerular muy frecuente, y con un curso benigno2; a día de hoy sabemos que no es siempre así.
En la nefropatía por IgA el curso clínico puede ser en ocasiones indolente, pudiendo aparecer durante muchos años la hematuria como única manifestación de la enfermedad y sin progresión en el tiempo, pero un número no despreciable de pacientes, hasta el 40% en algunas series, progresan a lo largo de los años hacia una enfermedad renal crónica, llegando a precisar tratamiento sustitutivo renal tras décadas de presentar la nefropatía. En ocasiones, también se puede producir una enfermedad que progresa en meses o pocos años hacia la enfermedad renal terminal de una forma rápida3,4.
Dada esta variabilidad respecto a la progresión y el pronóstico, lo que inicialmente se consideraba una entidad benigna, con un excelente pronóstico, a día de hoy sabemos que no es así, siendo la causa glomerular primaria más frecuente de entrada en diálisis5,6.
Esta característica ha hecho que en los últimos años se hayan desarrollado diferentes herramientas pronósticas para predecir el riesgo de enfermedad renal terminal en los pacientes diagnosticados de nefropatía IgA7.
Dentro de estas estrategias, las que han demostrado mayor relación con la progresión son las basadas en la histología, como es la clasificación de Oxford/MEST score8, cumplimentada en los últimos años por la asociación de las semilunas (en inglés crescents) al score MEST, denominándose MEST-C9. Estas técnicas son invasivas, precisando de biopsia renal.
Recientemente, han aparecido herramientas clínicas no invasivas. Una de ellas es la calculadora de progresión de la nefropatía IgA (IgA nephropathy progression calculator [IgANPC])10, únicamente validada en la población china, que incluye 4 parámetros clínicos y analíticos al diagnóstico de la enfermedad.
No obstante, todavía no se dispone de una herramienta validada en la población general para predecir la progresión de esta entidad.
En nuestro estudio pretendemos analizar la capacidad de predicción de la IgANPC en nuestra población, así como su vínculo con la clasificación de MEST-C, relacionando las diferentes variables de MEST-C con esta calculadora.
Material y métodosEn los últimos 25 años hemos realizado en nuestro centro 866 biopsias de riñones propios. El área de referencia de nuestro hospital para las biopsias renales incluye en la actualidad toda la provincia de Cantabria y al Complejo Hospitalario Río Carrión de Palencia. Hace años incluía también el hospital el Bierzo en León, por lo que también hay un menor número de pacientes con IgA en nuestro estudio de estas regiones.
Se realiza un estudio retrospectivo seleccionando a todos los pacientes biopsiados desde el año 1990 hasta el año 2015; de estos, 108 pacientes tenían un diagnóstico de glomerulonefritis por IgA. Realizamos una recogida de datos analíticos, clínicos y demográficos, descartando aquellos pacientes con un seguimiento incompleto (17 pacientes seguimiento incompleto), aquellos menores de edad (11 de los pacientes biopsiados eran menores de 18 años) y aquellos que no se pudieran obtener los datos necesarios de su historia clínica (32 pacientes del hospital el Bierzo y Río Carrión sin suficientes datos clínicos). Para los datos de los pacientes de Palencia que sí tenían un seguimiento correcto, se contó con la colaboración del Servicio de Nefrología del Hospital Rio Carrión. En total analizamos a 48 pacientes.
Además de los datos demográficos relevantes, se recogieron los siguientes parámetros clínicos y bioquímicos en sangre y orina: edad, talla, peso, presión arterial sistólica (PAS) y diastólica, presencia o no de hematuria macroscópica, creatinina, CKD-EPI, albúmina sérica, ácido úrico, hemoglobina, proteinuria de 24 h, cociente proteínas/creatinina en micción aislada, hemoglobinuria y hematuria en el sedimento urinario, todo ello en el momento de la biopsia, a los 2años y al final del seguimiento o el momento de iniciar un tratamiento renal sustitutivo (ERCT). También se recogió el momento en el que caía el filtrado glomerular (FG) por debajo de 30ml/min o se doblaba la cifra de creatinina inicial.
Respecto a los datos anatomopatológicos, se recogieron: el número de glomérulos, el número de glomérulos esclerosados y las variables del MEST, así como el porcentaje de semilunas y la presencia de C4d y C3 por inmunofluorescencia.
Todas las biopsias fueron revisadas y reclasificadas cuando fue necesario, de acuerdo con los criterios de Oxford/MEST-C con ayuda del Servicio de Anatomía Patológica de nuestro centro.
Por otro lado, se calculó el riesgo de progresión mediante la calculadora online IgANPC (http://www.columbiamedicine.org/divisions/gharavi/calc_progression.php). Esta calculadora se basa en 4 parámetros, tanto clínicos como bioquímicos, en el momento de la biopsia. Los parámetros en los que se basa son: FG, hemoglobina sérica expresada en g/dl, albúmina sérica expresada en g/dl y PAS expresada en mmHg. Estos datos se recogen de la historia clínica del paciente el día de la realización de la biopsia renal. En función del valor obtenido, se clasifica a los pacientes en riesgo bajo (< –0,887), medio (entre –0,887 y 0,993) o alto (> 0,993), y se registra el valor del resultado de esta calculadora.
Análisis estadísticoLas variables continuas se describieron con la media ± desviación típica, y las variables cualitativas se expresaron con la frecuencia y el porcentaje.
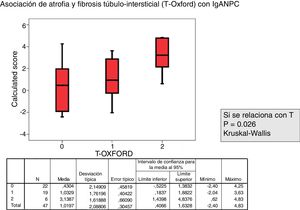
Para la comparación de los grupos del MEST-C score y el score IgANPC se utilizó la prueba de U de Mann-Whitney para variables cuantitativas. En el caso de la variable T (T0, T1 y T2 para definir el grado de fibrosis y atrofia túbulo-intersticial), se utilizó la prueba de Kruskal-Wallis.
El score de la IgANPC como variable continua se relacionó con el porcentaje de semilunas y con el número de glomérulos esclerosados mediante la prueba de correlación de Pearson.
Se aplicó la comparación de log rank para variables del MEST-C score y el tiempo a ERCT.
El análisis estadístico para relacionar las diferentes variables del MEST-C score con el tiempo a ERCT se realizó con la regresión de Cox.
Se realizaron curvas Kaplan-Meier para determinar la influencia del score en la progresión hacia ERCA (FG estimado [FGe] <30ml/min).
El paquete informático utilizado para el análisis será SPSS para Windows versión 15.0 (SPSS Inc., Chicago, IL, EE.UU.).
ResultadosEn nuestra serie de biopsias renales, la IgA constituye el 12% de las biopsias de riñones propios. La proporción hombres/mujeres fue del 83 y el 17%, respectivamente.
La edad media en el momento de la biopsia fue de 45,29 años, con una desviación típica de 20,8 años.
La cifra media de creatinina fue de 2mg/dl con un FGe 62,11±43,28ml/min (tabla 1).
Descripción de las características de la muestra
| Media | Mediana | Desv. típica | Mínimo | Máximo | Percentil 25 | Percentil 50 | Percentil 75 | |
|---|---|---|---|---|---|---|---|---|
| Edad (años) | 45,29 | 44,50 | 20,375 | 18 | 80 | 28,25 | 44,5 | 65,75 |
| N.° glom. | 15,36 | 15,00 | 8,719 | 2 | 38 | 8,00 | 15,00 | 20,00 |
| Glom. esclerosados | 2,26 | 1,00 | 2,641 | 0 | 12 | 0,00 | 1,00 | 3,00 |
| % semilunas | 11,45 | 0,00 | 20,487 | 0 | 78 | 0,00 | 0,00 | 14,00 |
| Creatinina Bx. (mg/dl) | 2,06 | 1,54 | 0,5291 | 0,50 | 7,80 | 0,90 | 1,54 | 2,90 |
| Albúmina sérica (g/dl) | 3,69 | 3,65 | 0,875 | 1,6 | 7,50 | 3,22 | 3,650 | 4,175 |
| FGe Bx. (ml/min) | 62,11 | 51,00 | 43,287 | 2,00 | 165 | 22 | 51,00 | 100,00 |
| PAS (mmHg) | 141 | 139 | 21,315 | 100 | 200 | 128 | 139 | 150 |
| PAD (mmHg) | 79,5 | 80 | 14,927 | 50 | 120 | 70 | 80 | 90 |
En función del score obtenido con la IgANPC, se clasificó a los pacientes en 3grupos de riesgo. En el grupo de riesgo bajo estaba el 25%, en el grupo de riesgo intermedio estaba el 27,1% y el 47,9%, en el grupo de riesgo alto.
El 100% de los pacientes clasificados en el grupo de riesgo bajo (grupo 1) de IgANPC mantienen un FGe> 30ml/min a los 10 años, mientras que solo el 68,6% tiene FGe> 30ml/min a los 10 años en el grupo de riesgo medio (grupo 2) y ninguno de los del grupo de riesgo alto (grupo 3) presenta un FGe> 30ml/min a los 10 años (p = 0.001) (fig. 1).
Tras reclasificar las biopsias mediante el MEST-C se aprecia una frecuencia de M1 del 83%, siendo E1 del 35%, S1 del 39,6% y T0 del 47,9%, T1 del 39,6% y T2 del 12,5%.
Se analizó la relación entre el valor de cada variable del MEST-C y la probabilidad de progresión calculada mediante la IgANPC, observando una concordancia entre pacientes con un score IgANPC alto y E1 estadísticamente significativa (p = 0,021). Así mismo encontramos relación entre el score y T (p = 0,026), a mayor score, mayor atrofia túbulo-intersticial (figs. 2 y 3).
El resto de las variables del MEST-C no se relacionaron de manera estadística con el score IgANPC.
Cuando analizamos la relación entre el porcentaje de semilunas y el score IgANPC mediante el estudio estadístico de correlación de Pearson, apreciamos un resultado estadísticamente significativo (p = 0,014) con r: 0,375. No se encontraron correlaciones estadísticamente significativas entre otras variables (fig. 4).
Cuando aplicamos la comparación de log rank para variables del MEST-C score, vemos resultados estadísticamente significativos entre E (0,036) y S (0,022), y el tiempo a ESRD.
El análisis estadístico con la regresión de Cox para ESRD es significativo (p = 0,028) entre IgANPC y ESRD, con una HR =1,864 (IC del 95%, 1,127-3,083). También se observa una relación estadísticamente significativa entre T1 y ESRD (HR = 4,465; IC del 95%, 1,179-16,905).
El análisis multivariante con la regresión de Cox para IgANPC y FGe <30ml/min muestra una fuerte correlación (p = 0,016) entre el grupo de riesgo y FGe <30ml/min (HR = 13,701; IC del 95%, 1,644-114,209).
Los pacientes con las variables histológicas de E y T más altas (los grupos del MEST de E1 y T2 y T3) mostraron un riesgo más elevado de alcanzar un FGe <30ml/min (p=0,016 y p=0,001, respectivamente).
El análisis multivariante de la regresión de Cox demostró que el score IgANPC se relaciona de forma independiente con un riesgo más alto de desarrollar un FGe <30ml/min (HR = 13,701; IC del 95%, 644-114,209; p=0,016).
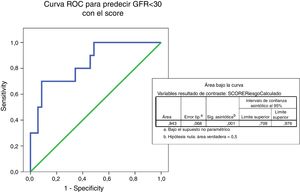
Mediante la curva ROC se determina la capacidad del IgANPC score para predecir la progresión a FGe <30, obteniendo un área bajo la curva de 0,843, lo que nos indica que el test es un buen predictor (entre 0,75-0,90) de evolución hacia ERCA (fig. 5)
Discusión y conclusionesLa glomerulonefritis por IgA es una entidad infradiagnosticada, y muy heterogénea en su evolución. Los factores que más intensamente se han relacionado con la progresión hacia la ERCT son la aparición de proteinuria mayor de 1.000mg/24h de forma persistente, la presencia de hipertensión (PA>140/90mmHg) y la elevación de la creatinina plasmática11-14, siendo los pacientes que combinan la elevación de creatinina y la proteinuria los que más riesgo tienen de progresión, presentando ERCT aproximadamente el 15-25% de los pacientes tras 10 años, y el 20-30% de los pacientes tras 20 años de seguimiento15-18. También se ha relacionado la persistencia de hematuria con peor pronóstico en diferentes trabajos19-23.
Existen evidencias en la actualidad de que muchos pacientes con glomerulonefritis por IgA presentan una glucosilación deficitaria en la molécula de IgA1 y parece que esta alteración puede ser un actor importante en la génesis de esta entidad24-31.
Yanagawa et al. demostraron que la determinación de IgG anti-IgA galactosil-deficiente tenía un área bajo la curva ROC de 0,813 para discriminar la nefropatía IgA de otras enfermedades renales crónicas de causa autoinmune32. Recientemente, también se ha relacionado la IgA galactosil-deficiente con el pronóstico renal en pacientes con NIgA33-35.
Distintos grupos han utilizado estos marcadores serológicos para valorar la actividad de la enfermedad y su respuesta a distintos tratamientos. Berthelot et al. demostraron que medir IgA1 galactosil-deficiente, IgG anti-IgA galactosil-deficiente y el complejo CD89-IgA soluble predice la recurrencia tras el trasplante renal36. Otros grupos han observado que el tratamiento con esteroides reduce los niveles de IgA1 galactosil-deficiente, mientras que el uso de rituximab no disminuye los niveles de IgA1 galactosil-deficiente e IgG anti-IgA galactosil-deficiente, lo que podría explicar su falta de eficacia para tratar la nefropatía IgA37,38. La posibilidad de disponer de un futuro tratamiento de la nefropatía IgA que se vislumbra en algunos modelos animales mediante la proteasa recombinante de IgA1 hace que disponer de estos marcadores serológicos mínimamente invasivos para monitorizar esta nefropatía sea del máximo interés39.
Dada la gran frecuencia de diagnóstico de nefropatía IgA es necesario disponer de herramientas que permitan conocer de la forma más acertada posible, y menos invasiva, la probabilidad de progresión de esta enfermedad hacia la ERCT para facilitar la labor del médico a la hora de seleccionar a aquellos pacientes susceptibles de tratar y también para dar una información lo más exacta posible al paciente respecto a su pronóstico en el momento del diagnóstico.
En este sentido, las herramientas pronósticas disponibles en la actualidad son claramente insuficientes y toda aportación es bienvenida.
En nuestro trabajo, no hemos analizado directamente los valores clásicos que se han relacionado con progresión, aunque la creatinina y la hipertensión están incluidos en la IgANPC, ya que el cálculo lo realiza en función del FGe, PAS, albúmina y hemoglobina sérica.
Respecto a la proteinuria, hematuria persistente y otros marcadores que clásicamente se han asociado al pronóstico y al MEST40-42, no ha sido materia de análisis en este trabajo.
En el 2014 se publica un trabajo realizado por el grupo VALIGA de la ERA-EDTA firmado por Coppo et al. en Kidney International, donde entre otras cosas se relacionan las diferentes variables del MEST con el pronóstico.
En dicho trabajo se relaciona un mayor valor de las variables M, S y T con un peor pronóstico, y esta asociación es independiente de otras variables. Cuando relacionan los cambios histológicos del MEST con variables clínicas como la proteinuria, la capacidad pronóstica del test aumenta significativamente en el grupo de pacientes no tratados41.
Nosotros hemos demostrado en nuestra población que la IgANPC es una herramienta adecuada para predecir el tiempo hasta FGe <30ml/min, y añade información pronóstica independiente del MEST-C. Además, es una herramienta no invasiva que, a diferencia del MEST-C, no precisa de una biopsia renal para su cálculo. También nos permite dar cifras pronósticas concretas respecto al riesgo de desarrollar ERCT o la necesidad de tratamiento sustitutivo renal, al expresar su resultado en un porcentaje. Esto último permite al clínico informar al paciente de una forma más clara y entendible sobre el pronóstico de su enfermedad, avalándolo una herramienta estandarizada y no únicamente su experiencia profesional.
En los últimos años, se ha optimizado la clasificación de MEST añadiendo el porcentaje de semilunas a este score9. En nuestro estudio se confirma lo acertado de esta decisión, ya que relacionamos el grupo de alto riesgo de progresión con un mayor porcentaje de lesiones con proliferación extracapilar en la biopsia.
Podemos concluir que la clasificación de MEST-C score y el IgANPC score son herramientas útiles e independientes para la predicción pronóstica, queda validar su uso en la población general y relacionarlas con los marcadores serológicos disponibles.
Limitaciones del estudioPrimera, este estudio es un análisis retrospectivo, con los sesgos inherentes a ellos. Sin embargo, es el primer estudio en evaluar y relacionar IgANPC y MEST-C score en nuestra población. Segunda, el número de pacientes analizados es bajo, por lo que los resultados estadísticos obtenidos están limitados a esto. Tercera, nuestros datos se refieren a la población de Cantabria y Palencia, por lo tanto, no pueden ser completamente extrapolables a otras áreas geográficas. Cuarta, el seguimiento clínico de los pacientes fue muy dispar en el tiempo (con una dispersión de 2 años el que menos seguimiento tenía, y 22 años el que más), lo que puede estar relacionado con la ausencia de diferencias en las variables de valoración clínica entre los grupos de estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.