Los pacientes con enfermedad renal crónica (ERC) tienen un alto riesgo de desarrollo de hiperkaliemia (HK). La relación entre HK y una mala evolución (mortalidad o progresión de la insuficiencia renal) en la ERC avanzada es controvertida.
ObjetivosDeterminar la incidencia, prevalencia, y factores relacionados con la HK en una cohorte de pacientes con ERC, y su relación con la mortalidad, tasa de hospitalización, progresión de la ERC, y necesidad de inicio de diálisis.
Material y métodosEstudio retrospectivo de observación en una cohorte de pacientes adultos con ERC estadio 4-5. Los criterios de inclusión fueron: tener al menos 3 medidas consecutivas de filtrado glomerular (FG) durante un periodo superior a 3 meses. HK se definió como un K sérico ≥ 5,5 mmol/l. La asociación entre HK y las variables de evolución fue ajustada a los principales factores de confusión mediante análisis mutivariantes.
ResultadosSe incluyeron 1079 pacientes (574 hombres, edad media: 65 ± 14 años) con un FG basal 14,8 ± 4,5 ml/min/1,73 m2. El tiempo medio de seguimiento fue de 15 meses y se determinaron una mediana de 7 muestras por paciente. Basalmente un 26% de pacientes tenía HK, un 68% en al menos una muestra durante el periodo individual de seguimiento, y un 33% de forma crónica (HK > 50% del seguimiento individual). Mediante regresión logística multivariable los mejores determinantes de la HK fueron: sexo masculino (OR = 1,529; IC 95% [1,154-2,025], p = 0,003), bicarbonato sérico (OR = 0,863, [0,829-0,900], p < 0,0001), tratamiento diurético (OR = 0,743, [0,556-0,992], p = 0,044), y tratamiento con inhibidores del sistema renina-angiotensina (OR = 4,412, [2,915-6,678], p < 0,0001). Estos pacientes con HK mostraron una progresión de la ERC significativamente más acelerada (−4,05 ± 5,22 vs. −2,69 ± 5,61 ml/min/1,73 m2/año, p < 0,0001), e inicio más frecuente de diálisis (63% vs. 57%, p = 0,115), pero menos mortalidad (9% vs. 17%, p = 0,003), y tasa de hospitalización (2,68 ± 5,94 vs. 3,16 ± 6,77 días/año, p = 0,301) que el resto de los pacientes estudiados. Sin embargo en el análisis multivariante, HK no se asoció de forma independiente con ninguna de las variables de evolución investigadas.
ConclusiónHK es un hallazgo bioquímico muy frecuente en la ERC avanzada, que se asocia con algunos medicamentos de uso habitual. Sin embargo, HK no se asocia de forma independiente con ninguna de las variables de mala evolución clínica estudiadas.
Patients with advanced chronic kidney disease (CKD) are at greatest risk of hyperkalemia (HK). The relationship between HK and negative outcomes (mortality or progression of renal insufficiency) in non-dialysis dependent CKD patients is controversial.
AimsTo determine the incidence, prevalence, and factors related with HK in a cohort of CKD patients, and its relationship with mortality, hospitalization rate, CKD progression, and dialysis initiation.
Material and methodsA retrospective, observational study in an incident cohort of adult patients with stage 4 or 5 CKD not on dialysis. Inclusion criteria were: having at least three consecutive estimated glomerular filtration rate (eGFR) measurements in a follow-up period >3 months. Decline in renal function was estimated as the slope of the individual linear regression line of eGFR over follow-up time. HK was defined as serum K levels ≥5.5 meq/l. Associations of HK with outcomes were adjusted for major confounding variables in the multivariate analysis.
ResultsThe study group consisted of 1079 patients (574 males, mean age: 65±14 years) with mean baseline eGFR 14.8±4.5 ml/min/1,73 m2. Mean follow-up time was 15 months with a median of 7 serum sample determinations per patient. HK was observed at baseline in 26% of patients; in at least one serum sample during the individual follow-up period in 68%; or chronically (>50% of samples) in 33% of patients. By multivariate logistic regression, the best determinants of chronic HK were: male sex (OR = 1.529; 95% CI [1.154-2.025], p = .003), serum bicarbonate (OR = 0.863 [0.829-0.900], p <.0001), diuretic treatment (OR = 0.743 [0.556-0.992], p = .044), and angiotensin converting enzyme inhibitor and/or angiotensin receptor blockers (OR = 4.412 [2.915-6.678], p <.0001). Patients whose serum K levels were in the upper quartile showed a significantly faster CKD progression (−4.05±5.22 vs. −2.69±5.61 ml/min/1.73 m2/year, p <.0001), and more frequent dialysis initiation (63% vs. 57%, p = .115), though lower mortality (9% vs. 17%, p = .003) and hospitalization rates (2.68±5.94 vs. 3.16±6.77 days per year, p = .301) than the other study patients. However, in the multivariate analysis, average serum K levels were not independently associated with the clinical outcomes investigated.
ConclusionHK is a common biochemical finding in non-dialysis dependent CKD patients, mainly associated with prescribed medication. However, HK was not independently associated with major negative clinical outcomes.
La hiperkaliemia (HK) es una alteración electrolítica muy frecuente en la insuficiencia renal1–6.
Debido a la frecuente asociación entre HK y efectos adversos graves, incluso letales, existe en la práctica clínica un temor casi atávico a este desorden iónico, que impone de forma habitual la necesidad de corregirlo sin tener en cuenta otras circunstancias y valoraciones7.
Los pacientes con enfermedad renal crónica (ERC) suelen presentar elevaciones leve-moderadas y persistentes de los niveles de potasio sérico. La asociación entre este tipo de HK y desarrollo de efectos adversos graves o una mala evolución clínica en la ERC es, sin embargo, controvertida4–17. Además, los fármacos que se utilizan para tratar actualmente la HK18,19 o la suspensión de medicamentos relacionados con su desarrollo7,8,20–25 pueden provocar otras complicaciones, lo que añadiría confusión a la relación entre HK y evolución clínica.
Nuestra prolongada experiencia en moderar la importancia de la HK en la ERC avanzada evitando de esta forma restricciones dietéticas severas, no prescribiendo fármacos para su tratamiento específico como las resinas de intercambio catiónico o la fludrocortisona, que suelen ser mal toleradas y pueden causar efectos adversos potencialmente graves, y manteniendo fármacos como los inhibidores del sistema renina-angiotensina, nos ha permitido reunir una cohorte de numerosos pacientes en los que analizar los efectos adversos y evolución asociados a esta alteración electrolítica, precaviendo algunos factores importantes de confusión.
Así, los objetivos del presente estudio fueron: determinar la incidencia, prevalencia, y factores relacionados con la HK en una cohorte de pacientes con ERC, y su relación con la mortalidad, tasa de hospitalización, progresión de la ERC, y necesidad de inicio de diálisis.
Material y métodosEstudio retrospectivo de observación longitudinal en una cohorte de pacientes adultos diagnosticados de ERC estadios 4-5 no en diálisis, seguidos en la consulta de ERC avanzada (ERCA) durante el periodo comprendido entre enero de 2000 y diciembre 2016. Los criterios de selección fueron: haber sido seguidos en la consulta ERCA durante un periodo superior a 3 meses y haber realizado durante este tiempo al menos 3 mediciones de la función renal, potasio sérico y resto de los parámetros bioquímicos de interés.
Todos los pacientes fueron remitidos a la consulta ERCA por deterioro progresivo de la función renal. Los datos demográficos, clínicos, y medicación prescrita se obtuvieron de las historias clínicas, exploración física y anamnesis. La comorbilidad fue evaluada en el momento de la inclusión, utilizando el índice de Davies26, y los pacientes fueron categorizados en tres grupos: sin comorbilidad, leve-moderada, o grave.
Todas las muestras y análisis bioquímicos se extrajeron y realizaron en un mismo laboratorio central (Servicio de Análisis Clínicos del Hospital Infanta Cristina) por métodos convencionales (Autoanalizador Advia Chemistry, Siemens Healthcare Diagnostics, New York, EE. UU.), en muestras frescas (no almacenadas), y tanto las calibraciones y trazabilidad de la creatinina se realizaron conforme a las recomendaciones de estándares internacionales NKDEP27. El filtrado glomerular fue estimado mediante la fórmula abreviada MDRD28.
La medición de la concentración de K fue en suero, no en plasma. Para detectar posibles interferencias y errores en la medición del K sérico se realizó revisión sistemática mediante índice hemolítico, y todas las muestras con un valor considerado como de interferencia significativa (índice hemolítico > 40) fueron descartadas. En caso de aumento patológico del número de elementos formes de la sangre (policitemia o trombocitosis,) se midieron también los niveles de K en plasma, y se investigó la existencia de seudohiperkaliemia mediante el cálculo de la diferencia entre K sérico y K en plasma.
Los pacientes fueron seguidos de forma ininterrumpida con revisiones entre cada 30 a 90 días. Para determinar la velocidad de progresión de la ERC se realizó en cada paciente una regresión lineal entre el filtrado glomerular estimado en cada control y el tiempo transcurrido desde la primera cita, con una precisión de días. La pendiente resultante de esta ecuación lineal se expresó en ± ml/min/1,73 m2/año, teniendo los valores negativos o positivos de este parámetro los significados de progresión de la insuficiencia renal o recuperación de la función renal basal, respectivamente.
Las alteraciones electrolíticas en todos los pacientes incluidos en este estudio se trataron de forma uniforme con medidas que consistieron en: no restricción de frutas ni vegetales frescos salvo HK grave (K sérico ≥ 6,5 mmol/l), intento de corrección de la acidosis metabólica con bicarbonato sódico oral, no prescripción en ningún caso de resinas de intercambio catiónico o fludrocortisona, restricción o suspensión inmediata de digoxina, antiinflamatorios no esteroideos y antagonistas receptores mineralocorticoides (espironolactona, eplerenona), no suspensión de inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas receptores angiotensina (ARA) ni prescripción de diuréticos por motivo exclusivo de la HK.
Diseño del estudio y métodos estadísticosEstudio retrospectivo de observación longitudinal en una cohorte de pacientes con ERC avanzada. En cada paciente se recogieron todas las mediciones de potasio (K) sérico obtenidas durante su seguimiento. Se consideró HK a una concentración de K ≥ 5,5 mmol/l. Se definió como HK crónica cuando el porcentaje total de concentraciones de K ≥ 5,5 mmol/l observadas durante cada seguimiento individual fue igual o superior al 50%.
Las variables resultado analizadas en este estudio fueron: muerte por cualquier causa antes del inicio del tratamiento sustitutivo renal, inicio de diálisis, tasa de ingresos hospitalarios (como índice subrogado de morbilidad), y velocidad de progresión de la ERC (pendiente de la relación filtrado glomerular/tiempo).
Los determinantes de HK se analizaron mediante regresión logística multivariante, incluyendo como variables dependientes los siguientes parámetros clínicos y bioquímicos de relevancia: edad, sexo, índice de masa corporal, fumador activo, diabetes mellitus, presión arterial sistólica y diastólica, filtrado glomerular, proteinuria, bicarbonato sérico, tratamiento con diuréticos, inhibidores SRAA, betabloqueantes, antagonistas de los canales de calcio.
De forma univariable se analizó la asociación entre cuartiles de la frecuencia de distribución del promedio de K sérico durante el tiempo de seguimiento con la mortalidad e inicio de diálisis mediante curvas de Kaplan-Meier. El valor predictivo de la HK sobre la progresión de la ERC, tiempo hasta el inicio de diálisis o mortalidad fueron analizadas mediante regresión lineal multivariante y regresión de riesgo proporcional de Cox, respectivamente, junto a las variables mostradas como determinantes de la HK, añadiendo el índice de comorbilidad. Los pacientes fueron censurados en el momento del fallecimiento, la pérdida del seguimiento, inicio de diálisis, o final del seguimiento (1 mayo 2017), cualquiera de los cuales ocurriera antes.
La elección de las variables independientes en los modelos multivariantes se realizó de forma automática mediante el proceso de eliminación progresiva condicional hacia atrás.
En el análisis de los determinantes de la velocidad de progresión de la ERC se excluyeron a pacientes que, aun teniendo un deterioro avanzado de la función renal, estaban siendo tratados de forma específica por una glomerulonefritis o vasculitis.
Para la comparación descriptiva de las variables continuas y dependiendo de sus características se utilizaron pruebas paramétricas o no paramétricas, y para las variables categóricas se utilizó la prueba chi cuadrado.
Los datos estadísticos descriptivos se presentan como media y desviación estándar, o como mediana y rangos intercuartiles para las variables continuas, y como porcentajes para las variables categóricas. Una p < 0,05 fue considerada estadísticamente significativa, y todos los valores de p que se muestran son bilaterales. Los análisis estadísticos se realizaron con el software IBM SPSS Statistics 24.0 (IBM Corp. Armonk, EE. UU.).
ResultadosDurante el periodo de estudio se atendieron un total de 1580 pacientes incidentes en la consulta ERCA. Se incluyeron en el estudio 1079 pacientes (68% del total de pacientes). La causa de exclusión del estudio fue no haber completado al menos 3 meses de seguimiento en esta consulta debido a necesidad de inicio de diálisis (remisión tardía) en 463 casos, mortalidad precoz en 16 pacientes, recuperación función renal en 16 pacientes y pérdida de seguimiento en 6 pacientes.
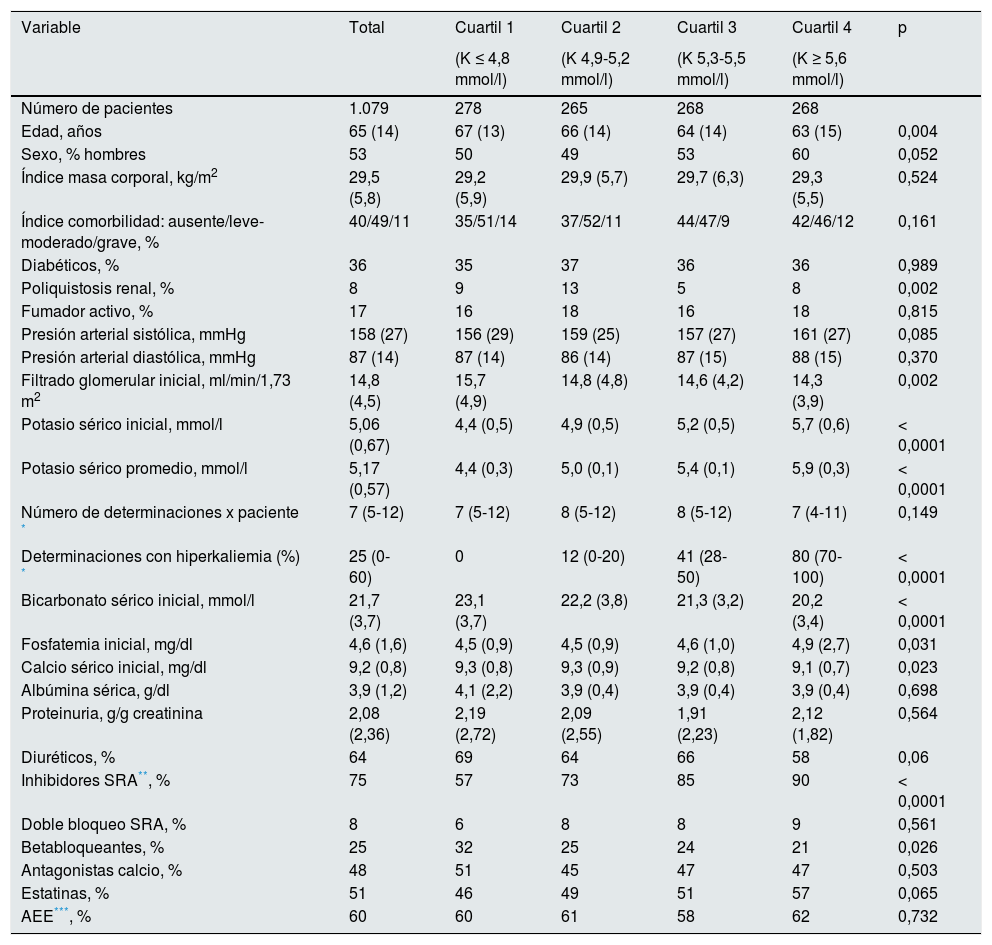
Las características demográficas, clínicas y bioquímicas de los pacientes incluidos en el estudio se detallan en la tabla 1.
Características del total de pacientes incluidos en el estudio y diferencias según cuartiles de niveles de K sérico promedio
| Variable | Total | Cuartil 1 | Cuartil 2 | Cuartil 3 | Cuartil 4 | p |
|---|---|---|---|---|---|---|
| (K ≤ 4,8 mmol/l) | (K 4,9-5,2 mmol/l) | (K 5,3-5,5 mmol/l) | (K ≥ 5,6 mmol/l) | |||
| Número de pacientes | 1.079 | 278 | 265 | 268 | 268 | |
| Edad, años | 65 (14) | 67 (13) | 66 (14) | 64 (14) | 63 (15) | 0,004 |
| Sexo, % hombres | 53 | 50 | 49 | 53 | 60 | 0,052 |
| Índice masa corporal, kg/m2 | 29,5 (5,8) | 29,2 (5,9) | 29,9 (5,7) | 29,7 (6,3) | 29,3 (5,5) | 0,524 |
| Índice comorbilidad: ausente/leve-moderado/grave, % | 40/49/11 | 35/51/14 | 37/52/11 | 44/47/9 | 42/46/12 | 0,161 |
| Diabéticos, % | 36 | 35 | 37 | 36 | 36 | 0,989 |
| Poliquistosis renal, % | 8 | 9 | 13 | 5 | 8 | 0,002 |
| Fumador activo, % | 17 | 16 | 18 | 16 | 18 | 0,815 |
| Presión arterial sistólica, mmHg | 158 (27) | 156 (29) | 159 (25) | 157 (27) | 161 (27) | 0,085 |
| Presión arterial diastólica, mmHg | 87 (14) | 87 (14) | 86 (14) | 87 (15) | 88 (15) | 0,370 |
| Filtrado glomerular inicial, ml/min/1,73 m2 | 14,8 (4,5) | 15,7 (4,9) | 14,8 (4,8) | 14,6 (4,2) | 14,3 (3,9) | 0,002 |
| Potasio sérico inicial, mmol/l | 5,06 (0,67) | 4,4 (0,5) | 4,9 (0,5) | 5,2 (0,5) | 5,7 (0,6) | < 0,0001 |
| Potasio sérico promedio, mmol/l | 5,17 (0,57) | 4,4 (0,3) | 5,0 (0,1) | 5,4 (0,1) | 5,9 (0,3) | < 0,0001 |
| Número de determinaciones x paciente * | 7 (5-12) | 7 (5-12) | 8 (5-12) | 8 (5-12) | 7 (4-11) | 0,149 |
| Determinaciones con hiperkaliemia (%) * | 25 (0-60) | 0 | 12 (0-20) | 41 (28-50) | 80 (70-100) | < 0,0001 |
| Bicarbonato sérico inicial, mmol/l | 21,7 (3,7) | 23,1 (3,7) | 22,2 (3,8) | 21,3 (3,2) | 20,2 (3,4) | < 0,0001 |
| Fosfatemia inicial, mg/dl | 4,6 (1,6) | 4,5 (0,9) | 4,5 (0,9) | 4,6 (1,0) | 4,9 (2,7) | 0,031 |
| Calcio sérico inicial, mg/dl | 9,2 (0,8) | 9,3 (0,8) | 9,3 (0,9) | 9,2 (0,8) | 9,1 (0,7) | 0,023 |
| Albúmina sérica, g/dl | 3,9 (1,2) | 4,1 (2,2) | 3,9 (0,4) | 3,9 (0,4) | 3,9 (0,4) | 0,698 |
| Proteinuria, g/g creatinina | 2,08 (2,36) | 2,19 (2,72) | 2,09 (2,55) | 1,91 (2,23) | 2,12 (1,82) | 0,564 |
| Diuréticos, % | 64 | 69 | 64 | 66 | 58 | 0,06 |
| Inhibidores SRA**, % | 75 | 57 | 73 | 85 | 90 | < 0,0001 |
| Doble bloqueo SRA, % | 8 | 6 | 8 | 8 | 9 | 0,561 |
| Betabloqueantes, % | 25 | 32 | 25 | 24 | 21 | 0,026 |
| Antagonistas calcio, % | 48 | 51 | 45 | 47 | 47 | 0,503 |
| Estatinas, % | 51 | 46 | 49 | 51 | 57 | 0,065 |
| AEE***, % | 60 | 60 | 61 | 58 | 62 | 0,732 |
En total se recogieron 9990 mediciones de K sérico (mediana: 7 determinaciones por pacientes), con un tiempo de seguimiento individual (mediana) de 15,4 meses (rangos IQ: 8,2-27,3 meses).
La prevalencia de HK en la primera determinación basal fue del 26% (283 pacientes), HK en al menos una determinación a lo largo de su seguimiento individual un 68% (732 pacientes), y HK crónica en un 33% (356 pacientes).
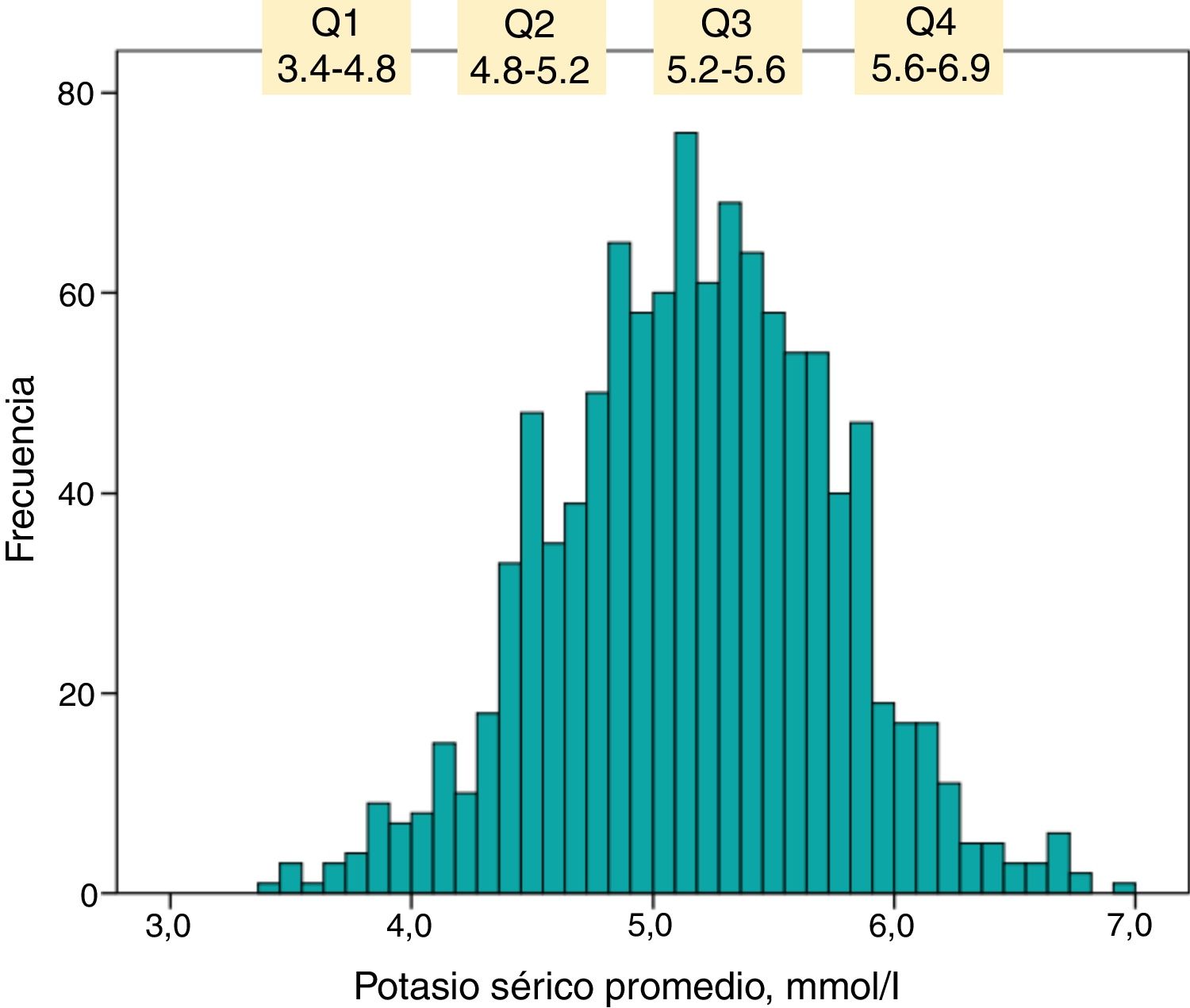
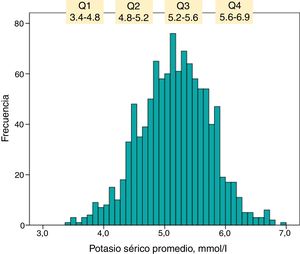
La frecuencia de distribución de los valores de K sérico promediado en cada seguimiento individual se representa en el histograma de la figura 1. El cuartil superior estaba formado por los pacientes que mantuvieron un K sérico promedio a lo largo del seguimiento ≥ 5,6 mmol/l.
El número de pacientes con K sérico ≥ 6 mmol/l fue de 100, de los cuales 34 tenían niveles de K sérico ≥ 6,5 mmol/l.
Las características clínicas y bioquímicas de los pacientes según los cuartiles de K sérico promedio se muestran en la tabla 1.
Los pacientes que presentaron HK se caracterizaron por ser con más frecuencia varones, más jóvenes, con una función renal basal ligeramente más reducida, más acidosis metabólica, tratados en un 90% de los casos con inhibidores del sistema renina-angiotensina (iSRA) (tabla 1).
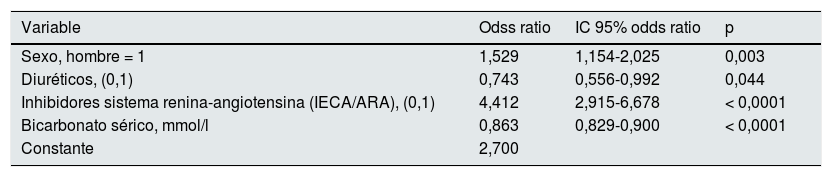
Por regresión logística multivariante, los principales determinantes de HK fueron: el sexo masculino, el tratamiento con diuréticos e iSRA, y la concentración de bicarbonato sérico basal (tabla 2).
Modelo de regresión logística multivariante* sobre los determinantes de la hiperkaliemia
| Variable | Odss ratio | IC 95% odds ratio | p |
|---|---|---|---|
| Sexo, hombre = 1 | 1,529 | 1,154-2,025 | 0,003 |
| Diuréticos, (0,1) | 0,743 | 0,556-0,992 | 0,044 |
| Inhibidores sistema renina-angiotensina (IECA/ARA), (0,1) | 4,412 | 2,915-6,678 | < 0,0001 |
| Bicarbonato sérico, mmol/l | 0,863 | 0,829-0,900 | < 0,0001 |
| Constante | 2,700 |
Selección de variable automática condicional hacia atrás.
Fuera de la mejor ecuación predictiva: edad, índice comorbilidad, índice masa corporal, presión arterial sistólica, presión arterial diastólica, fósforo sérico, filtrado glomerular basal, proteinuria, diabetes, betabloqueantes, antagonistas canales calcio, doble bloqueo sistema renina-angiotensina, agentes estimulantes eritropoyesis, estatina.
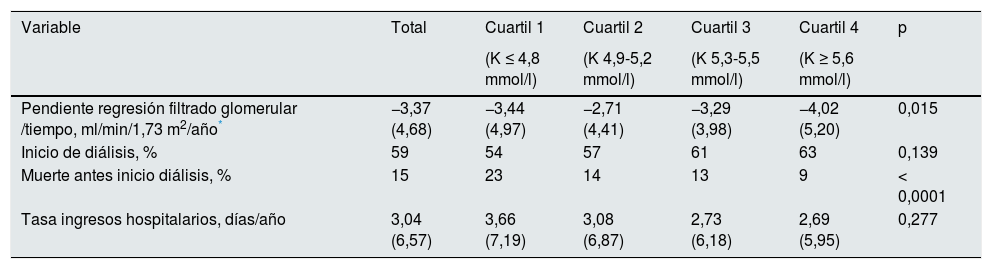
En la tabla 3 se muestran las variables resultado en el grupo total y según los cuartiles de K sérico promedio.
Variables resultado en el grupo total y según cuartiles de potasio sérico promedio
| Variable | Total | Cuartil 1 | Cuartil 2 | Cuartil 3 | Cuartil 4 | p |
|---|---|---|---|---|---|---|
| (K ≤ 4,8 mmol/l) | (K 4,9-5,2 mmol/l) | (K 5,3-5,5 mmol/l) | (K ≥ 5,6 mmol/l) | |||
| Pendiente regresión filtrado glomerular /tiempo, ml/min/1,73 m2/año* | −3,37 (4,68) | −3,44 (4,97) | −2,71 (4,41) | −3,29 (3,98) | −4,02 (5,20) | 0,015 |
| Inicio de diálisis, % | 59 | 54 | 57 | 61 | 63 | 0,139 |
| Muerte antes inicio diálisis, % | 15 | 23 | 14 | 13 | 9 | < 0,0001 |
| Tasa ingresos hospitalarios, días/año | 3,04 (6,57) | 3,66 (7,19) | 3,08 (6,87) | 2,73 (6,18) | 2,69 (5,95) | 0,277 |
Los pacientes en el cuartil superior de K sérico mostraron una progresión más acelerada de la ERC, y una mayor frecuencia, aunque no estadísticamente significativa, de necesidad de inicio de diálisis que en el resto de los pacientes. Sin embargo, tanto el porcentaje de fallecimientos en estadio prediálisis como la tasa de ingresos hospitalarios fueron más altas en el cuartil inferior de K sérico.
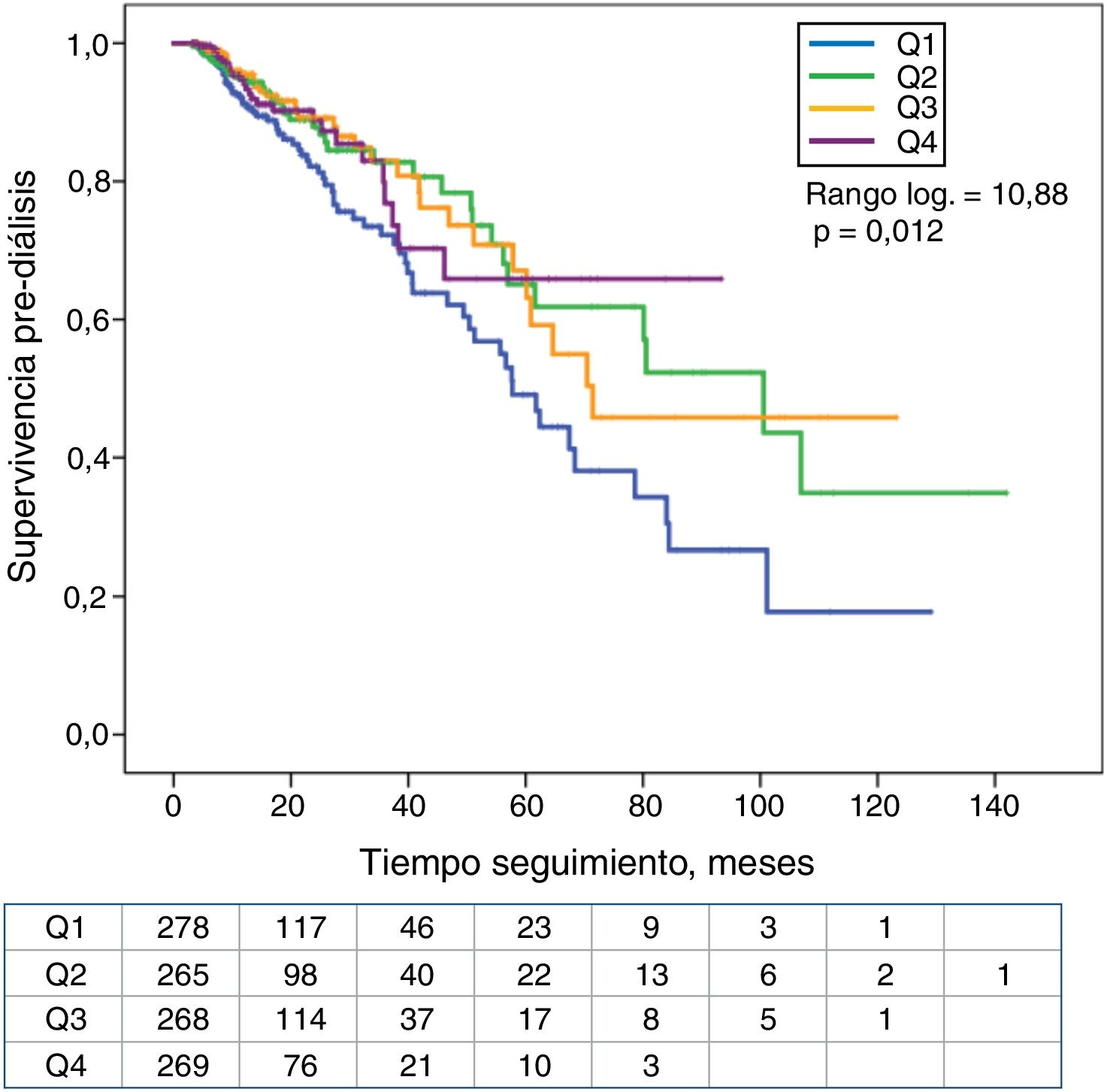
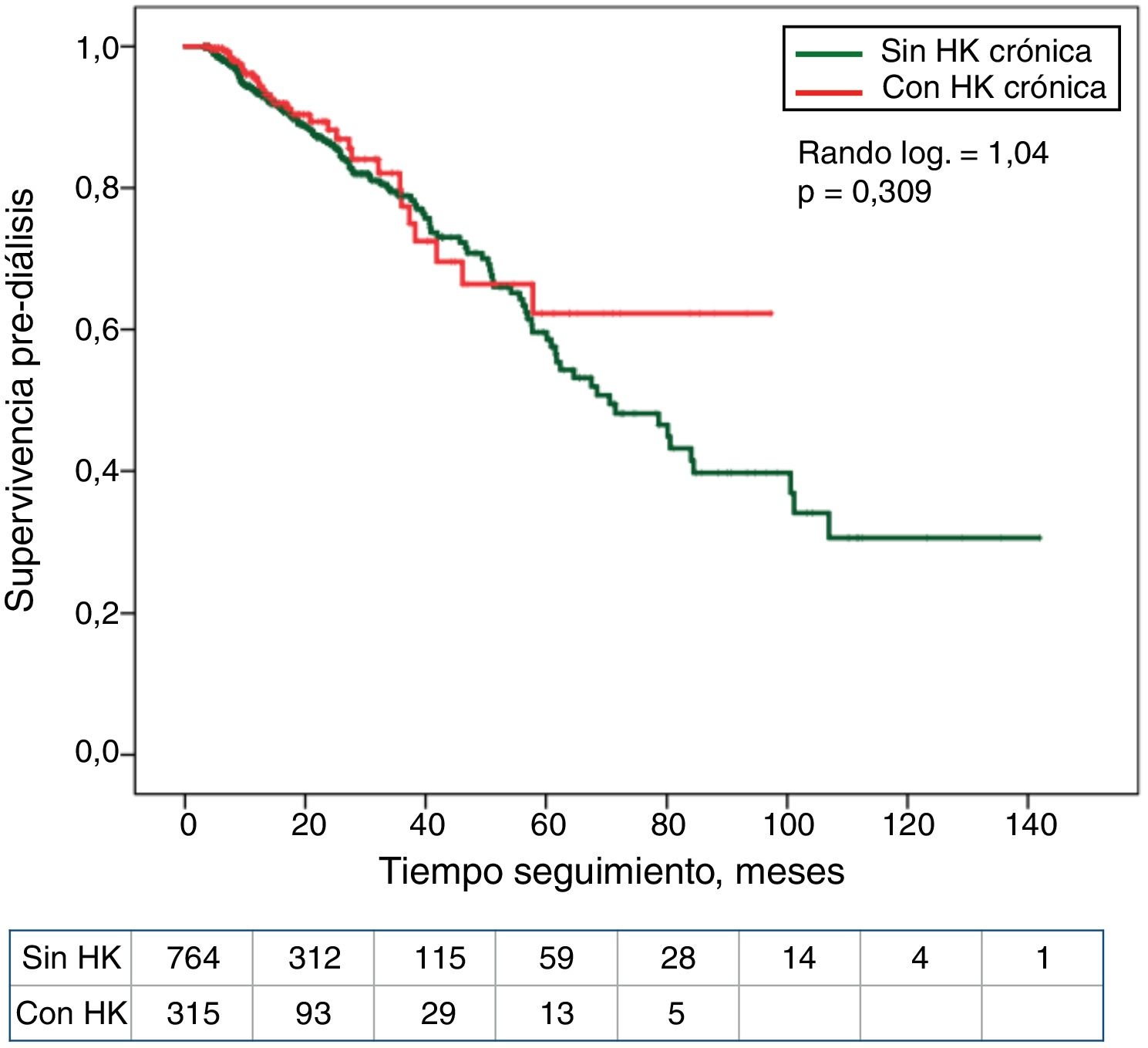
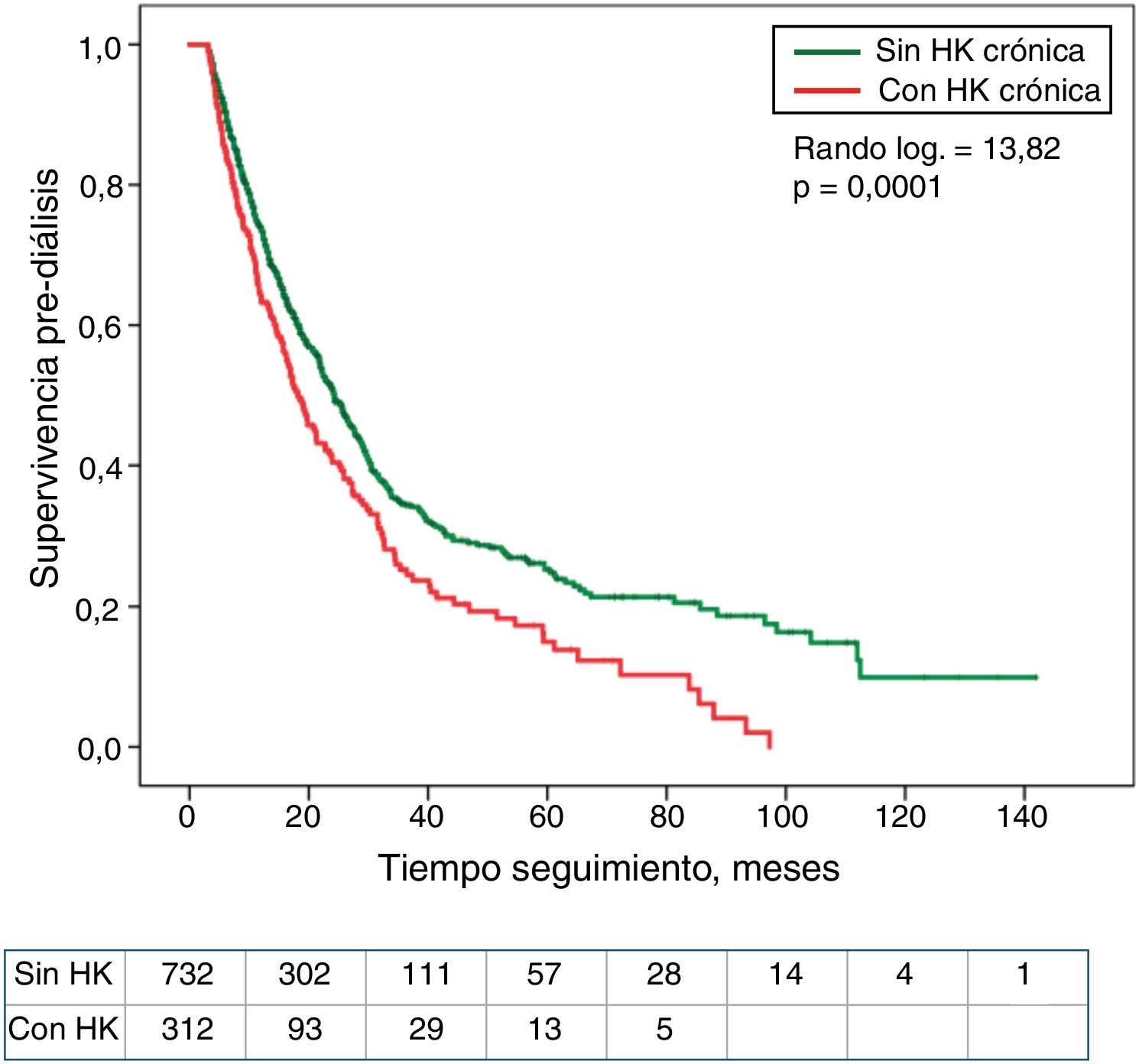
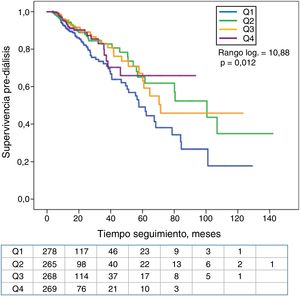
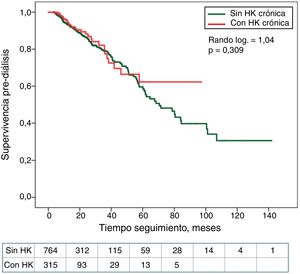
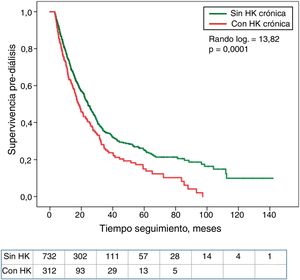
La asociación entre los cuartiles de K sérico o el diagnóstico de HK con el tiempo hasta el fallecimiento o el inicio de diálisis se muestran en las curvas de Kaplan-Meier (fig. 2). Los pacientes en el cuartil inferior de K sérico mostraron la peor supervivencia. En cambio, no se observaron diferencias significativas en la mortalidad de los pacientes con o sin HK (fig. 3).
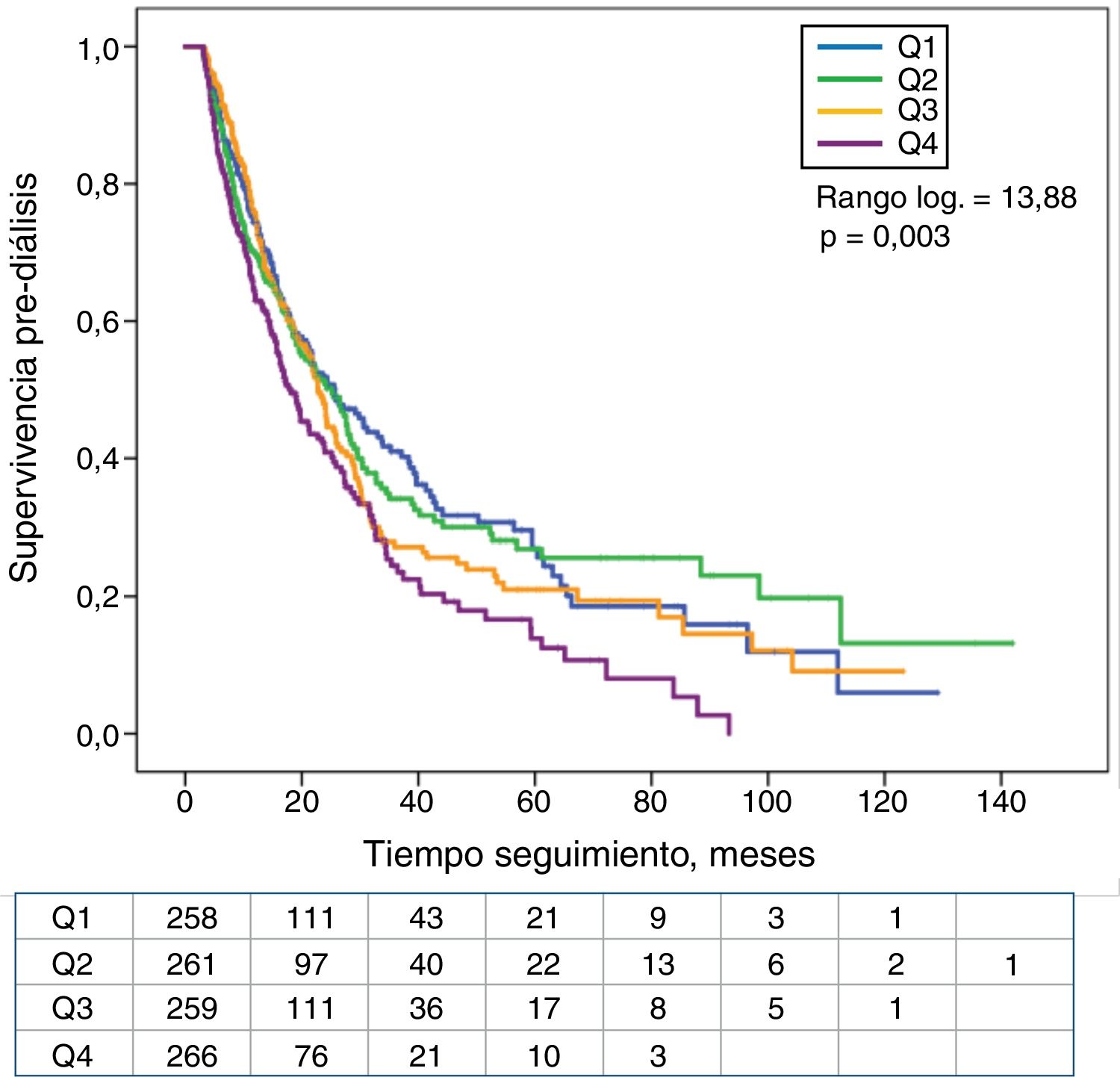
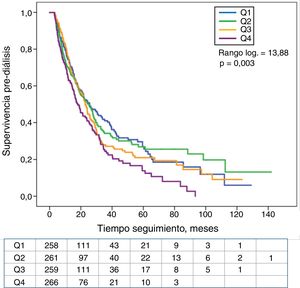
Los pacientes en el cuartil superior de K sérico mostraron una menor supervivencia sin diálisis que el resto de pacientes (fig. 4). También los que tenían HK necesitaron diálisis de forma significativamente más precoz que el resto de los pacientes (fig. 5).
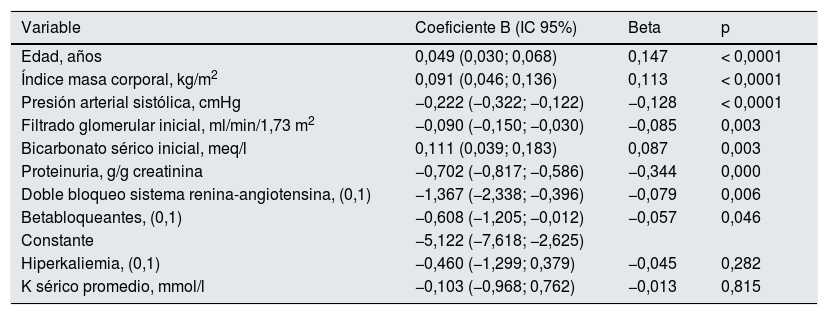
Mediante regresión logística multivariante se analizó la asociación de la HK con la velocidad de progresión de la ERC, ajustando este resultado a variables de confusión. En la tabla 4 se muestran los resultados de los determinantes de la mejor ecuación de asociación con la tasa de descenso del filtrado glomerular, entre los que no se encontraban ni las concentraciones promedio de K sérico (variable continua) ni la HK (variable discreta). Tampoco estas dos variables se asociaron de forma independiente con el cociente de riesgo instantáneo («hazard ratio») de inicio de diálisis, analizado mediante regresión de Cox, ni con una mayor tasa de ingresos anuales como se detalla en la tabla 5.
Regresión lineal multivariante sobre la progresión de la ERC (pendiente relación filtrado glomerular/tiempo). Mejor modelo predictivo y valor específico de la hiperkaliemia (fuera de la mejor ecuación)
| Variable | Coeficiente B (IC 95%) | Beta | p |
|---|---|---|---|
| Edad, años | 0,049 (0,030; 0,068) | 0,147 | < 0,0001 |
| Índice masa corporal, kg/m2 | 0,091 (0,046; 0,136) | 0,113 | < 0,0001 |
| Presión arterial sistólica, cmHg | −0,222 (−0,322; −0,122) | −0,128 | < 0,0001 |
| Filtrado glomerular inicial, ml/min/1,73 m2 | −0,090 (−0,150; −0,030) | −0,085 | 0,003 |
| Bicarbonato sérico inicial, meq/l | 0,111 (0,039; 0,183) | 0,087 | 0,003 |
| Proteinuria, g/g creatinina | −0,702 (−0,817; −0,586) | −0,344 | 0,000 |
| Doble bloqueo sistema renina-angiotensina, (0,1) | −1,367 (−2,338; −0,396) | −0,079 | 0,006 |
| Betabloqueantes, (0,1) | −0,608 (−1,205; −0,012) | −0,057 | 0,046 |
| Constante | −5,122 (−7,618; −2,625) | ||
| Hiperkaliemia, (0,1) | −0,460 (−1,299; 0,379) | −0,045 | 0,282 |
| K sérico promedio, mmol/l | −0,103 (−0,968; 0,762) | −0,013 | 0,815 |
Variables fuera de la mejor ecuación de predicción: sexo, índice comorbilidad, diabetes, fumador, presión arterial diastólica, diuréticos, inhibidores sistema renina-angiotensina (monoterapia), antagonistas canales del calcio, K sérico promedio e HK.
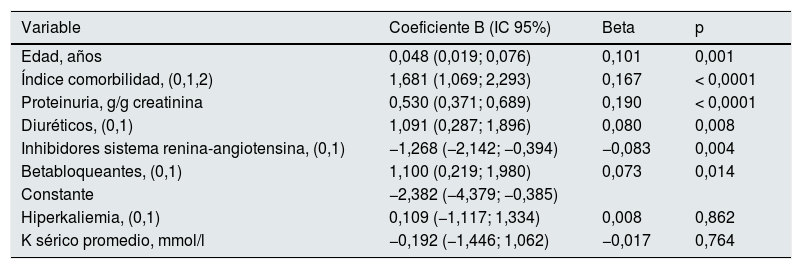
Regresión lineal multivariante sobre la tasa de ingresos hospitalarios anuales (días al año). Mejor modelo predictivo y valor específico de la hiperkaliemia
| Variable | Coeficiente B (IC 95%) | Beta | p |
|---|---|---|---|
| Edad, años | 0,048 (0,019; 0,076) | 0,101 | 0,001 |
| Índice comorbilidad, (0,1,2) | 1,681 (1,069; 2,293) | 0,167 | < 0,0001 |
| Proteinuria, g/g creatinina | 0,530 (0,371; 0,689) | 0,190 | < 0,0001 |
| Diuréticos, (0,1) | 1,091 (0,287; 1,896) | 0,080 | 0,008 |
| Inhibidores sistema renina-angiotensina, (0,1) | −1,268 (−2,142; −0,394) | −0,083 | 0,004 |
| Betabloqueantes, (0,1) | 1,100 (0,219; 1,980) | 0,073 | 0,014 |
| Constante | −2,382 (−4,379; −0,385) | ||
| Hiperkaliemia, (0,1) | 0,109 (−1,117; 1,334) | 0,008 | 0,862 |
| K sérico promedio, mmol/l | −0,192 (−1,446; 1,062) | −0,017 | 0,764 |
Variables fuera de la mejor ecuación de predicción: sexo, diabetes, fumador, índice masa corporal, presión arterial sistólica y diastólica, filtrado glomerular inicial, bicarbonato sérico, antagonistas canales del calcio, K sérico promedio e HK.
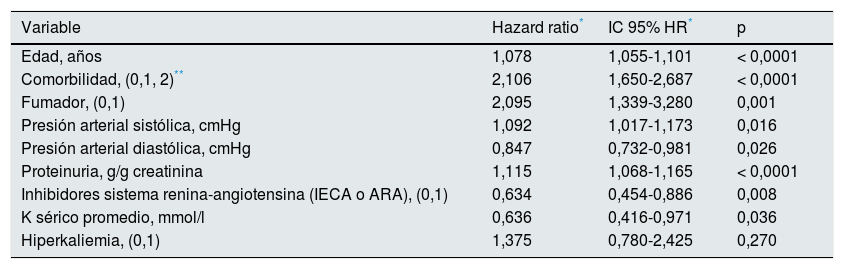
Aunque en el análisis univariable de regresión de Cox las concentraciones promedio de K sérico más bajas se asociaron de forma significativa con una mayor mortalidad (tabla 6), el ajuste multivariable descartó una asociación significativa del K sérico (tanto hipo- como hiperkaliemia) con la mortalidad.
Regresión de riesgo proporcional de Cox sobre la mortalidad durante el periodo prediálisis. Mejor modelo predictivo y valor específico de la hiperkaliemia (fuera de la mejor ecuación)
| Variable | Hazard ratio* | IC 95% HR* | p |
|---|---|---|---|
| Edad, años | 1,078 | 1,055-1,101 | < 0,0001 |
| Comorbilidad, (0,1, 2)** | 2,106 | 1,650-2,687 | < 0,0001 |
| Fumador, (0,1) | 2,095 | 1,339-3,280 | 0,001 |
| Presión arterial sistólica, cmHg | 1,092 | 1,017-1,173 | 0,016 |
| Presión arterial diastólica, cmHg | 0,847 | 0,732-0,981 | 0,026 |
| Proteinuria, g/g creatinina | 1,115 | 1,068-1,165 | < 0,0001 |
| Inhibidores sistema renina-angiotensina (IECA o ARA), (0,1) | 0,634 | 0,454-0,886 | 0,008 |
| K sérico promedio, mmol/l | 0,636 | 0,416-0,971 | 0,036 |
| Hiperkaliemia, (0,1) | 1,375 | 0,780-2,425 | 0,270 |
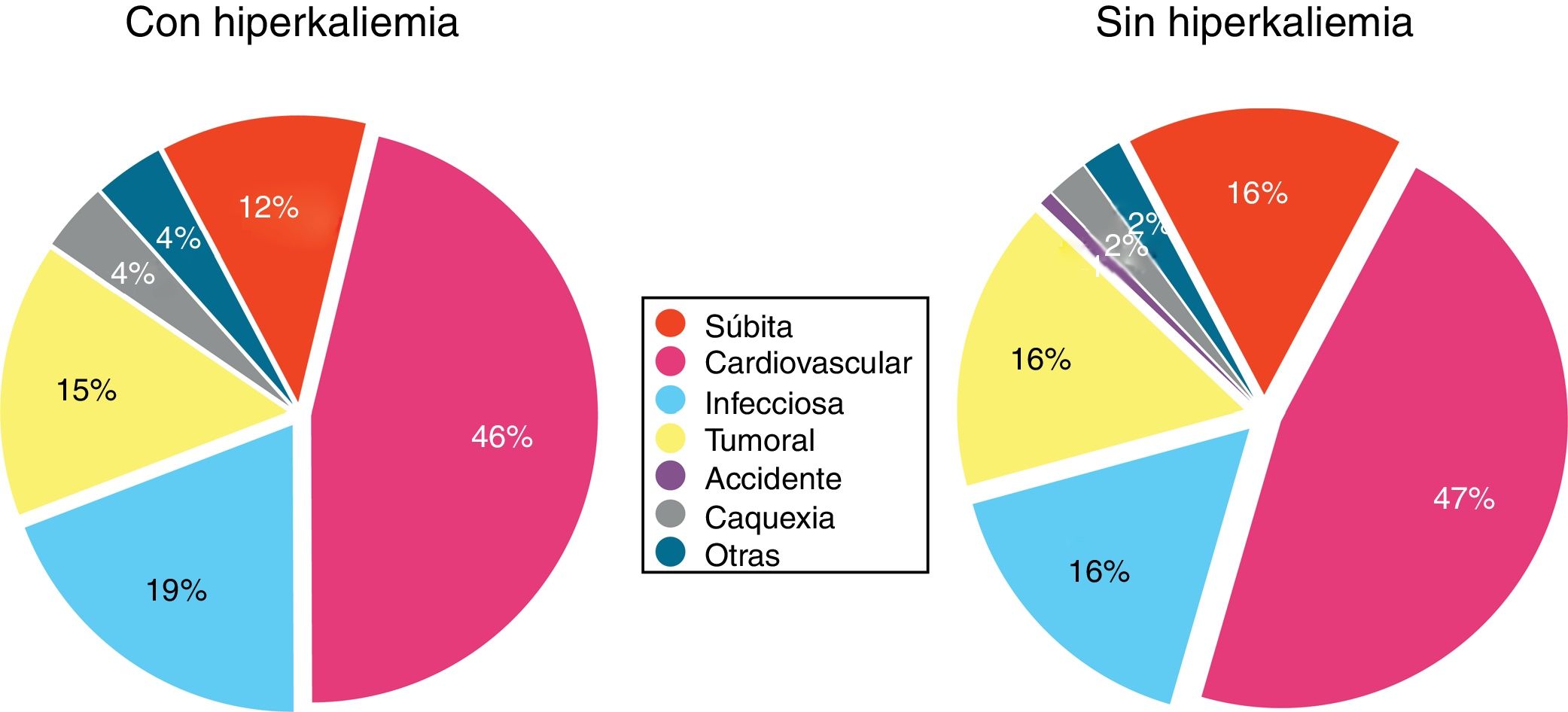
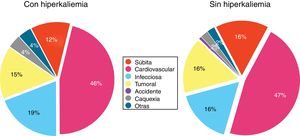
En la figura 6 se muestran las causas de fallecimiento en los pacientes con o sin HK, no observándose diferencias significativas.
DiscusiónLos resultados de este estudio en una cohorte de pacientes con ERC avanzada muestran una alta incidencia y prevalencia de HK, no solo esporádica sino también de forma mantenida en el tiempo. Sin embargo, esta alteración electrolítica no se asoció independiente ni significativamente con una mala evolución clínica: fallecimiento antes del inicio de diálisis, ingresos hospitalarios, inicio diálisis, o velocidad de progresión de la ERC.
Los resultados de este estudio en pacientes con ERCA en condiciones clínicas reales muestran que los mejores determinantes de una HK mantenida son el sexo masculino, la prescripción de diuréticos y de inhibidores del sistema renina-angiotensina (iSRA), así como la gravedad de la acidosis metabólica.
La asociación entre HK y sexo masculino en la ERC ha sido observada en otros estudios14,23, aunque no existe una explicación concluyente. En algún estudio se ha observado una mayor ingesta de K en los hombres29. Es posible también que la producción endógena de K por mayor masa-destrucción celular (muscular) pudiera influir en esta observación30.
Los diuréticos no distales aumentan la fracción de excreción de K y por tanto el hallazgo de una asociación entre la prescripción de estos fármacos y una menor incidencia de HK es consistente con esta explicación31. Por el contrario, la prescripción de iSRA fue en el presente estudio el factor determinante con más peso en el desarrollo de HK, en concordancia con la mayoría de las observaciones publicadas hasta el momento1,2,7,16,17,20–24. Estos hallazgos confirman la importancia que puede tener la interferencia farmacológica con los mecanismos adaptativos para el control de los niveles de K en la ERC.
La asociación entre la acidosis metabólica y la HK es bien conocida16,31,32, y su relación fisiopatológica es mutua31,32, es decir la acidosis podría promover el aumento de los niveles séricos de K, pero también la HK podría alterar los mecanismos de acidificación renal. Además, el uso de iSRA podría a su vez influir tanto en la excreción tubular de K como en los mecanismos de acidificación33.
Debido a la asociación entre el uso de iSRA y la HK, en muy frecuente la discontinuación de estos medicamentos7,8,20–25, e incluso el añadir diuréticos o medicamentos captores de K intestinal como las resinas de intercambios catiónico. Estas prácticas que persiguen la normalización de los niveles de K no están exentas de efectos adversos, los cuales siempre han sido agregados a la evolución y complicaciones de los pacientes que presentan HK.
La asociación entre HK y efectos adversos en la ERC es controvertida4–17. Las razones por las que en nuestro estudio no encontramos un efecto negativo de esta alteración electrolítica en la evolución de los pacientes podrían ser: 1) la definición de la HK no se basó en una determinación aislada. 2) Se evitaron en su prevención y tratamiento fármacos que podrían haber influido en la evolución (digoxina, antiinflamatorios, resinas, fludrocortisona, diuréticos, suspensión iSRA, etc.). 3) La corrección de la acidosis metabólica fue un objetivo terapéutico prioritario en todos los pacientes. 4) Los análisis se ajustaron a importantes variables de confusión. 5) El reclutamiento e inclusión de pacientes, así como el diagnóstico de HK no se hicieron en el momento de situaciones clínicas inestables que podrían promover elevaciones o cambios bruscos en la kaliemia y confundir en la evolución como por ejemplo descompensaciones de una insuficiencia cardiaca, infecciones, intoxicación por fármacos, acidosis metabólica grave, etc.
A diferencia de la HK, los niveles más reducidos de K sérico sí se asociaron a una peor evolución, y este hallazgo coincide con los observados por otros muchos autores4,8,9,11,14,15,34,35. La hipokaliemia en la ERC, no obstante, es una alteración que refleja una alta carga de comorbilidad, y así, cuando en los análisis evolutivos se introducen las principales variables de confusión, esta alteración electrolítica también pierde importancia predictiva como se observó en los resultados del presente estudio.
La primera muestra de K sérico (basal) no se incluyó como variable en los análisis de predicción en el presente estudio. Aunque se podría argumentar que un único incremento del K sérico podría causar efectos deletéreos, las características de inclusión de los pacientes en este estudio concedían a cada uno de ellos un periodo «inmortal» de al menos 3 meses, haciendo de esta forma muy improbable una relación causal entre el K inicial y la evolución posterior. No obstante, las cifras basales de K sérico se correlacionaron fuertemente con las obtenidas como promedio a lo largo del seguimiento (R2 = 0,58; p < 0,0001).
Aunque la HK no parece asociarse con estas importantes variables resultado estudiadas en nuestros pacientes con ERC al igual que las observaciones de otros investigadores14–17, sí podrían tener otros efectos adversos como por ejemplo los relacionados con disfunciones neurológicas (debilidad muscular, alteraciones cognitivas, polineuropatías, etc.) como ya se han observado en algún estudio36, hallazgos que merecería la pena continuar analizando y ensayando su posible reversibilidad mediante control exhaustivo de las concentraciones de K sérico.
Este estudio tiene limitaciones. Debido al diseño retrospectivo, no se pueden establecer relaciones causales firmes, y dado que se realizó en un solo centro con unos determinados criterios de prevención y tratamiento, los resultados podrían no ser generalizables. Tampoco se pudo determinar la existencia de diferencias en la tolerancia a la HK según características raciales, como han señalado algunos investigadores16,35, ya que todos los pacientes fueron caucásicos.
Podría existir la duda de un sesgo de selección debido al criterio de seguimiento mínimo de 3 meses. Así, aquellos pacientes en los que por alguna razón pudieran ser más tolerantes a la HK habrían sido incluidos, mientras que los no incluidos podrían haber sufrido las consecuencias fatales de la HK. Sin embargo, como se detalla en los resultados, la gran mayoría de los pacientes excluidos fue por la necesidad de inicio de diálisis (remisión tardía), y la mortalidad precoz antes del inicio de diálisis en este grupo fue muy baja (3,4% en menos de 3 meses), similar a la mortalidad anual de los pacientes incluidos en el estudio.
En conclusión, la HK es una alteración muy frecuente en la ERC avanzada, relacionada principalmente con el uso de fármacos iSRA y la acidosis metabólica. Sin embargo, la HK no se asocia de forma independiente y significativa con ninguna de las variables de mala evolución clínica estudiadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.