INTRODUCCIÓN
La enfermedad vascular periférica es una entidad frecuente en la población en hemodiálisis, con una prevalencia estimada que oscila del 17 al 48% en las distintas series estudiadas1,2. El motivo de presentar un rango tan amplio no está claro. Probablemente se deba a que existe una enorme variabilidad incidente y prevalente en la literatura por las diferentes formas en las que se realiza el diagnóstico; esto es, en la amplia variación en los criterios diagnósticos y en que existe un elevado porcentaje de vasculopatía periférica silente, en estadios iniciales, que no siempre es considerada como enfermedad.
Si en la población general la enfermedad vascular periférica implica mayor morbi-mortalidad tanto por los factores desencadenantes (edad, hábito tabáquico, hipertensión arterial, dislipemia o diabetes mellitus) como por sus posibles complicaciones (isquemia y sepsis)3, en la población en hemodiálisis la mortalidad estimada es mayor, puesto que también influyen otra serie de factores adicionales, como el estado de inflamación y malnutrición crónica secundario tanto a la enfermedad renal como al tratamiento sustitutivo; y el aumento del producto fosfocálcico y desarrollo de calcificaciones vasculares secundarias1,4. La tasa bruta anual de mortalidad en enfermedad renal crónica estadio V en hemodiálisis en España es del 14%, y está asociada a la presencia de eventos cardiovasculares5.
En cualquier caso, las unidades de hemodiálisis están compuestas de pacientes con mayor edad, pluripatología asociada y elevada tasa de diabetes mellitus. Por tanto es previsible que la prevalencia de enfermedad vascular periférica aumente de forma progresiva en los próximos años. Sin embargo, mientras que en enfermedad coronaria asociada a hemodiálisis las pautas de actuación y diagnóstico precoz están establecidas de forma universal, en el caso de la vasculopatía periférica no existen protocolos que pudieran contribuir a mejorar la supervivencia y la calidad de vida de los pacientes.
El objetivo del presente estudio es describir la prevalencia de enfermedad vascular periférica en nuestro entorno y analizar la relación con la comorbilidad, el estado inflamatorio y la mortalidad a medio plazo.
MATERIAL Y MÉTODOS
Se incluyeron en el estudio los pacientes prevalentes en HD, mayores de 18 años, pertenecientes a una área sanitaria de Madrid a fecha de junio de 2001, que fueron un total de 220.
Se trata de un estudio descriptivo, retrospectivo en el cual se analizó en cada paciente si en junio de 2001 presentaba enfermedad vascular periférica, en qué grado y tratamiento si precisaba. Se analizaron una serie de variables que pudiesen influir en el riesgo de muerte. Se realizó seguimiento de los pacientes durante 48 meses, es decir, hasta junio de 2005, fecha en la cual fue analizado el estado de cada paciente.
Fueron revisadas las historias clínicas de todos los pacientes considerando los siguientes datos: sexo, edad, etiología de la insuficiencia renal, diabetes mellitus, grado de enfermedad vascular periférica, tratamiento de enfermedad vascular periférica, índice de comorbilidad de Charlson, proteína C reactiva, albúmina, prealbúmina, fibrinógeno, índice de resistencia a la Eritropoyetina, Interleukina 6, y estado del paciente al finalizar el estudio.
El diagnóstico de enfermedad vascular periférica fue realizado cuando los pacientes presentaban sintomatología o cuando era detectada con estudios complementarios en las revisiones en pacientes asintomáticos. En todos los pacientes con clínica, se confirmó el diagnóstico con estudios de imagen: eco-doppler de miembros inferiores o presiones segmentarias.
El grado de enfermedad vascular periférica fue clasificado atendiendo a criterios clínicos: ausencia, claudicación intermitente, isquemia/úlceras y necrosis.
El tratamiento de enfermedad vascular periférica se clasificó como: tratamiento médico, angioplastia, by-pass y amputación. El tratamiento médico se basaba en antiagregantes y pentoxifilina.
El índice de comorbilidad de Charlson es un índice muy utilizado para medir la morbilidad de los pacientes; es especialmente útil y de uso común en la población en hemodiálisis. Para calcularlo son considerados los siguientes antecedentes personales: infarto agudo de miocardio, insuficiencia cardíaca congestiva, enfermedad pulmonar crónica, enfermedad reumatológica, enfermedad hepática, úlcera gastroduodenal, enfermedad renal, diabetes mellitus, enfermedad cerebrovascular, demencia, hemiplejía, enfermedad vascular periférica, neoplasia o enfermedad por HIV6.
El índice de resistencia a la eritropoyetina es un parámetro calculado a partir de la fórmula: dosis de eritropoyetina expresada en unidades internacionales por cada kilo de peso que recibe cada paciente por semana dividido entre la hemoglobina expresada en gramos/decilitro.
El estado de cada paciente a fecha de mayo de 2005 fue clasificado como exitus, activo en hemodiálisis, trasplantado o trasladado a otra unidad. Asimismo, se recogió la fecha del evento por el cual los pacientes abandonaron el seguimiento.
ANÁLISIS ESTADÍSTICO
Fue aplicado el Test Kolgomorov para identificar las variables de distribución normal. Las variables de distribución normal fueron interpretadas como media y desviación estándar (DE). Alguna variable como PCR se transformó en normal aplicando logaritmo. Las variables que no tenían distribución normal se expresaron con mediana e intervalo de confianza 95%. Para analizar las variables cualitativas y comparar proporciones se utilizó el chi cuadrado o prueba exacta de Fisher según fuese conveniente. Para la comparación de variables cuantitativas se utilizó la prueba T de Student para las muestras independientes. Con el método Kaplan-Meier se calcularon las curvas de supervivencia y para compararlas se utilizó la prueba de Log-Rank. Para el estudio de las variables independientes predoctoras de mortalidad se realizó una regresión de Cox. Se consideran significativas todas las probabilidades menores del 0,05%. Para el procesamiento y análisis de los datos se utilizó el programa estadístico SPSS.13.
RESULTADOS
Características de la población estudiada
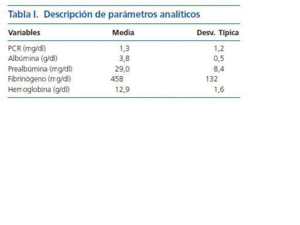
De los 220 pacientes incluidos en el estudio, 124 eran hombres (56 %) y 96 eran mujeres (44%), con una edad media al comienzo del estudio de 62 ± 14 años. El rango abarca de los 23 a los 88 años. El tiempo que llevaban los pacientes en tratamiento en hemodiálisis oscilaba entre un mes y 26 años, con una media de 69,9 ± 67,3 meses. La etiología de la insuficiencia renal más frecuente fue la glomerulonefritis crónica, en 41 pacientes (18,6%); la segunda más frecuente fue la etiología no filiada, en 37 pacientes (16,8%) seguida de nefropatía diabética en 18 casos (8,2%). Presentaban diabetes mellitus 47 pacientes (21,4%). El índice de comorbilidad de Charlson medio fue de 6,0 ± 5,1. El índice de resistencia a Eritropoyetina fue de 10,7 ± 8,8 UI/kg/semana/g/dl, con una hemoglobina media de 12,9 ± 1,7. La tabla I describe las características de los parámetros analíticos hallados en el estudio.
Características de los pacientes con vasculopatía periférica con respecto a los sanos
La prevalencia de enfermedad vascular periférica fue del 39,5%, esto es, de 89 pacientes entre los 220 analizados.
Se obtuvo información acerca del grado de vasculopatía periférica en 212 pacientes del total. De estos, 89 pacientes presentaron enfermedad vascular periférica.
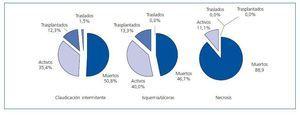
La clínica más común fue claudicación intermitente, en un total de 65 pacientes (30%). En los pacientes asintomáticos, el diagnóstico fue realizado mediante pruebas de imagen. Quince pacientes (6,5%) padecían isquemia/úlceras en miembros inferiores y 9 pacientes (3%) tenían signos de necrosis. En cuanto al tratamiento, recibieron tratamiento médico el 95%; 1 paciente fue tratado con angioplastia (0,5%); 4 pacientes fueron tratados con by-pass (2%) y 5 fueron amputados (2,5%). Todos los pacientes amputados presentaban diabetes mellitus.
Fue significativa la asociación entre los pacientes que presentaban enfermedad vascular periférica y las siguientes variables: edad, etiología de la insuficiencia renal, diabetes mellitus, índice de comorbilidad de Charlson, proteína C reactiva, albúmina, prealbúmina y fibrinógeno (tabla II).
No existió asociación estadísticamente significativa entre la presencia de enfermedad vascular periférica y el sexo, tiempo de seguimiento de cada paciente, tiempo de tratamiento con hemodiálisis e índice de resistencia a la Eritropoyetina.
Estado al finalizar el estudio, mortalidad y factores asociados
La población estudiada se siguió durante 47 meses. Al finalizar el estudio, el 36,8% de los pacientes permanecía activo en hemodiálisis, el 37,3% había fallecido, el 22,7% había sido trasplantado y el 3,2% había sido trasladado a otro centro hospitalario.
La mortalidad es superior en el grupo de pacientes con enfermedad vascular periférica más severa, como se muestra en la figura 1. La mortalidad bruta de la población estudiada es del 6%, 18% y 24% al año, 2 y 3 años respectivamente.
Mortalidad asociada a vasculopatía periférica
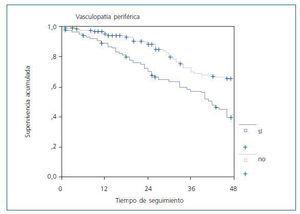
De los 87 pacientes con vasculopatía periférica habían fallecido 48 (55,2%). La supervivencia de los pacientes con enfermedad vascular periférica fue significativamente menor como se observa en la curva de Kaplan-Meier (fig. 2), con un log-rank de 12,42 (p = 0,0004) con respecto a los que no la padecían.
La mortalidad fue mayor en los pacientes con mayor edad, mayor índice de Charlson, mayores niveles de PCR y fibrinógeno y bajos niveles de albúmina y prealbúmina. La presencia de vasculopatía periférica, edad avanzada y niveles bajos de prealbúmina se relacionaron de forma independiente con la mortalidad.
Con respecto a la relación entre tratamiento y estado, el paciente tratado con angioplastia (0,5%) permanecía activo en hemodiálisis; de los 4 pacientes tratados con by-pass (1,9%), permanecen activos 2 (50%), 1 fallecido (25%) y uno trasplantado (25%). De los 5 pacientes amputados (2,5%), 4 habían fallecido (80%) y 1 permanecía en hemodiálisis (20%).
DISCUSIÓN
La prevalencia de enfermedad vascular periférica en la población en hemodiálisis de nuestro estudio es de un 40%, que se encuentra en el rango alto de la normalidad de la descrita en la literatura, que oscila entre un 17 y un 48% dependiendo de las series1,2; si bien en ambos los criterios de inclusión son similares a nuestro estudio, considerando tanto los antecedentes personales, los hallazgos a la exploración física y las pruebas diagnósticas, mencionan que la proporción se duplica cuando se utilizan éstas últimas como método de screening. Cabe destacar en nuestra población la elevada prevalencia de glomerulonefritis crónica y la baja prevalencia de nefropatía diabética. Los autores lo ponemos en relación con la elevada mortalidad de los pacientes con nefropatía diabética en hemodiálisis.
El presente estudio tiene una serie de limitaciones; se trata de un estudio descriptivo y retrospectivo que dificulta determinar los casos incidentes de vasculopatía periférica. Sólo es posible realizar una búsqueda de casos prevalentes. Es difícil determinar el momento en el cual fue realizado el diagnóstico, el tiempo de evolución de la enfermedad y si estaba presente en estadios previos de enfermedad renal crónica. Todos los casos de vasculopatía periférica habían sido confirmados con estudios de imagen. Sin embargo, dadas las características del diseño, puede existir un porcentaje de pacientes asintomáticos con vasculopatía silente, a los que no se les realizó estudio de imagen en las revisiones. Por todo ello, el diagnóstico de enfermedad vascular periférica es dificultoso y es necesario realizar valoraciones objetivas, fundamentalmente en los estadios iniciales de la enfermedad. Los estudios complementarios no se realizan a todos los pacientes de forma rutinaria al mostrar un coste elevado sin beneficios contrastados.
Analizando los factores de riesgo entre los pacientes que desarrollan enfermedad vascular periférica, observamos que se asocian tanto a factores de riesgo clásicos, similares a los de la población general1,3,4,7 como a factores propios de la población urémica. Además la enfermedad renal crónica junto a la diabetes mellitus son indicadores de riesgo de enfermedad vascular periférica y de mala evolución de la misma. En nuestro estudio se demuestra la asociación con los pacientes de mayor edad y diabéticos, aunque no hay asociación significativa con el sexo.
Los pacientes en hemodiálisis presentan una serie de factores de riesgo adicionales, en relación con la enfermedad renal crónica y con el propio tratamiento1,3. En fases tempranas de la enfermedad renal aumenta el producto calcio fósforo y desarrollo de calcificaciones vasculares. Asimismo, el estado de inflamación y malnutrición comienzan en etapas tempranas de la enfermedad renal, y se agrava al iniciar tratamiento sustitutivo puesto que por una parte en cada sesión se pierden proteínas y vitaminas hidrosolubles y por otra parte, el contacto de la sangre con las membranas de los dializadores desencadena una respuesta inflamatoria con aumento de proteína c reactiva y citoquinas proinflamatorias que estimulan el catabolismo proteico8. Como consecuencia se produce un aumento del estrés oxidativo, disfunción endotelial y arterioesclerosis secundaria9,10. En nuestro estudio, hemos pretendido centrarnos en datos epidemiológicos, de comorbilidad e inflamación y por tanto, no fueron estudiados factores de importancia como el hábito tabáquico, producto calcio-fósforo o características de la hemodiálisis. Fue significativa la asociación entre enfermedad vascular periférica y marcadores de inflamación y malnutrición tales como la proteína C reactiva, fibrinógeno y disminución de albúmina y prealbúmina. Un porcentaje muy elevado de pacientes en diálisis superior al 30% presentan desnutrición11, estado que
influye en la supervivencia de forma desfavorable12. De todos los marcadores de mal pronóstico, la concentración de albúmina plasmática inferior a 4 g/dl, es el dato analítico que más se asocia al riesgo de mortalidad, siendo de forma considerable cuando la concentración de albúmina plasmática es inferior a 3 g/dl13. Una de las principales críticas de las que ha sido objeto la hipoalbuminemia como determinante de la mortalidad es que no sólo podría ser un marcador de desnutrición, sino que además podría indicar de forma indirecta un aumento del volumen circulante (hemodilución), o ser consecuencia de una respuesta inflamatoria sistémica (disminución de la síntesis hepática)14. Junto con la albúmina sérica, un marcador inespecífico de inflamación como es la concentración sérica de la proteína C reactiva se ha relacionado con la mortalidad y morbilidad en los pacientes con insuficiencia renal15. La proteína C reactiva (PCR) en condiciones normales es de 0,2 mg/dl, aunque en algunos individuos puede llegar a ser de 1 mg/dl, se considera por encima de 1 mg/dl testimonio de inflamación clínica. La inflamación de la pared vascular es esencial en la iniciación y progresión de la arterioesclerosis relacionada con fenómenos de rarefacción vascular, sustitución de las fibras contráctiles por áreas de fibrosis y calcificación de estas últimas16. El origen de esta respuesta inflamatoria sistémica en los pacientes urémicos es incierto, aunque se ha relacionado íntimamente con la malnutrición y las complicaciones ateroescleróticas (síndrome MIA. Malnutrición-inflamación-terosclerosis)17. Los resultados del estudio de F. Caravaca y cols.18, demuestran la asociación entre el síndrome de malnutrición, inflamación, arterioesclerosis y el paciente urémico antes de iniciar el tratamiento dialítico; por consiguiente no se puede atribuir totalmente su desarrollo a los potenciales precipitantes de inflamación inherentes al procedimiento de diálisis (exposición a materiales bioincompatibles o toxinas bacterianas del líquido de diálisis) como han sugerido algunos investigadores19. De igual modo, la severidad de la uremia por sí sola tampoco parece explicar esta asociación, ya que a igual grado de severidad de la insuficiencia renal, el rango de concentraciones de la proteína C reactiva puede ser muy amplio en las poblaciones de pacientes estudiadas. Se ha propuesto recientemente clasificar la desnutrición de los pacientes sometidos a diálisis en dos tipos20. El tipo 2, asociado a otros procesos comórbidos e inflamación podría ser el más prevalente y difícilmente tratable si el control de las patologías asociadas no es satisfactorio. Uno de los hallazgos más notables del estudio de F. Caravaca y cols.18, pone de manifiesto la gran importancia de la enfermedad vascular sobre la mortalidad precoz en diálisis en la población más joven, lo cual hace reflexionar sobre lo importante que es el riguroso control y la prevención de la enfermedad vascular desde los estadios más tempranos de la insuficiencia renal.
Con respecto a la supervivencia, en nuestro estudio se demuestra que los pacientes con enfermedad vascular periférica presentan mayor índice de mortalidad con respecto a los pacientes libres de enfermedad como se demuestra en la curva de Kaplan-Meier. La mayor proporción de nuestros pacientes se encuentran en estadios iniciales de la enfermedad, es decir, con sintomatología de claudicación intermitente. Ya en este estadio el riesgo de muerte es significativamente mayor2,21.
Realizar un diagnóstico precoz de la enfermedad puede llegar a resultar dificultoso, por una parte porque la enfermedad puede desarrollarse de forma silente2. Savage y cols.22 observaron en un estudio que el 75% de 24 pacientes con enfermedad renal crónica estadio V, pero sin clínica de vasculopatía periférica, presentaba placas calcificadas en carótida y femoral. Asimismo, los métodos diagnósticos habituales una vez instaurada la sintomatología pueden no ser útiles por las calcificaciones de pequeño vaso2,23. En cualquier caso es necesario realizar métodos de screening para monitizar y controlar la enfermedad en nuestras unidades de hemodiálisis, y bien ante la falta de pulsos distales realizar un estudio de presiones segmentarias, o bien instaurarla de forma protocolizada en pacientes con factores de riesgo.
En cuanto al tratamiento, en nuestro estudio destaca la escasa proporción de pacientes que ha sido tratada de forma intervensionista; tan sólo un 5% recibió tratamiento con by pass, angioplastia o amputación, probablemente en relación a un diagnóstico tardío de la enfermedad o bien por una elevada morbilidad que dificulte un abordaje invasivo. No existen estudios acerca de qué técnica elegir, si by-pass o angioplastia. En general la angioplastia es utilizada en los casos de claudicación intermitente aunque el by-pass cada vez se está utilizando con mayor frecuencia en este estadio de la enfermedad2,24-26. En un estudio27 se demostró un aumento de mortalidad global mayor entre los pacientes en hemodiálisis tratados con by-pass con respecto a los pacientes tratados con angioplastia.
La incidencia de amputación en Estados Unidos es de diez veces mayor en la población en hemodiálisis con respecto a la población general2,28. Es conocido que la diabetes mellitus es el principal factor de riesgo de amputación entre la población en hemodiálisis29. También son factores predictivos de amputación en los dos siguientes años el sexo masculino, un diagnóstico previo de vasculopatía periférica, la hipertensión arterial sistólica y la hiperfosforemia30. Por tanto será necesario prestar especial atención a los pacientes con estas características e intentar controlar o tratar los factores de riesgo modificables. Puesto que la tasa de mortalidad tras la amputación es extremadamente elevada en la población en hemodiálisis10,28,31-34, es necesario realizar estrategias para prevenir la amputación, es decir, para enlentecer el desarrollo de la enfermedad31,35,36.
En resumen, la EVP es una complicación frecuente en la población en HD, que se asocia frecuentemente a un estado inflamatorio y a un mayor riesgo de mortalidad. Por tanto, su diagnóstico precoz, mediante interrogatorio dirigido o con exploraciones complementarias, es obligado para iniciar tratamiento.
Tabla 1.
Tabla 2.
Tabla 3.
Figura 1.
Figura 2.