La diabetes mellitus tipo 2 y la enfermedad renal crónica (ERC) son afecciones de elevada prevalencia en personas ≥ 65 años y constituyen un importante problema de salud pública.
ObjetivosConocer la prevalencia de la ERC, sus categorías y su relación con diversos factores demográficos y clínicos, en pacientes ancianos con diabetes mellitus tipo 2 en España.
MétodosEstudio epidemiológico, observacional, transversal, multicéntrico, ámbito nacional. Se incluyeron pacientes con diabetes mellitus tipo 2 conocida, edad ≥ 65 años atendidos en Atención Primaria. Se recogieron variables demográficas, antropométricas y analíticas de los últimos 12 meses, incluyendo el cociente albúmina-creatinina y el filtrado glomerular estimado para evaluar la función renal.
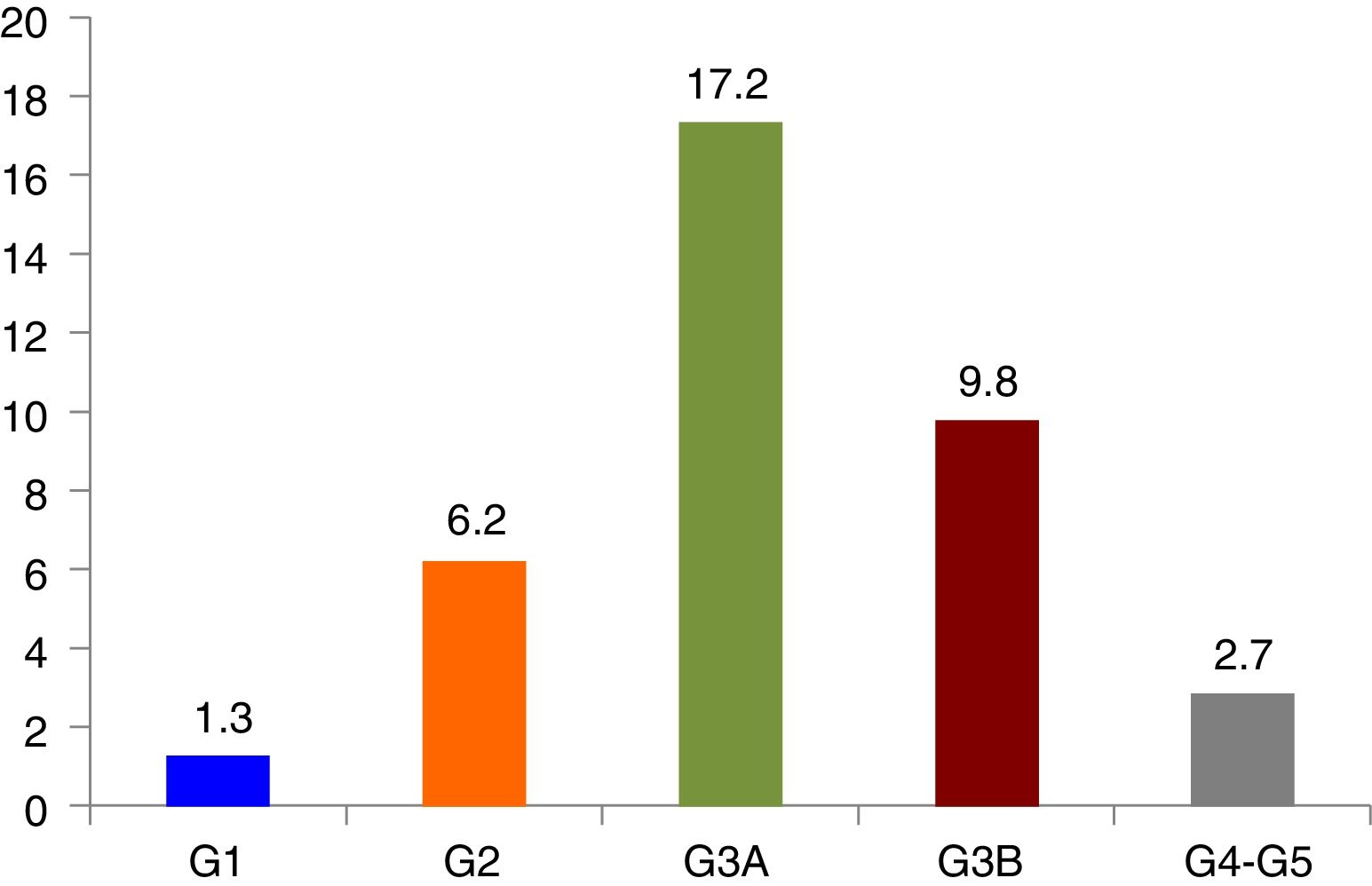
ResultadosLa prevalencia de ERC fue del 37,2% (IC95%, 34,1-40,3%), de insuficiencia renal del 29,7% (IC95%, 26,8-32,6%) y de elevación de la albuminuria del 20,6% (IC95%, 17,3-23,9%), moderadamente elevada 17,8% (IC95%, 14,7-20,9%), severamente elevada 2,8% (IC95%, 1,4-4,2%). La prevalencia de las categorías de ERC fueron: G1 1,3% (IC95%, 0,6-2%), G2 6,2% (IC95%, 4,6-7,8%), G3a 17,2% (IC95%, 14,8-19,6%), G3b 9,8% (IC95%, 7,9-11,7%), G4 2% (IC95%, 1,1-2,9%) y G5 0,7% (IC95%, 0,2-1,2%).
En el análisis multivariante, después de ajustar por el resto de variables, la ERC se asoció a mayor edad OR 5,13, (IC95%, 3,15-8,35), alta comorbilidad OR 3,36 (IC95%, 2,2-5,12) y la presencia de tratamiento antihipertensivo OR 2,43 (IC95%, 1,48-4,02).
ConclusionesLa ERC es frecuente en la población diabética ≥ 65 años y se asocia con mayor edad, alta comorbilidad e hipertensión tratada. No se ha encontrado asociación con el género y años de evolución de la diabetes.
Type 2 diabetes mellitus and chronic kidney disease (CKD) are conditions which have a high prevalence in individuals ≥ 65 years of age and represent a major public health problem.
ObjectivesTo determine the prevalence of CKD, its categories and its relationship with various demographic and clinical factors in elderly patients with type 2 diabetes mellitus in Spain.
MethodsObservational, cross-sectional, multicenter, Spanish epidemiological study. Patients with known type 2 diabetes mellitus, age ≥ 65 years of age treated in Primary Care were included. We collected demographic, anthropometric and analytical variables from the previous 12 months, including the albumin-to-creatinine ratio and estimated glomerular filtration rate to evaluate renal function.
ResultsThe prevalence of CKD was 37.2% (95% CI, 34.1–40.3%), renal failure was 29.7% (95% CI, 26.8–32.6%) and increased albuminuria was 20.6% (95% CI, 17.3–23.9%), moderately increased albuminuria was 17.8% (95% CI, 14.7–20.9%) and severely increased albuminuria was 2.8% (95% CI, 1.4–4.2%). In turn, the prevalence of CKD categories were: G1 1.3% (95% CI, 0.6–2%), G2 6.2% (95% CI, 4.6–7.8%), G3a 17.2% (95% CI, 14.8–19.6%), G3b 9.8% (95% CI, 7.9–11.7%), G4 2% (95% CI, 1.1–2.9%) and G5 0.7% (95% CI, 0.2–1.2%).
In the multivariate analysis, after adjusting for the remaining variables, CKD was associated with elderly age (OR 5.13, 95% CI, 3.15–8.35), high comorbidity (OR 3.36. 95% CI, 2.2–5.12) and presence of antihypertensive treatment (OR 2.43. 95% CI, 1.48–4.02).
ConclusionsCKD is frequent in the diabetic population ≥ 65 years of age and is associated with elderly age, high comorbidity and with treated hypertension. No relationship has been found with gender and time in years since onset of diabetes.
La enfermedad renal crónica (ERC) es una comorbilidad frecuente en pacientes con diabetes mellitus tipo 2 (DM2) y ambas condiciones están aumentando su prevalencia.
Los datos epidemiológicos de la DM2 a nivel mundial muestran que se trata de una de las principales epidemias del siglo XXI. Aproximadamente 415 millones de personas (entre 20 y 79 años) padecían esta condición en el año 2015, de las cuales 94,2 millones (el 22,7% del total) tenían entre 65 y 79 años; además, 318 millones de personas presentaban alto riesgo de desarrollarla en el futuro, estimándose que afectará a 642 millones en los años 40 (uno entre cada diez adultos presentará la enfermedad) y casi un tercio de ellos estará entre 65 y 79 años. La DM es más frecuente en hombres que en mujeres, según fuentes de la Federación Internacional de Diabetes1.
En España, según el estudio Di@bet.es2, la prevalencia de DM2 aumenta con la edad y es mayor en hombres que en mujeres excepto en mayores de 75 años, con una prevalencia del 40% (41,3% en mujeres y 37,4% en varones) mientras que en el grupo de entre 61-75 años la prevalencia en hombres es del 42,4% y en mujeres del 29,8%. Los datos sobre DM conocida en nuestro país en personas mayores de 60 años, que se encuentra entre 18 y 25%, son similares a los encontrados en la población de Estados Unidos de 65 o más años, que fue del 25,9% en 2012, afectando a 11,2 millones de personas3.
La ERC se asocia con un aumento de la morbimortalidad cardiovascular, mortalidad por cualquier causa y progresión de la enfermedad renal, tanto en población general como en pacientes con DM24. La prevalencia de ERC en poblaciones adultas de países occidentales varía entre un 5,8% en Polonia y un 14,8% en Estados Unidos5,6. La prevalencia de ERC aumenta con la edad y en las personas con diabetes, en las que la prevalencia de ERC varía entre 34,7 y 45,4% según poblaciones6–10. En nuestro país, según datos del estudio Epirce11, la ERC afecta al 9,16% de la población adulta mayor de 20 años (23,7% en mayores de 65 años) y la prevalencia de la ERC en las personas con diabetes alcanza el 27,9% según el estudio Percedime212, con una edad media de 66,8 años.
El presente trabajo forma parte del estudio ESCADIANE (Estudio de las características de los pacientes ancianos con diabetes en España) que fue diseñado por el Grupo de Atención Primaria de la Sociedad Española de Diabetes. Tiene como objetivo principal conocer la prevalencia de ERC y sus categorías en los pacientes con diabetes de edad ≥ 65 años en España y determinar su relación con diversos factores demográficos (sexo, edad) y clínicos: control glucémico, años de evolución de su DM, medidas antropométricas, tratamientos seguidos actualmente, hipoglucemias y grados de dependencia y comorbilidad.
Material y métodosDiseño del estudioEl presente trabajo se ha realizado como parte del estudio ESCADIANE, un estudio epidemiológico, observacional, transversal, multicéntrico, de ámbito nacional, a fin de conocer la situación de las personas con diabetes y edad ≥ 65 años en España.
La población de estudio comprende a pacientes, asignados a los cupos de los médicos investigadores, que tuvieran el diagnóstico de DM2 registrado en la historia clínica, según criterios de la Asociación Americana de Diabetes 201113, con una edad ≥ 65 años y con los datos necesarios para cumplimentar el cuestionario. Los participantes en el estudio debían firmar el consentimiento informado (el propio participante o su representante legal) y no tenían que estar participando en ningún otro tipo de estudio epidemiológico. Se excluyeron los pacientes en situación terminal y aquellos que no cumplieron los criterios de inclusión, según el comité evaluador. El estudio fue calificado como un estudio EPA-OD tipo observacional por la Agencia Española del Medicamento y fue valorado y aprobado por el CEIC de Aragón con fecha 30 de enero del 2013.
ProcedimientoComo investigadores, participaron profesionales sanitarios de Atención Primaria de Salud de las diferentes comunidades autónomas. Su distribución se llevó a cabo de forma proporcional a la población de cada comunidad autónoma de España.
A cada médico investigador se le propuso seleccionar doce pacientes con DM de 65 o más años. Con el fin de realizar el muestreo de forma aleatoria, se proporcionó una secuencia de números aleatorios mediante la que se debían elegir a los 12 pacientes de un listado en el que figuraban todos los pacientes con diabetes conocida, edad igual o superior a 65 años, pertenecientes a la consulta del médico investigador.
La recogida de datos se desarrolló entre octubre del 2014 y abril del 2015, en el contexto de la práctica clinica habitual.
Finalmente 82 médicos de Atención Primaria de Salud distribuidos por toda la geografía española, incluyeron en el estudio ESCADIANE a 939 pacientes cuyos datos se utilizaron para el análisis de la enfermedad renal.
MedidasSe recogieron las siguientes variables demográficas y antropométricas: edad, género, peso (kg), talla (cm), índice de masa corporal (IMC) (kg/m2), perímetro abdominal (cm) y relación perímetro cintura/talla (RC/T).
Igualmente se valoraron antecedentes personales de factores de riesgo cardiovascular (hipertensión arterial [HTA] y dislipemia) enfermedades cardiovasculares y otros eventos con diagnóstico confirmado y datado en la historia clínica de: enfermedad cerebrovascular y secuelas (hemiplejia o paraplejia), cardiopatía coronaria (infarto de miocardio, angina de pecho, presencia de intervenciones coronarias), insuficiencia cardiaca, arteriopatía periférica síntomática, retinopatía, neuropatía, enfermedad respiratoria crónica, enfermedades reumáticas, hepatopatía leve o grave, úlcera péptica, neoplasias (linfomas, leucemias, tumores sólidos y presencia de metástasis), ERC grave o diálisis y deterioro cognitivo crónico.
Además, se recogieron variables clínicas y analíticas: años de evolución de la DM2, hipoglucemias registradas en la historia clínica y asistencia requerida, presión arterial (mmHg), hábito tabáquico (fumador, exfumador, no fumador), consumo de alcohol (bebedor, exbebedor, no bebedor), fármacos tomados por el paciente en el momento de la recogida de los datos (antidiabéticos, antihipertensivos, hipolipemiantes, antiagregantes y anticoagulantes), índice de Barthel, glucemia basal (mg/dl), hemoglobina glucosilada (HbA1c, %), perfil lipídico (mg/dl), creatinina sérica (mg/dl) y el cociente albúmina/creatinina (CAC) (mg/g) en orina matinal. La analítica fue realizada en el laboratorio de referencia de cada investigador.
La obesidad se definió como IMC≥ 30kg/m2. La obesidad abdominal, como perímetro de cintura>102cm (hombres) o>88cm (mujeres). La hipertensión se definió como presión arterial ≥140/90mmHg o el uso de medicamentos antihipertensivos. Se consideró hiperlipidemia cuando el colesterol total era> 200mg/dl o colesterol LDL> 100mg/dl o colesterol HDL <40mg/dl en los hombres y <50mg/dl en las mujeres o triglicéridos> 150mg/dl o tratamiento farmacológico hipolipemiante, según la Asociación Americana de Diabetes 201113.
Para estudiar el nivel de dependencia se empleó el Índice de Barthel14 y se clasificó a los pacientes según su puntuación en: independientes (100 puntos), dependencia leve (91-99 puntos), dependencia moderada (61-90 puntos), dependencia severa o grave (21-60 puntos) y dependencia total (0-20 puntos). La comorbilidad fue investigada con la ayuda del Índice de Charlson original15. Los pacientes se clasificaron según la puntuación en ausencia de comorbilidad: 0-1 puntos, baja: 2 puntos y alta: ≥ 3 puntos.
Las variables de función renal fueron definidas según los criterios de la Kidney Disease: Improving Global Outcomes KDIGO 201216 y el Documento de consenso español para la detección y manejo de la ERC17: se consideró la presencia de ERC en pacientes con un filtrado glomerular renal estimado (FGe) <60mL/min/1,73 m2 y/o la presencia de daño renal (definido como un CAC superior o igual a 30mg/g); el filtrado glomerular se estimó mediante la ecuación Chronic Kidney Disease-Epidemiology Collaboration18. Se consideró insuficiencia renal (IR) si el FGe <60mL/m/1,73 m2. La albuminuria se definió como un CAC de 30mg/g o más, independientemente del género. Las categorías de albuminuria: A1 normal o aumento leve (CAC <30mg/g), A2 aumento moderado (CAC 30-299mg/g) y A3 aumento severo (CAC ≥ 300mg/g). Las categorías de ERC se definieron como sigue: G1 (FGe ≥ 90mL/min/1,73 m2 y CAC ≥ 30mg/g); G2 (FGe 60-89mL/min/1,73 m2 y CAC ≥ 30mg/g); G3a (FGe 45-59mL/min/1,73m2 independientemente del CAC); G3b (FGe 30-44mL/min/1,73m2 independientemente del CAC); G4 (FGe 15-29mL/min/1,73m2 independientemente del CAC) y G5 (FGe <15mL/min/1,73m2 independientemente del CAC). Las categorías de FGe (G1 a G5) se definen con los mismos intervalos de FGe independientemente del CAC. El análisis final del estudio se ha realizado con una sola determinación de creatinina y albuminuria, al no disponerse de más medidas y no se ha tenido en cuenta la variable raza, dadas las características de la población de nuestro medio, donde la raza caucásica (99%) es claramente predominante, especialmente en este grupo de edad.
Análisis estadísticoSe realizó un análisis descriptivo de las variables demográficas, antropométricas, analíticas y de las comorbilidades. Las variables continuas se han descrito mediante medidas de tendencia central, no central y de dispersión. Las variables cualitativas mediante distribuciones de frecuencias absolutas y relativas con IC del 95%. Para la comparación entre variables cuantitativas y variables cualitativas se comprobó, mediante la prueba de Kolmogorov-Smirnov, si las primeras seguían una distribución normal en las categorías de las variables cualitativas. Se utilizaron pruebas paramétricas (prueba t-Student o ANOVA) en el caso de normalidad, en caso contrario se utilizaron pruebas no paramétricas (U de Mann Whitney o Prueba de Kruskal Wallis) todas ellas para muestras independientes.
La comparación entre proporciones se realizó mediante la prueba de Chi-cuadrado. Cuando se ha precisado, se utilizó la corrección de Yates. En caso de realizar comparaciones múltiples, se aplicó la corrección de los valores de p por el método de Bonferroni. El grado de asociación entre las características demográficas y clínicas de los pacientes y la presencia o ausencia de ERC se estableció mediante regresión logística multivariante. La significación estadística se estableció en 0,05 cuando se contrastaban hipótesis. El análisis y procesamiento de los datos se realizó mediante el Sofware IBM SPSS Statistics v.23.
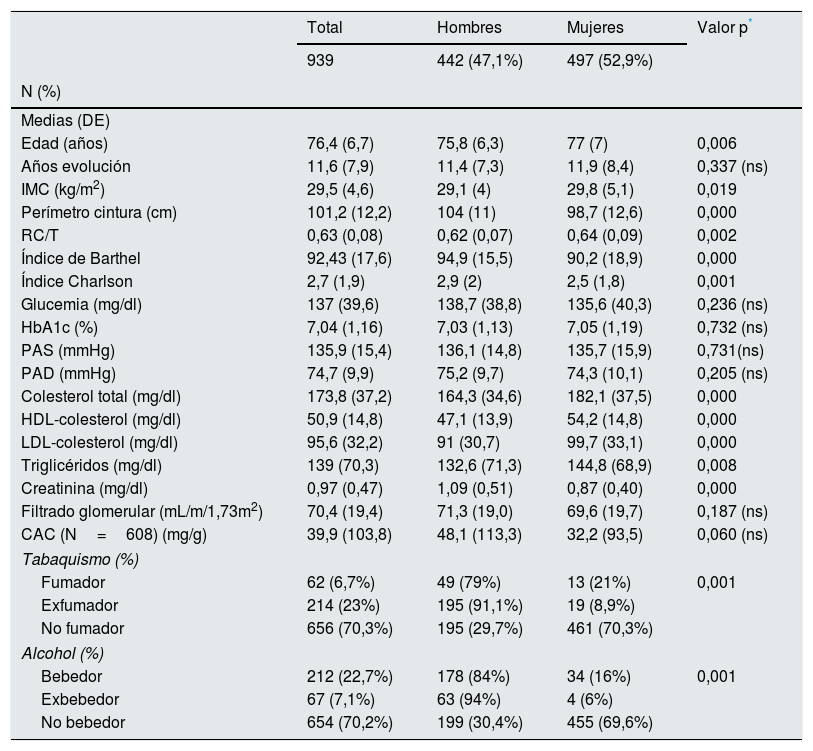
ResultadosEn el estudio se incluyeron 939 pacientes, por un total de 82 médicos de AP distribuidos por toda la geografía española; 929 aportaron el valor de creatinina y fueron los que se incluyeron en el análisis de la enfermedad renal. De ellos, 608 (65,5%) tenían realizada una determinación del CAC. La edad media de los participantes fue de 76,4 años (desviación estándar [DE] 6,7). El 52,9% (IC95%: 49,7-56,1) mujeres. Las caracteríticas demográficas, antropométicas y clínicas de los participantes se muestran en la (tabla 1).
Características de los pacientes con DM2 mayores 65 años (n=939)
| Total | Hombres | Mujeres | Valor p* | |
|---|---|---|---|---|
| 939 | 442 (47,1%) | 497 (52,9%) | ||
| N (%) | ||||
| Medias (DE) | ||||
| Edad (años) | 76,4 (6,7) | 75,8 (6,3) | 77 (7) | 0,006 |
| Años evolución | 11,6 (7,9) | 11,4 (7,3) | 11,9 (8,4) | 0,337 (ns) |
| IMC (kg/m2) | 29,5 (4,6) | 29,1 (4) | 29,8 (5,1) | 0,019 |
| Perímetro cintura (cm) | 101,2 (12,2) | 104 (11) | 98,7 (12,6) | 0,000 |
| RC/T | 0,63 (0,08) | 0,62 (0,07) | 0,64 (0,09) | 0,002 |
| Índice de Barthel | 92,43 (17,6) | 94,9 (15,5) | 90,2 (18,9) | 0,000 |
| Índice Charlson | 2,7 (1,9) | 2,9 (2) | 2,5 (1,8) | 0,001 |
| Glucemia (mg/dl) | 137 (39,6) | 138,7 (38,8) | 135,6 (40,3) | 0,236 (ns) |
| HbA1c (%) | 7,04 (1,16) | 7,03 (1,13) | 7,05 (1,19) | 0,732 (ns) |
| PAS (mmHg) | 135,9 (15,4) | 136,1 (14,8) | 135,7 (15,9) | 0,731(ns) |
| PAD (mmHg) | 74,7 (9,9) | 75,2 (9,7) | 74,3 (10,1) | 0,205 (ns) |
| Colesterol total (mg/dl) | 173,8 (37,2) | 164,3 (34,6) | 182,1 (37,5) | 0,000 |
| HDL-colesterol (mg/dl) | 50,9 (14,8) | 47,1 (13,9) | 54,2 (14,8) | 0,000 |
| LDL-colesterol (mg/dl) | 95,6 (32,2) | 91 (30,7) | 99,7 (33,1) | 0,000 |
| Triglicéridos (mg/dl) | 139 (70,3) | 132,6 (71,3) | 144,8 (68,9) | 0,008 |
| Creatinina (mg/dl) | 0,97 (0,47) | 1,09 (0,51) | 0,87 (0,40) | 0,000 |
| Filtrado glomerular (mL/m/1,73m2) | 70,4 (19,4) | 71,3 (19,0) | 69,6 (19,7) | 0,187 (ns) |
| CAC (N=608) (mg/g) | 39,9 (103,8) | 48,1 (113,3) | 32,2 (93,5) | 0,060 (ns) |
| Tabaquismo (%) | ||||
| Fumador | 62 (6,7%) | 49 (79%) | 13 (21%) | 0,001 |
| Exfumador | 214 (23%) | 195 (91,1%) | 19 (8,9%) | |
| No fumador | 656 (70,3%) | 195 (29,7%) | 461 (70,3%) | |
| Alcohol (%) | ||||
| Bebedor | 212 (22,7%) | 178 (84%) | 34 (16%) | 0,001 |
| Exbebedor | 67 (7,1%) | 63 (94%) | 4 (6%) | |
| No bebedor | 654 (70,2%) | 199 (30,4%) | 455 (69,6%) | |
CAC: cociente albúmina creatinina en orina; DE: desviación estándar; HbA1c: hemoglobina glucosilada; IMC: índice masa corporal; ns: no significativa; PAS, PAD: presión arterial sistólica, diastólica; RC/T relación cintura estatura.
Comparadas con los hombres, las mujeres presentaban una mayor edad media, IMC, relación perímetro de cintura/estatura, peor perfil lipídico, y mayor grado de dependencia. Por el contrario, los hombres presentaban mayores cifras de creatinina, comorbilidad y peores hábitos en cuanto a tabaco y alcohol. No se encontraron diferencias en cuanto a años de evolución de la DM2, cifras de glucemia, HbA1c, cifras de presión arterial, filtrado glomerular y CAC en orina.
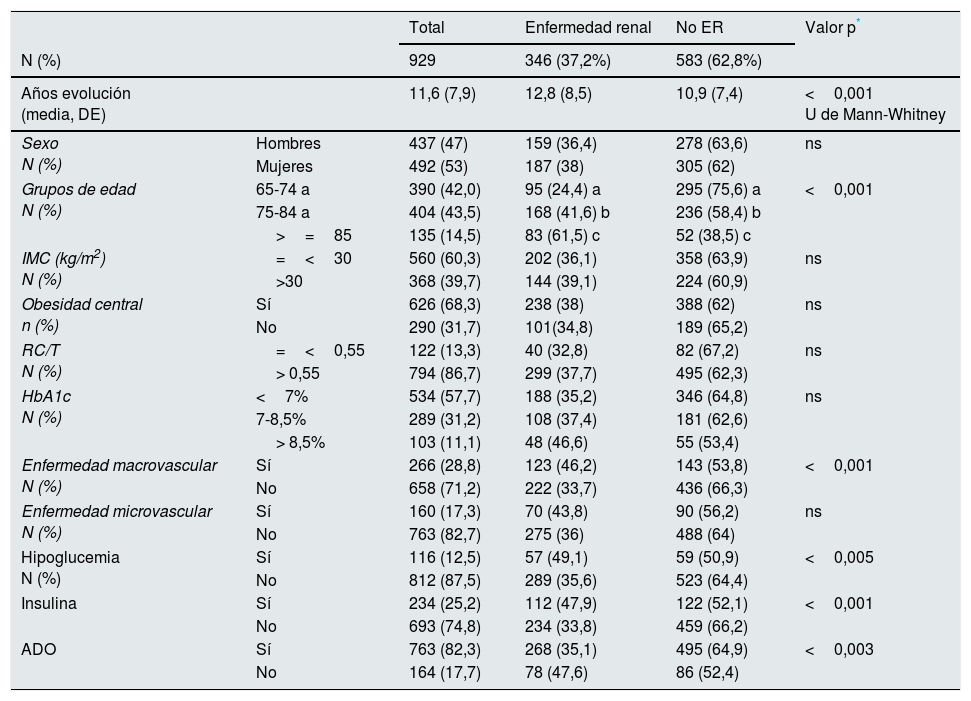
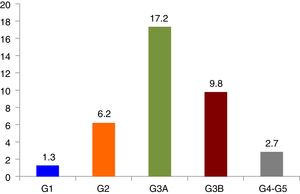
Prevalencia y características de la enfermedad renal crónicaLa prevalencia de ERC fue del 37,2% (IC 95%, 34,1-40,3%), la de IR fue del 29,7% (IC 95%, 26,8-32,6%) y la de elevación de la albuminuria del 20,6% (IC 95%, 17,3-23,9%): moderadamente elevada 17,8% (IC 95%, 14,7-20,9%) y severamente elevada 2,8% (IC 95%, 1,4-4,2%). La prevalencia de ERC según categorías siguiendo las guías KDIGO y el Documento de consenso español para la detección y manejo de la ERC17 se muestra en la figura 1. En la tabla 2 se describen las características de los pacientes según la presencia o no de ERC.
Prevalencia de ERC, clasificada en categorías siguiendo las guías KDIGO.
Categorías ERC. G1: FGe ≥90mL/m/1,73 m2 y CAC ≥30mg/g; G2: FGe 60-89mL/m/1,73 m2 y CAC ≥ 30mg/g; G3A: FGe 45-59mL/m/1,73 m2; G3B: FGe 30-44mL/m/1,73 m2; G4 FGe 15-29mL/m/1,73 m2; G5 FGe <15mL/m/1,73 m2; FGe: Filtrado glomerular estimado; CAC: cociente albúmina creatinina.
Características de los pacientes con y sin enfermedad renal (n=929)
| Total | Enfermedad renal | No ER | Valor p* | ||
|---|---|---|---|---|---|
| N (%) | 929 | 346 (37,2%) | 583 (62,8%) | ||
| Años evolución (media, DE) | 11,6 (7,9) | 12,8 (8,5) | 10,9 (7,4) | <0,001 U de Mann-Whitney | |
| Sexo N (%) | Hombres | 437 (47) | 159 (36,4) | 278 (63,6) | ns |
| Mujeres | 492 (53) | 187 (38) | 305 (62) | ||
| Grupos de edad N (%) | 65-74 a | 390 (42,0) | 95 (24,4) a | 295 (75,6) a | <0,001 |
| 75-84 a | 404 (43,5) | 168 (41,6) b | 236 (58,4) b | ||
| >=85 | 135 (14,5) | 83 (61,5) c | 52 (38,5) c | ||
| IMC (kg/m2) N (%) | =<30 | 560 (60,3) | 202 (36,1) | 358 (63,9) | ns |
| >30 | 368 (39,7) | 144 (39,1) | 224 (60,9) | ||
| Obesidad central n (%) | Sí | 626 (68,3) | 238 (38) | 388 (62) | ns |
| No | 290 (31,7) | 101(34,8) | 189 (65,2) | ||
| RC/T N (%) | =<0,55 | 122 (13,3) | 40 (32,8) | 82 (67,2) | ns |
| > 0,55 | 794 (86,7) | 299 (37,7) | 495 (62,3) | ||
| HbA1c N (%) | <7% | 534 (57,7) | 188 (35,2) | 346 (64,8) | ns |
| 7-8,5% | 289 (31,2) | 108 (37,4) | 181 (62,6) | ||
| > 8,5% | 103 (11,1) | 48 (46,6) | 55 (53,4) | ||
| Enfermedad macrovascular N (%) | Sí | 266 (28,8) | 123 (46,2) | 143 (53,8) | <0,001 |
| No | 658 (71,2) | 222 (33,7) | 436 (66,3) | ||
| Enfermedad microvascular N (%) | Sí | 160 (17,3) | 70 (43,8) | 90 (56,2) | ns |
| No | 763 (82,7) | 275 (36) | 488 (64) | ||
| Hipoglucemia N (%) | Sí | 116 (12,5) | 57 (49,1) | 59 (50,9) | <0,005 |
| No | 812 (87,5) | 289 (35,6) | 523 (64,4) | ||
| Insulina | Sí | 234 (25,2) | 112 (47,9) | 122 (52,1) | <0,001 |
| No | 693 (74,8) | 234 (33,8) | 459 (66,2) | ||
| ADO | Sí | 763 (82,3) | 268 (35,1) | 495 (64,9) | <0,003 |
| No | 164 (17,7) | 78 (47,6) | 86 (52,4) | ||
ADO: antidiabéticos orales; DE: desviación estándar; ER: enfermedad renal; HbA1c: hemoglobina glucosilada; IMC: índice masa corporal; ns: no significativa; RC/T relación cintura estatura.
En variables con más de dos categorías, las letras a, b o c que difieren indican en qué categorías las diferencias son estadísticamente significativas. Comparación por filas.
En la estadística bivariante, al comparar pacientes con ERC y sin ERC, no se encontraron diferencias estadísticamente significativas en cuanto a género, obesidad periférica, obesidad abdominal, relación perímetro cintura/talla, control glucémico y presencia de enfermedades microvasculares. Sin embargo, los pacientes con ERC tenían mayor duración de su diabetes, edad (mayor proporción de ERC en grupos de mayor edad), presencia de enfermedad macrovascular, más hipoglucemias, mayor utilización de insulina y menor uso de antidiabéticos orales, que aquellos sin ERC. La prevalencia de enfermedad renal aumentaba según grado de dependencia (35,8% independencia-dependencia leve vs. 56,3% dependencia moderada-grave p<0,001) y también según grado de comorbilidad, 24,7 vs. 54,2%, p<0,001, según ausencia morbilidad o morbilidad alta respectivamente.
La prevalencia de ERC considerando solamente los pacientes que aportan determinación de albuminuria fue del 39,5% (IC 95% 35,6-43,4%).
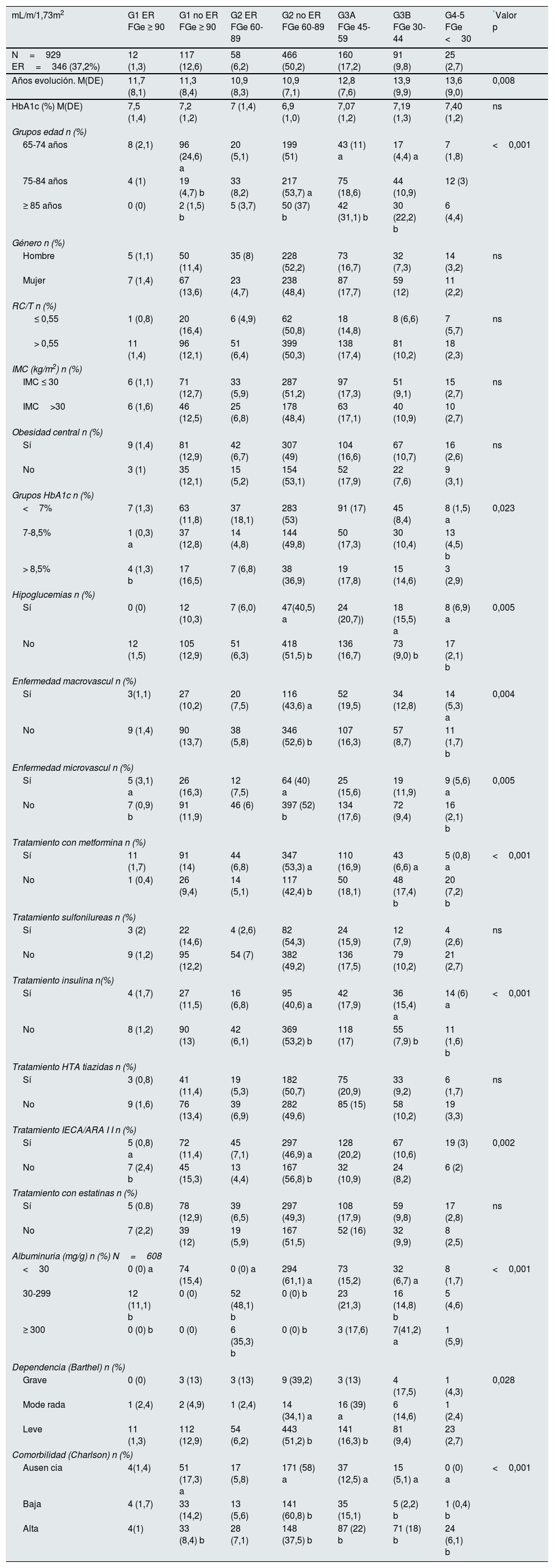
Las prevalencias de las diferentes categorías de FGe (G1, G2, G3A, G3B, G4-G5) fueron: 13,9% (IC 95%, 11,7-16,1%), 56,4% (IC 95%, 53,2-59,6%), 17,2% (IC 95%, 14,8-19,6%), 9,8% (IC 95%, 7,9-11,7%) y 2,7% (IC 95%, 1,7-3,7%) respectivamente.
El deterioro de la función renal se asoció con una mayor duración de la diabetes, mayor edad, peor control glucémico, presencia de enfermedad micro- o macrovascular, mayor número de hipoglucemias, mayor grado de dependencia y mayor presencia de comorbilidad. No se hallaron diferencias estadísticamente significativas respecto a ERC, entre las diferentes medidas antropométricas y el género.
En cuanto al tratamiento, el 25,2% de los pacientes utilizaba insulina, aumentando significativamente su uso con el deterioro de la función renal. Respecto a los antidiabéticos orales (ADO), el 70,2% utilizaban metformina, el 28,7% inhibidores de la enzima dipeptidil peptidasa-4 (IDPP-4) y el 16,3% sulfonilureas (SU) (glibenclamida 1,2%, el 36,4% de ellos en categorías 3-5 de ER) solas o en combinación. El uso de metformina y SU disminuye conforme empeora la función renal: en pacientes con FGe <60mL/m/1,73 m2 el 24,3% usan metformina y el 26,4% sulfonilureas y en aquellos con FGe <30mL/m/1,73 m2 solo el 0,8% (IC95%, 0,1-1,5%) y el 2,6% (IC95% 0,1-5,1%) utilizan metformina y SU respectivamente. Igualmente, el 1,7% (IC95%, 0,3-3,1%) de los pacientes utilizan diuréticos tiazídicos para el tratamiento de su HTA con FGe <30mL/m/1,73 m2. En estas situaciones estaría formalmente contraindicada la utilización de los fármacos por motivos de seguridad (metformina, sulfonilureas) o no recomendada por falta de eficacia (tiazidas). Casi el 70% de los pacientes incluyen un inhibidor del sistema renina-angiotensina en su pauta de tratamiento de la HTA y el 65% utilizan estatinas (tabla 3).
Características de los pacientes según categorías de enfermedad renal crónica (n=929)
| mL/m/1,73m2 | G1 ER FGe ≥ 90 | G1 no ER FGe ≥ 90 | G2 ER FGe 60-89 | G2 no ER FGe 60-89 | G3A FGe 45-59 | G3B FGe 30-44 | G4-5 FGe <30 | *Valor p |
|---|---|---|---|---|---|---|---|---|
| N=929 ER=346 (37,2%) | 12 (1,3) | 117 (12,6) | 58 (6,2) | 466 (50,2) | 160 (17,2) | 91 (9,8) | 25 (2,7) | |
| Años evolución. M(DE) | 11,7 (8,1) | 11,3 (8,4) | 10,9 (8,3) | 10,9 (7,1) | 12,8 (7,6) | 13,9 (9,9) | 13,6 (9,0) | 0,008 |
| HbA1c (%) M(DE) | 7,5 (1,4) | 7,2 (1,2) | 7 (1,4) | 6,9 (1,0) | 7,07 (1,2) | 7,19 (1,3) | 7,40 (1,2) | ns |
| Grupos edad n (%) | ||||||||
| 65-74 años | 8 (2,1) | 96 (24,6) a | 20 (5,1) | 199 (51) | 43 (11) a | 17 (4,4) a | 7 (1,8) | <0,001 |
| 75-84 años | 4 (1) | 19 (4,7) b | 33 (8,2) | 217 (53,7) a | 75 (18,6) | 44 (10,9) | 12 (3) | |
| ≥ 85 años | 0 (0) | 2 (1,5) b | 5 (3,7) | 50 (37) b | 42 (31,1) b | 30 (22,2) b | 6 (4,4) | |
| Género n (%) | ||||||||
| Hombre | 5 (1,1) | 50 (11,4) | 35 (8) | 228 (52,2) | 73 (16,7) | 32 (7,3) | 14 (3,2) | ns |
| Mujer | 7 (1,4) | 67 (13,6) | 23 (4,7) | 238 (48,4) | 87 (17,7) | 59 (12) | 11 (2,2) | |
| RC/T n (%) | ||||||||
| ≤ 0,55 | 1 (0,8) | 20 (16,4) | 6 (4,9) | 62 (50,8) | 18 (14,8) | 8 (6,6) | 7 (5,7) | ns |
| > 0,55 | 11 (1,4) | 96 (12,1) | 51 (6,4) | 399 (50,3) | 138 (17,4) | 81 (10,2) | 18 (2,3) | |
| IMC (kg/m2) n (%) | ||||||||
| IMC ≤ 30 | 6 (1,1) | 71 (12,7) | 33 (5,9) | 287 (51,2) | 97 (17,3) | 51 (9,1) | 15 (2,7) | ns |
| IMC>30 | 6 (1,6) | 46 (12,5) | 25 (6,8) | 178 (48,4) | 63 (17,1) | 40 (10,9) | 10 (2,7) | |
| Obesidad central n (%) | ||||||||
| Sí | 9 (1,4) | 81 (12,9) | 42 (6,7) | 307 (49) | 104 (16,6) | 67 (10,7) | 16 (2,6) | ns |
| No | 3 (1) | 35 (12,1) | 15 (5,2) | 154 (53,1) | 52 (17,9) | 22 (7,6) | 9 (3,1) | |
| Grupos HbA1c n (%) | ||||||||
| <7% | 7 (1,3) | 63 (11,8) | 37 (18,1) | 283 (53) | 91 (17) | 45 (8,4) | 8 (1,5) a | 0,023 |
| 7-8,5% | 1 (0,3) a | 37 (12,8) | 14 (4,8) | 144 (49,8) | 50 (17,3) | 30 (10,4) | 13 (4,5) b | |
| > 8,5% | 4 (1,3) b | 17 (16,5) | 7 (6,8) | 38 (36,9) | 19 (17,8) | 15 (14,6) | 3 (2,9) | |
| Hipoglucemias n (%) | ||||||||
| Sí | 0 (0) | 12 (10,3) | 7 (6,0) | 47(40,5) a | 24 (20,7)) | 18 (15,5) a | 8 (6,9) a | 0,005 |
| No | 12 (1,5) | 105 (12,9) | 51 (6,3) | 418 (51,5) b | 136 (16,7) | 73 (9,0) b | 17 (2,1) b | |
| Enfermedad macrovascul n (%) | ||||||||
| Sí | 3(1,1) | 27 (10,2) | 20 (7,5) | 116 (43,6) a | 52 (19,5) | 34 (12,8) | 14 (5,3) a | 0,004 |
| No | 9 (1,4) | 90 (13,7) | 38 (5,8) | 346 (52,6) b | 107 (16,3) | 57 (8,7) | 11 (1,7) b | |
| Enfermedad microvascul n (%) | ||||||||
| Sí | 5 (3,1) a | 26 (16,3) | 12 (7,5) | 64 (40) a | 25 (15,6) | 19 (11,9) | 9 (5,6) a | 0,005 |
| No | 7 (0,9) b | 91 (11,9) | 46 (6) | 397 (52) b | 134 (17,6) | 72 (9,4) | 16 (2,1) b | |
| Tratamiento con metformina n (%) | ||||||||
| Sí | 11 (1,7) | 91 (14) | 44 (6,8) | 347 (53,3) a | 110 (16,9) | 43 (6,6) a | 5 (0,8) a | <0,001 |
| No | 1 (0,4) | 26 (9,4) | 14 (5,1) | 117 (42,4) b | 50 (18,1) | 48 (17,4) b | 20 (7,2) b | |
| Tratamiento sulfonilureas n (%) | ||||||||
| Sí | 3 (2) | 22 (14,6) | 4 (2,6) | 82 (54,3) | 24 (15,9) | 12 (7,9) | 4 (2,6) | ns |
| No | 9 (1,2) | 95 (12,2) | 54 (7) | 382 (49,2) | 136 (17,5) | 79 (10,2) | 21 (2,7) | |
| Tratamiento insulina n(%) | ||||||||
| Sí | 4 (1,7) | 27 (11,5) | 16 (6,8) | 95 (40,6) a | 42 (17,9) | 36 (15,4) a | 14 (6) a | <0,001 |
| No | 8 (1,2) | 90 (13) | 42 (6,1) | 369 (53,2) b | 118 (17) | 55 (7,9) b | 11 (1,6) b | |
| Tratamiento HTA tiazidas n (%) | ||||||||
| Sí | 3 (0,8) | 41 (11,4) | 19 (5,3) | 182 (50,7) | 75 (20,9) | 33 (9,2) | 6 (1,7) | ns |
| No | 9 (1,6) | 76 (13,4) | 39 (6,9) | 282 (49,6) | 85 (15) | 58 (10,2) | 19 (3,3) | |
| Tratamiento IECA/ARA I I n (%) | ||||||||
| Sí | 5 (0,8) a | 72 (11,4) | 45 (7,1) | 297 (46,9) a | 128 (20,2) | 67 (10,6) | 19 (3) | 0,002 |
| No | 7 (2,4) b | 45 (15,3) | 13 (4,4) | 167 (56,8) b | 32 (10,9) | 24 (8,2) | 6 (2) | |
| Tratamiento con estatinas n (%) | ||||||||
| Sí | 5 (0.8) | 78 (12,9) | 39 (6,5) | 297 (49,3) | 108 (17,9) | 59 (9,8) | 17 (2,8) | ns |
| No | 7 (2,2) | 39 (12) | 19 (5,9) | 167 (51,5) | 52 (16) | 32 (9,9) | 8 (2,5) | |
| Albuminuria (mg/g) n (%) N=608 | ||||||||
| <30 | 0 (0) a | 74 (15,4) | 0 (0) a | 294 (61,1) a | 73 (15,2) | 32 (6,7) a | 8 (1,7) | <0,001 |
| 30-299 | 12 (11,1) b | 0 (0) | 52 (48,1) b | 0 (0) b | 23 (21,3) | 16 (14,8) b | 5 (4,6) | |
| ≥ 300 | 0 (0) b | 0 (0) | 6 (35,3) b | 0 (0) b | 3 (17,6) | 7(41,2) a | 1 (5,9) | |
| Dependencia (Barthel) n (%) | ||||||||
| Grave | 0 (0) | 3 (13) | 3 (13) | 9 (39,2) | 3 (13) | 4 (17,5) | 1 (4,3) | 0,028 |
| Mode rada | 1 (2,4) | 2 (4,9) | 1 (2,4) | 14 (34,1) a | 16 (39) a | 6 (14,6) | 1 (2,4) | |
| Leve | 11 (1,3) | 112 (12,9) | 54 (6,2) | 443 (51,2) b | 141 (16,3) b | 81 (9,4) | 23 (2,7) | |
| Comorbilidad (Charlson) n (%) | ||||||||
| Ausen cia | 4(1,4) | 51 (17,3) a | 17 (5,8) | 171 (58) a | 37 (12,5) a | 15 (5,1) a | 0 (0) a | <0,001 |
| Baja | 4 (1,7) | 33 (14,2) | 13 (5,6) | 141 (60,8) b | 35 (15,1) | 5 (2,2) b | 1 (0,4) b | |
| Alta | 4(1) | 33 (8,4) b | 28 (7,1) | 148 (37,5) b | 87 (22) b | 71 (18) b | 24 (6,1) b | |
DE: desviación estándar; ER: enfermedad renal; FGe: filtrado glomerular estimado; HbA1c: hemoglobina glucosilada; HTA: hipertensión; IMC: índice masa corporal; M: media; ns: no significativa; RC/T relación cintura estatura.
Se han agrupado las categorías G4-G5. En variables con más de dos categorías, (comparaciones múltiples) las letras a, b, o c indican en qué categorías las diferencias son estadísticamente significativas. Comparación de proporciones por filas.
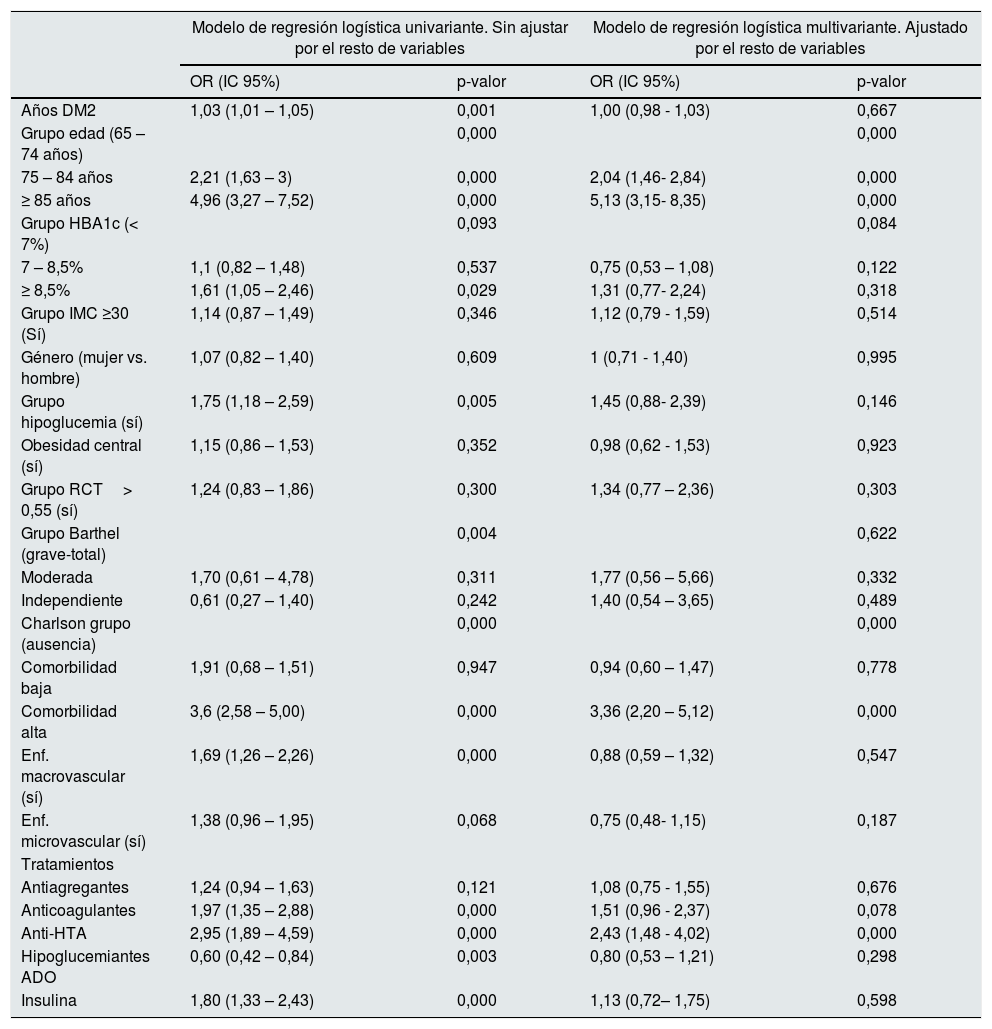
Finalmente, en el análisis multivariante, la ER se asoció a una mayor edad OR: 5,13
(IC95%, 3,15- 8,35 p<0,001), comorbilidad alta OR: 3,36 (IC95%, 2,20-5,12 p<0,001) y tratamiento antihipertensivo OR: 2,43 (IC 95%, 1,48- 4,02, p<0,001) (tabla 4).
Factores asociados con ERC en pacientes con DM2 ≥65 años (n=929)
| Modelo de regresión logística univariante. Sin ajustar por el resto de variables | Modelo de regresión logística multivariante. Ajustado por el resto de variables | |||
|---|---|---|---|---|
| OR (IC 95%) | p-valor | OR (IC 95%) | p-valor | |
| Años DM2 | 1,03 (1,01 – 1,05) | 0,001 | 1,00 (0,98 - 1,03) | 0,667 |
| Grupo edad (65 – 74 años) | 0,000 | 0,000 | ||
| 75 – 84 años | 2,21 (1,63 – 3) | 0,000 | 2,04 (1,46- 2,84) | 0,000 |
| ≥ 85 años | 4,96 (3,27 – 7,52) | 0,000 | 5,13 (3,15- 8,35) | 0,000 |
| Grupo HBA1c (< 7%) | 0,093 | 0,084 | ||
| 7 – 8,5% | 1,1 (0,82 – 1,48) | 0,537 | 0,75 (0,53 – 1,08) | 0,122 |
| ≥ 8,5% | 1,61 (1,05 – 2,46) | 0,029 | 1,31 (0,77- 2,24) | 0,318 |
| Grupo IMC ≥30 (Sí) | 1,14 (0,87 – 1,49) | 0,346 | 1,12 (0,79 - 1,59) | 0,514 |
| Género (mujer vs. hombre) | 1,07 (0,82 – 1,40) | 0,609 | 1 (0,71 - 1,40) | 0,995 |
| Grupo hipoglucemia (sí) | 1,75 (1,18 – 2,59) | 0,005 | 1,45 (0,88- 2,39) | 0,146 |
| Obesidad central (sí) | 1,15 (0,86 – 1,53) | 0,352 | 0,98 (0,62 - 1,53) | 0,923 |
| Grupo RCT> 0,55 (sí) | 1,24 (0,83 – 1,86) | 0,300 | 1,34 (0,77 – 2,36) | 0,303 |
| Grupo Barthel (grave-total) | 0,004 | 0,622 | ||
| Moderada | 1,70 (0,61 – 4,78) | 0,311 | 1,77 (0,56 – 5,66) | 0,332 |
| Independiente | 0,61 (0,27 – 1,40) | 0,242 | 1,40 (0,54 – 3,65) | 0,489 |
| Charlson grupo (ausencia) | 0,000 | 0,000 | ||
| Comorbilidad baja | 1,91 (0,68 – 1,51) | 0,947 | 0,94 (0,60 – 1,47) | 0,778 |
| Comorbilidad alta | 3,6 (2,58 – 5,00) | 0,000 | 3,36 (2,20 – 5,12) | 0,000 |
| Enf. macrovascular (sí) | 1,69 (1,26 – 2,26) | 0,000 | 0,88 (0,59 – 1,32) | 0,547 |
| Enf. microvascular (sí) | 1,38 (0,96 – 1,95) | 0,068 | 0,75 (0,48- 1,15) | 0,187 |
| Tratamientos | ||||
| Antiagregantes | 1,24 (0,94 – 1,63) | 0,121 | 1,08 (0,75 - 1,55) | 0,676 |
| Anticoagulantes | 1,97 (1,35 – 2,88) | 0,000 | 1,51 (0,96 - 2,37) | 0,078 |
| Anti-HTA | 2,95 (1,89 – 4,59) | 0,000 | 2,43 (1,48 - 4,02) | 0,000 |
| Hipoglucemiantes ADO | 0,60 (0,42 – 0,84) | 0,003 | 0,80 (0,53 – 1,21) | 0,298 |
| Insulina | 1,80 (1,33 – 2,43) | 0,000 | 1,13 (0,72– 1,75) | 0,598 |
ADO: antidiabéticos orales; DM2: diabetes mellitus tipo 2; Enf: enfermedad; ER: enfermedad renal; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IC: intervalo confianza; IMC: índice de masa corporal; OR: odds ratio; RCT: relación perímetro cintura/talla.
El objetivo del tratamiento de la diabetes en los ancianos es mantener su capacidad funcional y calidad de vida, además de prevenir las complicaciones. Sin embargo, este tipo de pacientes no solo tienen que hacer frente a su DM, sino que también soportan cargas adicionales relacionadas con el envejecimiento, comorbilidades asociadas y un porcentaje más elevado de síndromes geriátricos. Se ha objetivado que los pacientes ancianos con diabetes tienen una elevada prevalencia de discapacidad y deterioro funcional, lo que ocasiona un impacto significativo en el tratamiento y manejo de su diabetes19,20.
La DM2 y la enfermedad renal crónica son afecciones crónicas que coexisten frecuentemente en personas mayores de 65 años, en las que hay que evitar episodios hipoglucémicos y efectos adversos farmacológicos que puedan empeorar su calidad de vida.
La toma de decisiones en este grupo de pacientes es compleja y deben abordarse otros factores distintos de los objetivos biomédicos, incluyendo la morbilidad y la esperanza de vida. En este sentido, llama la atención el bajo nivel de HbA1c alcanzado en los pacientes de nuestro estudio, 7,04%, con una edad media de 76,4 años, y un 88,9% de los pacientes con valores inferiores al 8,5%, cifras por otra parte similares a las de otros estudios realizados en nuestro medio4,12,21–23, con HbA1c entre 6,84-7,3%, edades medias entre 66,7 y 68,8 años y un 80-88% de los pacientes con HbA1c <8,5%. En estudios de otros países occidentales (Estados Unidos, Finlandia y Francia)8,9,24 con pacientes con edades medias entre 60,5 y 71,2 años, los valores medios de HbA1c estuvieron entre 7,03-7,2%, similares a los de nuestro estudio, lo que hace pensar en un posible sobretratamiento de este tipo de pacientes, que junto al deterioro de su función renal puede favorecer los episodios hipoglucémicos.
En la población estudiada, atendidos en AP y con una media de 11,6 años de evolución de su DM, la prevalencia de ERC fue del 37,2%, de IR (FGe <60mL/m/1,73m2) del 29,7% y de albuminuria del 20,6% (moderadamente elevada 17,8%, severamente elevada 2,8%). Estos resultados muestran una prevalencia de ERC superior a la de estudios recientes en nuestro país. En el estudio Percedime212 realizado en consultas de AP en población diabética mayor de 40 años, edad media de 66,8 años y una media de 9 años de evolución de su DM2, se informó una prevalencia de ERC del 27,9%, de IR del 18% y una presencia de albuminuria del 15,4% (moderadamente elevada 13%, severamente aumentada 3,2%); a diferencia de nuestro estudio y otros llevados a cabo en España y fuera de nuestro país, se realizaron varias determinaciones analíticas para confirmar los resultados. Un trabajo previo realizado en la provincia de Teruel25en población diabética mayor de 18 años, edad media 67,9 años y con una sola determinación analítica, mostró una prevalencia de ERC del 34,6%, de IR del 25,2% y de albuminuria del 16,1% (moderadamente elevada 14,3%, severamente aumentada 1,8%). También en nuestro país, Vinagre et al.23 en diabéticos mayores de 30 años, edad media de 68,2 años y duración media de su DM2 de 6,5 años, encontraron una prevalencia de IR del 20% y albuminuria del 16,7% (moderadamente elevada 14,9, severamente elevada 1,8%). En el estudio de Coll et al.4 en pacientes con DM2 con una edad media de 68 años, duración media de su diabetes 7 años y con una única determinación de albuminuria, se encontró una prevalencia de ERC del 34,1%, de IR del 22,9% y de albuminuria del 19,5%, todas ellas similares a las de nuestro estudio. En Finlandia, en un estudio realizado en centros de AP9 en diabéticos mayores de 29 años, edad media 67 años, duración media de su diabetes 9,2 años y con una única determinación del CAC, se observó una prevalencia de ERC del 34,7%, de IR del 16,2% y de albuminuria del 24,3% (moderadamente elevada 17,1%, severamente elevada 7,2%), destacando en este estudio las cifras de albuminuria severamente elevada, que duplican o triplican las observadas en los estudios españoles. Otro estudio realizado en AP en Suiza10, con una edad media de 66,5 años y una duración media de su DM2 de 9,3 años, mostró una prevalencia de ERC del 45,4% y de IR del 22,4%; solo el 30% de los pacientes aportaron una determinación de albuminuria. El estudio de Wu et al.8, utilizando datos de la encuesta estadounidense National Health and Nutrition Examination Surveys 2007-2012, con una sola determinación analítica, informó de una prevalencia de ERC del 38,3%, en diabéticos mayores de 18 años con una duración media de su DM2 de 10 años; la prevalencia de IR fue del 19,8%. Considerando únicamente los pacientes mayores de 65 años, la prevalencia de ERC fue del 58,7% y de IR del 40,8% que resultan ser casi el doble de las obtenidas en nuestro estudio. Las diferentes prevalencias, según estudios, pueden deberse a diferencias metodológicas, una sola determinación analítica o varias para confirmar los resultados, o a las características étnicas y demográficas de las muestras.
La detección temprana de la ERC tiene importantes implicaciones clínicas, ya que tanto la albuminuria como la disminución del filtrado glomerular se asocian independientemente con la morbimortalidad cardiovascular y mortalidad total26 y pueden condicionar las opciones terapéuticas de la DM2 y otras comorbilidades presentes en este tipo de pacientes. En nuestro estudio el 82,3% de los pacientes utilizaba algún tipo de antidiabético oral y el 25,2% estaban tratados con insulina. La metformina es el ADO más utilizado en el 70,2% de los pacientes y solamente el 0,8% la utilizaba fuera de la indicación actual de la Agencia Europea del Medicamento27 (estadios G4-G5 de ERC) y los Documentos de Consenso españoles sobre detección17 y tratamiento de la DM2 en el paciente con ERC28, aunque en ficha técnica está contraindicada con FGe <60mL/m/1,73m2; las SU las utilizaban el 16,3% de los pacientes (2,6% en estadios G4-G5 fuera de indicación17,28). En el estudio de Ruiz Tamayo et al.29, el 88,4% utilizaban metformina, fuera de indicación en el 36,4% de los casos; el uso de SU se producía en el 31,1% de los pacientes, en el 66% de los casos fuera de indicación. Esta importante discrepancia puede ser debida a la implicación de los médicos investigadores en el seguimiento de sus pacientes diabéticos (en nuestro estudio) o bien al infrarregistro de la prescripción. Muller et al.24 informan en su estudio de una utilización de metformina en el 45,2% de los pacientes (49,3% fuera de indicación), del 32,2% en el caso de SU (26,7% fuera de indicación) y del 34,5% respecto a la insulina, con un progresivo aumento de su uso según el deterioro de la función renal. En otro estudio francés30, utilizaban metformina el 86% de los pacientes (33% fuera de indicación), SU el 32% (20% casos fuera de indicación) e insulina el 19% de los pacientes (61% en estadios más graves de ER). En el estudio suizo10, el 74% utilizaban metformina (43,8% fuera de indicación), 20,5% usaban SU (9,4% fuera de indicación) y el 28,9 seguían tratamiento con insulina (50% en estadios G4-G5 de la ERC). En el estudio de Wu et al.8, el 55,6% de los diabéticos utiliza metformina (6,5% en el estadio G4-G5 de ER), el 35,4% usa SU (en más del 50% de los caso fuera de indicación) y el 18,9% utiliza insulina (38% en estadios G4-G5 de ER). Este estudio también informa del uso de inhibidores del sistema renina-angiotensina-aldosterona para el tratamiento de la HTA en el 62% de los pacientes (en nuestro estudio lo hacen casi el 70%) y del uso de diuréticos tiazídicos en el 23,7% de los hipertensos diabéticos (33,4% en estadio G4 de ERC), mientras que en nuestro estudio utilizan este grupo de fármacos un 38,7% de diabéticos hipertensos, solamente un 1,7% con FGe <30mL/m 1,73 m2 situación en la que no se recomienda su uso por falta de utilidad. En definitiva, aunque los diversos estudios tienden a reflejar, en su patrón de prescripción, las recomendaciones de las guías para el tratamiento de individuos con ERC31, llama la atención el número de pacientes que usan algunos ADO fuera de indicación.
En nuestro estudio, un 7% de los pacientes presentaba un grado de dependencia moderada-total y el 42,8% tienen una alta comorbilidad, relacionándose ambas entidades con el deterioro de la función renal; un 56,1% de los pacientes con dependencia moderada y un 34,8% de aquellos con dependencia grave presentan insuficiencia renal, un 17,7% de los pacientes con comorbilidad media y un 46,1% de aquellos con comorbilidad alta tienen IR. Es preciso destacar que en el estudio Morbilidad Enfermedad REnal en pacieNtes diAbéticos y no diabéticos (MERENA)32,33, puesto en marcha por el Grupo Español de Estudio de la Nefropatía Diabética, los datos basales del estudio correspondientes a 1.129 pacientes en estadios 3 y 4 de ERC, muestran que la cohorte de pacientes diabéticos (40,8% del total, 91,7% DM2) presenta mayor morbilidad cardiovascular que la población no diabética. Por otra parte, en el estudio de Kim et al.34, realizado en Corea, los pacientes tenían un Índice de Charlson medio de 3,3 (2,7 en nuestro estudio) y el 60,8% de los pacientes presentaban una comorbilidad alta (Charlson ≥3) asociándose con el doble de riesgo de episodios hipoglucémicos.
El análisis multivariante apoya las investigaciones previas que identifican la edad avanzada, HTA tratada y la presencia de una alta comorbilidad como factores potenciales de la ERC en la población diabética. Por el contrario, no hemos encontrado asociación con la duración de la DM, HbA1c y género informadas en otros estudios4,8,12.
Los puntos fuertes de nuestro trabajo son: primero, recoge características de un grupo de pacientes poco representados en los ensayos clínicos, en la práctica clínica habitual. Segundo, mide el grado de dependencia y comorbilidad de los participantes.
Por otra parte el estudio tiene varias limitaciones: la albuminuria solo fue aportada por el 65,5% de los pacientes y solo se ha recogido una determinación analítica, lo que es habitual en estudios epidemiológicos pero no permite distinguir entre una alteración pasajera y persistente. Por lo tanto, las estimaciones de ERC informadas en este trabajo pueden ser más altas de lo que serían si se repitieran las medidas del FGe y CAC para cumplir con los criterios KDIGO16 y del documento de consenso español17, de persistencia de las alteraciones durante 3 meses o más, para el diagnóstico clínico de la enfermedad renal crónica; el disponer de valores de CAC en todos los participantes podría disminuir la posible sobreestimación, de hecho cuando en el análisis se consideran solamente los pacientes que aportaron albuminuria la prevalencias de ERC fue del 39,5%. Tampoco se ha tenido en cuenta la raza para el cálculo del FGe, situación poco relevante dadas las características homogéneas de la población estudiada.
ConclusionesLa ERC es frecuente en la población diabética de edad avanzada y se asocia con una alta frecuencia de enfermedades crónicas concomitantes y mayor grado de dependencia. El empleo de metformina y sulfonilureas en estadios avanzados de IR es escaso pero debería ser ajustado o eliminado, según el caso, por inadecuado. Insistir en la necesidad de determinar el CAC en orina como herramienta indispensable para la detección de la ERC, ya que estos pacientes con diabetes y ERC requieren una cuidadosa atención y monitorización. Tienen alto riesgo de padecer enfermedades cardiovasculares y de sufrir efectos secundarios de los medicamentos. Sin embargo, es probable que estos problemas se infraestimen comúnmente en la práctica clínica, por lo que debe hacerse mayor hincapié en la educación de los profesionales para actuar en estas situaciones.
FinanciaciónPara la realización del estudio se ha contado con una beca de colaboración entre la Sociedad Española de Diabetes y Boehringer-Ingelgeim. Las fuentes financieras no han tenido ningún papel en el diseño del estudio, recogida de datos o interpretación de los mismos. Tampoco han participado en la preparación, revisión o aprobación del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Daniel Bordonaba Bosque, del Instituto Aragonés de Ciencias de la Salud, por el tratamiento estadístico de los datos.
A los investigadores del estudio ESCADIANE en España:
Andalucía: Acosta González MD, Ávila Lachica L, Cano García MS, Carretero Anibarro E, Cobo Burgos S, Fábrega Escolá G, Fernández Baena M, García Lozano MJ, Garrido Redondo N, Ginel Mendoza L, Gómez García MC, Iranzo Luna AM, Losada Ruiz C, Martín Montero G, Pérez Verdugo J, Requena Carrión E, Ruiz Serrano M, Velázquez Lupiáñez L, Vergara Martín J.
Aragón: Ariza Ortín R, Canta Castro L, Chicote Abadía B, Gil Orna P, Gracia Tricas MM, Millaruelo Trillo JM, Rascón Velázquez MS, Sangrós González FJ, Sanz Rebollo G, Torrecilla Conde J.
Baleares: Angullo Martínez E, Segui Díaz M.
Canarias: Álvarez Hernández SM, Carrillo Fernández L, Fernández JA.
Cantabria: Arnaiz de las Revillas JM.
Castilla León: Gamarra Ortiz J, Gutiérrez Almarza MA, Sánchez Cabrero LG.
Castilla La Mancha: Gómez González L.
Cataluña: Barrot de la Puente J, Benito Badorrey B, Bobe Molina I, Cuatrecasas Cambra G, Franch Nadal J, Hidalgo Ortiz M, Luna Redondo G, Mata Cases M, Mur Martí T, Prats de la Iglesia P, Rodero Nuño M, Ruiz Tamayo I.
Extremadura: Carramiñana Barrera F, Igual Fraile D.
Galicia: García Soidán FJ, Malo García F, Martínez Vidal A, Navarro Echeverría MA. La Rioja: Babace Istúriz C, Torres Baile JL.
Madrid: Artola Menéndez S, Bedoya Frutos MJ, García Caro MG, Ibañez Brillas M, López Palomar R, Nogales Aguado P, Rollán Landeras MT, Sala Arnaiz C, Serrano Martín R, Yanes Baonza M.
Murcia: Álvarez García B, Granero Fernández E, Hernández Menarguez F, Martínez Candela J.
Navarra: Astrain Jaunsaras L, Buil Cosiales P, Díez Espino J, Escriche Erviti L, Fernández Clavero E.
País Vasco: Ezcurra Loiola P.
Valencia: Marco Macián MD, Salanova Peñalba A.