Los pacientes con insuficiencia renal crónica (IRC) corren mayor riesgo de desarrollar enfermedad cardiovascular. En los pacientes con IRC, los mecanismos implicados en la disfunción endotelial y el papel de los diferentes fármacos utilizados en estos pacientes no se conocen por completo. El objetivo de este artículo es analizar el efecto de las estatinas y los antiagregantes plaquetarios (AP) sobre las microvesículas endoteliales (MVE) y otros marcadores de la disfunción endotelial.
Enfoque experimentalEstudio transversal con 41 pacientes con IRC 3b-4 y 8 voluntarios sanos. Se cuantificaron los niveles de MVE, factor de crecimiento vascular endotelial (FCVE) y productos avanzados de oxidación de proteínas (AOPP, por sus siglas en inglés) en la circulación y se evaluó la correlación con diferentes variables de comorbilidad y estrategias terapéuticas.
ResultadosLas MVE aumentaron en pacientes con IRC al comparar los niveles con los controles (171,1 frente a 68,3/μl; p < 0,001). Se observó una correlación negativa entre la edad y las MVE. Las estatinas y los AP se asociaron con una reducción de los niveles de MVE y FCVE, independientemente de los niveles séricos de colesterol total (CT). Los niveles de AOPP y FCVE no fueron diferentes entre los pacientes con IRC y los controles.
ConclusiónLa IRC se asocia con un cambio de los niveles de MVE, FCVE y AOPP. El tratamiento con estatinas y AP normaliza estos valores a casi los observados en los controles y este efecto es independiente del nivel de CT predominante. Estos hallazgos explican la existencia de los efectos pleiotrópicos de las estatinas y los AP que merecen estudios adicionales.
Patients with chronic kidney disease (CKD) have higher risk of developing cardiovascular disease. In CKD patients the mechanisms involved in, endothelial damage and the role of different drugs used on these patients are not completely understood. The aim of this work is to analyze the effect of statins and platelet antiaggregant (PA) on endothelial microvesicles (EMVs) and other markers of endothelial dysfunction.
Experimental approachCross-sectional study of 41 patients with CKD 3b-4 and 8 healthy volunteers. Circulating levels of EMVs, vascular endothelial growth factor (VEGF), and advance oxidized protein products (AOPPS) were quantified and the correlation with different comorbidity variables and therapeutic strategies were evaluated.
ResultsEMVs are increased in CKD patients as compared with controls (171.1 vs. 68.3/μl, P<.001). It was observed a negative correlation between age and EMVs. Statins and PA were associated with a reduction in EMVs and VEGF levels, independently of the serum total cholesterol levels (TC). The levels of AOPPS and VEGF were not different in CKD vs. controls.
ConclusionCKD is associated with a change in EMVs, VEGF and AOPP levels. The treatment with statins and PA normalizes these values to almost the observed in controls and this effect is independently of the prevailing TC level. These findings explain the existence of the pleiotropic effects of statins and PA which deserve further studies.
Los pacientes con enfermedad renal crónica (ERC) son más propensos a desarrollar enfermedad cardiovascular (ECV), independientemente de su progresión a estadios avanzados. Es un hecho que la principal causa de muerte en los pacientes con ERC es la cardiovascular (CV)1. El desarrollo de ECV en pacientes urémicos involucra procesos complejos de inflamación y disfunción endotelial, cuyo resultado final es la ateroesclerosis. Además, la pérdida de elasticidad de la pared arterial es un hallazgo común en la ERC y se ha descrito como un predictor independiente de eventos CV2.
Las microvesículas (MV) son unos corpúsculos que pueden ser liberados de casi cualquier célula eucariota durante su activación y apoptosis celular3. Durante las últimas décadas se ha demostrado que las MV derivadas del endotelio (MVE) son marcadores sanguíneos útiles para diferentes situaciones patológicas, como la inflamación vascular (aguda o crónica) y la disfunción endotelial4. Es más, muchos estudios han mostrado que las MVE circulantes pueden fusionarse con distintas células, como las células endoteliales y los leucocitos, suministrando componentes de sus células parentales a las células diana3. La medición de los niveles plasmáticos de MVE puede aportar información relevante tanto en sujetos sanos como en pacientes.
Normalmente, el recuento de MVE aumenta después de la inducción de disfunción endotelial aguda o crónica5. Los mecanismos por los que se generan o movilizan estas partículas no son del todo conocidos y se han postulado como reguladores intermedios varios factores de crecimiento y citosinas, tales como el factor de crecimiento endotelial vascular (VEGF)6.
Varios estudios han reportado la asociación entre ERC y MV circulantes, mostrando cambios en los niveles de MV en suero, según el estadio de ERC o el tipo de terapia sustitutiva renal7. Sin embargo, los estudios centrados en MVE circulantes y ERC han obtenido datos contradictorios8,9. Tampoco se ha analizado si los fármacos de uso común en ERC y que actúan sobre la función endotelial (estatinas y antiagregantes) tienen algún efecto en la regulación de estos biomarcadores.
Los productos avanzados de oxidación de proteínas (AOPP) son una familia de proteínas oxidadas que contienen ditirosina, que se generan durante el estrés oxidativo, medibles en plasma y que son útiles como marcador temprano de daño tisular oxidativo. También se han descrito como mediadores activos de la inflamación asociada con el estado urémico10.
El objetivo de este estudio fue analizar el efecto que tiene el uso de estatinas y antiagregantes plaquetarios (AP) sobre las MVE circulantes y la expresión de marcadores séricos de disfunción endotelial, estrés oxidativo e inflamación como AOPP y VEGF en una cohorte de pacientes con ERC. Así mismo, analizar su relación con otros factores de riesgo CV (FRCV).
Material y métodosSe realizó un estudio transversal a partir de 41 pacientes con ERC. Se excluyó a los pacientes con historia de enfermedades autoinmunes como lupus, vasculitis o glomerulonefritis con signos de actividad en el sedimento urinario. El grupo control estaba formado por 8 voluntarios sanos.
El estudio fue aprobado por el comité de ética e investigación clínica del Hospital Universitario Puerta de Hierro Majadahonda y todos los participantes proporcionaron su consentimiento por escrito antes de su inclusión. Los datos demográficos, de laboratorio estándar (nivel de colesterol total [CT] y fracciones, ácido úrico, creatinina sérica, etc.) y tratamiento farmacológico se recogieron de los historia clínica electrónica estructurada (Nefrolink®, Sistema de información renal Versión 4.5.2017.5. Fresenius Medical Care y Selene®, Siemens).
Recolección de sangre, aislamiento y análisis por citometría de flujo de microvesículas endotelialesSe extrajeron muestras de sangre con una aguja de calibre 21 G después de aplicar un torniquete ligero. Se descartaron los primeros 4ml, se recogió la sangre en tubos con citrato trisódico al 3,2% (Becton Dickinson [BD], Plymouth, Reino Unido). Veinte minutos después de la recogida, se centrifugó el plasma a 1.500g, sin freno, durante 20 min a temperatura ambiente. El plasma se centrifugó adicionalmente durante 2 min a 13.000g para obtener plasma pobre en plaquetas, de acuerdo con el método desarrollado anteriormente con modificaciones menores11. Se congelaron instantáneamente alícuotas de plasma y se almacenaron a –80°C hasta su uso.
La caracterización de los MVE se realizó como se ha descrito previamente en otros estudios11 utilizando citometría de flujo (Beckman Coulter Cytomic FC 500, CoulterInc, Fullerton, CA, EE. UU.) con el software CXP (Beckman Coulter). De acuerdo con el diagrama de detector de dispersión lateral vs. detector de dispersión frontal, se consideraron MV aquellos eventos con un tamaño entre 0,5-1,5μm. Este sistema se estableció previamente en un experimento de estandarización utilizando esferas fluorescentes calibradas con tamaños que varían desde 0,1 hasta 1,9μm (SPHERO ™ Flow Cytometry Nano Fluorescent Size Standard Kit, Spherotech, Lake Forest, IL, EE. UU.). Para la caracterización de las MVE plasmáticas se realizó un etiquetado triple fluorescente. Se incubaron 100ml de plasma pobre en plaquetas con anticuerpo anti-CD31 monoclonal marcado con isotiocianato de fluoresceína (BD Pharmingen, San Diego, California, EE. UU.), anticuerpo monoclonal anti-CD42b (Abcam, Cambridge, MA, EE. UU.) de Peridinin Chlorophyll Protein Complex, y kits de ficoeritrina-anexina V (BD Pharmingen, San Diego, California, EE. UU.) en tampón de unión de anexina V (HEPES 10mM, pH 7,4, NaCl 140mM, CaCl2 2,5mM) siguiendo las instrucciones del fabricante del kit de anexina.
Para identificar las MV unidas a anticuerpos monoclonales específicos de células, las MV fueron incubadas con concentraciones idénticas de anticuerpos de control isotípico para establecer el umbral.
Solo se definieron como eventos CD31+/CD42b–, debido a que las MV derivadas de células endoteliales y de plaquetas expresan CD31 pero solo estas últimas también manifiestan CD42b. El número absoluto de MVE por microlitro se cuantificó de acuerdo con las especificaciones del fabricante usando gránulos de recuento celular para citometría de flujo (Beckman Coulter Inc, Fullerton, CA, EE. UU.).
Productos avanzados de oxidación de proteínas y factor de crecimiento endotelial vascularLa concentración plasmática de AOPP se midió en muestras de plasma en ayunas recogidos en tubos con etilendiaminotetraacético (EDTA) y se mantuvieron congeladas a –80°C. La concentración de AOPP se midió mediante Western-Blot utilizando el kit de detección de oxidación de proteínas Oxy Blot™, número de catálogo, S7150, Millipore (Merck, KGaA, Alemania).
Los niveles de VEGF se analizaron en suero mediante ELISA utilizando el kit Quantikine VEGF ELISA (R & D Systems, Minneapolis, EE. UU.).
Análisis estadísticosLos resultados se expresan como porcentaje, mediana y rango o rango intercuartílico (RIC), excepto donde se indique lo contrario. Las diferencias entre los grupos se evaluaron por el test de la chi al cuadrado, el test exacto de Fisher, Kruskal-Wallis, el test de los rangos con corrección de Bonferroni o ANOVA, según las variables estudiadas (análisis post hoc realizados con test de Tukey). Se realizó un análisis de regresión lineal para determinar el nivel de MVE según tomen estatinas o antiagregantes, ajustado para niveles de CT, indicando el valor β y su intervalo de confianza (IC) del 95%. Las diferencias se consideraron significativas cuando los valores de p fueron inferiores a 0,05. Todos los análisis se realizaron con software SSPS v 15.0 (Spss Inc. Chicago, IL, EE. UU.) y Stata (StataCorp 2015. Stata Statistical Software: Release 14. College Station, TX: StataCorp LP, EE. UU.).
ResultadosSe analizaron las muestras de 41 pacientes, la mediana de edad fue de 51,5 años (RIC 42,5-72,5), un 39% de los pacientes eran diabéticos, un 85,4% hipertensos y un 9,8% presentaban antecedente de cardiopatía isquémica.
La causa más frecuente de ERC de la población estudiada fue la nefropatía diabética con un 39%, seguida por otras causas o no filiada con un 19%, enfermedad poliquística con un 14,6%, enfermedad glomerular con un 14,6% y vascular con un 12,2%.
La mediana del filtrado glomerular estimado (FGe) mediante la ecuación Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) fue de 31,9ml/min, (48,8% con un FGe <30 ml/min).
Respecto al tratamiento farmacológico, la mayoría de los pacientes recibían inhibidor de la enzima conversora de angiotensina (IECA) o antagonistas de los receptores de la angiotensina ii (ARA-II) (78%), estatinas (48,8%) y AP (14,3%).
Niveles de microvesículas endoteliales en la enfermedad renal crónicaDetectamos un aumento en las MVE circulantes en los pacientes con ERC en comparación con los controles (171,1 MVE/μl vs. 68,3 MVE/μl, p <0,001), sin presentar ninguna correlación entre el FGe y la cantidad de MVE circulantes.
Al analizar la población con ERC, no encontramos diferencias en función del tratamiento recibido, para IECA/ARA-II, diuréticos, betabloqueantes, ni eritropoyetina.
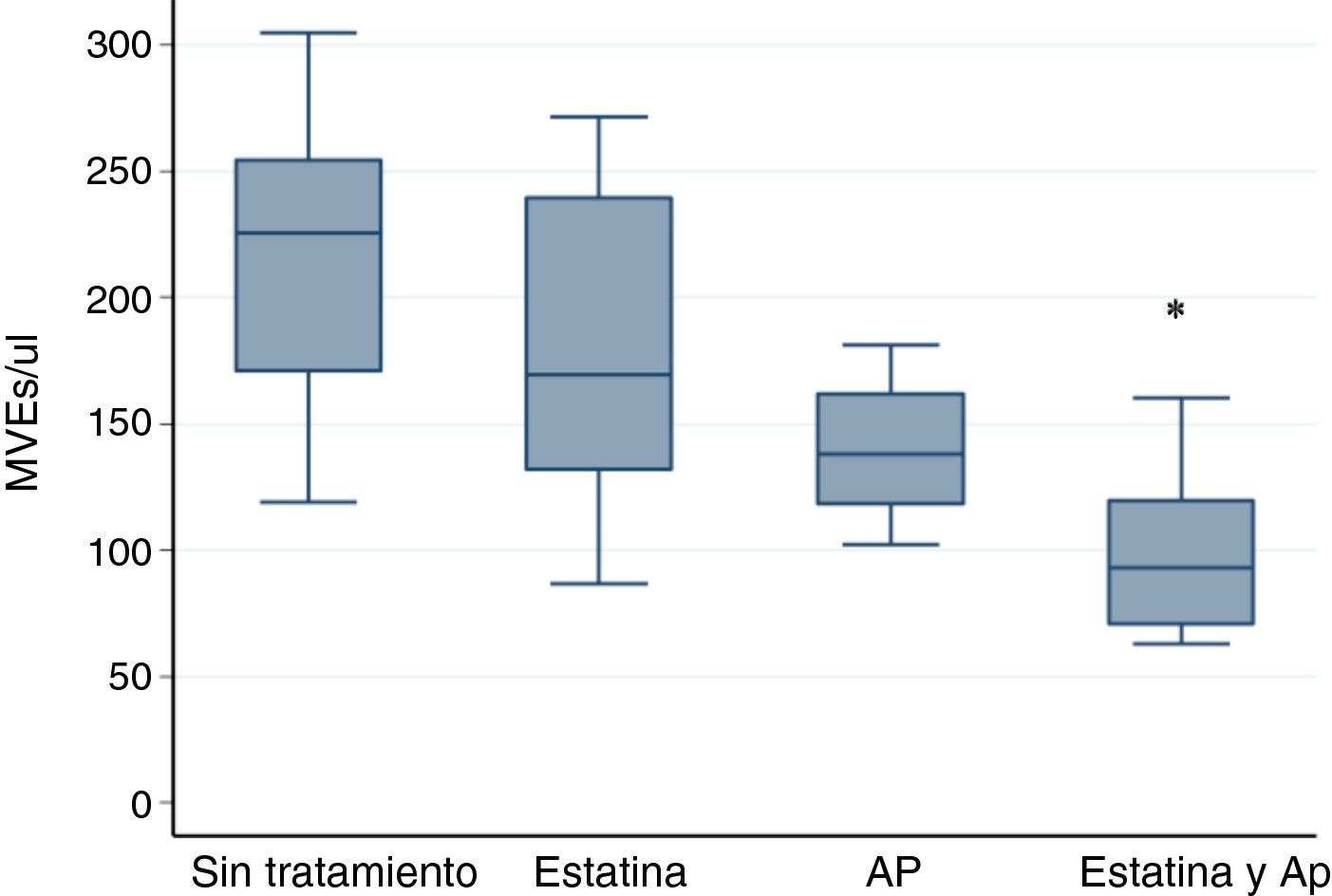
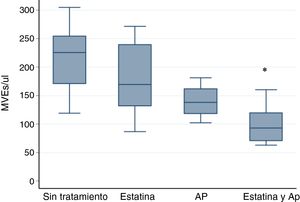
Solo la asociación de estatina y AP disminuye significativamente la cantidad de MVE. Los niveles para cada grupo fueron: sin tratamiento (ST) 225,55 MVE/μl (119,11-304,88); estatina 169,33 MVE/μl (86,9-271,56); AP 138,33 MVE/μl (102,44-181,11); estatina y AP 93,11 MVE/μl (63,11-160,22), con una p <0,001 según el test de Kruskal-Wallis. El análisis post hoc con el test de los rangos con corrección de Bonferroni solo indica diferencias estadísticamente significativas entre el grupo de estatina y AP vs. el de ST p <0,001 (fig. 1).
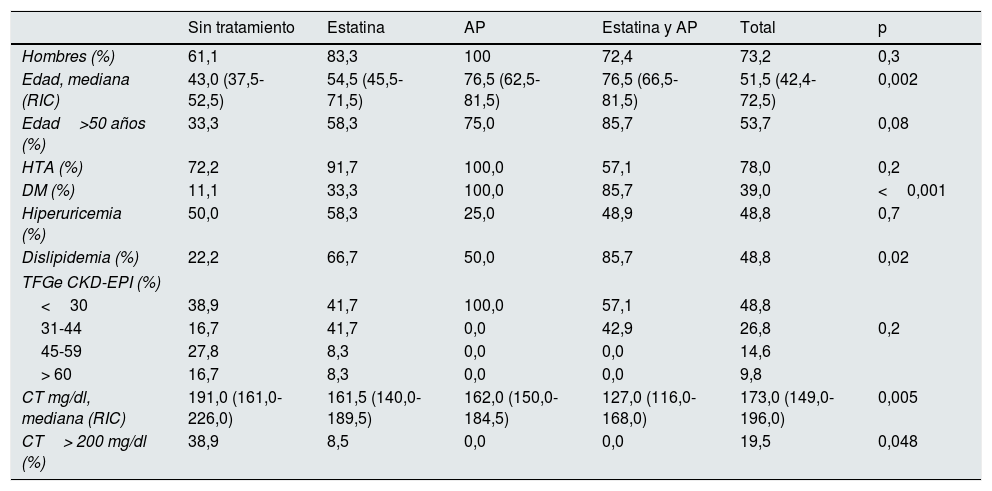
En la tabla 1 se describen las características basales según el tratamiento recibido. Los pacientes en tratamiento con estatina o AP eran mayores, tenían un mayor porcentaje de diabetes mellitus (DM) y tenían niveles de colesterol sérico total (CT) más bajos.
Características basales según tratamiento recibido
| Sin tratamiento | Estatina | AP | Estatina y AP | Total | p | |
|---|---|---|---|---|---|---|
| Hombres (%) | 61,1 | 83,3 | 100 | 72,4 | 73,2 | 0,3 |
| Edad, mediana (RIC) | 43,0 (37,5-52,5) | 54,5 (45,5-71,5) | 76,5 (62,5-81,5) | 76,5 (66,5-81,5) | 51,5 (42,4-72,5) | 0,002 |
| Edad>50 años (%) | 33,3 | 58,3 | 75,0 | 85,7 | 53,7 | 0,08 |
| HTA (%) | 72,2 | 91,7 | 100,0 | 57,1 | 78,0 | 0,2 |
| DM (%) | 11,1 | 33,3 | 100,0 | 85,7 | 39,0 | <0,001 |
| Hiperuricemia (%) | 50,0 | 58,3 | 25,0 | 48,9 | 48,8 | 0,7 |
| Dislipidemia (%) | 22,2 | 66,7 | 50,0 | 85,7 | 48,8 | 0,02 |
| TFGe CKD-EPI (%) | ||||||
| <30 | 38,9 | 41,7 | 100,0 | 57,1 | 48,8 | |
| 31-44 | 16,7 | 41,7 | 0,0 | 42,9 | 26,8 | 0,2 |
| 45-59 | 27,8 | 8,3 | 0,0 | 0,0 | 14,6 | |
| > 60 | 16,7 | 8,3 | 0,0 | 0,0 | 9,8 | |
| CT mg/dl, mediana (RIC) | 191,0 (161,0-226,0) | 161,5 (140,0-189,5) | 162,0 (150,0-184,5) | 127,0 (116,0-168,0) | 173,0 (149,0-196,0) | 0,005 |
| CT> 200 mg/dl (%) | 38,9 | 8,5 | 0,0 | 0,0 | 19,5 | 0,048 |
Se consideran valores significativos con un valor p<0,05.
AP: antiagregantes plaquetarios; CT: colesterol total; DM: diabetes mellitus; HTA: hipertensión arterial; RIC: rango intercuartílico; TFGe: tasa de filtrado glomerular estimado por CKD-EPI ml/min/1,73 m2.
No pudimos realizar un subanálisis con la población diabética debido a que la mayoría recibía tratamiento con estatina o AP.
Encontramos una asociación positiva entre recuento de MVE y niveles de CT. Aquellos pacientes con un CT <200mg/dl tratados con estatinas presentaban niveles más bajos de MVE (191,0 MVE/μl vs. 119,8 MVE/μl, p=0,032). Mediante regresión lineal se identificó que los pacientes en tratamiento con estatinas o AP tuvieron menores niveles circulantes de MVE, independientemente de los niveles de séricos de CT (β = –46,02, IC –88,59 a –3,46).
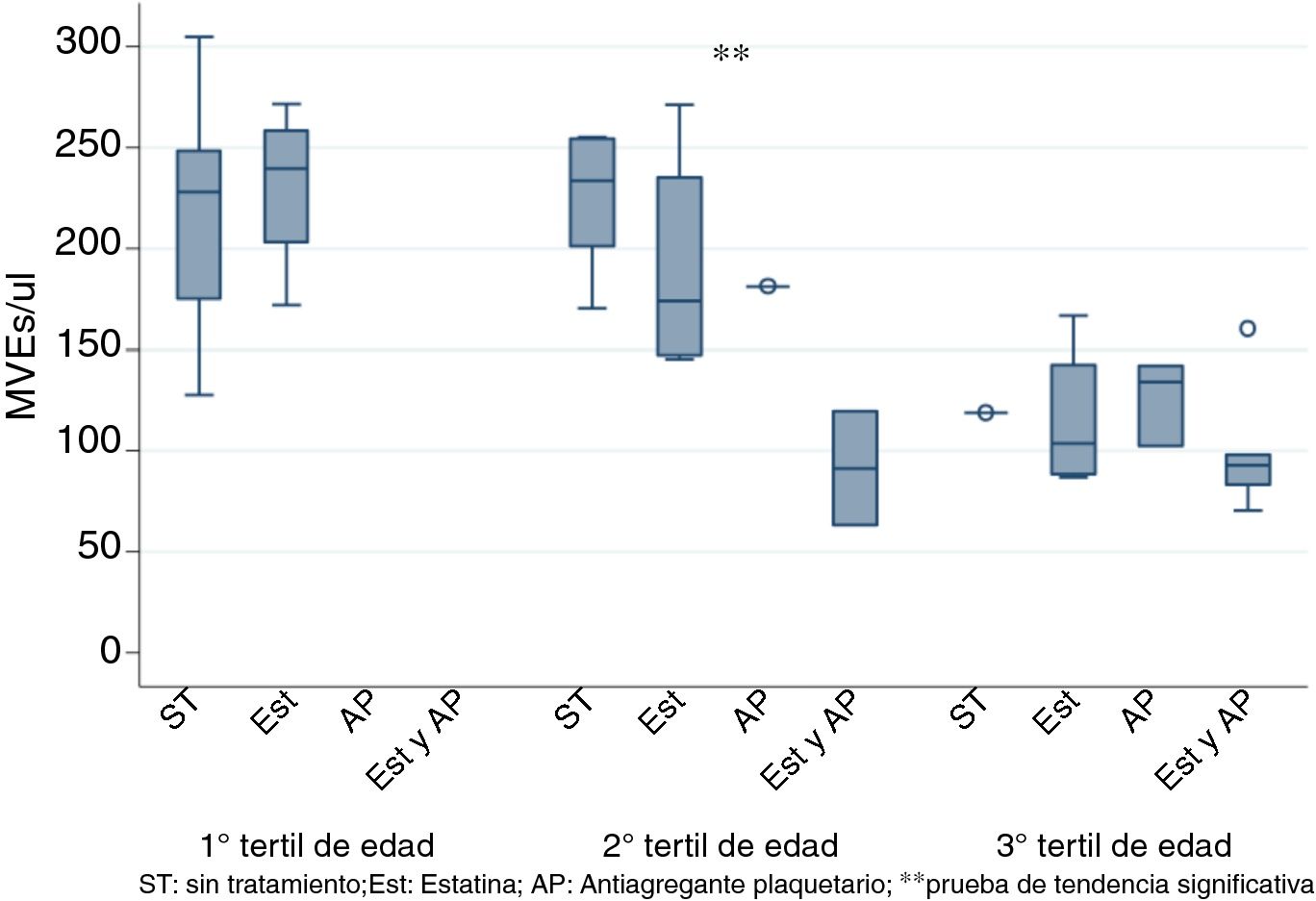
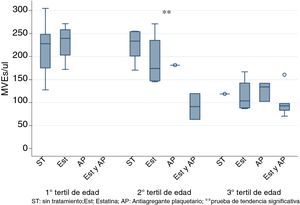
Respecto a la edad, encontramos una correlación negativa entre la edad y los niveles de MVE (test de Spearman p <0,05). Para eliminar el sesgo producido por la edad estratificamos por terciles y observamos que el uso de estatinas y AP de manera conjunta disminuyen los niveles de MVE. Esta diferencia es solo significativa para el segundo tercil de edad (50-70 años), como se muestra en la figura 2 (test de tendencia K tau <0,05).
Valores de MVE estraficando la población por tertiles de edad.
Se indica la significación estadística del test de tendencia K tau con 2asteriscos (**) y los valores outliers con este símbolo (o).
Los gráficos de cajas indican mediana y rango intercuartílico.
MVE: microvesículas endoteliales.
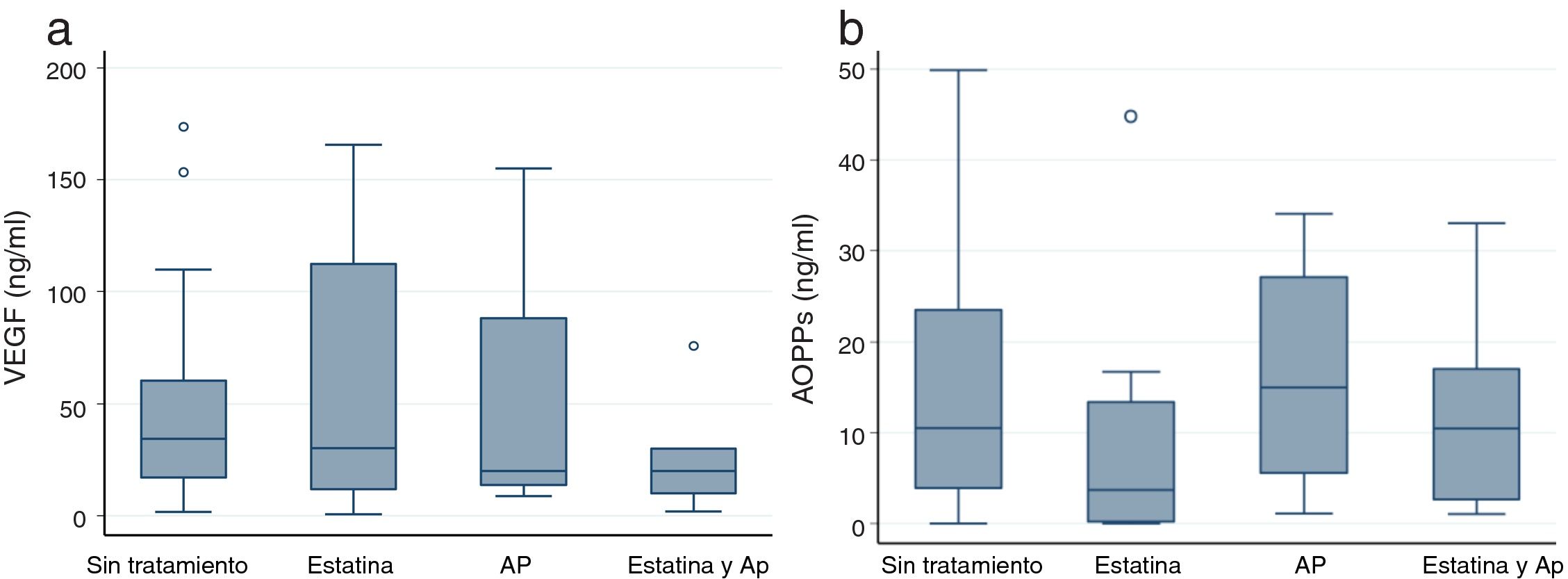
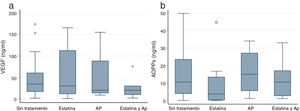
No hemos encontrado diferencias en los niveles séricos de VEGF entre los grupos de ERC y control. El tratamiento con estatinas y AP tuvo un efecto sobre los niveles séricos de VEGF similar al observado en las MVE circulantes (fig. 3a), aunque sin alcanzar significación estadística.
Valores de AOPP (3a) y VEGF (3b), según el tratamiento con estatina o AP.
Valores de p <0,05 se indican con un asterisco (*) y los valores outliers con este símbolo (o).
Los gráficos de cajas indican mediana y rango intercuartílico.
AOPP: productos avanzados de oxidación de proteínas; AP: antiagregantes plaquetarios; VEGF: factor de crecimiento endotelial vascular.
Objetivamos un aumento en el suero de AOPP en pacientes con ERC en comparación con el grupo control, aunque sin significación estadística (7,51 ng/ml vs. 9,91 ng/ml). El tratamiento farmacológico no mostró ningún efecto sobre los niveles serios de AOPP (fig. 3b).
DiscusiónNuestro trabajo describe, por primera vez en pacientes con ERC, la asociación entre los niveles circulantes de MVE, VEGF, AOPP y los fármacos habitualmente usados en nuestra población, específicamente, el uso de estatinas y AP. Adicionalmente, hemos demostrado un incremento en los niveles circulantes de MVE en pacientes con ERC corroborando el hallazgo previamente descrito por otros autores12.
Sabemos que los pacientes con ERC son más propensos presentar ECV, como se refleja en los estudios epidemiológicos previos1. Existen varios cambios en la estructura y las características funcionales de la pared de la arteria que se han relacionado con la ERC, como la rigidez arterial, la disfunción endotelial y una reducción en la producción de óxido nítrico (ON)13,14. A pesar de que los factores de riesgo tradicionales, como la edad, la hipertensión arterial y la dislipidemia, están asociados clásicamente con estas alteraciones, no son capaces de explicar completamente los cambios observados en los pacientes con ERC. Por ello, necesitamos de nuevas hipótesis que sustenten un modelo fisiopatológico integrado y más completo.
Otros autores han descrito niveles elevados de MVE en pacientes con ERC, de forma similar a lo que sucede en otros pacientes de alto riesgo CV con síndrome coronario agudo o hipertensión4. No conocemos los mecanismos que dan lugar al incremento de las MVE observado en los pacientes con ERC. Para ello, se han propuesto varias hipótesis fisiopatológicas que incluyen el estrés oxidativo, las citocinas y los lipopolisacáridos endógenos15.
Los experimentos de Amabile et al.8 demostraron que las MVE de los pacientes con ERC de cualquier causa generaban disfunción endotelial disminuyendo la generación in vitro de ON y afectando a la relajación en la pared arterial sana dependiente de ON y guanosín monofosfato cíclico. Por lo tanto, las MVE podrían ser más un agente efector que un biomarcador alternativo de daño endotelial en la ECV asociada a la ERC y de este modo podría convertirse una diana terapéutica.
El papel de las estatinas en la formación de las MVE ha sido testado previamente con resultados contradictorios. Probablemente, esto se deba a la complejidad de los mecanismos fisiopatológicos que envuelven la ECV y los efectos de factores de confusión como la edad, el sexo y la comorbilidad asociada. En estudios previos se describe que la atorvastatina disminuye los niveles de MVE circulantes en pacientes con miocardiopatía isquémica, independientemente de los niveles de CT y sus fracciones16, datos que han sido refrendados en nuestro análisis.
Por otro lado, el ensayo clínico de la protección cardíaca y renal (SHARP) demostró que la terapia con estatinas modifica los eventos ateroescleróticos en pacientes con ERC, independientemente de los niveles séricos de CT17, lo que sugiere un efecto pleiotrópico de estos fármacos.
Los estudios in vitro de nuestro grupo han demostrado previamente que la adición de atorvastatina disminuye la producción de las especies reactivas de oxígeno (ROS) inducidas por el indoxil sulfato en las células endoteliales de vena de cordón umbilical (HUVEC) (datos no publicados) que apoyan la hipótesis previa de la existencia de efectos pleiotrópicos de las estatinas sobre las células endoteliales18,19.
Los resultados aquí presentados plantean la posible existencia de otros mecanismos pleiotrópicos de la estatina sobre la pared vascular, en este caso mediado por las MVE.
Los fármacos antiagregantes también han demostrado modificar la cantidad de MVE circulantes en varios escenarios clínicos y experimentales20. En este sentido, Bulut et al.21 demostraron que el tratamiento con ácido acetilsalicílico reduce el número de MVE circulantes en pacientes con enfermedad coronaria aguda por un mecanismo desconocido. Es conocido que la aspirina mejora la función endotelial vascular, por mecanismos independientes de la ciclooxigenasa22, y es discutible si esto podría ejercer efectos cardioprotectores adicionales más allá de los atribuidos a la actividad antitrombótica.
Puesto que las MVE pueden inducir directamente disfunción endotelial, el efecto reductor de la aspirina sobre las MVE circulantes podría explicar el mecanismo de protección endotelial de este fármaco.
Los mediadores inflamatorios, tales como el factor de necrosis tumoral α, la interleucina-1β y la trombina, impulsan la generación de MVE y se cree que estas MV actúan de forma paracrina, induciendo una inflamación vascular adicional23. Se sabe que el VEGF, uno de los principales mediadores de la angiogénesis, tiene potentes efectos de movilización en células endoteliales progenitoras. Sin embargo, su efecto sobre los niveles circulantes de MVE es controvertido. Las MVE han demostrado alterar la angiogénesis en una serie de situaciones clínicas8 y son además promotores de la generación de VEGF en algunos subtipos celulares, como la célula tubular renal (datos descritos por Fernandez-Martínez et al.24).
En nuestra serie, hemos reportado que el tratamiento con agentes antiplaquetarios y estatinas disminuye los niveles séricos de VEGF, sin correlación con niveles de MVE. Por ello, en este estudio no podemos aclarar si ambos fenómenos están relacionados o son mecanismos fisiopatológicos independientes.
Por último, observamos un aumento en el estado de estrés oxidativo estimado por las concentraciones circulantes de AOPP en pacientes con ERC. El estrés oxidativo, definido como una alteración del equilibrio entre la generación de oxidantes y la actividad de los sistemas antioxidantes, desempeña un papel importante en el desarrollo del síndrome inflamatorio asociado con la insuficiencia renal crónica10. Los niveles séricos de AOPP han demostrado ser un muy buen marcador del estrés oxidativo derivado de fagocitos, pero también son mediadores activos del estado inflamatorio asociado con la uremia. En este sentido, Arsat et al. demostraron que los niveles de AOPP ya están aumentados en las primeras etapas de la ERC y aumentan con la progresión de la uremia10. Estudios experimentales indican que los AOPP podrían aumentar el estrés oxidativo en el riñón y estar implicados en la génesis de la glomeruloesclerosis25. De hecho, la administración intravenosa de AOPP en ratas diabéticas aumenta los AOPP en el riñón, promueve inflamación renal, hipertrofia glomerular, sobreexpresión de fibronectina y conduce a la albuminuria24.
En nuestro estudio, la edad se asocia con disminución de los niveles de MVEs, resultados similares a los ya descritos previamente por algunos grupos de trabajo26,27. Eitan et al. sostiene la hipótesis de que las MVs disminuyen con la edad por aumento de su internalización en los leucocitos26 o que sencillamente, estos niveles bajos de MVEs podrían reflejar una desaceleración del proceso de recambio debido a un endotelio senescente con menor metabolismo y actividad celular27. Al analizar el efecto del tratamiento estratificando por edad, observamos que el uso de estatinas y AP guarda correlación con la disminución de los niveles de MVEs siendo significativo en el segundo tercil.
Otro dato que se debe recalcar es el bajo porcentaje de diabéticos ST (estatina y AP). La disminución de MVE circulantes que nosotros observamos en nuestra población diabética no concuerda con análisis reportados previamente acerca de una asociación entre la DM y las complicaciones micro y macrovasculares con un incremento de las MVE28. Esta discordancia podría estar en relación con el efecto del tratamiento con estatina y AP, pero dado que apenas hemos encontrado paciente diabético ST (estatina y AP) en nuestra muestra, no podemos profundizar más en este aspecto.
Nuestro estudio piloto tiene algunas limitaciones. El grupo control está formado por sujetos sanos de edades no pareadas con las de la población a estudio y sin comorbilidad asociada, pero resulta imprescindible incluir estos resultados dada la ausencia de valores de referencia de normalidad para estos factores.
Por último, es importante recalcar la variabilidad de las medidas efectuadas, dado que son medidas no convencionales. Para intentar minimizar este posible error, utilizamos rectas patrón interensayo, que permiten homogeneizar resultados. Además, determinamos cada muestra por triplicado, utilizando la media de las determinaciones.
ConclusionesEste grupo ha demostrado que los pacientes con ERC presentan modificaciones en el recuento de MVE circulantes, niveles de VEGF y AOPP. Además, el uso de estatinas y AP se asocia con una corrección de este efecto, indicando la existencia de mecanismos pleiotrópicos de estos fármacos sobre la función endotelial en este grupo de pacientes. En la población con ERC, la edad también parece ser un determinante en el número de MVE. Son necesarios más estudios que aclaren si las MVE actúan como biomarcadores subrogados o son propiamente efectores de daño endotelial.
FinanciaciónFinanciado por Proyecto FIS, Instituto de Salud Carlos III. 2014 Expediente: Q2818018J PI14/00806 y REDInREN RD12/0021/0019 y RD16/009/009 Instituto de Salud Carlos III.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nos gustaría agradecer al Dr. Antonio J. Sánchez López, coordinador científico del biobanco del IIS HUPH-M, y a Paula López, data manager H.U. Puerta de Hierro Majadahonda, Nefrología, por su asistencia técnica en el desarrollo de este trabajo.