El factor de crecimiento de tejido conectivo (CTGF) aparece aumentado en diferentes patologías asociadas a fibrosis, incluidas múltiples enfermedades renales. CTGF participa en procesos biológicos, como la regulación del ciclo celular, migración, adhesión y angiogénesis. Su expresión está regulada por diversos factores implicados en el daño renal, entre los que destacan el factor la angiotensina II, el factor de crecimiento transformante-beta, altas concentraciones de glucosa y situaciones de estres celular. CTGF participa en el inicio y progresión del daño renal al ser capaz de inducir una respuesta inflamatoria y promover la fibrosis, señalándole como una posible diana terapéutica en el tratamiento de patologías renales. En este trabajo revisamos las principales acciones de CTGF en la patología renal, los mecanismos intracelulares de actuación y las estrategias terapéuticas para su bloqueo.
INTRODUCCIÓN
Diversas enfermedades, como desordenes proliferativos y lesiones fibróticas, afecciones de la piel, aterosclerosis, fibrosis pulmonar y diversas patologías renales, presentan niveles elevados de CTGF tisular, localizado principalmente en áreas fibróticas1-5. Aunque clásicamente CTGF se ha considerado como un factor profibrótico, se trata de un factor multifuncional, cuyas actividades biológicas varían según el tipo celular, y que incluyen la regulación de la proliferación/apoptosis celular, angiogénesis, migración, adhesión y fibrosis2,3. En este trabajo hemos revisado el papel de CTGF centrándonos en su importancia en la patología renal.
ESTRUCTURA
CTGF es una proteína secretable, rica en cisteínas, con un peso molecular de 38 KDa, que fue identificada en el medio condicionado de células endoteliales de vena de cordón umbilical6. CTGF, también conocido como CCN2, pertenece a la familia de genes de respuesta temprana CCN, la cual se compone de otros cinco miembros: Cyr61 (proteína rica en cisteína 61), Nov (gen sobreexpresado en nefroblastoma), WISP-1 (proteína secretada inducida por Wnt-1), WISP-2 y WISP-31,2,7,8. Todos los miembros de esta familia se caracterizan por un alto porcentaje de homología en su secuencia de aminoácidos, que oscila entre un 50 y 90%, y presentan 38 residuos de cisteína que se agrupan en dos segmentos (22 en la región N-terminal y 16 en la C-terminal), característico de otros factores de crecimiento, como el factor de crecimiento derivado de plaquetas (PDGF), el factor de crecimiento del nervio y el factor de crecimiento transformante-β (TGF-β)3,9.
Las proteínas de esta familia poseen un péptido señal secretor en la región NH2-terminal y cuatro dominios o módulos conservados9. Estos dominios son: 1) dominio de unión al factor de crecimiento similar a la insulina (IGF), con la secuencia de unión conservada Gly-Cys-Gly-Cys-Cys-X-XCys que se localiza dentro de la región amino-terminal de todas las proteínas de unión a IGF10-12; 2) dominio del factor Von Willebrand tipo C, que participa en la oligomerización y formación de las proteínas13; 3) dominio trombospondina-1, implicado en la unión de macromoléculas solubles y de matriz14; y 4) dominio C-terminal: dominio de dimerización, está implicado en la unión a la superficie celular, posee actividad mitogénica para fibroblastos y es el responsable de la interacción con fibronectina15.
REGULACIÓN
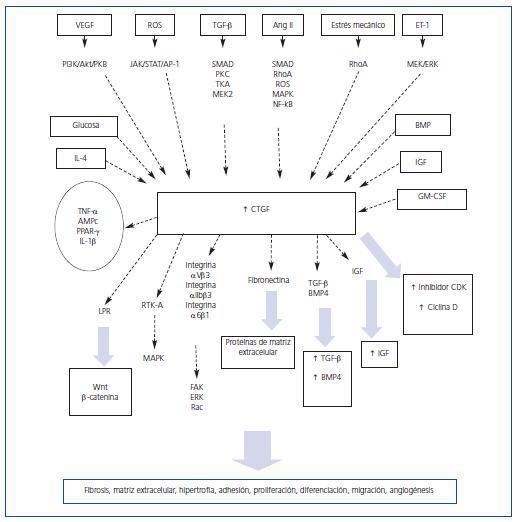
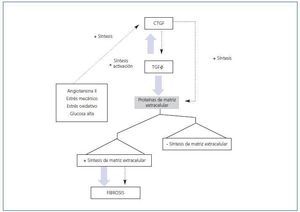
Según el tipo celular, una gran variedad de factores y moléculas están implicadas en la regulación de la expresión de CTGF. Los agonistas de receptores acoplados a proteínas G, factores de crecimiento como TGF-β, la angiotensina II (AngII), la proteína morfogenética del hueso (BMP), el factor de crecimiento del endotelio vascular (VEGF), IGF, el factor de estimulación de colonias de granulocitos/macrófagos (GM-CSF), la interleucina-4 (IL-4), las altas concentraciones de glucosa, la hipoxia, el estrés mecánico y el estrés oxidativo aumentan rápidamente la expresión de CTGF (figura 1)16-24. Sin embargo, otros factores como el factor de necrosis tumoral-α, (TNF-α), interleucina-1β (IL-1β), AMPc y el tratamiento con agonistas del receptor activado por la proliferación de peroxisomas-γ (PPAR-γ), inhiben la expresión de CTGF inducida por TGF-β‚ y AngII en algunos tipos celulares25-29. Diversos mecanismos de señalización se han relacionado con el aumento de CTGF. Entre ellos, se encuentran la vía de señalización de las proteínas Smad, las especies reactivas de oxígeno (ROS), la proteína G pequeña RhoA, la proteína quinasa C (PKC), la quinasa Janus (JAK), la quinasa 3-fosfatidil inositol (PI3K) y las cascadas de quinasas activadas por mitógenos (MAPK)30-33.
La mayor parte de los estudios realizados se han centrado en el estudio de la regulación de CTGF inducida por TGF-β. En el promotor de CTGF se ha descrito un elemento de unión a Smad necesario para su inducción por TGF-β34. En células tubuloepiteliales proximales y en células mesangiales, TGF-β aumenta la producción de CTGF en un proceso regulado por las proteínas Smad y la cascada de señalización Ras/MEK/ERK36,37. Sin embargo, en fibroblastos renales se trata de un proceso mediado por la activación de Rho35. La cascada de señalización de MAPK también desempeña un papel importante en la regulación de CTGF. En hepatocitos, TGF-β induce la expresión y la producción de CTGF a través de ERK1/238, mientras que en fibroblastos de pulmón se trata de un proceso mediado mayoritariamente por la quinasa JNK1/239. Los estudios realizados por nuestro grupo se han centrado en la regulación causada por AngII. En células tubuloepiteliales humanas, AngII induce la producción de CTGF a través de la activación de MAPK (ERK, p38 y JNK) y de la proteína quinasa de Rho, ROCK39. La implicación de Rho en la regulación de CTGF se ha descrito en muchos tipos celulares, incluyendo fibroblastos de pulmón y células de músculo liso vascular34,41. En estas últimas, CTGF aumenta en respuesta a AngII a través de otras vías como ROS, las proteínas Smad y las quinasas p38, JNK1/2, ROCK, PKC y PTK34,42. En fibroblastos, los inhibidores de ERK1/2 y JNK1/2, pero no p38, disminuyen la expresión de CTGF estimulada por AngII43. Sin embargo, en células mesangiales de rata, entre las rutas implicadas en la producción de CTGF causada por AngII encontramos la producción de ROS y p3829. Estudios moleculares recientes han revelado la presencia de un sitio de unión NF-κB altamente conservado en la región proximal del promotor de CTGF44. En células mesangiales hemos observado que el bloqueo del NF-κB disminuye la producción de CTGF causada por AngII (datos no publicados), lo que sugiere que la activación del factor de transcripción NF-κB está implicada en la regulación del CTGF en el riñón.
TRANSDUCCIÓN DE LA SEÑAL Y FUNCIONES BIOLÓGICAS DE CTGF
Aún no se conoce un receptor específico para CTGF. Sin embargo, se ha descrito que interacciona con diversas proteínas, como receptores tirosín-quinasa e integrinas, que activan múltiples sistemas de señalización. Los primeros estudios de interacción revelaron que existen complejos «receptor-CTGF» con un peso molecular de unos 280 KDa en condrocitos, osteoblastos y células endoteliales45. En diversos tipos celulares, CTGF actúa a través de su unión a diversas integrinas, como la integrina α5β1 o αIIbβ3, a receptores de proteoglicanos heparan sulfato, activando varias quinasas como la quinasa de adhesión focal (FAK), ERK y Rac16,47-49, y al receptor macroglobulina de la proteína relacionada con el receptor de lipoproteínas de baja densidad (LPR)46 (figura 1). A través de su dominio rico en cisteínas se une de forma directa a BMP-4 y TGF-β50 por su dominio carboxilo-terminal interacciona con fibronectina51 y mediante el dominio aminoterminal se une a IGF52. En células mesangiales humanas, el CTGF interacciona con el sistema dual de receptores tirosín-quinasa A (RTK-A) y p75NTR que participa en la transducción de señales de neurotrofina (figura 1). Los receptores de tirosín-quinasas unen una gran cantidad de proteínas adaptadoras y activan múltiples vías de señalización intracelular, lo que estaría en concordancia con las propiedades multifuncionales de CTGF66, que incluyen la regulación y la síntesis de matriz extracelular (MEC)4,53,54, migración de células endoteliales y angiogénesis, regulación del ciclo celular55, apoptosis de células mesoteliales56, supervivencia de células hepáticas y mesangiales57,58, proliferación y diferenciación de fibroblastos y condrocitos59,60. En riñón, CTGF participa de forma activa en la fibrosis y la transición epitelio mesenquimal (TEM) y, como hemos descrito recientemente, en la regulación de la respuesta inflamatoria, como se comenta con más profundidad a continuación.
RELACIÓN ENTRE EL CTGF Y EL TGF-β
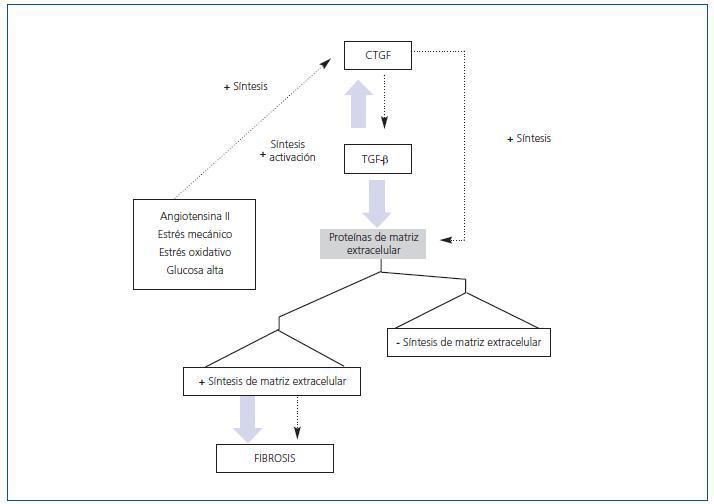
Hay numerosas evidencias que demuestran que el TGF-β participa en los procesos fibróticos in vivo. Se ha descrito que CTGF y TGF-β actúan de manera sinérgica para promover fibrosis crónica (figura 2). En ratones, la coinyección subcutánea de ambos produce una fibrosis sostenida y persistente. En varios modelos experimentales, como la obstrucción unilateral del uréter, nefritis por anticuerpos anti-Thy1, glomeruloesclerosis diabética, infusión de AngII61-63, TGF-β y CTGF, se encuentran aumentados en etapas avanzadas de fibrosis, indicando que estos factores contribuyen a la progresión del daño renal (figura 3). Se ha descrito que el CTGF se une directamente al TGF-β. Esta unión lleva a una potenciación de la actividad del TGF-β. El mecanismo se basa en una función de chaperona del CTGF que incrementa la afinidad del TGF-β por sus diferentes receptores, por lo que sus respuestas son más intensas y prolongadas64. Esta no es la única forma por la que el CTGF ayuda a las respuestas del TGF-β. La producción endógena de CTGF por el TGF-β lleva a una supresión transcripcional del Smad-7 a través de la inducción del factor de transcripción del gen de respuesta temprana inducible por TGF-β (TIEG-1). Mediante este mecanismo, el TGF-β bloquea la regulación por retroalimentación a través del Smad-7, perpetuando la activación de la señalización del TGF-β32. Esto puede ser relevante en condiciones patológicas en las que la expresión del CTGF está aumentada.
El bloqueo de la actividad del TGF-β con anticuerpos neutralizantes y/o decorina, un secuestrador de su forma activa, ha demostrado una reducción de la fibrosis en modelos experimentales de daño renal. Sin embargo, el ratón deficiente en TGF-β es letal, desarrollando un defecto en la reparación de herida, con problemas en los depósitos de colágeno, y presenta un fenotipo hiperinflamatorio65. Esto sugiere que se debe encontrar una diana terapéutica que sea más específica para las enfermedades fibróticas. Los ratones heterocigotos para la deleción del gen del CTGF presentan defectos en la organización y la síntesis de la matriz durante la osteogénesis, teniendo como resultado un defecto mayor en el desarrollo del componente esquelético de la caja torácica y, consecuentemente, mueren inmediatamente después del nacimiento66.
Además, es un mediador de la fibrosis causada por TGF-β y otros factores implicados en daño tisular, por lo que CTGF podría ser una diana nueva más útil en las terapias antifibróticas.
CTGF COMO MEDIADOR DE LA FIBROSIS RENAL y TRANSDIFERENCIACIÓN EPITELIO-MESÉNQUIMA (TEM)
En el riñón sano, CTGF no se expresa, pero este factor se induce en patologías renales humanas, incluyendo glomerulonefritis, glomeruloesclerosis y nefropatía diabética, correlacionándose sus niveles de expresión con la gravedad y la progresión de la fibrosis renal5,67-69. Nuestro grupo ha utilizado el modelo de daño renal causado por la infusión sistémica de AngII en ratas para estudiar el papel de CTGF en el inicio y progresión del daño renal in vivo.
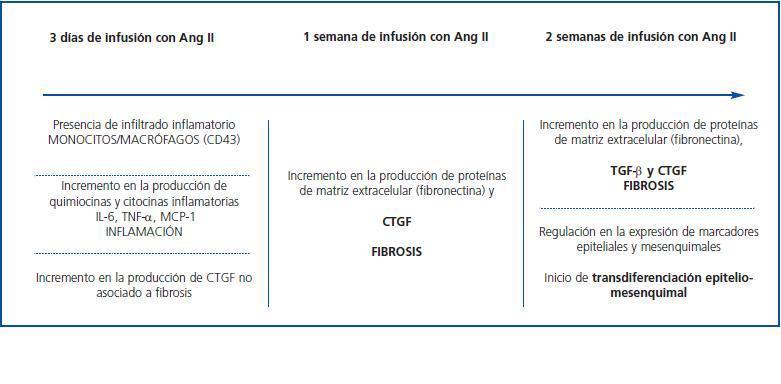
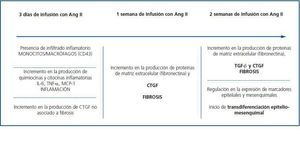
La infusión de AngII induce la expresión de CTGF renal rápidamente, apareciendo a los tres días, y se mantiene elevada hasta las dos semanas, tiempo final del estudio (figura 3). La aparición de CTGF, observada a los tres días de infusión en células tubuloepiteliales y glomerulares, precede en el tiempo a la acumulación de MEC (caracterizado por aumento en el depósito de fibronectina), observada tras una semana, indicando que CTGF puede actuar como mediador de la fibrosis renal causada por AngII in vivo70. Mediante estudios in vitro en células mesangiales de rata hemos observado que el bloqueo de la síntesis endógena de CTGF, mediante el uso de oligonucleótidos antisentido, previene la producción de fibronectina y colágeno IV causada por AngII43. Estos datos demuestran que CTGF es un mediador de la respuesta fibróticade AngII en el riñón.
La infusión de AngII también aumenta la expresión de TGF-β en el riñón. Este factor es sintetizado como una proteína inactiva, la cual es anclada a la membrana antes de su activación71. En células en cultivo, AngII incrementa la expresión del ARNm de TGF-β, la producción de proteína y la activación de TGF-β latente, en un proceso mediado por trombospondina-172. Los niveles de expresión renal de TGF-β, pero no los de trombospondina-1, aparecen aumentados después de tres días de infusión con AngII. Sin embargo, los niveles proteicos de TGF-β activo no aumentaron hasta las dos semanas73. Esto sugiere que CTGF se induce con anterioridad a TGF-β, participando en el inicio de la fibrosis, y que permanece aumentado hasta etapas avanzadas, contribuyendo a la perpetuación del daño renal (figura 3).
Muchas evidencias sugieren que en condiciones patológicas las células tubuloepiteliales pueden sufrir transición epiteliomesénquima (TEM), convirtiéndose en fibroblastos productores de matriz extracelular y contribuyendo a la fibrosis renal y la progresión de la enfermedad74. En este proceso participan diversos factores, entre los que destacan CTGF, TGF-β, factor de crecimiento de fibroblastos (FGF), IL-1, EGF, productos terminales de glucosilación avanzada (AGES) y AngII39,73,75-78. CTGF promueve transdiferenciación de células tubuloepiteliales humanas a miofibroblastos in vitro y el bloqueo de CTGF da lugar a la inhibición de la transdiferenciación inducida por TGF-β79, por productos terminales de glucosilación avanzada75 y AngII39. En el modelo de daño renal por AngII, el aumento en la expresión de CTGF se mantiene a las dos semanas, coincidiendo con el inicio de la TEM, caracterizada por el aumento en la expresión del marcador mesenquimal α-SMA y la disminución del marcador epitelial E-cadherina73 (figura 3) . Además, el incremento de la expresión de CTGF en el riñón diabético colocaliza sobre el epitelio tubular en sitios de TEM75 . Estos datos se han confirmado en otros modelos experimentales, como nefrectomía 5/6 en ratas, donde el aumento de CTGF se asocia con la sobreexpresión de TGF-β y PDGF en fibroblastos intersticiales y con el aumento de la fibrosis y la gravedad del daño renal80. Con estos datos podemos concluir que CTGF es un inductor de la fibrosis y TEM renal in vivo, actuando como mediador de las acciones de factores profibróticos como TGF-β y AngII. Además, contribuye a la perpetuación de la fibrosis, al interaccionar con TGF-β.
CTGF PARTICIPA EN LA RESPUESTA INFLAMATORIA RENAL
Utilizando el modelo de infusión de AngII, hemos observado que a los tres días hay una clara respuesta inflamatoria en el riñón81, caracterizada por la presencia de células inflamatorias infiltrantes (células T, macrófagos y granulocitos) en áreas tubulointersticiales y glomerulares (figura 3). En estos animales se observa también un aumento en la producción de mediadores inflamatorios clásicos como IL-6, TNF-β y MCP-1, y en la producción de CTGF en células mesangiales y podocitos, y en células tubuloepiteliales70, lo que sugiere que CTGF podría estar implicado en la regulación de la respuesta inflamatoria en situaciones de daño renal. Varios estudios in vitro, en células mesangiales glomerulares, tubuloepiteliales, pancreáticas y hepáticas, han demostrado que CTGF regula mediadores inflamatorios58,82,83.
Nuestro grupo ha demostrado recientemente que la administración sistémica de CTGF en ratones causó una respuesta inflamatoria renal pasadas 24 horas, caracterizada por reclutamiento de células inflamatorias (macrófagos y células T) al intersticio, producción de factores quimiotácticos (MCP-1 y RANTES), citocinas proinflamatorias (INF-γ, IL-6 y IL-4), y activación del factor de transcripción NF-κB84. El tratamiento con parthenolide, inhibidor de NF-κB (24 horas antes de la inyección de CTGF), redujo la respuesta inflamatoria renal, demostrando que este factor es clave en las acciones de CTGF en el riñón84.
ESTRATEGIAS TERAPÉUTICAS FRENTE A LA PROGRESIÓN DEL DAÑO RENAL
En pacientes con nefropatía diabética, se ha descrito que niveles elevados de CTGF en plasma podrían considerarse como un marcador temprano de la progresión de la disfunción renal en el riñón diabético85, y predicen la evolución de la enfermedad renal86. Estudios en pacientes con nefropatía IgA han observado que niveles elevados en orina de CTGF y TGF-β se correlacionan con el grado de daño tubulointersticial87. Por otro lado, en pacientes con daño cardíaco crónico, los niveles de CTGF en plasma dan información sobre la aparición de fibrosis miocárdica, pudiendo considerarlo como nuevo marcador de disfunción cardíaca88. Estos datos sugieren que CTGF podría ser un marcador de la fibrosis y progresión del daño en diferentes enfermedades.
Entre los tratamientos clínicos existentes para detener la progresión del daño renal, el bloqueo de AngII es una de las opciones farmacológicas más extendidas, con probados efectos órgano-protectores89. El tratamiento con antagonistas del receptor AT1 e inhibidores de la enzima convertidora de angiotensina89,90 disminuyen la expresión renal de CTGF y la fibrosis en varios modelos experimentales de daño renal70. Sin embargo, estos fármacos sólo retardan el progreso de la enfermedad, y es necesaria una nueva opción terapéutica para conseguir que regrese la fibrosis renal e impida el proceso de la TEM.
Entre las nuevas opciones terapéuticas, el bloqueo del CTGF es una de las más prometedoras. Actualmente, los estudios de inhibición de CTGF están dirigidos hacia el desarrollo de oligonucleótidos antisentido, ARN de interferencia o anticuerpos neutralizantes que bloqueen CTGF endógeno. Estudios experimentales han demostrado que el bloqueo de CTGF, mediante oligonucleótidos antisentido, reduce la acumulación de MEC en ratones transgénicos para TGF-β1 sometidos a nefrectomía91 y en ratones con nefropatía diabética92. En un modelo de fibrosis hepática, el tratamiento con un ARN de interferencia para CTGF vía vena intraportal atenuó la fibrosis hepática93. Sin embargo, los efectos del bloqueo de CTGF en la respuesta inflamatoria renal aún no se han estudiado, lo que hace necesario profundizar en este campo. Todos estos datos sugieren que el bloqueo de CTGF endógeno podría ser una buena alternativa en el tratamiento de patologías renales asociadas a inflamación y fibrosis.
CONCLUSIÓN FINAL
En esta revisión se muestra la gran complejidad de las vías de señalización intracelular que regulan CTGF, que varían dependiendo del tipo celular y el factor inductor y, además, la existencia de factores activadores y reguladores negativos que condicionan su síntesis y el desarrollo de sus respuestas. Con respecto a la patología renal, CTGF está implicado en todas las etapas del daño renal: participando en la respuesta inflamatoria (a través de la activación del factor NF-κB regulando quimiocinas y citocinas) y promoviendo la fibrosis y la TEM, lo que le señala como una buena diana terapéutica en el tratamiento de las enfermedades renales.
Figura 1.
Figura 2.
Figura 3.