La glomerulonefritis extracapilar (GNEC) pauciinmune o de tipo iii es una de las causas más comunes de glomerulonefritis rápidamente progresiva y suele estar asociada con la presencia de anticuerpos antineutrófilos citoplasmáticos (ANCA). Están reportándose evidencias sobre la importancia de la activación del complemento en la patogénesis de la GNEC.
El objetivo de nuestro estudio fue evaluar el papel pronóstico del depósito de C3 en las GNEC de tipo iii.
MétodosSe estudió a pacientes diagnosticados de GNEC de tipo iii entre 1995 y 2015 (n=72). Comparamos a pacientes con tinción positiva para C3 en el estudio de inmunofluorescencia con aquellos con tinción negativa. Se analizaron variables clínicas e histológicas y se relacionaron con progresión a enfermedad renal terminal.
ResultadosSe encontró tinción positiva para C3 en 22 pacientes de un total de 72 (30,5%).
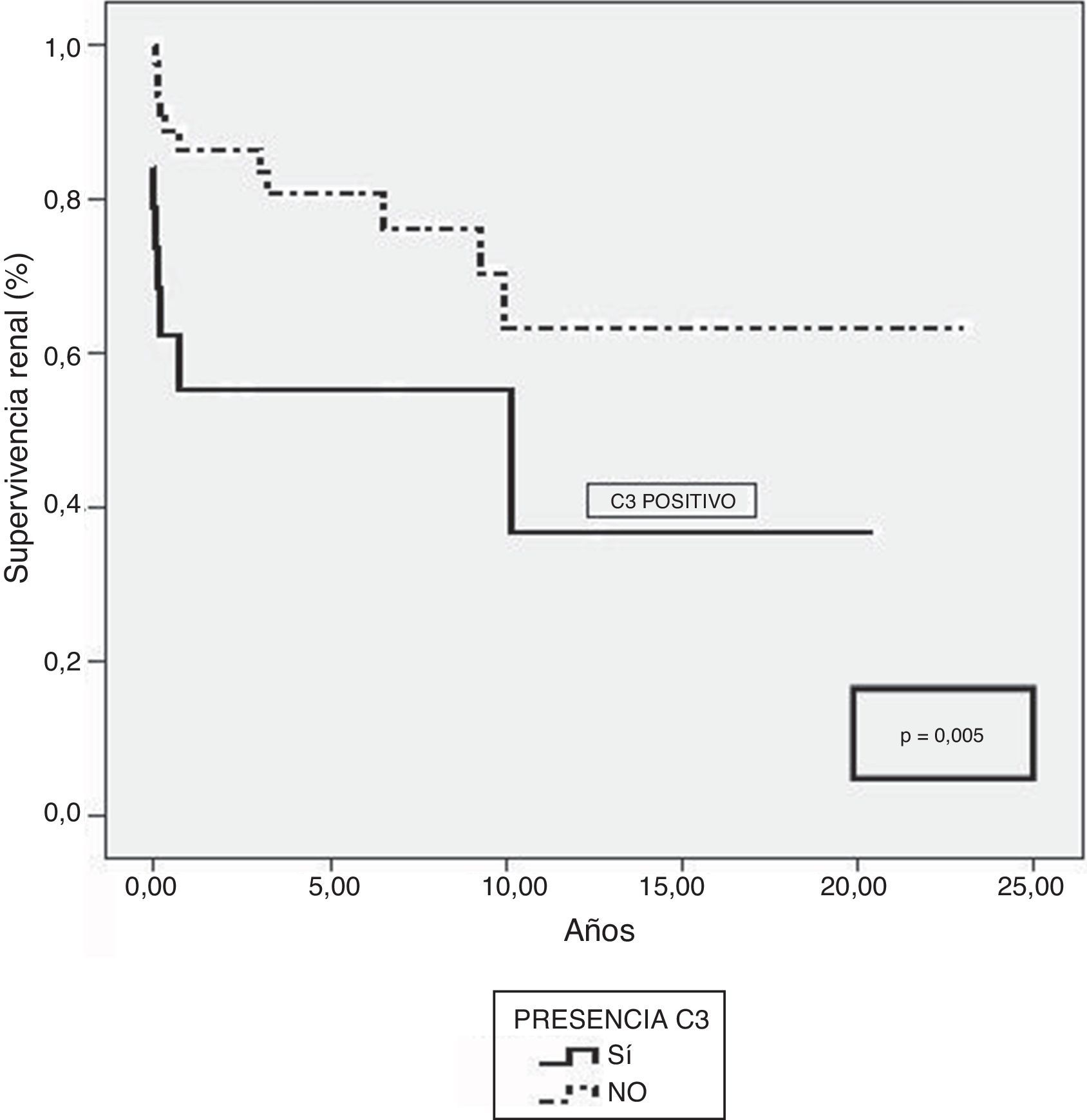
Basalmente los pacientes con depósitos de C3 tenían peor función renal que aquellos sin depósitos (creatinina sérica 5 vs. 3,85mg/dl; p=0,050). La supervivencia renal a los 10 años fue del 36,9% en los pacientes con tinción positiva para C3 frente al 64,4% en los pacientes con tinción negativa (p=0,005). La supervivencia a los 10 años fue peor en los pacientes con depósitos de C3 (77 vs. 49,3%).
ConclusionesNuestro estudio revela que la presencia de depósito de C3 en la GNEC de tipo iii se asocia a un peor pronóstico renal y de la supervivencia del paciente. Estos resultados son compatibles con la hipótesis de que la activación de la vía alternativa del complemento contribuye al daño renal asociado a la GNEC de tipo iii.
Type iii extracapillary glomerulonephritis (PEGN) is a common cause of rapidly progressive glomerulonephritis and it is usually associated with circulating anti-neutrophil cytoplasmic antibodies (ANCAs). Recent evidence points to complement activation as an important factor in the pathogenesis of PEGN.
The aim of the present study was to assess the value of C3 deposits in the prognosis of PEGN.
MethodsAll patients diagnosed of PEGN from 1995 to 2015 (n=72) were included in this study. Progression of renal disease in patients with positive staining for C3 by immunofluorescence was compared with those with negative staining. Mean follow up was 73 months. Progression to end-stage renal disease in relation to clinical and histological variables was analyzed.
ResultsPositive staining for C3 was observed in 22 out of the 72 patients (30.5%).
At the time of diagnosis, patients with C3 deposits had higher serum creatinine concentration than those without C3 staining (5.00 vs. 3.85mg/dl, P=0.050). Renal survival at 10 years was 36.9% in patients with positive C3 staining vs. 64.4% in patients with negative staining (P=0.005). Mortality at 10 years was higher in patients with C3 deposits than in patients without deposits (77 vs. 49.3%).
ConclusionsThus, our study shows that PEGN with deposits of C3 is associated with worse renal prognosis and greater mortality. These results would support the hypothesis that activation of the alternative pathway complement may play an important role in the generation of renal injury associated with PEGN.
La glomerulonefritis extracapilar (GNEC) de tipo iii es una enfermedad glomerular grave que se asocia a un deterioro progresivo de la función renal. El término glomerulonefritis extracapilar es generalmente usado para referirse a las glomerulonefritis con semilunas en más del 50% de los glomérulos. No es una enfermedad específica sino una manifestación de daño glomerular severo causado por muchos factores etiológicos1,2.
Clásicamente se ha asociado a presencia de anticuerpos antineutrófilos citoplasmáticos (ANCA). Los ANCA se dirigen principalmente a 2antígenos, mieloperoxidasa y proteinasa3.
En la patogénesis de esta enfermedad hay aspectos que no están aclarados. El papel del complemento, en el pasado, se suponía que era mínimo4. En el momento actual, y dados los recientes avances, se postula que la activación de la vía alternativa del complemento podría contribuir a la patogenia de esta enfermedad. Modelos experimentales han demostrado la importancia de la activación de la vía alternativa del complemento en esta entidad5.
Son pocos los estudios que han analizado la presencia de factores del complemento en muestras renales. Chen et al.6 observaron el depósito de C3c en el 33% de los pacientes con GNEC de tipo iii. El depósito de C3c se asoció con insuficiencia renal más grave y una mayor proteinuria al inicio de la GNEC de tipo iii. Xing et al.7 detectaron la presencia de C3d en glomérulos y pequeños vasos sanguíneos en muestras renales de pacientes con GNEC de tipo iii. Hilrost et al.8 encontraron factores del complemento en biopsias renales de pacientes con GNEC de tipo iii y asociaron la presencia de C3d y properdina a mayor proporción de semilunas y mayor proteinuria. Recientemente, Villacorta et al.9 demostraron que la presencia de C3d es un factor de riesgo independiente para la supervivencia en las GNEC de tipo iii.
El objetivo de nuestro estudio fue evaluar el papel pronóstico que el depósito de C3 tiene en la evolución a corto y largo plazo en los pacientes con GNEC de tipo iii.
MétodosPacientesSe trata de un estudio observacional retrospectivo en el que se han incluido 72pacientes diagnosticados de GNEC de tipo iii mediante biopsia renal en el periodo 1995-2015 en el Hospital Universitario Reina Sofía (Córdoba). Se recogieron variables demográficas, clínicas y analíticas en el momento de la biopsia y se observó el curso clínico analítico durante los años de seguimiento.
Para cada paciente, el punto de referencia se estableció en el momento de la biopsia. El tiempo de seguimiento se estableció como el intervalo entre la biopsia renal y la última visita de seguimiento, la muerte o la llegada a ERCT (hemodiálisis o trasplante renal). El objetivo principal del estudio fue analizar si la presencia de C3 en la inmunoflurescencia de las GNEC de tipo iii afecta al pronóstico.
Características histológicasLa glomerulonefritis rápidamente progresiva de tipo iii o pauciinmune fue definida histológicamente como la presencia de proliferación extracapilar en ausencia de depósitos inmunes glomerulares significativos.
Las muestras renales fueron analizadas mediante microscopia óptica e inmunofluorescencia. Para la microscopia óptica las muestras fueron teñidas de manera rutinaria mediante hematoxilina-eosina, tricrómico de Masson y plata metenamina. Las biopsias fueron analizadas por el patólogo especialista en el centro de referencia. En todas las muestras se analizaron el grado de atrofia tubular, la fibrosis intersticial, la glomeruloesclerosis y la proliferación intro- y extracapilar. El fragmento destinado para inmunofluorescencia se congeló en fresco para hacer cortes en el criostato de aproximadamente 4 μ; se fijó en acetona antes de teñirse y se procesó con inmunorreactantes para IgG, IgA, IgM, complemento (C3 y C1q), fibrinógeno y cadenas ligeras (kappa/lambda). La visualización se hizo en el microscopio de campo oscuro con luz ultravioleta.
Se consideró C3 positivo cuando la presencia de C3 era 1+(leve), 2+(moderada) o 3+(severa) y C3 negativo o ausente cuando no existían depósitos de C3 en el estudio de inmunofluorescencia. Según la clasificación histológica ya descrita por Berden10, se dividieron en 4clases: 1) la clase esclerótica cuando existían al menos un 50% de los glomérulos esclerosados; 2) la clase crescéntica o con semilunas cuando existían igual o más del 50% de semilunas; 3) la clase focal, cuando al menos el 50% de los glomérulos eran normales y 4) la clase mixta cuando existía la combinación de la clase crescéntica, focal y esclerótica en los glomérulos y en una proporción menor al 50%. Se definió la atrofia tubular y fibrosis intersticial como ausente (0%), leve (<25%), moderada (25-50%) o grave (>50%).
Análisis estadísticoLas comparaciones de las variables continuas entre ambos grupos fueron evaluadas mediante la prueba t de Student. Las diferencias entre las proporciones de ambos grupos se calcularon según la prueba de chi cuadrado. El tiempo de seguimiento de cada paciente se calculó con la diferencia entre el punto inicial de referencia y la llegada a ERCT o última visita. Se realizó un modelo de regresión de Cox para estimar el riesgo relativo ajustado de cada parámetro respecto a la supervivencia renal. Se incluyeron en el modelo variables que previamente se ha encontrado que afectan a la supervivencia renal. Las variables no estadísticamente significativas se fueron eliminando según el modelo de paso hacia atrás. En el análisis multivariante se incluyeron 2modelos, uno que incluía la clasificación histológica, la creatinina al ingreso, la presencia de C3 y la presencia de ANCA. En un segundo modelo se excluyó la creatinina al ingreso, ya que esta era significativamente superior en los pacientes C3 positivo (5mg/dl) que en los C3 negativo (3,85mg/dl; p=0,050).
Las comparaciones en la supervivencia se realizaron con el modelo de long-rank.
El nivel de significación estadística fue fijado en 0,05. Los cálculos se realizaron con SSPS (versión 15.0).
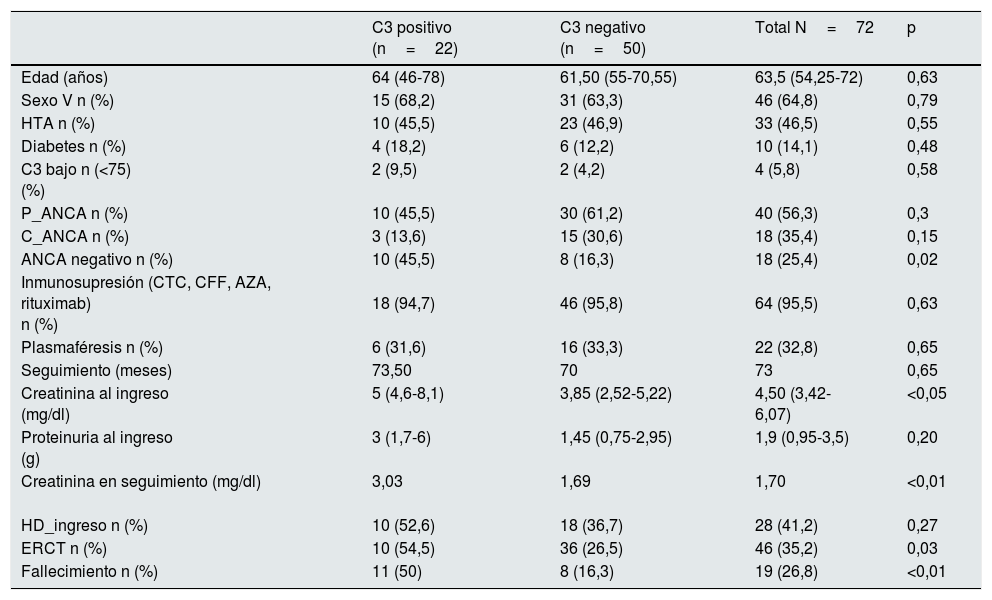
ResultadosLa tabla 1 muestra las características demográficas y analíticas de los 72 pacientes.
Características demográficas y analíticas
| C3 positivo (n=22) | C3 negativo (n=50) | Total N=72 | p | |
|---|---|---|---|---|
| Edad (años) | 64 (46-78) | 61,50 (55-70,55) | 63,5 (54,25-72) | 0,63 |
| Sexo V n (%) | 15 (68,2) | 31 (63,3) | 46 (64,8) | 0,79 |
| HTA n (%) | 10 (45,5) | 23 (46,9) | 33 (46,5) | 0,55 |
| Diabetes n (%) | 4 (18,2) | 6 (12,2) | 10 (14,1) | 0,48 |
| C3 bajo n (<75) (%) | 2 (9,5) | 2 (4,2) | 4 (5,8) | 0,58 |
| P_ANCA n (%) | 10 (45,5) | 30 (61,2) | 40 (56,3) | 0,3 |
| C_ANCA n (%) | 3 (13,6) | 15 (30,6) | 18 (35,4) | 0,15 |
| ANCA negativo n (%) | 10 (45,5) | 8 (16,3) | 18 (25,4) | 0,02 |
| Inmunosupresión (CTC, CFF, AZA, rituximab) n (%) | 18 (94,7) | 46 (95,8) | 64 (95,5) | 0,63 |
| Plasmaféresis n (%) | 6 (31,6) | 16 (33,3) | 22 (32,8) | 0,65 |
| Seguimiento (meses) | 73,50 | 70 | 73 | 0,65 |
| Creatinina al ingreso (mg/dl) | 5 (4,6-8,1) | 3,85 (2,52-5,22) | 4,50 (3,42-6,07) | <0,05 |
| Proteinuria al ingreso (g) | 3 (1,7-6) | 1,45 (0,75-2,95) | 1,9 (0,95-3,5) | 0,20 |
| Creatinina en seguimiento (mg/dl) | 3,03 | 1,69 | 1,70 | <0,01 |
| HD_ingreso n (%) | 10 (52,6) | 18 (36,7) | 28 (41,2) | 0,27 |
| ERCT n (%) | 10 (54,5) | 36 (26,5) | 46 (35,2) | 0,03 |
| Fallecimiento n (%) | 11 (50) | 8 (16,3) | 19 (26,8) | <0,01 |
AZA: azatioprina; C-ANCA: anticuerpos antineutrófilos citoplasmáticos antiproteinasa; CFF: ciclofosfamida; CTC: corticoides; HD_ingreso: hemodiálisis al ingreso; HTA: hipertensión arterial; P-ANCA: anticuerpos antineutrófilos citoplasmáticos antimieloperoxidasa; V: varones.
La mayoría de los pacientes fueron hombres (64,8%), con una media de edad de 63,5 años. La creatinina al ingreso fue de 4,50mg/dl y la proteinuria de 1,9g/día. Un 42% de los pacientes requirieron diálisis al ingreso. El 85% de los pacientes tenían autoinmunidad positiva para ANCA, un 56,3% para P-ANCA y un 35,4% para C-ANCA. Todos los pacientes a excepción de uno recibieron inmunosupresión. El tratamiento inmunosupresor constaba en la gran mayoría de los casos de esteroides y ciclofosfamida y, en otros casos, de esteroides más azatioprina o rituximab.
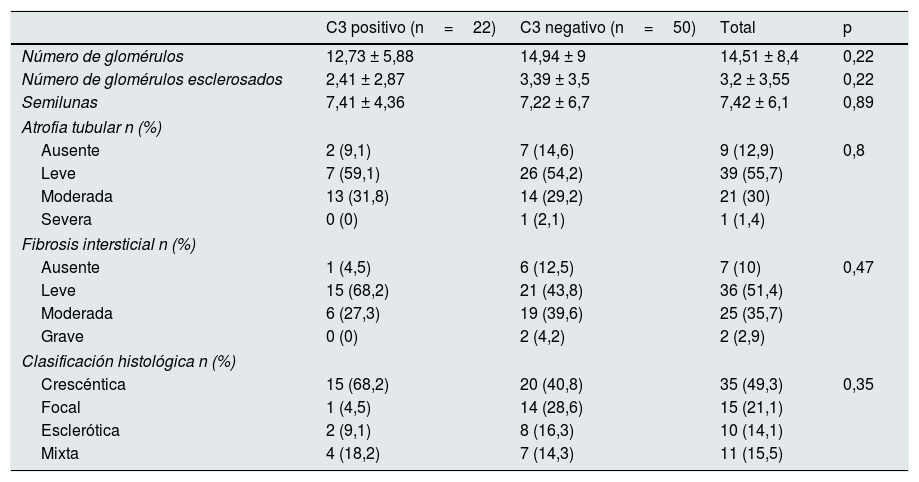
En 22 pacientes (30,5%) existía depósito de C3 por IF y 50 pacientes (69,5%) fueron considerados como C3 negativo. No existen diferencias significativas entre pacientes con C3 positivo y C3 negativo en cuanto al número de glomérulos esclerosados, semilunas, grado de atrofia tubular, fibrosis intersticial o clasificación histológica (tabla 2). En solo 2pacientes con C3 positivo (9,09%) y en un paciente (2%) con C3 negativo había depósito de C1q (+). En ningún paciente el depósito de inmunoglobulinas fue mayor a 1 (+). El promedio de número de glomérulos de las muestras renales obtenidas fue de 14,5. El 22% de los glomérulos estaban esclerosados. El promedio de porcentaje de semilunas en cada muestra renal fue del 51%. La atrofia tubular era leve en el 50% y moderada en el 30% de los casos. La fibrosis intersticial era leve en el 51,4% y moderada en el 35,7%. Según la clasificación de Berden, el 49,3% fue clasificada como crescéntica, el 21,1% como focal, el 14,1% como esclerótica y 15,5% como mixta, sin diferencias significativas entre los pacientes según la tinción de C3 en la inmunofluorescencia.
Características histológicas
| C3 positivo (n=22) | C3 negativo (n=50) | Total | p | |
|---|---|---|---|---|
| Número de glomérulos | 12,73 ± 5,88 | 14,94 ± 9 | 14,51 ± 8,4 | 0,22 |
| Número de glomérulos esclerosados | 2,41 ± 2,87 | 3,39 ± 3,5 | 3,2 ± 3,55 | 0,22 |
| Semilunas | 7,41 ± 4,36 | 7,22 ± 6,7 | 7,42 ± 6,1 | 0,89 |
| Atrofia tubular n (%) | ||||
| Ausente | 2 (9,1) | 7 (14,6) | 9 (12,9) | 0,8 |
| Leve | 7 (59,1) | 26 (54,2) | 39 (55,7) | |
| Moderada | 13 (31,8) | 14 (29,2) | 21 (30) | |
| Severa | 0 (0) | 1 (2,1) | 1 (1,4) | |
| Fibrosis intersticial n (%) | ||||
| Ausente | 1 (4,5) | 6 (12,5) | 7 (10) | 0,47 |
| Leve | 15 (68,2) | 21 (43,8) | 36 (51,4) | |
| Moderada | 6 (27,3) | 19 (39,6) | 25 (35,7) | |
| Grave | 0 (0) | 2 (4,2) | 2 (2,9) | |
| Clasificación histológica n (%) | ||||
| Crescéntica | 15 (68,2) | 20 (40,8) | 35 (49,3) | 0,35 |
| Focal | 1 (4,5) | 14 (28,6) | 15 (21,1) | |
| Esclerótica | 2 (9,1) | 8 (16,3) | 10 (14,1) | |
| Mixta | 4 (18,2) | 7 (14,3) | 11 (15,5) | |
Veintidós pacientes (30,5%) fueron clasificados como C3 positivos. Estos depósitos de C3 fueron leves (+) en 17 pacientes (77,28%) y moderados (++) en 5 pacientes (22,72%). Cuatro de estos 5 pacientes (con 2cruces de C3 en el estudio de IF) presentaban ANCA negativo, 4 se incluyeron dentro de la clasificación histológica crescéntica y 2 de los 5 pacientes presentaban una paraproteína en sangre.
Los pacientes con C3 positivo presentaban ANCA negativo en mayor proporción que el grupo C3 negativo (45,5 vs. 16,3%; p=0,02).
Según la clasificación histológica, tampoco se encontraron diferencias significativas en cuanto a los depósitos de C3 (tabla 2).
La creatinina al ingreso fue significativamente mayor en los pacientes con C3 positivo que en el grupo C3 negativo (5 vs. 3,85mg/dl; p < 0,05) así como la creatinina en el seguimiento, excluyendo en este caso a los pacientes que llegaban a ERCT (3,03 vs. 1,69mg/dl; p < 0,01). Aunque no resultaba estadísticamente significativo, vemos que los pacientes con C3 positivo requerían en mayor proporción terapia renal sustitutiva mediante hemodiálisis al ingreso (52,6 vs. 36,7%; p=0,27).
Tras un seguimiento mediano de 73 meses, el 35,2% de los pacientes llegaron a ERCT y un 26,8% fallecieron. La supervivencia renal a los 10 años según la clase histológica fue 83% para la subclase focal, 70% para la mixta, 45% para la crescéntica y 0% para la esclerótica (p=0,049) (tabla 3).
Análisis uni- y multivariante de regresión de Cox
| Características | HR (IC 95%) | p |
|---|---|---|
| Univariante | ||
| Edad | 0,99 (0,97-1,01) | 0,64 |
| Plasmaféresis | 0,71 (0,31-1,62) | 0,41 |
| Creatinina al ingreso | 1,12 (1,06-1,19) | <0,01 |
| Proteinuria al ingreso | 1,08 (0,99-1,2) | 0,04 |
| Presencia de C3 | 3,32 (1,16-9,51) | <0,01 |
| Multivariante | ||
| Modelo 1 | ||
| ANCA negativo | 0,59 (0,17-2,00) | 0,39 |
| C3 positivo | 2,23 (0,8-6,17) | 0,12 |
| Creatinina al ingreso | 1,12 (1,04-1,21) | <0,01 |
| Clasificación histológica | ||
| Mixta | 1(ref) | 1 |
| Semilunas | 1 (0,2-3,8) | 0,19 |
| Focal | 0,2 (0,02-2,15) | 0,32 |
| Esclerótica | 2,1 (0,45-10,4) | |
| Modelo 2 | ||
| ANCA negativo | 0,57 (0,15-2,04) | 0,38 |
| C3 positivo | 2,95 (1,08-8,04) | 0,03 |
| Clasificación histológica | ||
| Mixta | 1 (ref) | 1 |
| Semilunas | 1 (0,26-3,82) | 0,14 |
| Focal | 0,21 (0,02-1,72) | 0,17 |
| Esclerótica | 2,18 (0,70-6,75) | |
ANCA: anticuerpos antineutrófilos citoplasmáticos.
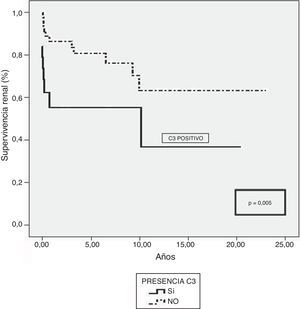
Los pacientes con inmunofluorescencia positiva para C3 evolucionaban con mayor frecuencia a ERCT (54,5 vs. 26,5%; p=0,03). La supervivencia renal fue mayor en pacientes con C3 negativo a los 5 años (88%) y a los 10 años (63,4%) que en aquellos con C3 positivo, que presentaban una supervivencia renal a los 5 años del 55% y a los 10 años del 36,9% (p=0,005) (fig. 1). La supervivencia también fue mejor en pacientes con C3 negativo a los 5 años (92%) y a los 10 años (77%) que en los del grupo C3 positivo (85 y 49,3%, respectivamente; p=0,006).
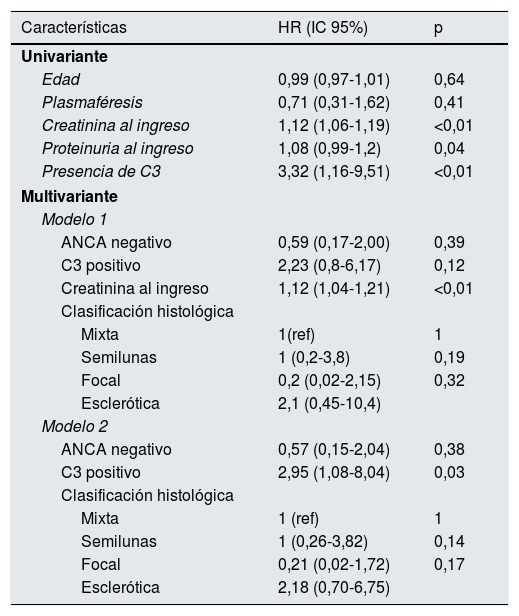
Realizamos 2modelos de regresión de Cox. El primero incluía las variables: clasificación histológica, creatinina al ingreso, presencia de C3 y presencia de ANCA. Según este modelo solo la creatinina al ingreso resultó ser un factor de riesgo independiente de una peor evolución (1,12; 1,04-1,21; p < 0,01). Como la creatinina al ingreso era significativamente superior en los pacientes C3 positivo, calculamos un segundo modelo en el que excluimos la creatinina al ingreso. Según este modelo solo el depósito de C3 resultó ser un factor de riesgo independiente para el desarrollo de ERCT (2,95; 1,08-8,04; p=0,02).
DiscusiónLa GNEC de tipo iii es una enfermedad glomerular con un curso grave. En nuestra serie, que incluyó todos los casos diagnosticados de manera consecutiva, la supervivencia renal libre de diálisis a los 5 años fue del 64,8%, cifra favorable cuando se compara con la media de los estudios publicados (58,7%)11,12.
Existen factores claramente implicados en el pronóstico de la enfermedad a corto largo plazo, muchos de ellos deducibles del estudio histológico.
El estudio con microscopia óptica analiza muchos de estos factores, como el porcentaje de glomérulos esclerosados, porcentaje de glomérulos normales, porcentaje de semilunas, grado de fibrosis y atrofia tubular, entre otros13-18. Nuestros datos son compatibles con las distintas series publicadas en cuanto a supervivencia según la clase histológica: las subclases con mejor supervivencia son la focal (83% a los 10 años) y la mixta (70% a los 10 años). Como era de esperar, la subclase esclerótica es la que conlleva una supervivencia menor (0% a los 10 años), similar a la de las observaciones descritas previamente por Berden10.
En nuestro estudio hemos analizado los factores clínicos e histológicos que pueden estar implicados en la evolución a corto y a largo plazo de las GNEC de tipo iii. Especialmente hemos estudiado si el depósito de C3 mediante inmunofluorescencia puede tener también implicaciones pronósticas a corto y largo plazo.
Este estudio retrospectivo muestra que los pacientes con GNEC de tipo iii con depósito con C3 en el estudio de IF tienen un peor pronóstico a corto plazo. En el momento de la biopsia, en los pacientes con depósito de C3, la creatinina era significativamente peor (5,00 vs. 3,85mg/dl; p < 0,05) y precisaron diálisis en mayor proporción (53,6 vs. 36,7%; p=0,27) que los pacientes que no presentaban depósito de C3. También es importante el dato de que este depósito de C3 se asocia a una peor supervivencia renal (36,9 vs. 64,4% a los 10 años en C3 positivo vs. C3 negativo). En el estudio multivariante, cuando se excluye la creatinina en el momento del diagnóstico, el depósito de C3 también es un factor independiente de una peor función renal. Esto ya ha sido demostrado recientemente por Villacorta et al.9, quienes también demostraron que la presencia de C3d mediante inmunohistoquímica es un factor de riesgo independiente para el desarrollo de ERCT en las GNEC de tipo iii.
En la patogénesis de esta enfermedad hay factores etiológicos que no están del todo aclarados. Estudios recientes asocian la activación del complemento con esta entidad. En el pasado, se suponía que el papel del complemento era mínimo, ya que las vasculitis renales asociadas a ANCA se han caracterizado por el escaso depósito glomerular de factores de complemento y de inmunoglobulinas4. Neumman et al. demostraron que la presencia de depósitos de IgG resultaban en una mayor proteinuria y podría estar asociada a un peor pronóstico19.
Varios estudios han demostrado un importante papel del complemento en las vasculitis asociadas a ANCA20-23. Recientes estudios indican que los neutrófilos son una fuente de factores de complemento y que su activación puede provocar alteraciones en las proteínas del complemento en zonas de daño glomerular24. Xiao et al. señalan que la estimulación de los neutrófilos causa liberación de factores que activan el complemento a través de la vía alternativa, lo que inicia una amplificación inflamatoria que media las lesiones glomerulares21-26. Huugen et al.20 y Xiao et al.21 han encontrado que C5 juega un papel fundamental en la implicación del complemento en las vasculitis asociadas a ANCA y Xiao et al.21 han visto como el bloqueo de C5 en modelos de ratones implica el desarrollo de una glomerulonefritis menos grave. Más recientemente, Hilhorst et al.8 han analizado las biopsias renales de pacientes diagnosticados de glomerulonefritis asociada a ANCA y han encontrado tinciones positivas para C3d, C4d y C5b-9 en la mayoría de ellas. Por otro lado, han encontrado asociación entre la presencia de C3d y properdina con mayor proteinuria y mayor porcentaje de semilunas. Xing et al.7 encontraron C3d en semilunas fibrocelulares en 7 pacientes con ANCA-mieloperoxidasa.
Estos datos apoyan la hipótesis de que la activación de la vía alternativa del complemento puede estar implicada en la patogénesis de estas glomerulonefritis y que puede condicionar un peor pronóstico a corto y largo plazo. Esta activación diferente del complemento puede tener su origen en factores genéticos predisponentes, hoy día no bien identificados, o ser consecuencia de diferentes factores ambientales. En este sentido, se ha hipotetizado que un mayor grado de activación y de granulación de los neutrófilos en los pacientes con GNEC ANCA negativo podría resultar en una mayor activación del complemento y ocasionar una lesión más severa27. Indudablemente, hasta que no conozcamos mejor estos factores es difícil dar recomendaciones para el manejo clínico de los pacientes. No obstante, siempre se deja abierta la puerta a tratar en un futuro con anticuerpos monoclonales antifactores del complemento.
También es importante destacar que en 5 pacientes el depósito de C3 era moderado (++). El hecho de que 4 de ellos fueran ANCA negativo y que en 2 de ellos se detectara, además, una paraproteína apunta claramente al importante papel patogénico que tiene la activación de la vía alternativa del complemento. Si somos estrictos con la definición de glomerulopatía C3 según el último consenso28, actualmente estos pacientes podrían considerarse dentro del espectro de glomerulopatía C3. En este sentido, se han detectado paraproteínas en el 31% de los pacientes con glomerulonefritis C3. Se piensa que la paraproteína activa es un anticuerpo anti-FH que desregula la vía alternativa del complemento29.
Estas observaciones se encuentran limitadas por la naturaleza retrospectiva de nuestro estudio. Son necesarios más estudios que analicen si el depósito de C3 se asocia con un peor pronóstico a corto y largo plazo. Sin embargo, el estudio cuenta con el seguimiento clínico analítico estrecho a largo plazo de los pacientes, diagnosticados todos mediante biopsia renal analizada cuidadosamente por un patólogo especialista en el área.
Como conclusión, podemos decir que nuestro estudio muestra que en los pacientes diagnosticados de GNEC de tipo iii el depósito de C3 se asocia a un peor pronóstico de la función renal y del paciente. Estos resultados serían compatibles con la hipótesis de que la activación de la vía alterna del complemento puede jugar un papel importante en esta entidad.
Autoría/colaboracionesLos tres primeros autores (Sánchez-Agesta Martínez, M; Rabasco Ruiz, C y Sánchez Sánchez, R) se consideran coautores.
Conflicto de interesesLos autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.