Objetivos: Los pacientes con insuficiencia renal presentan una prevalencia elevada de dosis inapropiadas y de concentraciones elevadas de digoxina, y se ha recomendado el ajuste de la dosificación en función de la tasa de filtración glomerular (TFG). El objetivo de nuestro estudio fue evaluar el grado de dependencia con respecto a la TFG del aclaramiento total (CL) de digoxina, y la eficiencia diagnóstica de un modelo predictivo para la concentración sérica de digoxina en el estado de equilibrio (Css) en función de la TFG estimada por la ecuación de Cockcroft-Gault. Métodos: En 400 pacientes ambulatorios tratados por vía oral con digoxina se determinaron las Css séricas (inmunoanálisis de polarización de fluorescencia, Abbott Laboratories), calculandose el CL total. La predicción de Css se hizo mediante un modelo hiperbólico desarrollado por Konishi, et al. (J Clin Pharm Ther 2002;27:257), y las constantes de la ecuación fueron modificadas para la población caucasiana. Resultados: Sólo el 26% de la variabilidad interindividual del CL de digoxina puede ser explicado por diferencias de la TFG, y este hecho constituye una seria limitación para los modelos predictivos derivados. Se obtuvo una eficiencia diagnóstica del 65% para los modelos predictivos original y modificado en la clasificación correcta de las Css predichas como subterapéuticas, terapéuticas o supraterapéuticas con respecto a las Css obtenidas. Conclusiones: La eficiencia diagnóstica obtenida en la predicción de las concentraciones séricas de digoxina en función de los valores estimados de TFG es inaceptable para el ajuste de la dosificación del fármaco en la práctica clínica.
Background: Inappropriate doses and high serum concentrations of digoxin are highly prevalent in patients with renal impairment, and the drug dosage adjustment according to the glomerular filtration rate (GFR) is recommended. The aim of our study was to evaluate the dependence degree of digoxin total clearance (CL) on GFR, and the diagnostic efficiency of a predictive model for serum digoxin steady-state concentrations (Css) from estimated GFR by Cockcroft-Gault formula. Methods: In 400 outpatients treated orally with digoxin, serum Css were determined (fluorescence polarization immunoassay from Abbott Laboratories), and total CL was calculated. The prediction of Css was carried out using a hyperbolic model developed by Konishi et al in Japan (J Clin Pharm Ther 2002;27:257), and the constants of the equation were modified for a Caucasian population. Results: Only 26% of the digoxin CL interindividual variability may be explained by differences in GFR, and this fact is a serious limitation for the derived predictive models. A 65% diagnostic efficiency was obtained for original and modified hyperbolic models in the correct classification of predicted Css as subtherapeutic, therapeutic or supratherapeutic with respect to obtained Css concentrations. Conclusions: The diagnostic efficiency obtained in the prediction of serum digoxin concentrations from estimated GFR values is unacceptable for the drug dosage adjustment in clinical practice.
INTRODUCCIÓN
La digoxina se utiliza desde hace más de dos siglos, y la preocupación por su toxicidad se remonta a los comienzos de su introducción en terapéutica. Sin embargo, teniendo en cuenta su efecto beneficioso sobre la reducción de la mortalidad y hospitalización de pacientes con insuficiencia cardíaca progresiva, su relación coste-efectividad y su fácil disponibilidad en todo el mundo, la digoxina no debe ser considerada un fármaco del pasado, sino más bien un fármaco del presente y, probablemente, del futuro1.
Habitualmente la digoxina se administra por vía oral, alcanzando la concentración sérica máxima a las dos o tres horas posteriores a la administración de la dosis, aunque para su monitorización terapéutica se utiliza la concentración valle (inmediatamente antes de la próxima dosis), o al menos una vez finalizada la fase de distribución2. La determinación de la concentración sérica de digoxina es fundamental para un uso seguro y adecuado del fármaco, que presenta un estrecho índice terapéutico, lo cual es la razón principal de morbilidad y mortalidad asociadas con su empleo; actualmente se recomienda que la dosificación se haga para alcanzar concentraciones séricas comprendidas entre 0,5 y 1, 1 ng/ml1,3-5. Una importante fracción de la dosis absorbida de digoxina es eliminada por los riñones, siendo su aclaramiento sistémico un importante determinante de la dosis de mantenimiento1,6, por lo que frecuentemente el deterioro de la función renal es la causa de aparición de efectos tóxicos1.
La tasa de filtración glomerular (TFG) es ampliamente aceptada como una medida adecuada de la función renal, y el ajuste de la dosificación de digoxina en función de la TFG es un hecho ampliamente recomendado en la bibliografía6-11; sin embargo, estudios recientes sugieren una frecuente dosificación inapropiada de digoxina en pacientes con distintos grados de insuficiencia renal7,12. Utilizando procedimientos farmacocinéticos convencionales para el cálculo del aclaramiento (CL) y la predicción de la concentración de digoxina, se han realizado previamente estudios comparativos de la estimación de la TFG en función la cistatina C13 y creatinina mediante las formulas de Cockcroft-Gault y MDRD (modification of diet in renal disease)13,14. En el presente artículo, con los datos obtenidos en 400 pacientes adultos, se indica la eficiencia diagnóstica de un modelo hiperbólico para la estimación de la concentración de digoxina en función de la TFG15.
PACIENTES Y MÉTODOS
Se estudió un grupo de 400 pacientes de ambos sexos (158 hombres y 242 mujeres) con insuficiencia cardíaca, y presentando una edad media (± desviación estándar de la media [DEM]) de 78,6 ± 0,64 años (rango, 24-97 años), que fueron atendidos en forma ambulatoria en los servicios de urgencias, cardiología y medicina interna de nuestro hospital. En todos los casos recibían digoxina por vía oral en forma de tabletas, con una dosificación de 0,125-0,25 mg/24-48 horas y que no había sido cambiada al menos desde hacía 20 días antes de la toma de las muestras de sangre. Ésta se hizo después que se completase la fase de distribución, 24-48 horas después de la última dosis, por lo que los niveles de digoxina corresponden a la concentración mínima del estado de equilibrio (Css). El estudio se realizó de acuerdo con las normas de buenas prácticas para investigación en humanos de la Consellería de Sanidade de la Xunta de Galicia, y fue aprobado por el Comité de Ética de Investigación Clínica del Complejo Hospitalario Universitario de Santiago de Compostela.
La concentración sérica de digoxina se determinó por inmunoanálisis de polarización de fluorescencia, utilizando reactivos de Abbott Laboratories (Abbott Park, EE.UU.). La determinación de creatinina sérica se hizo en un Advia 2400 Chemistry System (Siemens Health Care Diagnostics Inc., Newark, EE.UU.). La cistatina C se determinó por PENIA (particle enhanced nephelometric immunoassay) en un nefelómetro BN ProSpec (Siemens Health Care Disgnostics, Inc.). La estimación de la TFG mediante las concentraciones séricas de creatinina y cistatina C se hizo mediante el empleo de las fórmulas de Cockcroft-Gault16 y de Hoeck, et al.17, respectivamente. El aclaramiento aparente de la digoxina se calculó mediante un procedimiento farmacocinético convencional18: CL = (dosis/intervalo dosificación)/Css, expresando los resultados en ml/min. La predicción de la concentración de digoxina se hizo de acuerdo con el modelo hiperbólico de Konishi, et al.15: Css/D = 1/(2,22 TFGCG + 25,7), en donde Css = nivel de digoxina (ng/ml), D = dosis (μg/día) y TFGCG = TFG estimada mediante la fórmula de Cockcroft-Gault (ml/min).
El análisis estadístico se realizó mediante el programa StatGraphics Plus (v.5.0), utilizando la prueba de Shapiro-Wilks para la evaluación de la distribución de los datos. En caso de distribución gausiana se utilizó el coeficiente de correlación de Pearson, y en caso contrario el coeficiente de correlación de Spearman. El análisis de regresión se hizo por el método no paramétrico de Passing-Bablock. El ajuste hiperbólico de la relación entre el cociente Css/dosis y la TFGCG se hizo mediante al programa Microcalc Origin® (v. 8.0).
RESULTADOS
En un grupo de 300 de los pacientes estudiados (120 hombres y 180 mujeres) con una edad de de 79,2 ± 0,5 años (rango, 24-97 años), se encontraron correlaciones significativas de las Css de digoxina, CL de digoxina, y cociente CL digoxina/TFG, con la TFG como se indica en la figura 1. De acuerdo con trabajos previos9,11,12, las Css de digoxina presentaron una correlación inversa con la TFG (figura 1A). Sin embargo, aunque el CL de digoxina es significativamente dependiente de la TFG (figura 1B), el modesto coeficiente de determinación (r2 = 0,257) entre ambas variables indica que únicamente un 26% de la variabilidad interindividual del CL de digoxina podría ser explicado en función de la variación de la TFG19. Una dicotomía de los datos en función del sexo, la normalización del CL digoxina por kg de peso (ml/min/lg), o la utilización de las ecuaciones MDRD con cuatro o seis variables para la estimación de la TFG, no introdujeron una mejora significativa para este coeficiente de determinación. Para valores de TFG menores de 70 ml/min se produciría un aumento de tipo exponencial de la proporción relativa del CL no renal con respecto al CL total de digoxina, como se pone de manifiesto en la figura 1C.
En 60 de estos pacientes se determinaron las concentraciones séricas de cistatina C, y las correlaciones obtenidas entre CL de digoxina y la TFG estimada por creatinina (r = 0,403; p <0,005) y cistatina C (r = 0,500; p <0,005), sugieren una modesta mejora del coeficiente de determinación entre CL de digoxina y la TFG estimada por cistatina C.
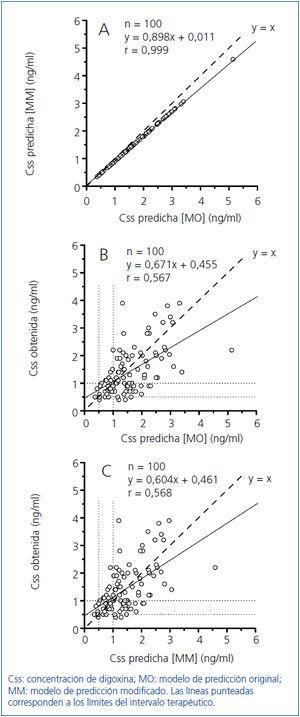
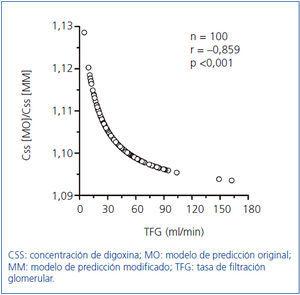
Como Konishi, et al.15 desarrollaron su modelo predictivo en un grupo de población japonesa; con vistas a su optimización se calcularon las constantes de la ecuación hiperbólica para nuestro grupo de 300 pacientes, obteniendo la expresión: Css/D = 1/(2,42 ± 0,18 TFGCG + 29,44 ± 4,06). En la figura 2 se indican los resultados obtenidos en el grupo de los 100 pacientes restantes (38 hombres y 62 mujeres) con una edad de 77,2 ± 1,0 años (rango, 24-92 años), para la relación entre las concentraciones de digoxina obtenidas experimentalmente y las predichas mediante el modelo original de Konishi, et al.15 y el modelo modificado para nuestro grupo poblacional de 300 pacientes. Las concentraciones de digoxina predichas por el modelo original fueron por término medio un 10% mayores que las proporcionadas por el modelo modificado para nuestro grupo de población (figura 2A). La diferencia proporcional entre las concentraciones predichas por ambos modelos (expresada como cociente) presentó una correlación altamente significativa de signo negativo con la TFG como se indica en la figura 3.
Se obtuvieron modestos coeficientes de correlación y una amplia dispersión entre las concentraciones de digoxina obtenidas y predichas por los modelos de estimación original (figura 2B) y modificado (figura 2C), presentando las concentraciones obtenidas y las predichas por ambos modelos una concordancia del 65% en su clasificación como subterapéuticas, terapéuticas o supraterapéuticas.
DISCUSIÓN
En la actualidad distintos autores20-24, así como la US Food and Drug Administration y la National Kidney Foundation22, recomiendan el uso de la ecuación de Cockcroft-Gault para la estimación de la TFG en estudios farmacocinéticos y para ajustes posológicos.
Consecuentemente, en el presente estudio la estimación de la TFG se hizo mediante la ecuación de Cockcroft-Gault16, que es también el método utilizado por Konishi, et al.15 para el desarrollo de su modelo predictivo.
Estudios recientes han puesto de manifiesto que pacientes con mayor o menor grado de insuficiencia renal reciben frecuentemente dosis inadecuadas de digoxina7,12, y en estos casos la estimación de la TFG permitiría un mejor ajuste de la dosificación6-11. De acuerdo con estudios previos9,11,12, en nuestros pacientes se encontró una correlación inversa de la concentración de digoxina con la TFG (figura 1A), con una prevalencia del 54% de casos con inadecuada dosificación de digoxina (de los cuales un 94% tenían TFG <60 ml/min) y presentaban concentraciones séricas mayores de 1,1 ng/ml, que se considera el límite de seguridad en el tratamiento crónico1,3-5. En este sentido, debe indicarse que los pacientes de edad avanzada con disfunción renal son particularmente susceptibles a presentar elevadas concentraciones de digoxina, con mayor predisposición a toxicidad cardíaca, lo que aumenta, en consecuencia, el riesgo de mortalidad25.
Sin embargo, los resultados indicados en la figura 1B muestran el pobre coeficiente de determinación (r2 = 0,257) existente entre el CL de digoxina y la TFG, lo que indica que las diferencias de esta variable sólo explicarían el 26% de la variabilidad interindividual del CL de digoxina. Aunque previamente se ha señalado que la concentración sérica de cistatina C presenta algunas ventajas sobre la de creatinina en la estimación de la TFG para la predicción de niveles de digoxina10,13, el uso de cistatina C para la estimación de la TFG no mejoró a efectos prácticos el coeficiente de determinación entre esta variable y el CL de digoxina. Por otra parte, los resultados indicados en la figura 1C muestran que para una TFG <60-70 ml/min aumenta significativamente la variabilidad interindividual del cociente CL digoxina/TFG, con un incremento significativo de la proporción relativa del CL no renal con respecto a CL total del fármaco. Estos resultados ya indicarían a priori que en pacientes con TFG <60-70 ml/min existen factores claramente limitantes para una correcta predicción de las concentraciones (o dosis) de digoxina en función de la TFG.
Las concentraciones de digoxina predichas por el modelo original de Konishi, et al.15 fueron, por término medio, un 10% mayores que las predichas por el modelo modificado para nuestro grupo de población (figura 2A), aunque en ningún caso se alcanzó una diferencia del 15%, que es el límite de desviación aceptado según las normas de validación de métodos para determinación de fármacos y sus metabolitos en medios biológicos26. Debe considerarse la posibilidad de una mayor biodisponibilidad de las tabletas administradas a los pacientes japoneses, así como la diferente metodología analítica utilizada por nosotros para la determinación de digoxina. Sin embargo, como a medida que disminuye la TFG aumenta la diferencia proporcional entre las concentraciones predichas por ambos modelos (figura 3), así como la proporción relativa del CL no renal con respecto al CL total de digoxina (figura 1C), las mayores concentraciones predichas por el modelo original podrían deberse a un menor CL no renal de la digoxina en la población japonesa.
La eficiencia diagnóstica de una prueba de laboratorio es el porcentaje del total de resultados que son verdaderos (excluyendo falsos positivos y falsos negativos), y se acepta como norma general que la prueba no es clínicamente válida si la eficiencia diagnóstica es menor del 80%27. La concordancia en la clasificación como subterapéuticas, terapéuticas o supraterapéuticas entre las concentraciones de digoxina obtenidas y predichas fue solamente del 65%, lo que indica que tanto el modelo predictivo original como el modificado para nuestra población tienen una eficiencia diagnóstica inaceptable.
En conclusión, aunque para evitar la intoxicación con digoxina se ha destacado la importancia de ajustar la dosificación en función de la TFG7-9, esta variable explicaría solamente un 25% de la variabilidad interindividual del CL de digoxina. Por otra parte, en la eliminación de digoxina en casos con TFG <60-70 ml/min aumenta de forma muy variable la contribución del CL no renal, que es dependiente de distintos factores28-30 de muy difícil consideración en los modelos predictivos. Estos hechos conducen a que la eficiencia diagnóstica de los modelos predictivos de niveles (o dosis) de digoxina en función de la TFG sea clínicamente inaceptable. De acuerdo con Schentang, et al.31, nos parece de mayor utilidad práctica asumir que a medio plazo para un mismo paciente la biodisponibilidad y CL de digoxina (si no se producen cambios importantes para TFG o medicación concomitante con posible interacción farmacocinética) permanecen estables, y que en el estado de equilibrio existe una relación lineal entre dosis y Css. Se podría entonces, en función de la Css obtenida experimentalmente para una dosis D que deba ser ajustada, hacer una predicción de la Css* para una nueva dosis D* mediante la expresión: Css*/D* = Css/D.
Figura 1. Correlación entre tasa de filtración glomerular y concentración de digoxina obtenida (A), aclaramiento de digoxina (B) y relación aclaramiento de digoxina/tasa de filtración glomerular (C).
Figura 2. Correlación y regresión entre Css predicha [MO] y Css predicha [MM] (A), Css predicha [MO] y Css obtenida (B) y Css predicha [MM] y Css obtenida.
Figura 3. Correlación del cociente Css predicha [MO]/Css predicha [MM] con TFG.