Antecedentes: La frecuencia de tumores en pacientes con trasplante renal (TR) está aumentando. El carcinoma de células renales (CCR) en riñones nativos es uno de los más frecuentes y su evolución puede ser más agresiva que en la población general. Objetivo: Evaluar la incidencia y pronóstico del CCR en los pacientes sometidoa a trasplante renal de nuestra unidad. Métodos: Desde enero de 1997 hasta diciembre de 2009 se realizaron en nuestro hospital 683 TR. Para la detección precoz de esta patología, en todos los pacientes sometidos a trasplante realizamos una ecografía abdominal anual de forma sistemática. Los casos sospechosos se confirmaron con tomografía computarizada (TC) antes de proceder a la nefrectomía. Resultados: Por sospecha de CCR se realizaron 14 nefrectomías radicales en 12 pacientes. En 11 nefrectomías (correspondientes a 9 pacientes), el diagnóstico anatomopatológico fue de CCR (incidencia del 1,5%). Todos fueron diagnosticados en estadio T1N0M0. En los tres pacientes restantes, en los que no se detectó tumor, el diagnóstico fue de quiste renal complicado en el contexto de poliquistosis hepatorrenal. En los pacientes con CCR, el tiempo en diálisis antes del diagnóstico fue de 36,7 ± 24,3 meses y el intervalo entre el TR y el diagnóstico fue de 39 ± 25,8 meses. Tras un seguimiento medio de 58,6 ± 38,6 meses, la evolución en todos ha sido excelente, sin recurrencia del tumor. Conclusiones: La realización de ecografías anuales permite un diagnóstico precoz del CCR. El tratamiento de esta patología en estadios iniciales se asocia con un excelente pronóstico en los pacientes con TR.
Background: The frecuency of malignancies in renal transplant (RT) patients is increasing. Renal cell carcinoma (RCC) of native kidneys is one of the most frequent and its outcome can be more aggressive than in general population. Objetive: To evaluate the incidence and prognosis of RCC in renal transplant patients followed in our transplantation unit. Methods: Between January 1997 and December 2009, 683 patients underwent kidney transplant at our hospital. Ultrasonography of the native kidneys was annually performed in all renal transplant patients. When suspect solid masses were found at ultrasonography, patients underwent computed tomography. If the suspicion was confirmed, nephrectomy was performed. Results: 14 radical nephrectomies were performed in 12 patients due to suspect CCR. In 11 nephrectomies (corresponding to 9 patients), anatomopathologic diagnosis was CCR (incidence 1.5%). Histologic stage was T1N0M0 in all cases. In the other 3 RT, the diagnosis was complicated renal cyst. Those patients without carcinoma had polycystic kidney disease. The time on dialysis before CCR diagnosis was 36.7 ± 24.3 months and the interval between RT and diagnosis was 39 ± 25.8 months. After a mean follow-up of 58.6 ± 38.6 months, the outcome of all cases has been excellent, without tumor recurrence. Conclusions: Annual renal ultrasonography plays a key role in the early diagnosis of CRR. The early treatment of this pathology is associated with an excellent prognosis in RT patients.
INTRODUCCIÓN
En los últimos años, la supervivencia del paciente y del injerto renal ha aumentado en relación con la introducción de nuevos inmunosupresores y el mejor manejo de las complicaciones a corto y largo plazo1. Sin embargo, esta mayor supervivencia, así como el progresivo incremento de la edad media de los pacientes incluidos en lista de espera de trasplante renal (TR), han hecho que aumente la incidencia de cáncer en esta población1,2.
Uno de los tumores cuya incidencia ha aumentado más es el carcinoma de células renales (CCR) en riñones nativos3. Su aparición se ha relacionado con diversos factores de riesgo como el tratamiento inmunosupresor, la edad, historia previa de CCR y la enfermedad renal quística adquirida (ERQA), entre otros3-6. Muchos estudios confirman que el tamaño del tumor en el momento del diagnóstico influye de forma importante en el pronóstico, y que éste es mucho mejor en tumores pequeños5.
La ecografía abdominal es un método diagnóstico sencillo y útil en la detección precoz de estos tumores. Sin embargo, no existe aún consenso sobre la frecuencia óptima con la que deben realizarse estas exploraciones4-7.
El objetivo de este estudio es evaluar la incidencia y el pronóstico del CCR en los TR realizados en los pacientes de nuestro servicio desde enero de 1997 hasta diciembre de 2009, vigilados todos ellos para el desarrollo de estos tumores mediante ecografías anuales.
MATERIAL Y MÉTODOS
Desde 1997, todos los pacientes que han recibido TR en nuestra unidad han sido seguidos regularmente con un protocolo de detección de neoplasias. Como prueba habitual de detección para el CCR en riñones nativos realizamos una ecografía abdominal anual de forma sistemática en todos los pacientes sometidos a TR. En los pacientes en los que ecográficamente se encuentran lesiones sospechosas de CRR, completamos el estudio con tomografía computarizada (TC) abdominal, y si esta sospecha se confirma, se procede a la nefrectomía y al estudio histopatológico de la pieza tumoral. Hemos analizado los resultados en los 683 TR realizados en nuestro hospital desde enero de 1997 hasta diciembre de 2009.
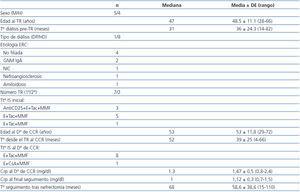
Se recogieron datos demográficos y clínicos de los pacientes con CCR como: edad, sexo, enfermedad renal primaria, modalidad de diálisis previa al TR, duración de la diálisis, número de TR, inmunosupresión recibida, tiempo desde el TR hasta el diagnóstico de CCR y función renal en el momento de la nefrectomía.
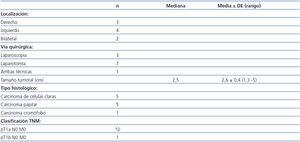
En relación con el diagnóstico de CCR, se analizaron la vía de abordaje quirúrgico, la localización, el tamaño, el tipo histológico y el grado del tumor. Este último se estratificó según la clasificación internacional TNM8, y en los carcinomas de células claras, el grado nuclear se clasificó según los criterios propuestos por Fuhrman9.
También se valoró la coexistencia de ERQA, la aparición de tumores en otras localizaciones, así como si se realizó modificación del tratamiento inmunosupresor tras el diagnóstico de CCR. Finalmente, recogimos la evolución de los pacientes tras la nefrectomía, analizando recurrencia o no del tumor, supervivencia y función renal durante el seguimiento.
Los resultados aparecen expresados como mediana y media ± desviación estándar para variables cuantitativas, y como frecuencia absoluta y/o relativa para variables cualitativas.
RESULTADOS
Por sospecha de CCR, se realizaron 14 nefrectomías radicales en 12 pacientes. En tres pacientes, sometidos cada uno de ellos a una nefrectomía unilateral, no se encontraron tumores. Estos tres enfermos tenían como enfermedad renal primaria poliquistosis hepatorrenal. Como en todos, en estos tres casos se realizó también una TC prenefrectomía, con el diagnóstico de masa renal quística Bosniak III. En los tres se realizó, además, una ecografía Doppler con ecopotenciador (con hexafluoruro de azufre como contraste i.v.), que fue indicativa de neoplasia en dos casos, y dudosa en el tercero. Finalmente, se realizó la nefrectomía en los tres, y el diagnóstico anatomopatológico fue de quiste renal complicado.
En los nueve sometidos a TR restantes (siete pacientes con nefrectomía unilateral y dos con nefrectomía bilateral) se detectaron 11 casos de CCR (cinco carcinomas de células claras, cinco carcinomas papilares y un carcinoma de células cromófobas). En los dos pacientes con nefrectomía bilateral, en uno de ellos se realizó nefrectomía bilateral por CCR bilateral en el mismo acto quirúrgico, y el otro, al año de la primera nefrectomía, fue sometido a una segunda por aparición de otro CCR en el riñón contralateral.
En nuestra serie, la incidencia de CCR de riñones nativos ha sido del 1,5%. Las características demográficas de los pacientes con CCR aparecen recogidas en la tabla 1. En el momento del diagnóstico del tumor, todos los pacientes, salvo uno, llevaban más de seis años en tratamiento renal sustitutivo con diálisis y trasplante. No hubo ningún caso de nefropatía por analgésicos y sólo un paciente tenía una ERQA.
Todos los pacientes recibían tratamiento inmunosupresor con micofenolato mofetil y anticalcineurínicos desde el TR. Sólo uno de ellos recibía tratamiento con ciclosporina A, estando el resto con tacrolimus. Tres pacientes recibieron inducción con anticuerpos anti-CD25. Ningún paciente tenía antecedentes de episodios de rechazo agudo. Todos los pacientes estaban asintomáticos en el momento del diagnóstico, siendo éste un hallazgo casual en la ecografía abdominal sistemática.
Las características de los tumores se exponen en la tabla 2. En todos los casos se realizó nefrectomía radical: en siete por laparotomía (aquellos casos más antiguos en los que aún no se había incorporado la laparoscopia en nuestro hospital), en tres por vía laparoscópica, y en un paciente fue necesaria la conversión a cirugía abierta por complicaciones de la cirugía laparoscópica. El tamaño medio del tumor fue de 2,6 ± 0,45 cm (1,3-5). Todos los tumores, salvo uno, fueron inferiores a 3,5 cm de diámetro. Todos los casos de CCR fueron diagnosticados en estadio T1N0M0. En los cinco carcinomas de células claras, el grado nuclear de Furhman fue II.
En todos los pacientes se procedió a una modificación del tratamiento inmunosupresor. En cinco de ellos se realizó conversión del anticalcineurínico a un inhibidor de m-TOR, con buena tolerancia en todos, salvo en un caso en el que hubo que reintroducir el anticalcineurínico por edemas incontrolables y proteinuria. En los cuatro casos restantes el uso de inhibidores de m-TOR estaba contraindicado (insuficiencia renal y/o proteinuria), por lo que se realizó descenso del tratamiento inmunosupresor, con disminución de la dosis del anticalcineurínico y/o micofenolato mofetil, o suspensión de este último.
Tras un seguimiento medio de 58,6 ± 38,6 meses (15-110), la evolución en todos ha sido excelente, con una supervivencia del paciente del 100% y sin recurrencia del tumor. Tres de los pacientes han sido diagnosticados posteriormente de un nuevo tumor en otra localización (dos fueron diagnosticados de carcinoma basocelular de piel y en otro se diagnosticó un tumor vesical y un carcinoma basocelular de piel).
En cuanto a la evolución del injerto renal, dos pacientes precisaron nueva inclusión en diálisis por nefropatía crónica del injerto, ya diagnosticada antes del hallazgo de CCR. La reinclusión en diálisis fue a los 44 y 47 meses, respectivamente, desde el diagnóstico del CCR. En el resto, la función renal es óptima, con una cifra media de creatinina sérica de 1,12 ± 0,3 mg/dl (0,7-1,5) al final del seguimiento.
DISCUSIÓN
La mayor supervivencia de los pacientes sometidos a TR, así como el progresivo aumento de la edad media de los pacientes incluidos en lista de espera de TR, ha hecho que complicaciones a largo plazo, como la enfermedad cardiovascular y el cáncer, adquieran cada vez mayor importancia en esta población2. Aunque la enfermedad cardiovascular sigue siendo la principal causa de muerte en estos pacientes, la incidencia de cáncer ha aumentado considerablemente en los últimos años, en especial en los receptores de mayor edad1.
El riesgo de desarrollar una neoplasia está aumentado en el paciente con enfermedad renal crónica, en general. Entre los principales factores de riesgo asociados se pueden incluir la edad, la exposición previa a agentes oncogénicos (tabaco, alcohol, exposición solar), la predisposición genética, así como la etiología de la enfermedad renal, el tiempo en diálisis y la disfunción inmune de la uremia2-6. No obstante, la incidencia de cáncer es aún mayor tras el TR debido, principalmente, al papel de la inmunosupresión, junto a otros factores como la reactivación de virus con potencial oncogénico, la edad en el momento del trasplante y el tiempo transcurrido desde éste1-5. Por otro lado, el cáncer en el paciente sometido a TR se caracteriza, por lo general, por un comportamiento más agresivo, con una progresión más rápida y una peor respuesta al tratamiento3,5.
Los tumores más frecuentes en la población sometida a TR son los tumores de piel, los genitourinarios y los trastornos linfoproliferativos. Kasiske, et al. encuentran que la incidencia de los tumores de piel no melanocíticos, del sarcoma de Kaposi y del linfoma no hodgkiniano es 20 veces superior a la de la población general4. En los últimos años se ha observado también un aumento en la aparición de CCR en riñón nativo en pacientes sometidos a TR, que es 10-100 veces más frecuente que en la población general3. Su incidencia es muy variable, y oscila entre un 0,3 y un 4,8% según las series, debido probablemente a que aún no existe acuerdo en la forma de realizar el cribado diagnóstico de esta enfermedad5.
Se han asociado varios factores de riesgo con la aparición de CCR en la población sometida a TR como son el tratamiento inmunosupresor, tiempo en diálisis, edad, historia previa de CCR, abuso de analgésicos, y la ERQA3-6,10-13. En nuestra experiencia, el tiempo en tratamiento renal sustitutivo fue prolongado en casi todos los casos, con una mediana de 31 meses en diálisis previo al TR y de 52 meses desde el TR hasta el desarrollo del CCR. De nuestros pacientes, sólo uno tenía ERQA, y era el que llevaba más tiempo en diálisis (82 meses) antes del diagnóstico de CCR. Esta entidad se considera un factor independiente de riesgo de CCR, aunque su ausencia no lo excluye14, como comprobamos en nuestra serie.
El curso de CCR en el TR es más agresivo que en la población general, con un pronóstico menos favorable y una peor respuesta al tratamiento5,15. Por otro lado, muchos estudios confirman que el tamaño del tumor en el momento del diagnóstico influye de forma importante en la evolución de la enfermedad, y que el pronóstico es mucho mejor en tumores menores de 3 cm de diámetro5. Sabemos también que el tratamiento de esta patología en estadios iniciales se asocia con una excelente evolución, de ahí, por tanto, la importancia del diagnóstico precoz de este cuadro, especialmente en los pacientes con TR5,16,17.
La ecografía abdominal es un método diagnóstico sencillo y no invasivo, útil en la detección del CCR en el riñón primitivo de los pacientes con TR. Sin embargo, las guías de las Sociedades americanas y europeas de nefrología y urología aún no han establecido con qué frecuencia deben realizarse estas exploraciones para la detección precoz de CCR de riñones nativos en TR4-7. Algunos grupos aconsejan realizar estudios ecográficos anuales en los pacientes asintomáticos, y semestralmente en pacientes de alto riesgo5,15. Otros autores, en cambio, los realizan cada tres años3. En nuestra experiencia, todos los pacientes estaban asintomáticos en el momento del diagnóstico, siendo éste un hallazgo casual en el cribado habitual que llevamos a cabo en nuestra unidad. La realización anual de ecografía nos permitió diagnosticar muy precozmente todos los casos.
En nuestro estudio, igual que se describe en otras series10,18, los tres casos de falsos positivos fueron pacientes con poliquistosis hepatorrenal con quistes complicados Bosniak III, lo cual resalta la dificultad del diagnóstico de CCR en esta patología, dado que esas dos lesiones no son siempre fáciles de distinguir. Según la clasificación Bosniak para masas quísticas renales, un estadio III, como en nuestros pacientes, es de alto riego de lesión maligna19. Por otro lado, la incidencia de CCR en pacientes poliquísticos con quistes complicados puede ser elevada (hasta de un 50% según Schwarz, et al.) 20. Por todo ello, en los pacientes con quistes renales Bosniak III se aconseja la realización de nefrectomía, como finalmente decidimos en nuestros casos20,21.
Entre los factores pronósticos más importantes del CCR, además del tamaño del tumor, se encuentran la estadificación (clasificación TNM) y el grado nuclear de Fuhrman9,10. Así, la supervivencia a los cinco años varía claramente según el estadio TNM; ésta es del 90-100% en el estadio I (T1N0M0), mientras que en el estadio IV es menor del 10%, si ya existen metástasis a distancia17,22. Según el grado nuclear de Fuhrman, los CCR se dividen en bajo (I y II) y alto (III y IV) grado. En nuestra serie, el diagnóstico precoz mediante ecografía ha permitido que, en el momento del diagnóstico, los tumores fueran de pequeño tamaño, todos en estadio T1N0M0 y con bajo grado nuclear de Fuhrman. Esto, con toda probabilidad, ha influido en la excelente evolución observada.
Un paciente de nuestra serie, tras una primera nefrectomía por CCR, desarrolló otro CCR en el riñón contralateral un año después y otros tres pacientes fueron diagnosticados con posterioridad al CCR de tumores en otras localizaciones. Ello sugiere que estos enfermos tienen una mayor predisposición a desarrollar cáncer, como han observado también otros grupos11. En estos pacientes, por tanto, creemos que hay que ser especialmente cuidadosos en el seguimiento y vigilancia de otras posibles nuevas neoplasias.
La asociación del tratamiento inmunosupresor con un mayor riesgo de tumores en el paciente sometido a trasplante es bien conocido23. Los inhibidores de la calcineurina se han relacionado, en general, con un aumento en la incidencia de cáncer y, en algún estudio, se ha encontrado que esta incidencia es mayor con tacrolimus que con ciclosporina24. En nuestro caso, casi todos los pacientes estaban en tratamiento con tacrolimus, aunque ello es lo esperable teniendo en cuenta que ésta es la pauta de inmunosupresión más habitual en el período de tiempo en el que se desarrolla el estudio. Por el contrario, los inhibidores de la señal de proliferación han demostrado tener un papel antitumoral. Varios estudios han comunicado que los inhibidores de m-TOR pueden ser beneficiosos en el tratamiento del sarcoma de Kaposi, cáncer de piel recurrente, carcinoma de células renales y otros tumores sólidos25-29. En todos nuestros pacientes se procedió a una modificación del tratamiento inmunosupresor, con conversión del anticalcineurínico a inhibidores de m-TOR en los pacientes en los que fue posible, y descenso de la inmunosupresión en todos ellos. Esto, junto al tratamiento quirúrgico precoz del CCR, probablemente ha contribuido también a nuestros buenos resultados.
La evolución en todos los pacientes ha sido excelente, con una supervivencia del 100%, y sin que la enfermedad haya recurrido durante el tiempo de seguimiento. Aunque el número de pacientes es pequeño, nuestra experiencia muestra que, a pesar de la mayor incidencia de CCR en el paciente sometido a TR en comparación con la población general, el pronóstico de esta enfermedad es excelente si el tratamiento se realiza en estadios iniciales. Por todo ello, consideramos conveniente la realización de una ecografía abdominal anual en los pacientes sometidos a TR como método de detección precoz del CCR.
Tabla 1. Características de los pacientes
Tabla 2. Características de los carcinomas de células renales