Las alteraciones del metabolismo óseo y mineral son muy frecuentes en la enfermedad renal crónica (ERC). El aumento en los niveles de fósforo condiciona enfermedad ósea, riego de calcificación y mayor mortalidad, por lo que cualquier estrategia encaminada a su reducción debe ser bienvenida. El último fármaco incorporado al arsenal terapéutico para tratar la hiperfosforemia en la ERC es el oxihidróxido sucroférrico (OSF).
ObjetivoAnalizar la eficacia y seguridad de OSF en 3 cohortes de pacientes, una con ERC avanzada no en diálisis, otra en diálisis peritoneal y finalmente otra en hemodiálisis, seguidas durante 6 meses.
MétodosEstudio observacional multicéntrico, prospectivo, de práctica clínica. Se analizaron variables clínicas y epidemiológicas. Se valoró la evolución de parámetros relacionados con las alteraciones del metabolismo óseo y mineral y la anemia.
ResultadosSe incluyeron en el estudio 85 pacientes (62±12 años, 64% varones, 34% diabéticos), 25 con ERC avanzada no en diálisis, 25 en diálisis peritoneal y finalmente 35 en hemodiálisis. En 66 pacientes (78%) OSF fue el primer captor del fósforo; en los otros 19 se sustituyó un captor previo por OSF, por falta de tolerancia o eficacia. La dosis inicial de OSF fue 964±323mg/día. Globalmente los niveles séricos de fósforo experimentaron un descenso significativo a los 3 meses de tratamiento (19,6%; p<0,001). No hubo diferencias en la eficacia del fármaco al comparar las distintas poblaciones analizadas. A lo largo del estudio no se modificaron los niveles de calcio, PTHi, ferritina, índice de saturación de la transferrina ni hemoglobina, aunque se manifestó una tendencia al aumento de los 2 últimos. Doce pacientes (14%) abandonaron el seguimiento, 10 por efectos adversos gastrointestinales (diarrea fundamentalmente) y 2 por pérdida de seguimiento (trasplante renal). La dosis media del fármaco que recibieron los pacientes se incrementó a lo largo del tiempo hasta alcanzar los 1.147±371mg/día.
ConclusionesOSF es una opción eficaz para el tratamiento de la hiperfosforemia en pacientes con ERC tanto en fases avanzadas de la enfermedad como en diálisis. Encontramos una eficacia similar en los 3 grupos analizados. A mayor nivel basal de fósforo, mayor descenso de sus niveles séricos. Con dosis de alrededor de 1.000g/día se puede conseguir un notable descenso de los niveles de fósforo. La diarrea fue el efecto secundario más frecuente, aunque tuvo poca importancia generalmente.
Alterations in bone and mineral metabolism are very common in chronic kidney disease (CKD). The increase in phosphate levels leads to bone disease, risk of calcification and greater mortality, so any strategy aimed at reducing them should be welcomed. The latest drug incorporated into the therapeutic arsenal to treat hyperphosphataemia in CKD is sucroferric oxyhydroxide (SFO).
ObjectiveTo analyse the efficacy and safety of SFO in 3 cohorts of patients, one with advanced CKD not on dialysis, another on peritoneal dialysis and the last on haemodialysis, followed for 6 months.
MethodsA prospective, observational, multicentre study in clinical practice. Clinical and epidemiological variables were analysed. The evolution of parameters relating to alterations in bone and mineral metabolism and anaemia was analysed.
ResultsEighty-five patients were included in the study (62±12 years, 64% male, 34% diabetic), 25 with advanced CKD not on dialysis, 25 on peritoneal dialysis and lastly, 35 on haemodialysis. In 66 patients (78%), SFO was the first phosphate binder; in the other 19, SFO replaced a previous phosphate binder due to poor tolerance or efficacy. The initial dose of SFO was 964±323mg/day. Overall, serum phosphate levels saw a significant reduction at 3 months of treatment (19.6%; P<.001). There were no differences in the efficacy of the drug when the different populations analysed were compared. Over the course of the study, there were no changes to levels of calcium, PTHi, ferritin, transferrin saturation index or haemoglobin, although there was a tendency for the last 2 to increase. Twelve patients (14%) withdrew from follow-up, 10 due to gastrointestinal adverse effects (primarily diarrhoea) and 2 were lost to follow-up (kidney transplant). The mean dose of the drug that the patients received increased over time, up to 1,147±371mg/day.
ConclusionsSFO is an effective option for the treatment of hyperphosphataemia in patients with CKD both in the advanced phases of the disease and on dialysis. We found similar efficacy across the 3 groups analysed. The higher their baseline phosphate level, the greater the reduction in the serum levels. A notable reduction in phosphate levels can be achieved with doses of around 1,000mg/day. Diarrhoea was the most common side effect, although it generally was not significant.
Las alteraciones del metabolismo óseo y mineral son muy frecuentes en la enfermedad renal crónica (ERC) y aparecen ya en etapas precoces de la misma. Así, se ha descrito en pacientes con leves descensos del filtrado glomerular un aumento en la concentración del factor de crecimiento fibroblástico 23 y una disminución de Klotho1. Debido al efecto fosfatúrico del factor de crecimiento fibroblástico 23, los niveles séricos de fósforo permanecen en rango de normalidad en esos primeros momentos del daño renal. Sin embargo, según va progresando la enfermedad renal, se reduce la capacidad de eliminar la carga de fósforo, el cual procede fundamentalmente de la dieta. La hiperfosforemia es una situación clínica que suele aparecer cuando el filtrado glomerular cae por debajo de 30ml/min2, y parece implicada en los mecanismos de progresión de la propia enfermedad renal3 o en el fenómeno de calcificación vascular en pacientes sin enfermedad renal4. El control de los niveles de fósforo ha sido siempre objeto de intensa preocupación por los profesionales que se dedican al cuidado de los pacientes con ERC. Se ha demostrado una asociación directa entre niveles elevados de fósforo y mortalidad en numerosos estudios observacionales llevados a cabo en pacientes en diálisis y prediálisis5–10. Ante esta tesitura, cualquier estrategia encaminada a reducir los niveles de fósforo sérico en el paciente urémico debe ser bienvenida. De esta forma, se han publicado los efectos beneficiosos de las dietas bajas en fósforo11, modificaciones en las pautas de diálisis para conseguir mayor depuración extrarrenal del mismo12 o el uso de captores intestinales13, empleados con el objeto de reducir su absorción. También se ha visto que el empleo de fármacos que disminuyen la hormona paratiroidea (PTH), como puede ser el cinacalcet, son capaces de reducir los niveles de fósforo sérico, en probable relación con una mejoría en el remodelado óseo14. Todas estas medidas se han asociado con una reducción del riesgo de mortalidad.
Los captores de fósforo actualmente comercializados se dividen en aquellos de base cálcica y los que no llevan calcio en su composición. Las últimas guías de la Kidney Disease: Improving Global Outcomes, del año 2017, recomiendan restringir el uso de captores de fósforo de base cálcica por contribuir al balance positivo de calcio en el paciente con ERC y aumentar el riesgo de calcificación de tejidos blandos15. El oxihidróxido sucroférrico (OSF) es un nuevo captor de fósforo con hierro que está indicado en pacientes adultos con ERC. Además de los estudios precomercialización16, ya se están publicando algunos de práctica clínica tanto en pacientes en hemodiálisis (HD) como en diálisis peritoneal (DP). En todos los casos se observa una reducción clara de los niveles de fósforo sérico; este efecto ocurre tanto en pacientes en los que OSF es el primer captor como en los que resulta de la sustitución de otro17–19. No hay datos publicados sobre el efecto de este fármaco en pacientes en fases avanzadas de la ERC que no han llegado a precisar diálisis.
El objetivo principal del presente estudio fue analizar la eficacia y seguridad de OSF en 3 cohortes de pacientes: una con ERC avanzada no en diálisis, otra en DP y finalmente otra en HD, seguidas durante 6 meses.
Material y métodosEstudio observacional multicéntrico, prospectivo, de práctica clínica llevado a cabo en los servicios de nefrología de 4 hospitales públicos de nuestra región. Se valoraron todos los pacientes a los que se les prescribió OSF con la indicación de hiperfosforemia. Los pacientes procedían de los programas de DP, HD y de las consultas de ERC avanzada (todos ellos con filtrados glomerulares menores de 30ml/min).
Se consideraron criterios de inclusión: 1) pacientes de ambos sexos, mayores de 18 años; 2) diagnosticados de ERC y de hiperfosforemia (definida como una concentración de fósforo sérico por encima de 4,5mg/dl), y 3) con ausencia de reacción conocida o eventual intolerancia al fármaco en estudio. Fueron excluidos aquellos pacientes con conocida mala adherencia al tratamiento.
El estudio fue aprobado por el Comité Ético y los pacientes participantes firmaron un consentimiento informado para incorporarse al mismo.
ProcedimientosLa intervención consistió en la administración oral de OSF durante 6 meses. Al tratarse de un estudio de práctica clínica, el médico responsable del paciente decidió la dosis inicial del fármaco y se basó fundamentalmente en la concentración de fósforo en ese momento. Las variaciones posteriores en la dosificación se basaron en la evolución de los valores de fósforo sérico. Si no se conseguía el descenso deseado, se aumentaba la dosis de OSF. Los pacientes fueron instruidos para tomar el fármaco durante las comidas.
A los pacientes que previamente estaban recibiendo otro captor del fósforo se les sometió a un período de lavado de 2 semanas para evitar interferencias que pudieran alterar los resultados. Como medida adicional y antes de empezar el estudio, se informó a todos los pacientes de que sufrían hiperfosforemia y de los riesgos que ello conlleva. Se les explicaron además los posibles efectos adversos que podría tener el fármaco, como la coloración negruzca de las heces o el aumento del ritmo intestinal y la menor consistencia de las heces. Aquellos pacientes que por cualquier razón no concluyeron el período de estudio se analizaron por intención de tratar.
Determinaciones bioquímicasLos análisis generales, incluyendo los niveles séricos de calcio y fósforo, se determinaron con autoanalizador, siguiendo los procedimientos del laboratorio del hospital. Los valores de calcio referidos en el presente estudio se expresan como calcio total sin corregir con los niveles de proteínas o albúmina séricas. La determinación de la PTH se llevó a cabo mediante electroquimioluminiscencia (EQL Elecsys® PTH, de Roche) y se corrigieron los resultados con el coeficiente 0,97 para expresarlos como IRMA, de Nichols, según las guías K/DOQI20. La función renal se determinó mediante el aclaramiento de creatinina con recogida de orina de 24h.
Análisis estadísticoLas variables continuas se expresaron como media y desviación estándar y las categóricas como porcentaje. Previamente se había empleado el test de KoImogorov-Smirnov para ver si seguían una distribución normal. Aquellas variables que no mostraban una distribución normal se expresaron como mediana y rango intercuartílico. Para analizar la evolución de los niveles séricos de las distintas variables durante el período de estudio se utilizó el modelo lineal general con medidas repetidas. Para conocer los mejores predictores de respuesta al tratamiento se aplicó un modelo de regresión lineal. Se utilizó el paquete estadístico SPSS® 20 para Windows (SPSS Inc., Chicago, IL) para el análisis de los resultados.
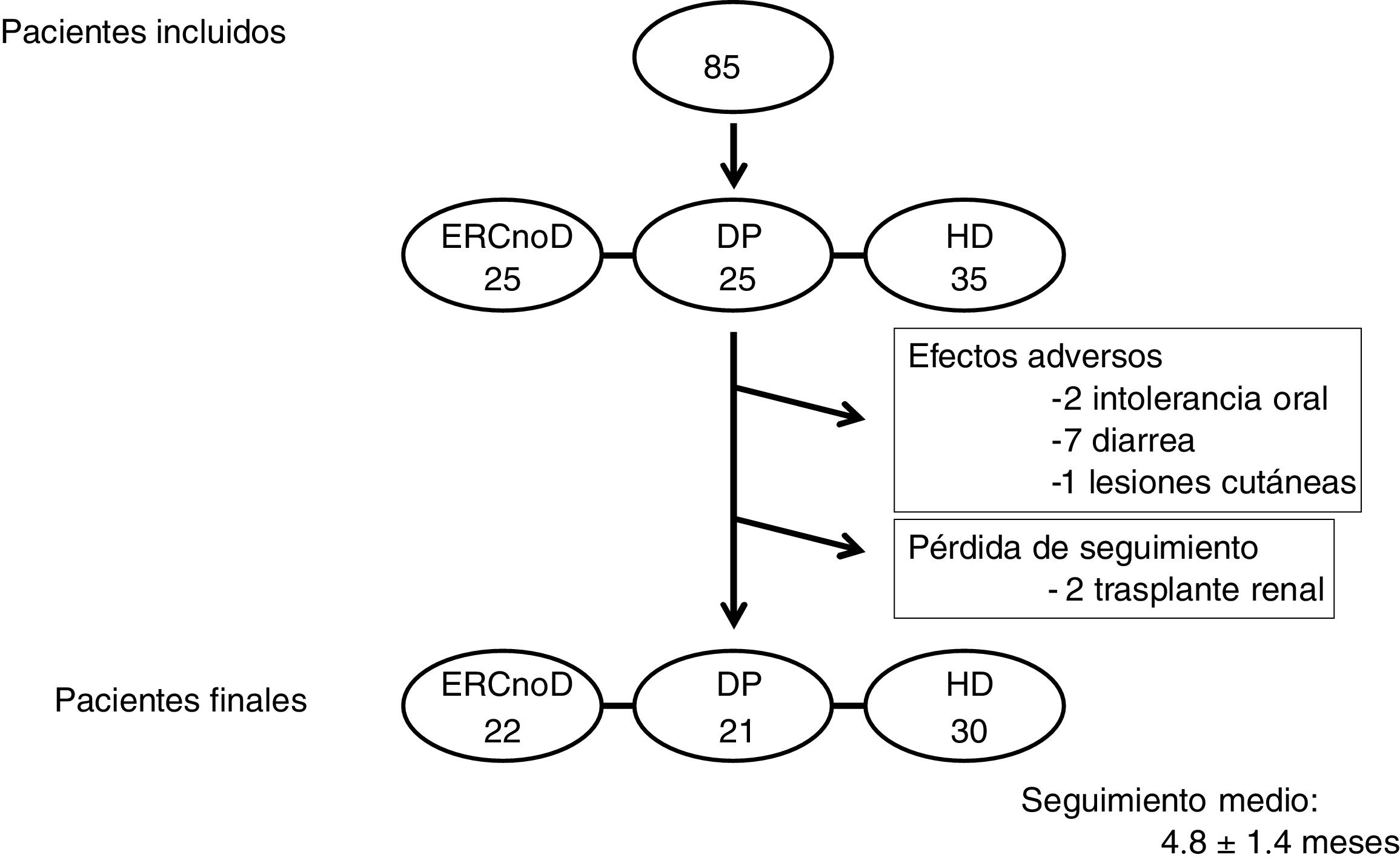
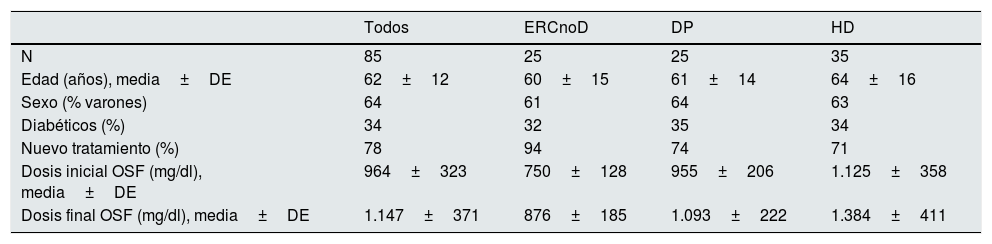
ResultadosFinalmente se incluyeron en el estudio 85 pacientes, de los cuales 35 estaban en HD, 25 en DP y los restantes eran vistos en consulta por ERC avanzada no en diálisis. Las características de los pacientes aparecen en la tabla 1. Los 3 grupos de pacientes tenían unas características similares, salvo una edad ligeramente mayor en los que estaban en HD. En 66 pacientes (78%) OSF fue el primer captor del fósforo prescrito debido al reciente diagnóstico de hiperfosforemia; en los otros 19 se sustituyó un captor previo por OSF, por falta de tolerancia o eficacia. La dosis inicial de OSF fue de 964±323mg/día, por debajo de las recomendaciones sobre dosificación que aparecen en la ficha técnica del producto.
Características basales de los pacientes y dosis inicial y final de oxihidróxido sucroférrico
| Todos | ERCnoD | DP | HD | |
|---|---|---|---|---|
| N | 85 | 25 | 25 | 35 |
| Edad (años), media±DE | 62±12 | 60±15 | 61±14 | 64±16 |
| Sexo (% varones) | 64 | 61 | 64 | 63 |
| Diabéticos (%) | 34 | 32 | 35 | 34 |
| Nuevo tratamiento (%) | 78 | 94 | 74 | 71 |
| Dosis inicial OSF (mg/dl), media±DE | 964±323 | 750±128 | 955±206 | 1.125±358 |
| Dosis final OSF (mg/dl), media±DE | 1.147±371 | 876±185 | 1.093±222 | 1.384±411 |
DE: desviación estándar; DP: diálisis peritoneal; ERCnoD: enfermedad renal crónica no en diálisis; HD: hemodiálisis; OSF: oxihidróxido sucroférrico.
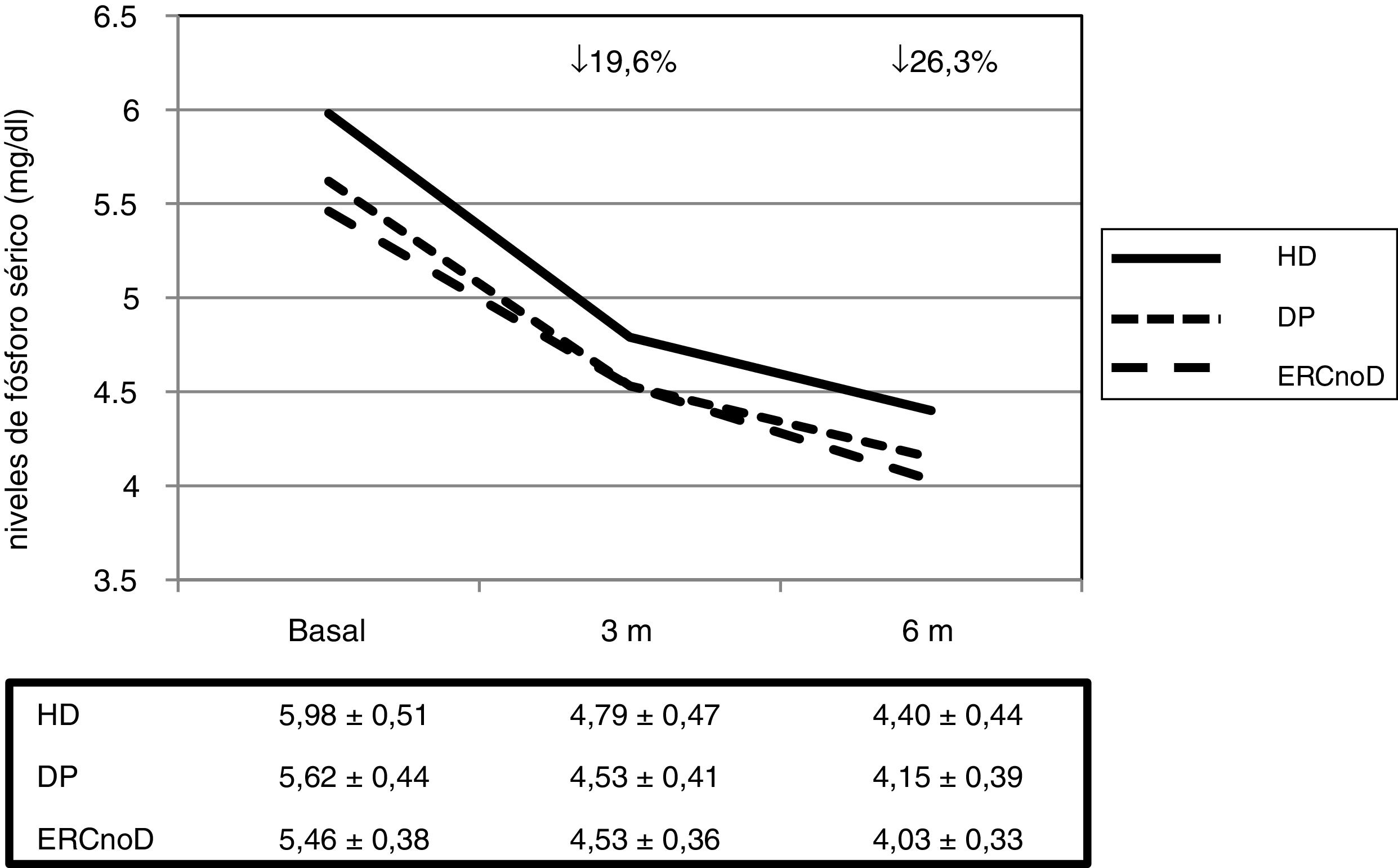
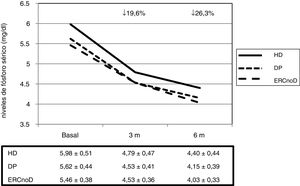
De forma global, los niveles séricos de fósforo experimentaron un descenso significativo a los 3 y 6 meses de tratamiento, pasando de 5,7±0,5 a 4,6±0,4 y a 4,3±0,4mg/dl, respectivamente (p<0,001). El descenso medio fue del 19,6% a los 3 meses y se alcanzó un 26,3% a los 6. Con estos descensos de la concentración de fósforo se consiguió que el 68% estuvieran en rango de normalidad a los 3 meses y un 83% a los 6 meses, según los valores de referencia publicados por las últimas guías de la Sociedad Española de Nefrología20.
No hubo diferencias en la eficacia del fármaco al comparar las distintas poblaciones analizadas (fig. 1). Tampoco hubo diferencias en relación con aquellos pacientes en los cuales OSF era el primer captor o aquellos en los que fue un cambio respecto a otro previo.
En el análisis univariado observamos que el porcentaje de descenso de fósforo sérico respecto al basal tras 6 meses de tratamiento se asoció de forma directa con los niveles basales de fósforo (r=0,473; p<0,001). Otros parámetros demográficos y bioquímicos no tuvieron efecto. En el modelo de regresión lineal multivariado solamente los niveles basales de fósforo (Exp[B]=0,87 [IC 95% 0,74-0,94]; p<0,001) fueron predictores independientes de la respuesta al tratamiento.
A lo largo del estudio no se modificaron de forma significativa los niveles de calcio, PTHi, ferritina, índice de saturación de la transferrina ni hemoglobina, aunque se manifestó una tendencia al aumento de los 2 últimos (tabla 2).
Evolución de los parámetros analíticos
| Basal | 3 meses | 6 meses | p | |
|---|---|---|---|---|
| Ca (mg/dl), media±DE | 9,2±0,6 | 9,1±0,5 | 9,1±0,6 | 0,150 |
| P (mg/dl), media±DE | 5,7±0,5 | 4,6±0,4 | 4,3±0,4 | <0,001 |
| PTH (pg/ml), mediana (RIC) | 305 (356) | 292 (331) | 318 (345) | 0,384 |
| Hemoglobina (g/dl), media±DE | 11,1±1,2 | 11,3±1,2 | 11,4±1,4 | 0,089 |
| Ferritina (ng/ml), media±DE | 177±56 | 186±71 | 194±77 | 0,101 |
| IST (%), media±DE | 18,1±2,3 | 19,3±2,8 | 19,8±3,1 | 0,092 |
Ca: calcio; DE: desviación estándar; IST: índice de saturación de la transferrina; P: fósforo; PTH: hormona paratiroidea; RIC: rango intercuartílico.
La dosis media del fármaco que recibieron los pacientes se incrementó a lo largo del período de seguimiento en aras de alcanzar el objetivo de control de los niveles de fósforo sérico hasta conseguir los 1.147±371mg/día.
Doce pacientes (14%) abandonaron el seguimiento, 10 por efectos adversos gastrointestinales (diarrea fundamentalmente) y 2 por pérdida de seguimiento (trasplante renal) (fig. 2). El seguimiento medio del total de la muestra de pacientes fue de 4,8±1,1 meses.
DiscusiónEn el presente estudio se confirma la eficacia de OSF en el control de los niveles de fósforo en pacientes con ERC tanto en diálisis como en aquellos otros con ERC en la etapa prediálisis.
En condiciones normales, eliminamos por la orina el 90% del fósforo ingerido, siendo el restante 10% eliminado por las heces21. Cuando la enfermedad renal avanza, las nefronas funcionantes no van a ser capaces de eliminar el fósforo y sus niveles plasmáticos se irán elevando progresivamente22. Las técnicas de diálisis convencionales no consiguen eliminar ese exceso de fósforo, aunque sí se ha descrito que el uso de técnicas convectivas23 o la HD frecuente24 pueden ayudar a normalizarlo sin llegar a necesitar el empleo de fármacos. Por todo ello, en la mayoría de los casos va a ser necesaria la prescripción de captores intestinales para intentar normalizar la fosforemia.
Los captores de fósforo de base cálcica suelen ser bien tolerados, son eficaces y baratos; sin embargo, las guías de práctica clínica15 recomiendan no utilizarlos en caso de hipercalcemia o calcificación vascular diagnosticada previamente. Y debemos saber que son muchos los pacientes con ERC avanzada que están calcificados, alcanzando casi el 90% de los pacientes prevalentes en HD25 y el 80% de los prevalentes en DP26. Por eso, hace ya años surgió la necesidad de utilizar captores de base no cálcica. Sevelamer y lantano son 2 captores no cálcicos, comúnmente utilizados.
La eficacia de los captores de fósforo no cálcicos ha sido ampliamente analizada y parece que hay unanimidad a la hora de estimar la reducción de la fosforemia en los diferentes grupos de tratamiento: en torno al 25%. Así, se ha visto como sevelamer es capaz de reducir los niveles séricos de fósforo en torno al 20% tras 8 semanas de tratamiento en pacientes con ERC que no están en diálisis27; en estudios realizados en pacientes en HD, se estimó un descenso de alrededor del 25% en una cohorte de casi 200 pacientes seguidos durante 46 semanas28; finalmente, en pacientes en DP se ha publicado un descenso de alrededor del 22% tras 12 semanas de tratamiento29. Algo parecido ocurre con lantano. Se ha comprobado un descenso de en torno al 25%30 en solo 4 semanas de tratamiento en una cohorte de pacientes con ERC que no están en diálisis, un descenso del 21% en pacientes en HD tras administrar lantano durante 36 meses31 y, finalmente, se apreció una reducción del 24% en 48 semanas de tratamiento en un grupo de pacientes en DP32. Los estudios que compararon sevelamer con lantano no encontraron diferencias entre la eficacia de ambos33, aunque una ventaja adicional en relación con sevelamer son los efectos pleiotrópicos asociados a su empleo (mejoría del perfil lipídico y en los niveles de ácido úrico, aumento de la fosfatasa alcalina, reducción en la proteína C reactiva)34. A pesar de este arsenal terapéutico del que disponemos, la mitad de los pacientes en HD y DP no alcanzan los objetivos deseados y recomendados por las guías35. Muchas son las causas que se han implicado en esta ausencia de consecución de objetivos; entre ellas destaca la polimedicación (un paciente en HD puede llegar a tomar 20 comprimidos diarios, siendo la mitad de ellos captores de fósforo), y por otro lado, la frecuente aparición de efectos adversos, la mayoría de ellos gastrointestinales, que llevan a los pacientes a reducir las dosis o abandonar los tratamientos36. Los hábitos alimenticios actuales, entre los que se encuentra el consumo frecuente de productos precocinados o tratados con conservantes ricos en fósforo inorgánico, ayudan a empeorar la situación37.
Este es el escenario en el que aparece el OSF. Entre las ventajas que se le otorgan a este fármaco destacan su eficacia, el menor número de comprimidos necesarios y la mejor tolerancia gastrointestinal. Estos efectos se han ido confirmando en los distintos estudios publicados hasta ahora. Previamente a su comercialización se desarrollaron ensayos clínicos con el objeto de valorar la eficacia y seguridad de este fármaco en pacientes en diálisis. Floege et al.16 publicaron los resultados del seguimiento de 644 pacientes en diálisis (91% en HD, 9% en DP), con hiperfosforemia (definida como fósforo sérico mayor de 6mg/dl), aleatorizados a recibir carbohidrato de sevelamer u OSF con el objetivo de alcanzar unos niveles de fósforo entre 2,5 y 5,5mg/dl. En este estudio se constató que OSF es igual de eficaz que sevelamer a la hora de reducir la fosforemia, consiguiendo que el mismo número de pacientes consiguieran los objetivos recomendados por las guías de práctica clínica. El descenso medio de fosforemia alcanzado fue de un 25% a los 3 meses, manteniéndose posteriormente estable hasta las 52 semanas de seguimiento. Un aspecto destacado de este estudio es que con OSF se redujo el número de comprimidos necesarios para conseguir el objetivo de fósforo, en comparación con sevelamer.
Posteriormente se han ido publicando diferentes estudios de vida real que analizaron la eficacia de OSF en pacientes en diálisis. Así, Kendrick et al.18 analizaron los cambios en la consecución de objetivos de fósforo sérico a la hora de sustituir tratamientos con distintos captores (acetato cálcico, sevelamer o lantano). El estudio concluyó que con OSF la posibilidad de tener los niveles de fósforo sérico dentro del rango recomendado por las guías es del doble que con otros captores. Coyne et al.17 siguieron la evolución de más de 1.000 pacientes prevalentes en HD tratados con OSF. Con este fármaco se consiguió un aumento del 12% en el número de pacientes que alcanzaban los objetivos recomendados de fósforo sérico. Por último, Kalantar-Zadeh et al. analizaron la evolución del fósforo sérico en una cohorte de 258 pacientes en DP a los que se les prescribió OSF, consiguiendo un descenso generalizado en la fosforemia y que casi tres cuartas partes de los pacientes alcanzaran el objetivo de fósforo indicado en las guías19. Hasta el momento no hay datos publicados acerca del efecto de OSF sobre el fósforo sérico en pacientes con ERC que no están en diálisis, por lo que nuestro trabajo será el primero en aportar información al respecto.
El descenso medio de los niveles de fósforo en nuestro estudio fue del 20% a los 3 meses y del 26% a los 6 meses. Un aspecto diferencial respecto al ensayo clínico de Floege et al.16 es que el fósforo sérico siguió bajando hasta las 26 semanas frente a las 12 semanas en las que, de forma consecutiva, se redujo la fosforemia en el estudio anteriormente comentado.
Pocos pacientes en DP son habitualmente incluidos en estudios de eficacia de fármacos. En nuestro caso, quisimos tenerlos en cuenta. No encontramos diferencias estadísticamente significativas en los niveles de fósforo basales de la cohorte en DP frente a los pacientes que estaban en HD, y el porcentaje de descenso de la fosforemia fue similar en ambos grupos. En nuestro estudio se incluyeron también 25 pacientes procedentes de las consultas de ERC avanzada. En ellos, el porcentaje de descenso en los niveles de fósforo fue similar al conseguido en la población en diálisis. No se produjeron modificaciones en los niveles de calcio ni PTH a lo largo del período de seguimiento.
A pesar de que la ficha técnica recomienda una dosis de 1.500mg/día de OSF (3 comprimidos), en nuestro caso, la dosis inicial del fármaco no alcanzó el gramo diario, llegando a la finalización del estudio a aumentar una media de 200mg diarios. Este dato habla de su eficacia y lleva a la conclusión de que el coste total del tratamiento de la hiperfosforemia con OSF es menor del inicialmente considerado. A este respecto, se ha publicado que OSF es coste-efectivo al compararlo con sevelamer en un horizonte de 10 años38.
Aunque no se alcanzó significación estadística en la diferencia en los parámetros relacionados con la anemia y la ferrocinética a lo largo del seguimiento, sí que se observó una tendencia al alza en la hemoglobina y en el índice de saturación de la transferrina. Nuestro estudio no estaba diseñado para analizar las causas de estos cambios, por lo que estas variaciones no pueden ser achacadas en exclusiva a OSF. A algunos pacientes incluidos en el análisis se les modificó la dosis de agentes estimulantes de la eritropoyesis o de hierro (tanto oral como intravenoso); además, 2 pacientes precisaron de la transfusión de hemoderivados. Otros estudios han analizado el papel que la administración de un captor de fósforo que contiene hierro puede tener en el control de la anemia y parámetros ferrocinéticos. Floege et al.16 encontraron también una tendencia al alza en todos estos parámetros, que tampoco alcanzó la significación estadística. Sin embargo, Kendrick et al.18 sí encontraron en su amplia serie de pacientes en HD un aumento significativo en la hemoglobina, la ferritina y el índice de saturación de la transferrina, con un descenso en las necesidades de agentes estimulantes de la eritropoyesis y de hierro intravenoso. No sería de extrañar que parte del hierro que compone la molécula de OSF pueda ser absorbido a nivel intestinal y que pueda repercutir en los parámetros descritos.
En relación con los efectos adversos, cabe destacar que 10 pacientes (11,7% del total) abandonaron el tratamiento por alguna reacción asociada al fármaco, mayoritariamente la presencia de diarrea. La tasa de abandonos con OSF es menor que la publicada por Floege et al.16 y similar a la descrita es estudios previos con sevelamer o lantano39,40. Todos los pacientes tuvieron las heces negras, en relación con la eliminación en heces del hierro que contienen los comprimidos. La consistencia de las heces fue, en general, más blanda, especialmente las primeras semanas de tratamiento. Este efecto, que podría considerarse adverso, podría tener un efecto beneficioso añadido en los pacientes en DP, que con frecuencia necesitan usar laxantes para mantener el ritmo intestinal adecuado y evitar el desplazamiento del catéter peritoneal o problemas de drenaje. A este respecto está en marcha un estudio multicéntrico español que valorará la eficacia de OSF en el control de fósforo en pacientes en DP, y evaluará también el ritmo intestinal y la posible reducción de la necesidad de laxantes.
Entre las limitaciones del presente trabajo cabe destacar que se trata de un estudio de práctica clínica y la ausencia de un grupo control para comparar la eficacia del fármaco. Sin embargo, tiene la fortaleza de ser un estudio multicéntrico, con prescriptores de varios ámbitos de la nefrología y de varios hospitales, que siguen las normas de práctica clínica habitual. Por otro lado, la incorporación de pacientes en DP y especialmente de la consulta de ERC avanzada aporta información sobre grupos de pacientes de los que se tenía poca o ninguna información hasta ahora.
En conclusión, nuestro estudio demuestra la eficacia de OSF en una muestra de pacientes en diálisis, tanto HD como DP, y también de pacientes con ERC avanzada. El descenso de más de un 25% en los niveles de fósforo sérico, a una dosis significativamente menor a lo recomendado en la ficha técnica, habla de la potencialidad de este fármaco. Los efectos adversos, especialmente la diarrea, pueden limitar el efecto de este fármaco en alrededor del 10% de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.