Las glomerulonefritis (GN) constituyen una de las principales causas de enfermedad renal crónica estadio 5 en diálisis, sin embargo, pocos estudios se centran en su pronóstico en diálisis. Analizamos la supervivencia y características de los pacientes con GN primaria (GNP) en diálisis peritoneal (DP) y comparamos sus resultados con otros enfermos.
MétodosEstudio observacional con recogida de datos de manera prospectiva durante 2 décadas (1995-2014). Incluimos a todos los pacientes del registro Levante que iniciaron DP como primera técnica dialítica. Los datos se transfirieron a una base de datos anonimizada en Access. El análisis estadístico se realizó mediante el programa SPSS (versión 19.0).
ResultadosEl estudio incluyó a 2.243 pacientes, siendo las GN la principal causa de enfermedad renal primaria (21,5%). La nefropatía IgA fue la GNP con confirmación histológica más frecuente. Comparados con el resto de la muestra, los pacientes con GNP fueron en mayor proporción varones (65 vs. 58%, p=0,004), con menor edad (48 vs. 55 años, p<0,001), menos comorbilidad y mayor tasa de inclusión en lista de espera de trasplante renal (87 vs. 63%, p<0,001). Asimismo, los pacientes con GNP se trasplantaron más (48,9%, p<0,001) y este fue su motivo más frecuente de salida de DP; además de presentar menor tasa global de peritonitis (0,34 vs. 0,45 episodios/paciente-año, p<0,001). La supervivencia técnica fue del 90,6% al año, del 71,7% a los 3 años y del 59% a los 5 años (mediana 76,8 meses), sin diferencias entre grupos. La supervivencia de los pacientes fue del 94,9% al año, del 80,1% a los 3 años y del 63,7% a los 5 años (mediana 90,7 meses). Los enfermos con GNP presentaron mejor supervivencia media que el resto de patologías (153,5 meses [IC 95%: 137-169,9) vs. 110,3 meses [IC 95%: 100,8-119,7], p<0,001). En el multivariante, se relacionó de manera negativa con la supervivencia técnica tener mayor transporte peritoneal (p=0,018), y con la supervivencia del paciente tener mayor edad (p<0,001) y alguna comorbilidad, especialmente diabetes y hepatopatía (p<0,001). Por el contrario, la inclusión en lista de espera y la función renal residual (p<0,001) favorecieron ambas supervivencias.
ConclusionesA la vista de nuestros resultados y teniendo en cuenta las ventajas de la DP como primer tratamiento dialítico, consideramos que esta terapia es una excelente técnica para los enfermos con GNP mientras esperan un trasplante renal.
Glomerulonephritis (GN) is one of the main causes of chronic terminal kidney disease; however, few studies assess its prognosis in dialysis. We analyze the survival and characteristics of patients on peritoneal dialysis (PD) with primary GN (PGN), and compare their results with other kidney patients.
MethodsThis prospective observational study took place from 1995 to 2014. We included all incident patients who were initiated on the technique in the Levante registry. Data were transferred to an anonymized database in Access. Statistical analysis was performed using SPSS software (version 19.0).
ResultsThe study included 2,243 patients, with GN representing the main cause of primary kidney disease (21,5%). IgA nephropathy was the most frequent histologically confirmed form of PGN. Compared with the rest of the sample, patients with PGN were more often men (65% vs 58%, P=.004), and they were on average younger (48 years vs 55 years, P<.001). They also had fewer comorbidities and a higher rate of inclusion on the waitlist for a kidney transplant (87 vs 63%, P<.001). Patients with PGN also had more transplants (48,9%, P<.001), and this was the most frequent reason for stopping PD; beyond that, their peritonitis mean rate was lower (0,34 vs 0,45 episodes/patient-year, P<.001). Technique survival was 90,6% at one year, 71,7% at 3 years, and 59,0% at 5 years (median 76,8 months); there were no differences between groups. Survival was 94,9% at one year, 80,1% at 3 years, and 63,7% at 5 years (median 90,7 months). Patients with PGN showed better mean survival than patients with other kidney pathologies (153,5 months [95% IC: 137,0 to 169,9] vs 110,3 months [95% CI: 100,8 to 119,7], P<.001). In the multivariable analysis, the main negative risk factor influencing technique survival was a higher peritoneal transport (P=.018). Factors with a negative influence on mortality were being older (P <.001) and having any comorbidity, mainly diabetes and liver disease (P <.001). By contrast, protective survival factors were inclusion on the transplant waitlist and a higher baseline residual renal function (P=.001).
ConclusionsPD has several advantages as a first dialytic treatment, and our results suggest that it is an excellent technique to manage patients with PGN while they await a kidney transplant.
Las glomerulonefritis (GN) constituyen un grupo heterogéneo de enfermedades con una elevada morbimortalidad1 y coste. Afectan fundamentalmente a pacientes jóvenes y son una de las principales causas de enfermedad renal crónica estadio 5 en diálisis (ERC5D) en diferentes registros internacionales1. En España son la cuarta causa de ERC5D en pacientes incidentes y la primera en prevalentes (REER 2013)2.
La diálisis peritoneal (DP) ha mejorado sus resultados en los últimos años, con una supervivencia que podría ser incluso superior a la de la hemodiálisis (HD) en los primeros años de inicio de la técnica y especialmente en pacientes jóvenes con baja comorbilidad3–8. Al mismo tiempo, la DP ofrece otras ventajas adicionales tales como evitar la realización de un acceso vascular, permitir una mayor autonomía y tiempo libre al paciente, y reducir el coste económico para el sistema9–11.
La mayoría de los estudios publicados sobre GN primarias (GNP), se centran en su prevalencia y manifestaciones clínicas. Pocas series analizan su pronóstico, con disparidad en los resultados y ciertas limitaciones como el número de pacientes, corto tiempo de seguimiento y/o falta de datos clínicos12–18.
El objetivo fundamental del presente trabajo es analizar la supervivencia de los pacientes y la técnica de DP, a lo largo de 20 años (1995-2014), en los enfermos incidentes en DP con GNP en un registro multicéntrico español. Comparamos los resultados con los registrados en pacientes con otras enfermedades renales primarias (ERP) identificando los principales factores de riesgo asociados a la supervivencia de pacientes y de técnica. Igualmente describimos las características demográficas, aspectos técnicos y complicaciones presentadas.
Materiales y métodosSe trata de un estudio observacional multicéntrico. La recogida de datos se realizó de manera prospectiva durante un periodo de 2 décadas (1995-2014) en el Registro Levante, constituido por diferentes hospitales públicos de la zona sureste de España (provincias de Albacete, Alicante, Castellón, Cuenca, Murcia y Valencia), que alberga una población de 7,1 millones de habitantes.
Se incluyeron un total de 2.243 pacientes que iniciaron DP como primera técnica dialítica. Se excluyeron los pacientes procedentes de HD, trasplante renal (TR) y otros centros, así como los pacientes en terapia por síndrome cardiorrenal.
Las variables estudiadas fueron: edad de inicio de la DP, sexo, causa de ERC, factores de riesgo cardiovascular (CV) y comorbilidad según el índice de Charlson (CCI-E), inclusión en lista de espera de TR, modalidad de DP (manual o automatizada), datos de adecuación y transporte peritoneal (D/P Cr4), tiempo medio de permanencia en la técnica, peritonitis, estado al final del seguimiento (transferencia a HD, trasplante, fallecimiento o continuidad en DP) y causa del fallecimiento si había tenido lugar.
El evento final para el análisis de supervivencia del paciente fue la muerte (se consideraron perdidas para el seguimiento las salidas por TR, la recuperación de la función renal o la transferencia a HD). Para la supervivencia de la técnica, el episodio estudiado fue la transferencia a HD.
Análisis estadísticoLos datos se transfirieron a una base de datos anonimizada en Access para su manejo, y el análisis estadístico se realizó mediante el programa IBM SPSS Statistics en su versión 19.0.
Se realizó una descripción de la muestra obtenida de acuerdo a la naturaleza de las variables, media y desviación típica para variables continuas y frecuencias para variables categóricas.
En el análisis bivariado se utilizó la Chi cuadrado de Pearson y sus residuos tipificados para comparar proporciones, o el test exacto de Fisher cuando el tamaño muestral lo aconsejaba. La comparación de medias entre 2 grupos se realizó mediante la T de Student o la U de Mann-Whitney mientras que para varios grupos se usó el análisis de la varianza con pruebas de comparación múltiple de Bonferroni y el coeficiente de correlación de Pearson al relacionar variables cuantitativas.
Con respecto a las variables de adecuación, nutrición y cinética peritoneal, se modelizó mediante regresión lineal tanto el parámetro inicial como el final así como la media de la pérdida anual, si procedía. Para el análisis de supervivencia se utilizó el test de log-rank. Para las peritonitis, se examinó el hecho de presentar alguna (regresión logística) y el tiempo hasta la aparición de la primera (regresión de Cox). Finalmente, para las exclusiones definitivas (exitus, paso a HD, TR o mejoría de la función renal residual [FRR]) se realizó el análisis multivariante mediante la regresión de Cox.
ResultadosEl número total de pacientes incidentes en DP entre el 1 de enero de 1995 y el 31 de diciembre de 2014 fue de 2.243 pacientes. El 60% (n: 1.345) fueron hombres, y la edad media de la muestra fue 53,72 años (DT: 15,81).
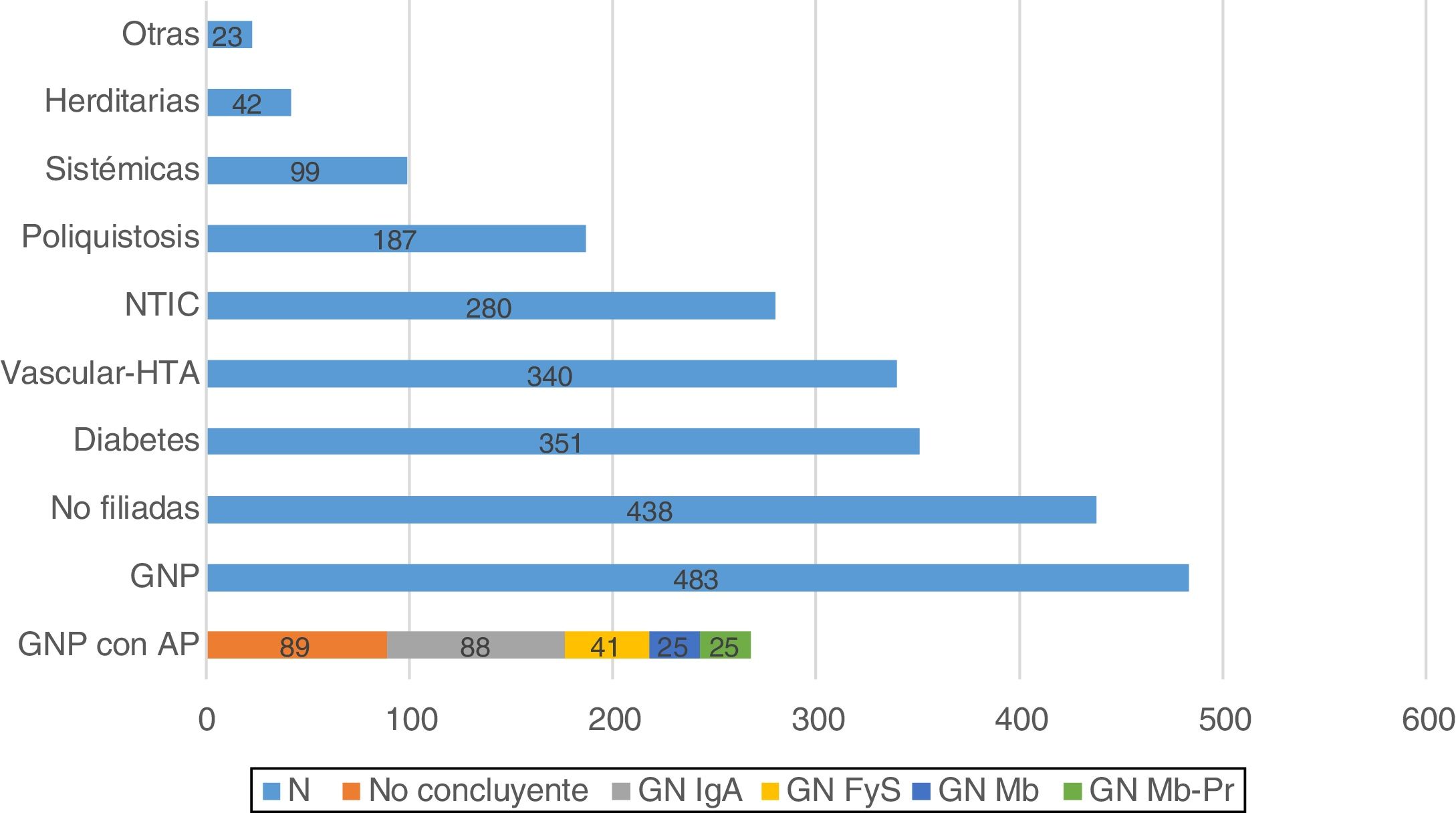
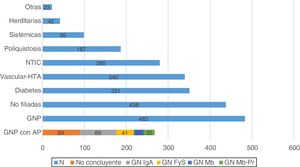
La principal causa de ERP fueron las GNP (n: 483; 21,5%), seguida de las nefropatías no filiadas (n: 438; 19,5%), la nefropatía diabética (n: 351; 15,7%) y la vascular-hipertensiva (n: 340; 15,2%) (fig. 1).
Disponemos de estudio anatomopatológico en 268 de los pacientes clasificados como GNP (55,5%). De las biopsias realizadas, 89 mostraron resultados no concluyentes (18,4%), y de las 179 restantes (37,1%), la nefropatía IgA fue la GN más frecuente (n: 88; 18,2%) (fig. 1).
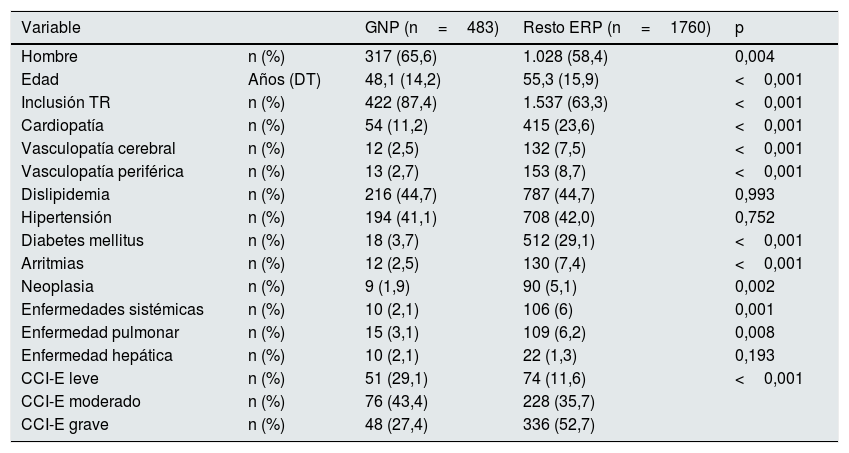
Las GNP comparadas con el resto de ERP fueron en mayor proporción varones (65,6 vs. 58,4%; p=0,004), eran más jóvenes (48,1 vs. 55,3 años; p<0,001), con menor comorbilidad y tenían mayor tasa de incluidos en lista de espera de TR (87,4 vs. 63,3%; p<0,001) (tabla 1).
Factores de riesgo y comorbilidad en las GNP vs. el resto de patologías
| Variable | GNP (n=483) | Resto ERP (n=1760) | p | |
|---|---|---|---|---|
| Hombre | n (%) | 317 (65,6) | 1.028 (58,4) | 0,004 |
| Edad | Años (DT) | 48,1 (14,2) | 55,3 (15,9) | <0,001 |
| Inclusión TR | n (%) | 422 (87,4) | 1.537 (63,3) | <0,001 |
| Cardiopatía | n (%) | 54 (11,2) | 415 (23,6) | <0,001 |
| Vasculopatía cerebral | n (%) | 12 (2,5) | 132 (7,5) | <0,001 |
| Vasculopatía periférica | n (%) | 13 (2,7) | 153 (8,7) | <0,001 |
| Dislipidemia | n (%) | 216 (44,7) | 787 (44,7) | 0,993 |
| Hipertensión | n (%) | 194 (41,1) | 708 (42,0) | 0,752 |
| Diabetes mellitus | n (%) | 18 (3,7) | 512 (29,1) | <0,001 |
| Arritmias | n (%) | 12 (2,5) | 130 (7,4) | <0,001 |
| Neoplasia | n (%) | 9 (1,9) | 90 (5,1) | 0,002 |
| Enfermedades sistémicas | n (%) | 10 (2,1) | 106 (6) | 0,001 |
| Enfermedad pulmonar | n (%) | 15 (3,1) | 109 (6,2) | 0,008 |
| Enfermedad hepática | n (%) | 10 (2,1) | 22 (1,3) | 0,193 |
| CCI-E leve | n (%) | 51 (29,1) | 74 (11,6) | <0,001 |
| CCI-E moderado | n (%) | 76 (43,4) | 228 (35,7) | |
| CCI-E grave | n (%) | 48 (27,4) | 336 (52,7) |
CCI-E: índice de comorbilidad de Charlson ajustado por la edad; DT: desviación típica; ERP: enfermedad renal primaria; GNP: glomerulonefritis primarias; TR: trasplante renal.
Con respecto a la técnica, los pacientes con GNP tuvieron un porcentaje similar de uso de cicladora (23,7 vs. 22,5%; p=0,02) y utilizaron menos icodextrina (19,5 vs. 24%; p<0,001) que el resto de ERP.
Los pacientes con GNP presentaron una excelente dosis dialítica media, sin diferencias con otros enfermos (Kt/V total medio de 2,40 vs. 2,43). Tuvieron mayor nPCR inicial (1,11 vs. 1,05) y esta descendió menos con el tiempo (p<0,001), con una tasa anual de pérdida de FRR similar a la del resto de nefropatías (1,5 vs. 1,8ml/min).
No encontramos diferencias en el transporte peritoneal según el D/P Cr4 inicial para las GNP frente al resto de ERP, con un valor medio global de 0,68 (DT: 0,13) vs. 0,67 (DT: 0,12) respectivamente. Sin embargo, sí apreciamos un aumento del transporte con el tiempo, más acusado en las GN que en el resto de enfermos (0,71 vs. 0,68 al quinto año; p=0,029).
Al final del periodo de estudio, 467 pacientes (20,8%) continuaban en programa, 755 (33,7%) se habían trasplantado, 536 (23,9%) se habían transferido a HD, 394 (17,6%) habían fallecido y 50 (2,2%) habían recuperado la FRR. Se perdió el seguimiento en 41 pacientes (1,8%).
El tiempo de permanencia en DP para las GNP fue de 28,5 meses (DT: 30,07), sin diferencias con el resto de patologías.
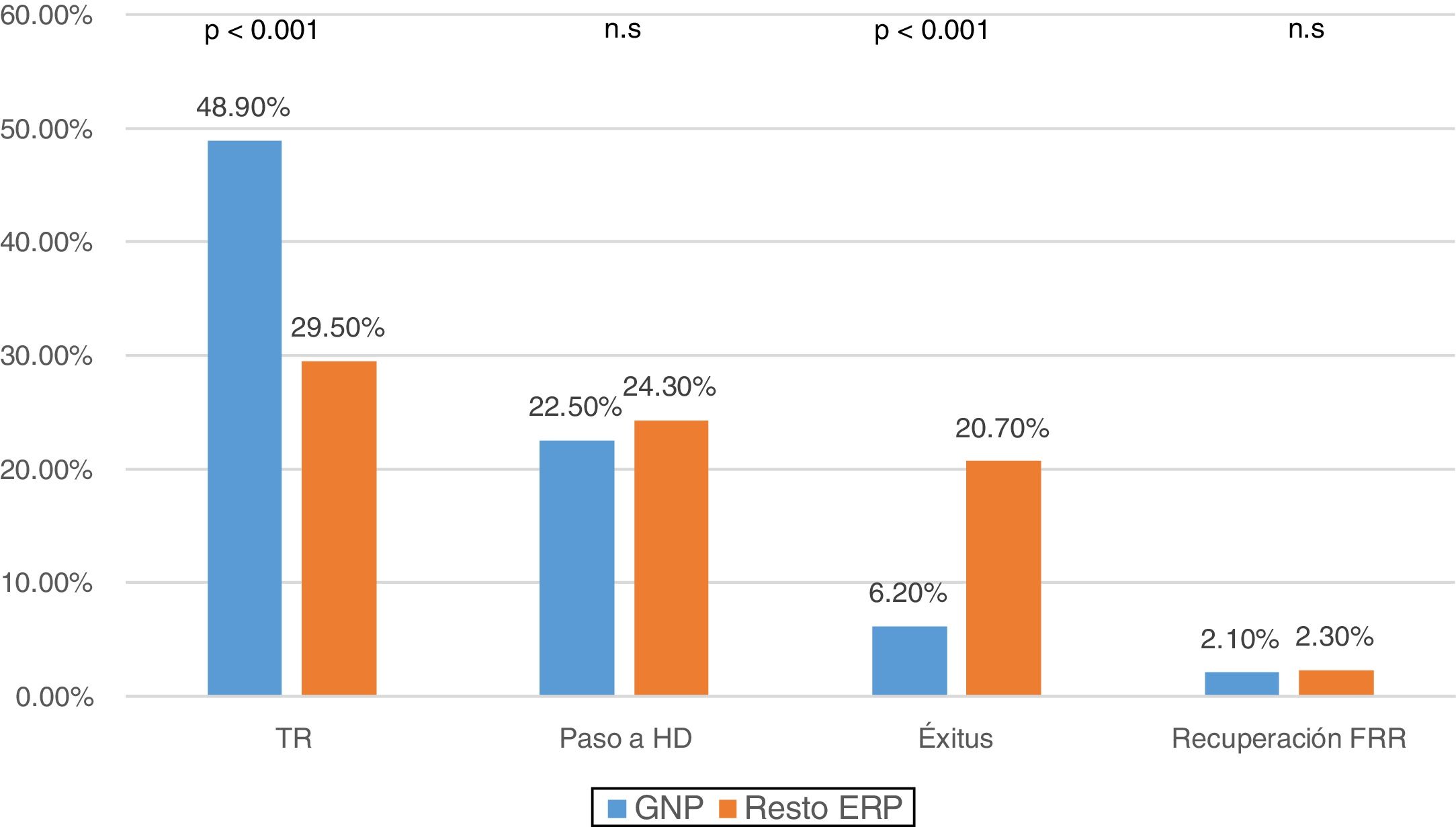
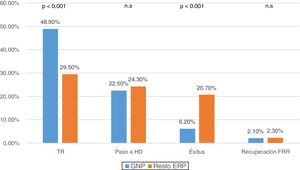
Al comparar las causas de salida según la ERP, observamos que el 48,9% de las GNP (n: 236) se trasplantaron y el 6,2% (n: 30) fallecieron, frente a un 29,5% de TR (n: 519) y una mortalidad del 20,7% (n: 364) en el resto de patologías (p<0,001) (fig. 2).
La principal causa de mortalidad en nuestro estudio fue la CV (37,3%), seguida de las infecciones (26,9%). Sin embargo, en los pacientes con GNP, la primera causa de mortalidad fue la infecciosa (36,7%), seguida de la CV (30%) y en tercer lugar las neoplasias (13,3%), aunque sin significación.
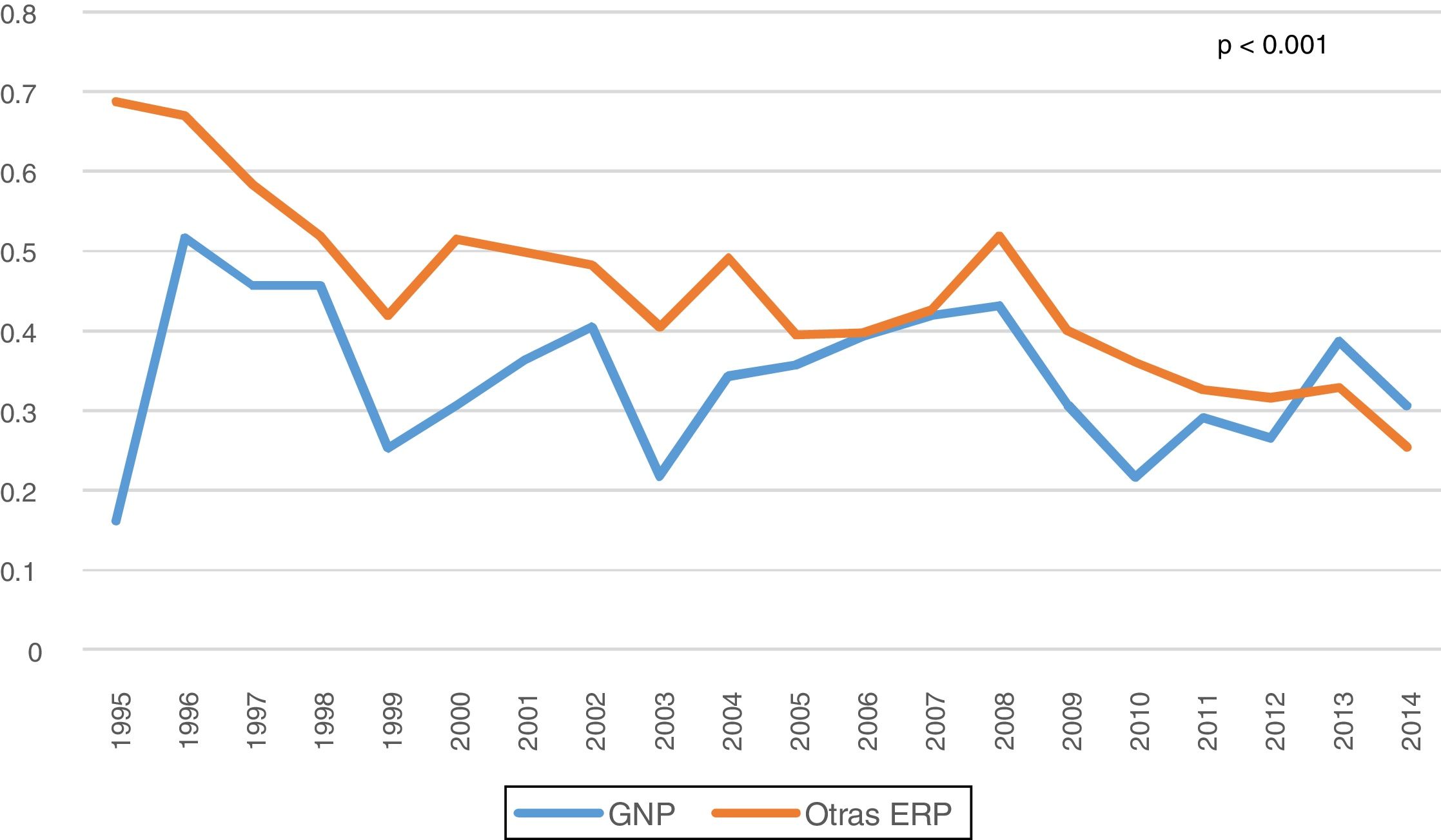
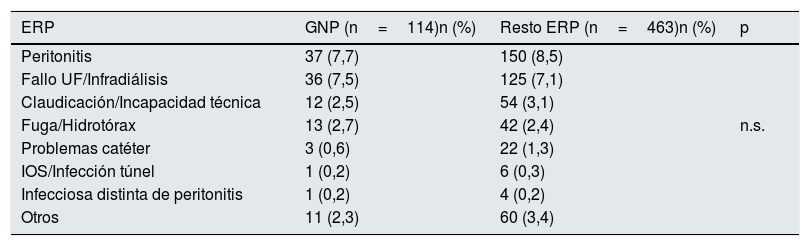
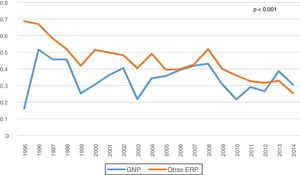
Entre las complicaciones de la técnica, revisamos las peritonitis, observando una disminución en la tasa global a lo largo de los años del estudio, que fue aún menor para las GNP (0,34 vs. 0,45 episodios/paciente-año, p<0,001) (fig. 3). La mayoría de los episodios de peritonitis evolucionaron favorablemente con una curación de casi el 80%. Sin embargo, las peritonitis fueron la causa más frecuente de paso a HD (n: 187; 34,9%), seguidas del fallo de ultrafiltración y/o la infradiálisis (n: 161; 30%). No encontramos diferencias en la transferencia a HD según su ERP (tabla 2).
Causas de salida definitiva con paso a HD o pérdida de seguimiento según la ERP
| ERP | GNP (n=114)n (%) | Resto ERP (n=463)n (%) | p |
|---|---|---|---|
| Peritonitis | 37 (7,7) | 150 (8,5) | |
| Fallo UF/Infradiálisis | 36 (7,5) | 125 (7,1) | |
| Claudicación/Incapacidad técnica | 12 (2,5) | 54 (3,1) | |
| Fuga/Hidrotórax | 13 (2,7) | 42 (2,4) | n.s. |
| Problemas catéter | 3 (0,6) | 22 (1,3) | |
| IOS/Infección túnel | 1 (0,2) | 6 (0,3) | |
| Infecciosa distinta de peritonitis | 1 (0,2) | 4 (0,2) | |
| Otros | 11 (2,3) | 60 (3,4) |
ERP: enfermedad renal primaria; GNP: glomerulonefritis primarias; HD: hemodiálisis; IOS: infección orificio salida; UF: ultrafiltración.
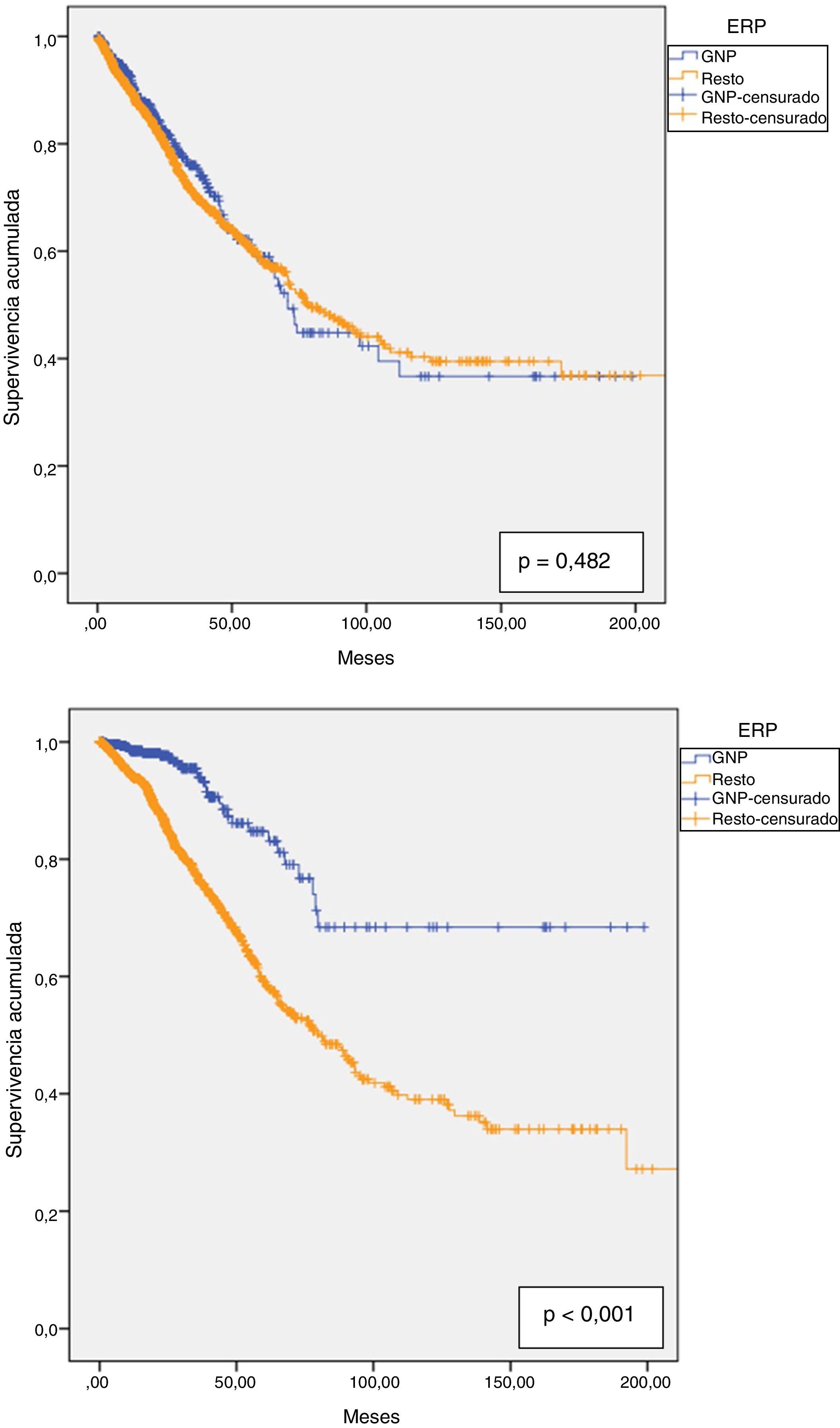
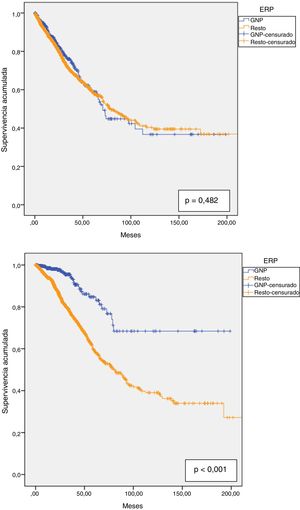
La supervivencia de la técnica fue del 90,6% al año, del 81,2% a los 2 años, del 71,7% a los 3 años, del 64,4% a los 4 años y del 59% a los 5 años, con una mediana de 76,8 meses (IC 95%: 66,4-87,2). No observamos diferencias con las GNP, que presentaron una supervivencia de la técnica de DP similar al resto de enfermos, que fue del 92,6; 82,8; 76; 64 y 59% al año, 2, 3, 4 y 5 años respectivamente, con una mediana de 70,8 meses (IC 95%: 64,0-77,5) en las GNP vs. 78 meses (IC 95%: 66,9-89,2) en el resto (fig. 4.a).
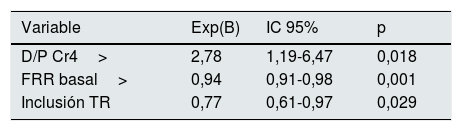
En el análisis multivariante, el principal factor de riesgo para la supervivencia de la técnica fue el último D/P Cr4 más elevado (p=0,018). Protegieron estar incluido en lista de espera de TR (p=0,029) y una mayor FRR basal (p=0,001) (tabla 3).
Transferencia a HD: regresión de Cox
| Variable | Exp(B) | IC 95% | p |
|---|---|---|---|
| D/P Cr4> | 2,78 | 1,19-6,47 | 0,018 |
| FRR basal> | 0,94 | 0,91-0,98 | 0,001 |
| Inclusión TR | 0,77 | 0,61-0,97 | 0,029 |
D/P Cr4: relación dializado/plasma de creatinina en la hora 4; FRR: función renal residual; HD: hemodiálisis; IC: intervalo de confianza; TR: trasplante renal.
La supervivencia de los pacientes al año fue del 94,9%, a los 2 años del 88,1%, a los 3 años del 80,1%, a los 4 años del 72% y a los 5 años del 63,7%. La mediana estimada fue de 90,7 meses (IC 95%: 76,9-104,6). En el caso de las GNP la supervivencia fue del 98,5; 97,7; 94; 87,3 y 83,1% al año, 2, 3, 4 y 5 años respectivamente. Estos tuvieron mayor supervivencia global que el resto de patologías (p<0,001), con una supervivencia media estimada de 153,5 meses (IC 95%: 137,0-169,9) vs. 110,3 meses (IC 95%: 100,8-119,7) para el resto de patologías (fig. 4b.).
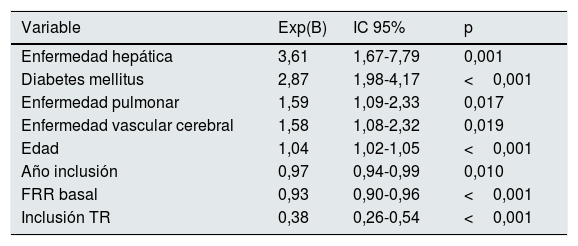
En el análisis multivariante, encontramos que influyeron negativamente en la supervivencia de los pacientes, tener mayor edad (p<0,001), y padecer diabetes mellitus (DM) (p<0,001), enfermedad hepática (p=0,001), enfermedad pulmonar (p=0,017) y enfermedad vascular cerebral (p=0,019). Por el contrario, la mortalidad fue menor en los pacientes incluidos en lista de espera de TR (p<0,001), con mejor FRR al inicio de la técnica (p<0,001), y en los años más recientes del estudio (p=0,010) (tabla 4). De hecho, al comparar la supervivencia entre ambas décadas de estudio, encontramos que esta fue menor para la primera, con una mediana de 81,7 meses (IC 95%: 67,7-95,7) vs. 93,3 meses en la segunda (p<0,001).
Supervivencia global de los pacientes: regresión de Cox
| Variable | Exp(B) | IC 95% | p |
|---|---|---|---|
| Enfermedad hepática | 3,61 | 1,67-7,79 | 0,001 |
| Diabetes mellitus | 2,87 | 1,98-4,17 | <0,001 |
| Enfermedad pulmonar | 1,59 | 1,09-2,33 | 0,017 |
| Enfermedad vascular cerebral | 1,58 | 1,08-2,32 | 0,019 |
| Edad | 1,04 | 1,02-1,05 | <0,001 |
| Año inclusión | 0,97 | 0,94-0,99 | 0,010 |
| FRR basal | 0,93 | 0,90-0,96 | <0,001 |
| Inclusión TR | 0,38 | 0,26-0,54 | <0,001 |
FRR: función renal residual; IC: intervalo de confianza; TR: trasplante renal.
La mayoría de los trabajos referentes a las GNP se centra en la epidemiología, manifestaciones clínicas y tratamiento inmunosupresor. Son escasas las publicaciones que analizan su pronóstico y progresión a ERC5D. Por otro lado, algunos autores agrupan las GN en una única entidad, independientemente de que sean primarias o secundarias a otra enfermedad sistémica, si bien sabemos que difieren tanto en su forma de presentación como evolución12,13,19.
Las GNP representaron la etiología más frecuente de ERP en el Registro Levante (21,5%). Sin embargo, en el informe de la ERA-EDTA del 201420, la nefropatía diabética fue la primera causa de ERC (19%) seguida de las GN y las nefropatías de etiología no filiada con un 17% cada una de ellas. Los datos presentados por el informe de la USRD del 201221 muestran la DM como la primera causa de ERP en diálisis y la hipertensión arterial en segundo lugar, mientras que las GN pasan a representar la tercera causa más frecuente de ERC5D. Nuestros datos contrastan con los referidos por otras grandes series en las que la DM es la ERP más frecuente y la primera causa de incidentes en ERC5D2,20–22. Este hecho podría explicarse por una menor indicación de DP en diabéticos de mayor edad ante una posible peor supervivencia comunicada por otros autores4,5.
La incidencia anual publicada para las GNP establece que la nefropatía IgA es la más frecuente, seguida de la GN membranosa, la enfermedad por cambios mínimos, la GN focal y segmentaria y en último lugar la GN membranoproliferativa15. Las diferencias con el presente estudio, con escasa representación de la GN membranosa y ausencia de enfermedad por cambios mínimos, se deberían al distinto pronóstico de cada una de las GN con diferente probabilidad de evolucionar a ERC5D (variable entre un 16 y 39% según las series y tiempo de seguimiento)16–18.
En nuestra serie, observamos una disminución en la tasa de peritonitis desde el inicio del estudio (0,59 peritonitis/paciente-año) hasta la finalización del mismo (0,26 peritonitis/paciente-año). Presentamos unas tasas inferiores a las recomendadas por la Guía de la ISPD (0,5 peritonitis/paciente-año)23, con una media global de 0,41 peritonitis/paciente-año, que fue incluso inferior para las GNP con 0,34 peritonitis/paciente-año, probablemente en relación con su menor edad y comorbilidad. A nivel internacional existen importantes discrepancias entre diferentes países con tasas que varían entre 0,06-1,66 peritonitis/paciente-año24. Sin embargo, se coincide en una caída progresiva en la tasa de peritonitis, especialmente en las ocasionadas por bacterias grampositivas, gracias a las mejoras introducidas en la DP y la mayor experiencia acumulada.
Los motivos más frecuentes de salida en la técnica de DP se distribuyen clásicamente en 3 tercios, descrito por otros autores, correspondientes al fallecimiento del paciente, al TR y al fracaso de la técnica25–27. En nuestro registro no se cumple esta regla de los 3 tercios, especialmente en los pacientes afectos de GNP, dado que por sus características prácticamente la mitad abandonaron el programa tras recibir un TR, y cuya mortalidad se situó muy por debajo de la media. Debemos destacar que España se sitúa como el país con la mayor tasa de TR de donante fallecido, con una tasa global de donación que está en aumento y que alcanzó el 70,8 por millón de población en 201828.
Con respecto a la transferencia a HD, la literatura muestra amplias variaciones con porcentajes que van del 9 al 32%22,25,26,29–33. Nos situamos en la media, sin diferencias según la ERP, y donde los motivos más frecuentes de fracaso de la técnica (peritonitis, fallo de ultrafiltración e infradiálisis) fueron coincidentes con los de otros registros29–31,34,35.
En nuestro estudio apreciamos una marcada disminución de la mortalidad a lo largo de las 2 décadas, que también se ha observado a nivel nacional25,29. Los pacientes con GNP no solo presentaron un porcentaje menor de fallecidos, sino que difirieron en las causas de muerte, destacando las infecciones como primera causa y las neoplasias como tercera. Zhang et al.19 analizaron las características de 179 pacientes que fallecieron en su programa de DP entre 2006 y 2011. En esta serie, las GN fueron la causa de ERP en un 24,6%, presentaron un riesgo de mortalidad inferior al de otras enfermedades renales (DM, vasculitis, mieloma y amiloidosis), y su principal causa de mortalidad fue la CV (34%) y en segundo lugar las infecciones (20%).
No observamos diferencias en la supervivencia de la técnica entre nuestro grupo y el resto de enfermos, con cifras comparables a otros registros25. Entre los factores protectores cabe destacar tener una mayor FRR basal, con todos los beneficios que ya se le conocen, y que incluyen entre otros, una mejor adecuación y manejo de volumen, así como una mayor supervivencia y calidad de vida36–38.
La supervivencia global de los pacientes de nuestro registro está en la media a la presentada por otros estudios25,26,29–31,33,35,39, aunque recordemos que solo incluimos a pacientes incidentes. La supervivencia aún fue mejor para los pacientes con GNP, como se podría deducir de los resultados del análisis multivariante. Al igual que en otras publicaciones, las variables con un impacto negativo en la supervivencia fueron tener mayor edad, padecer DM y alguna comorbilidad (especialmente la enfermedad hepática, pulmonar y vascular cerebral, variables que coinciden con las identificadas en la serie de Wang et al.40). Por el contrario, la mortalidad fue menor en los pacientes incluidos en lista de espera de TR (más jóvenes, con menor comorbilidad y mejor estado nutricional) y con mejor FRR al inicio de la técnica. No disponemos de variables analíticas como la proteinuria, la albúmina o la hemoglobina, sin embargo la nPCR y el transporte peritoneal no se identificaron como factores pronósticos en nuestra serie.
Una de las limitaciones de nuestro estudio es no contar con determinados datos relacionados con la GN (tratamiento inmunosupresor pautado y duración, tiempo transcurrido desde el diagnóstico hasta la inclusión en programa de DP, hallazgos histológicos…) que podrían influir en su pronóstico. Hemos de mencionar la ausencia de confirmación histológica en un porcentaje importante de pacientes clasificados como GNP, aunque entendemos que estarían bien registradas por tener un porcentaje de representación parecido al de otras series, y presentar un comportamiento similar, así como edad y comorbilidad asociada, al de los pacientes con biopsia. Otra de las limitaciones de nuestro estudio es la agrupación de los distintos subtipos de GNP en una única entidad al hacer el análisis, si bien son varios los estudios que han demostrado que cada uno de los subtipos de las GNP son nefropatías bien diferenciadas en cuanto a su forma de presentación y pronóstico12,13,19.
Como fortalezas, contamos con el número de pacientes incluidos, procedentes de un registro multicéntrico, así como el largo periodo de seguimiento, que nos ofrece una visión de la evolución de la DP como técnica dialítica en nuestro medio. Destacamos, además, el análisis de las GNP como grupo independiente y entidad bien diferenciada de las GN secundarias a una enfermedad sistémica, que sabemos presentan unas características específicas con un pronóstico diferente.
A la vista de los resultados de nuestra serie, concluimos que los pacientes con GNP son la ERP más frecuente en DP en nuestro medio, tienen menor edad y comorbilidad, mayor tasa de inclusión en lista de espera de TR, mejor supervivencia media del paciente y similar supervivencia de la técnica con respecto a otras patologías. Enfatizamos en la importancia de preservar la FRR, que se relacionó favorablemente tanto con la supervivencia del paciente como de la técnica. Consideramos que los pacientes con GNP constituyen un grupo excelente que se podría beneficiar de la DP y sus ventajas, al igual que otras ERP, mientras esperan un TR.
Conflicto de interesesLos autores declaran que no tienen conflictos de interés.