El fracaso renal agudo en el mieloma múltiple (MM) ocurre en un 12-20 % y es un factor de mal pronóstico para la supervivencia del paciente. Estudios recientes muestran que la diálisis con membrana «High-Cut-Off» (HCO) depura eficazmente las cadenas ligeras libres (CLL), aunque con gran pérdida de albúmina. Otras técnicas basadas en la adsorción, como la hemodiafiltración con regeneración del ultrafiltrado mediante adsorción en resina (HFR SUPRA), no han sido estudiadas. Se presentan tres casos de MM, dependientes de hemodiálisis desde el diagnóstico: dos son IgG kappa y uno IgA lambda. Los tres recibieron quimioterapia y HFR SUPRA. El objetivo del estudio fue evaluar la eficacia de la HFR SUPRA en la reducción de CLL, así como su efecto sobre la albúmina. Se obtuvieron muestras sanguíneas pre y posdiálisis y muestras de ultrafiltrado (UF) pre y posresina a los 5 minutos de empezar la sesión y 5 minutos antes de finalizar. La tasa de reducción media por sesión de CLL en sangre en los tres pacientes fue del 53 % y del 63 % (kappa) y del 38 % (lambda). En el UF la tasa de reducción media de CLL fue cercana al 99 %, tanto al inicio como al final de la diálisis, sin eliminación de albúmina. Con los resultados obtenidos podemos concluir que con esta técnica se consigue una reducción eficaz de las CLL, que se mantiene durante toda la sesión, sin que se produzca saturación de la resina y sin pérdida de albúmina. Por tanto, la HFR SUPRA es eficaz como tratamiento coadyuvante del MM.
Acute kidney failure in multiple myeloma (MM) occurs in 12%-20% of patients and is a poor prognostic factor for patient survival. Recent studies have shown that dialysis with a High-Cut-Off membrane (HCO) removes free light chains (FLC) effectively although with significant albumin loss. Other adsorption-based techniques, such as haemodiafiltration with ultrafiltrate regeneration by adsorption in resin (SUPRA-HFR), have not been studied. We present three cases of MM, all haemodialysis-dependent since diagnosis. Two cases were IgG kappa and one was IgA lambda. All patients were treated with chemotherapy and SUPRA-HFR. The aim of this study was to evaluate the effectiveness of SUPRA-HFR in the reduction of FLC and its effect on albumin. We collected blood samples pre- and post-dialysis, and ultrafiltrate (UF) samples pre- and post-resin 5 minutes into the session and 5 minutes from the end. The mean reduction rate of FLC in blood per session in the three patients was 53% and 63% (kappa) and 38% (lambda). In the UF, the mean FLC reduction rate was close to 99%, both at the start and at the end of dialysis, without the removal of albumin. With the results obtained we can conclude that this technique achieves an effective reduction of FLC, which is maintained throughout the session, without resin saturation and without albumin loss. Therefore, SUPRA-HFR is effective as an adjunctive therapy for MM.
INTRODUCCIÓN
El mieloma múltiple (MM) es una proliferación clonal de células plasmáticas que se caracteriza por la producción excesiva de un determinado tipo de inmunoglobulina o de una de sus fracciones. El fracaso renal agudo (FRA) se produce en un 12-20 % de los casos y es un factor de mal pronóstico para la supervivencia del paciente1,2, probablemente porque indica que la enfermedad es más agresiva y presenta más complicaciones3-5. Aproximadamente, un 10 % de los pacientes con FRA por MM requieren hemodiálisis (HD)3,6 y la supervivencia media al año en este caso oscila entre el 30 % y el 84 %7. Además la supervivencia media en pacientes en HD crónica con mieloma es de 11 meses8.
La causa más frecuente de FRA es la producción excesiva de cadenas ligeras libres (CLL) que ocasiona una nefropatía por cilindros, conocida como «riñón del mieloma». Estos cilindros están compuestos por fragmentos celulares, CLL y proteína de Tamm-Horsfall. La mayoría de los cilindros producen, a nivel microscópico, obstrucción de la luz del túbulo distal y, con frecuencia, inducen una reacción inflamatoria local con aparición de células gigantes multinucleadas características del riñón del mieloma9.
El objetivo del tratamiento del MM es reducir o eliminar la producción de CLL con quimioterápicos (dexametasona, bortezomib, melfalán, ciclofosfamida, talidomida, lenalidomida) y/o autotrasplante de células hematopoyéticas9,10. Como coadyuvante para reducir el daño renal asociado a CLL, en los últimos años se están utilizando técnicas de depuración extracorpórea que reducen su concentración en plasma. La eficacia de la plasmaféresis en este tipo de pacientes es incierta11. Clark publicó en 2005 un ensayo controlado y aleatorizado con 104 pacientes con MM y FRA, en el que no se demuestra que existan beneficios clínicos tras el tratamiento con plasmaféresis12. En los últimos años se han publicado estudios sobre la eficacia de membranas de muy alta permeabilidad, «High-Cut-Off» (HCO), en la eliminación de CLL. Las membranas HCO tienen gran poro, con un cut-off de 45-60 kD, por lo que permiten la filtración de CLL kappa y lambda, que poseen un peso molecular de 22,5 kD y 45 kD, respectivamente3,13,14. Con esta membrana se consigue una gran eliminación de CLL, tanto más eficaz cuanto más precoces son el diagnóstico y el tratamiento del MM3,15. Los primeros estudios publicados obtienen buenos resultados utilizando HD diarias largas (8 horas) con HCO. Con este esquema de tratamiento se obtiene una reducción sostenida de cadenas ligeras, con una tasa de recuperación de la función renal de hasta el 60 %10,16. Además, existe una relación lineal entre la precocidad en el tratamiento y la tasa de recuperación de la función renal, lo que se asocia con la supervivencia17. El principal inconveniente de las membranas HCO es que producen una pérdida sustancial de albúmina, por lo que precisan posteriormente reposición de esta10,16. Otra cuestión a tener en cuenta es su elevado precio.
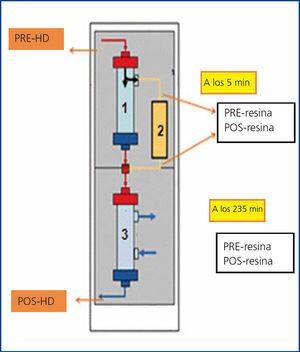
Recientemente, se ha introducido la HFR SUPRA (hemodiafiltración con regeneración del ultrafiltrado mediante adsorción en resina) como técnica de depuración extrarrenal que combina convección, adsorción y difusión. Utiliza un dializador de doble cámara: la primera con una membrana de polifenileno «Super High Flux», que posee un cut-off de 42 kD y en la que se realiza una ultrafiltración, y la segunda con la misma membrana, pero de baja permeabilidad, donde se realiza la difusión. El ultrafiltrado (UF) obtenido en la primera cámara pasa por un cartucho de resina donde se produce la adsorción y es reinfundido antes de la segunda cámara. Esta técnica se utiliza en pacientes en HD por su alta capacidad de adsorción de toxinas unidas a proteínas, con la gran ventaja de que no se elimina albúmina18,19.
Dado que el cut-off de 42 kD permite teóricamente el paso de CLL, sobre todo kappa, la HFR podría ser útil para eliminar CLL, como coadyuvante de la quimioterapia en el MM con FRA asociado. Un estudio ha demostrado recientemente que la HFR elimina eficazmente las CLL, sobre todo kappa, en pacientes en diálisis con gammapatías tanto monoclonales como policlonales20 y nuestro grupo ha obteniendo resultados preliminares muy prometedores en un paciente con FRA por MM que precisó HD21.
El objetivo de este estudio fue evaluar la eficacia de la HFR SUPRA en la reducción de CLL y albúmina en tres pacientes con MM y FRA debido a mieloma.
MÉTODOS
Presentamos tres pacientes con fracaso renal secundario a MM diagnosticados en nuestro centro desde julio de 2012 a enero de 2013. Los dos primeros fueron FRA por MM IgG kappa y el último fue una enfermedad renal crónica (ERC) que se reagudizó debido a un MM IgA lambda.
Pacientes
Caso número 1
Mujer de 63 años, sin antecedentes personales de interés, que ingresa por FRA secundario a MM IgG kappa dependiente de terapia renal sustitutiva (TRS) desde el diagnóstico. Este se realizó por aspirado de médula ósea, en el que se observaba un 90 % de células plasmáticas. Aunque se tomaron muestras de sangre y orina para medir las CLL, estas no se pudieron determinar hasta dos meses después de iniciado el tratamiento. Tampoco se pudo realizar biopsia renal. Inicialmente recibió bortezomib y dexametasona, y al no tener la cifra de CLL se desestimaron las técnicas de depuración especiales iniciándose hemodiafiltración on-line, cuatro veces por semana, en sesiones de 240 minutos. La paciente mantenía diuresis residual de 1000 cc/24 h y valores de creatinina en plasma en torno a 5 mg/dl. Cuando se pudieron medir las CLL, observamos que partía de una cifra de 18 806 mg/l (CLL en orina: 77 mg/l, kappa/lambda: 8593,9) y que no se había obtenido respuesta a la quimioterapia, permaneciendo en torno a los 17 422 mg/l a los dos meses de tratamiento, por lo que se asoció ciclofosfamida. En ese momento se decidió comenzar con HFR SUPRA, tres días por semana, en sesiones de 240 minutos, aunque tras la primera dosis de ciclofosfamida las CLL habían descendido notablemente (de 17 422 mg/l a 761 mg/l a los 14 días). Los resultados preliminares de este caso habían sido publicados previamente, de forma separada21.
Caso número 2
Mujer de 52 años con antecedentes de hipertensión arterial y aplastamientos vertebrales, en tratamiento con antiinflamatorios no esteroideos y con función renal previa normal. Ingresa en Hematología por anemia en rango transfusional y FRA (urea 192 y creatinina 12,5 mg/dl) y es diagnosticada de MM IgG kappa. El aspirado medular tenía un 33 % de células plasmáticas y la cifra de CLL en plasma era 6178 mg/l y en orina era 135 mg/l (kappa/lambda: 440,9). No se pudo realizar biopsia renal por escasa colaboración de la paciente debido a sus aplastamientos vertebrales. Tras el diagnóstico, se inició quimioterapia con talidomida, bortezomib y dexametasona, y TRS con HFR SUPRA, inicialmente diaria, en sesiones de 180 minutos con reducción progresiva del número de sesiones y del tiempo, en función de los niveles plasmáticos de CLL y de la evolución de la función renal. Mantuvo una diuresis residual de unos 800 cc, que se incrementó posteriormente.
Caso número 3
Varón de 79 años de edad con antecedentes personales de hipertensión arterial, hipoacusia bilateral, hiperplasia benigna de próstata, enfermedad pulmonar obstructiva crónica y ERC de etiología desconocida de 1 año de evolución con creatinina basal de 1,7 mg/dl. Ingresó por reagudización de su ERC, con creatinina de 4,3 mg/dl, siendo diagnosticado de MM IgA lambda. El aspirado medular tenía un 14 % de células plasmáticas y la cifra de CLL en plasma era 1325 mg/l (kappa/lambda: 0,01). No se pudo realizar biopsia renal por tener un riñón izquierdo disminuido de tamaño (8,5 cm), con adelgazamiento de la cortical, que era muy ecogénica y muy sugestiva de nefropatía crónica. En este momento se inició quimioterapia con bortezomib y dexametasona y ante el empeoramiento de la función renal se inicia TRS con HFR SUPRA a los 13 días del ingreso, con un esquema de tres días por semana, en sesiones de 240 minutos. El paciente estaba oligúrico.
Técnica de depuración
HFR SUPRA (Bellco©) es una técnica de depuración extrarrenal que combina convección, adsorción y difusión. Para ello utiliza un primer filtro que tiene una membrana de polifenileno «Super High Flux» (SHF), de la familia Purema®, con un poro mayor que otras SHF usadas en hemodiafiltración (cut-off de 42 kD) y una superficie de 0,7 m2. El segundo filtro es polifenileno de baja permeabilidad y 1,7 m2 de superficie. En primer lugar se realiza el proceso convectivo, generándose un UF que pasa al cartucho de resina adsorbente (Suprasorb, 80 ml) a un flujo de hasta 70 ml/min, donde se libera de toxinas. Posteriormente el UF es reinfundido antes del segundo filtro, que es donde se lleva a cabo el proceso difusivo (figura 1).
El flujo de sangre fue de 300 a 350 ml/min, el del líquido de diálisis 500 ml/min y la tasa de ultrafiltración se ajustó según la ganancia de peso interdiálisis del paciente. Se utilizó una concentración de calcio de 3 mEq/l y de potasio de 2 mEq/l en el baño. El número de sesiones y su duración se ajustó de forma individual en cada caso. El circuito extracorpóreo se anticoaguló con un bolus inicial de heparina sódica y una dosis horaria. Inicialmente el acceso vascular fue un catéter temporal que, después de dos semanas de tratamiento, se sustituyó por uno permanente. Dado que la HFR es solo moderadamente más cara que otras técnicas de hemodiafiltración, el tratamiento se prolongó mientras el paciente precisara diálisis, incluso aunque las cadenas ligeras estuvieran por debajo de 500 mg/l.
Determinaciones analíticas
Se obtuvieron muestras de sangre de la línea arterial al principio y al final de la diálisis y muestras de UF antes y después del cartucho de resina, a los 5 minutos de empezar la sesión y 5 minutos antes de finalizar (figura 1). De esta forma, por sesión se extrajeron 6 alícuotas (2 de sangre y 4 de UF) y en cada una se determinaban las CLL y la albúmina. Las extracciones se realizaron semanalmente, el primer día de diálisis.
La albúmina en sangre y UF se midió por el método enzimático colorimétrico del púrpura de bromocresol. Para la cuantificación, de forma independiente, de CLL kappa y lambda, tanto en sangre como en UF, se utilizó un kit Freelite (The Binding Site) para uso en el nefelómetro BN® II de Siemens, test validado para pacientes con insuficiencia renal22. El rango normal con esta técnica es 3,3-19,4 mg/l para kappa y 5,71-26,3 mg/l para lambda.
RESULTADOS
Todos los pacientes recibieron quimioterapia, según protocolo de Hematología, y TRS con HFR SUPRA, con indicación del número de sesiones de forma individualizada. Los casos número 1 y 3 recibieron sesiones de HFR 3 días por semana (con un total de 59 y 30 sesiones, respectivamente), mientras que el caso número 2 recibió inicialmente sesiones diarias, con disminución progresiva del tiempo y del número de sesiones según la función renal y los niveles plasmáticos de CLL (66 sesiones en total).
Eliminación de cadenas ligeras libres y albúmina en sangre
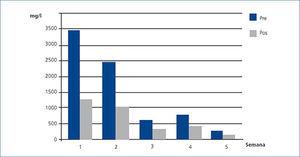
El caso número 1 era un FRA por MM IgG kappa con mala respuesta inicial al tratamiento hematológico. Cuando se decidió iniciar HFR SUPRA, los niveles de CLL kappa eran 105,19 mg/l, aunque a partir de la semana 16 observamos una elevación de estas a 700 mg/l. La tasa de reducción media por sesión a lo largo del tratamiento fue del 63,4 %. La concentración de albúmina en sangre no se modificó (figura 2).
El caso número 2 era un FRA por MM IgG kappa con niveles de CLL previos a la primera sesión de HFR de 3642 mg/l. A partir de la tercera semana de tratamiento se observaron cifras de CLL en plasma que oscilaban alrededor de los 500 mg/l, que se hicieron inferiores a esta cifra y de forma sostenida a partir de la quinta semana. La tasa de reducción media por sesión en esta paciente fue del 53,8 %. La albúmina en sangre se incrementó levemente posdiálisis, probablemente debido a hemoconcentración (figura 3).
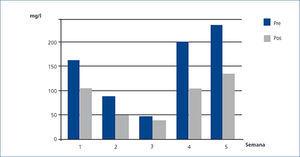
El caso número 3 era una ERC reagudizada por MM IgA lambda con niveles de CLL de 160,4 mg/l antes de iniciar tratamiento con HFR. En este caso, la tasa de reducción media por sesión de CLL lambda fue del 38 % y la albúmina también se elevó discretamente (figura 4).
Observamos que la tasa de reducción de las CLL guarda relación con su nivel en plasma, por lo que a medida que disminuye su concentración se obtiene un menor porcentaje de reducción.
Eliminación de cadenas ligeras libres y albúmina en ultrafiltrado
En el UF, la tasa de reducción media de CLL fue mucho mayor que en sangre. En el caso número 1, la tasa de reducción media de CLL kappa en el UF al inicio fue del 98 % y 5 minutos antes de finalizar la sesión del 79 %. Respecto a la albúmina, su concentración en el UF fue 0,4 g/dl antes de la resina y 0,4 g/dl después de ella, tanto a los 5 minutos de iniciar como 5 minutos antes de finalizar la sesión.
En el caso número 2, la tasa de reducción media de CLL kappa fue del 99 % al inicio y del 58 % al final. La concentración de albúmina en el UF fue 0,5 g/dl pre y 0,5 g/dl posresina al inicio y al final de la sesión.
Y en el caso número 3, la tasa de reducción media de CLL lambda fue del 99 % a los 5 minutos de iniciar la técnica y del 72 % 5 minutos antes de finalizarla. En este caso tampoco se detectó prácticamente albúmina en el UF ni al principio ni al final de la sesión.
Evolución de los pacientes
En el caso número 1, cuando se inició tratamiento con HFR SUPRA los niveles de cadena kappa eran ya de 105 mg/l. A pesar del tratamiento la paciente no recuperó función renal. Se realizó autotrasplante de células hematopoyéticas de sangre periférica y falleció diez días después debido a un shock séptico.
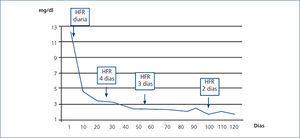
En el caso número 2 el tratamiento con HFR SUPRA se inició precozmente. A las 3 semanas de tratamiento las cifras de CLL eran inferiores a 500 mg/l y la creatinina estaba en torno a 3 mg/dl, por lo que se redujo el número de sesiones de HFR SUPRA a tres días por semana, en sesiones de 240 minutos. A los tres meses las CLL se habían normalizado y la paciente salió de diálisis, permaneciendo estable con una creatinina de 1,9 mg/dl ocho meses después (figura 5).
El caso número 3 no era un FRA secundario a MM, sino una ERC reagudizada debido a un MM y, además, era un IgA lambda. Se inició TRS con HFR SUPRA a los tres días de recibir la primera dosis de bortezomib, pero no presentó mejoría de la función renal, permaneciendo dependiente de HD. Continúa vivo 6 meses después del diagnóstico.
No se produjeron complicaciones asociadas a la técnica en ninguno de los casos. Tampoco hubo alteraciones en los niveles de fósforo, potasio o magnesio.
DISCUSIÓN
Nuestro estudio demuestra que con la técnica de diálisis HFR SUPRA se consigue una eliminación eficaz de las CLL, que se mantiene durante toda la sesión, sin que se produzca saturación de la resina y sin pérdida de albúmina. En combinación con la quimioterapia, HFR SUPRA es eficaz como tratamiento coadyuvante del MM y permite la recuperación de la función renal, como sucedió en el segundo caso de nuestra pequeña serie. En nuestros pacientes obtuvimos una tasa de reducción media en plasma de CLL del 53 % y el 63 %, respectivamente, en los dos casos de MM kappa, y del 38 % en el MM lambda. Este porcentaje de reducción es la media de todas las sesiones realizadas a cada paciente. Observamos que en las primeras sesiones la reducción de las CLL era mucho mayor y, a medida que disminuían sus niveles en plasma, el porcentaje de reducción descendía. Se ha de resaltar que en el caso número 3 (CLL lambda) partíamos de niveles basales muy bajos, por lo que no obtuvimos un gran porcentaje de reducción. Además, las CLL lambda poseen un peso molecular que es algo superior al cut-off de la membrana de polifenileno SHF (42 kD), pese a lo cual se consiguió una reducción media del 38 %.
En los últimos años se están ensayando diferentes técnicas de depuración extracorpórea para reducir la concentración de CLL en plasma y, por tanto, para disminuir el daño renal. Los primeros intentos de extracción de CLL se realizaron con plasmaféresis. Clark publicó en 2005 un estudio controlado y aleatorizado con 104 pacientes con MM y FRA. En él no se demuestra que existan beneficios clínicos (reducción sustancial de mortalidad, dependencia de diálisis o mejoría del filtrado glomerular) tras tratamiento con plasmaféresis asociada a la quimioterapia12. En cambio, en 2008 Leung observa que, de 40 pacientes con nefropatía por cilindros, diagnosticada por biopsia, y tratados con plasmaféresis, en el 75 % de ellos la nefropatía se resolvió cuando las CLL en plasma se redujeron en más del 50 %. Cuando la reducción de la CLL fue menor no se obtuvo respuesta clínica11. En nuestros casos, la HFR SUPRA consiguió una reducción de la cifra de CLL kappa en plasma de más del 50 % en los dos pacientes con mieloma IgG kappa y esto contribuyó sin duda a la recuperación de la función renal en la paciente número 2. El principal inconveniente de la plasmaféresis es el elevadísimo cut-off que tienen los plasmafiltros, por lo que altas tasas de recambio plasmático, como las que se requieren para eliminar CLL, que son fundamentalmente extravasculares, se asocian a pérdida de albúmina y de otras proteínas de mayor peso molecular que son esenciales para el organismo. Esto hace que sea prácticamente imposible prolongar el tratamiento por mucho tiempo. Recientemente, se han publicado varios estudios sobre la eficacia en la eliminación de CLL de membranas de diálisis de muy alta permeabilidad, HCO, diseñadas para ese fin. En 2007 Hutchison et al. publican por primera vez que la membrana HCO elimina una cantidad de ambas CLL significativamente superior a otros seis dializadores estudiados, incluyendo el polimetilmetacrilato (PMMA)10. Estos mismos autores tratan a 13 pacientes con diálisis extendida con HCO, durante 8 horas, en combinación con un régimen de quimioterapia basado en bortezomib, y consiguen una tasa media de reducción plasmática de CLL por sesión que oscila entre el 69 % para las kappa y el 71 % para las lambda16. Cuando la diálisis con HCO se utiliza en pacientes con FRA dependiente de diálisis por MM, en combinación con los regímenes de quimioterapia basados en bortezomib, se consiguen tasas de recuperación de la función renal del 60-74 %16,23-25. En nuestro estudio la paciente número 1 logró una reducción del 63,4 % y la paciente número 2 del 53,8%, cifras solo discretamente inferiores a las comunicadas con HCO para las CLL kappa. El caso número 3 era un MM IgA lambda y en este caso el porcentaje de reducción fue del 38 %, claramente menor que el de las kappa. Esto es debido, por una parte, a que el peso molecular de las CLL lambda es algo superior al cut-off del dializador de polifenileno que se utiliza en HFR SUPRA y, por otra, a que este paciente partía de una cifra de 160,4 mg/l, que no es excesivamente elevada. De los tres pacientes, la número 1 tuvo una mala respuesta al bortezomib, solo respondió parcialmente cuando se asoció ciclofosfamida y el tratamiento con HFR SUPRA se inició dos meses después del inicio del FRA. El tercer paciente tenía una ERC que se reagudizó por el mieloma y, además, la cifra de CLL era baja cuando requirió TRS. Solo la paciente número 2 salió de diálisis y recuperó la función renal prácticamente ad integrum. En esta paciente se dieron varias circunstancias favorables: el tratamiento con HFR se inició rápidamente tras el diagnóstico, la respuesta a la quimioterapia fue buena y la cifra de CLL kappa se situó por debajo de 500 mg/l a partir de la tercera semana de tratamiento. Estudios recientemente publicados demuestran que la diálisis con membranas HCO es tanto más eficaz cuanto más precoces son el diagnóstico y el tratamiento del MM3, lo que se puede hacer extensivo a otras membranas o técnicas de diálisis. Además, existe una relación lineal entre la tasa de reducción de las CLL y la recuperación de la función renal, de tal manera que una reducción del 60 % en el día 21 de tratamiento se asocia con recuperación de la función renal en el 80 % de los pacientes17. En estudios posteriores, con un menor número de pacientes, se han obtenido resultados similares, aunque una mayor tasa de reducción de CLL no se ha asociado directamente con recuperación renal25.
Algunas técnicas de depuración extrarrenal basadas en la adsorción pueden eliminar una gran cantidad de CLL sin el inconveniente de la pérdida de albúmina y con un menor precio que las membranas HCO. Testa et al. demuestran en 2010, en un grupo de pacientes con ERC en diálisis y gammapatía monoclonal, que la HFR es capaz de reducir la cifra de CLL kappa en un 30-35 %. En este estudio, utilizan una membrana de polifenileno superflux de menor superficie y un cartucho con menos cantidad de resina que la SUPRA, lo que explica el menor porcentaje de reducción en las CLL. Con HFR SUPRA las CLL que se obtienen en el UF son adsorbidas casi totalmente en la resina, consiguiéndose una reducción del 99 % en el UF al principio de la sesión y del 58-79 % al final, lo que indica que la resina se satura muy poco.
Recientemente se han estudiado las propiedades adsortivas de la membrana de PMMA y se ha comprobado que produce una reducción del 31 % en las CLL kappa y del 53 % en las CLL lambda, utilizando dializadores en serie, que se cambian cada 2 horas26 o mediante un único circuito con dos filtros en serie27. La reducción de las CLL con dializadores de PMMA se produce fundamentalmente por adsorción de estas a la membrana10. Aunque es una técnica barata, en la que tampoco se pierde albúmina, parece que la eliminación de CLL es inferior a la que se obtiene con HFR SUPRA y con HCO.
Una ventaja de la HFR SUPRA frente a la diálisis extendida con HCO es que con esta última se pierde una cantidad considerable de albúmina, que es preciso reponer al final de la sesión. Dependiendo del número de filtros utilizados, se produce una pérdida de albúmina sérica de 3,9 g/l como promedio10. La reposición de albúmina que se requiere por 8 horas de HD usando un dializador es 12 g y con dos dializadores 45 g14, lo que supone un coste adicional para la técnica. Con la HFR SUPRA encontramos una mínima cantidad de albúmina en el UF, que es devuelta al paciente después de pasar por la resina, por lo que la cifra en sangre no se modifica.
Otra ventaja muy importante de la HFR SUPRA es su bajo coste comparado con la diálisis con HCO. Un estudio reciente comparó el coste-efectividad del tratamiento del riñón del mieloma con HD convencional y con HCO, teniendo en cuenta la recuperación renal, y la utilización de HCO supuso un ahorro anual por paciente de 6000 libras esterlinas (algo más de 7000 euros)28. En este estudio se considera que un filtro HCO tiene un coste aproximado de 600 euros (1200 por sesión si se usan dos filtros) y la albúmina repuesta unos 75, por lo que cada sesión cuesta cerca de 1300 euros, sin tener en cuenta los gastos de personal sanitario. La sesión de HFR SUPRA cuesta unas ocho o nueve veces menos, incluyendo el doble filtro, el cartucho de resina y las líneas, ya que con esta técnica no hay que reponer albúmina. Por este motivo, el tratamiento con HFR se prolongó en los tres casos mientras el paciente precisara diálisis, incluso aunque las cadenas ligeras estuvieran por debajo de 500 mg/l, ya que dicha técnica es solo moderadamente más cara que otras técnicas de hemodiafiltración. Harán falta nuevos estudios que comparen la eficacia de ambas técnicas en cuanto a la recuperación de la función renal y en cuanto a los costes.
A todo ello habría que añadir el efecto de HFR sobre la inflamación, que podría resultar beneficioso en la evolución del MM. Estudios recientes demuestran que la HFR reduce marcadores de inflamación, como factor de necrosis tumoral alfa, interleucina 6 y proteína C reactiva, así como el estrés oxidativo29,30.
El principal inconveniente de la HFR SUPRA es que su eficacia en la eliminación de las cadenas ligeras lambda es inferior a la de HCO, por lo que, a nuestro juicio, se debe usar fundamentalmente en pacientes con MM cuya CLL sea kappa.
La principal limitación de nuestro estudio es el escaso número de pacientes tratados. Para compensar esta deficiencia, al menos en parte, se realizó una determinación de CLL pre y posdiálisis y pre y posresina al principio y al final de la sesión al menos una vez por semana y durante al menos 16 semanas. Esto minimiza las posibles desviaciones en los valores medidos y permite obtener un buen perfil de reducción de CLL a lo largo de las sucesivas sesiones. Otra limitación ha sido la imposibilidad de realizar una biopsia renal en los tres casos. Si bien las técnicas de depuración extrarrenal solo son efectivas en la nefropatía por cadenas ligeras y esta solo se puede diagnosticar por biopsia, no siempre es factible su realización, como ocurrió en nuestros pacientes. Aunque en los primeros estudios publicados la biopsia era un requisito imprescindible para incluir a los pacientes, en un estudio multicéntrico reciente, liderado por Hutchison, solo tenía biopsia renal el 56,7 % de los pacientes y en ellos la nefropatía por cilindros era el diagnóstico predominante (86,7 %)24. Creemos que la biopsia renal debe realizarse siempre que se pueda, no solo para establecer el diagnóstico, sino también el pronóstico, pero, si ello no es posible, el paciente con MM e insuficiencia renal debe ser tratado con técnicas que reduzcan la concentración plasmática de CLL.
En conclusión, la HFR SUPRA es una técnica de diálisis que proporciona una reducción importante y sostenida de la cifra de CLL en plasma en pacientes con MM y FRA, sin pérdida de albúmina y con un coste económico bajo. Asociada a una quimioterapia eficaz y utilizada precozmente, puede conseguir la recuperación del fracaso renal en estos pacientes.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Esquema de hemodiafiltración con regeneración del ultrafiltrado mediante adsorción en resina.
Figura 2. Cadenas ligeras kappa libres en suero pre y poshemodiafiltración con regeneración del ultrafiltrado (HFR) (caso 1).
Figura 3. Cadenas ligeras kappa libres en suero pre y poshemodiafiltración con regeneración del ultrafiltrado (HFR) (caso 2).
Figura 4. Cadenas ligeras lambda libres en suero pre y poshemodiafiltración con regeneración del ultrafiltrado (HFR) (caso 3).
Figura 5. Evolución de la creatinina sérica en relación con las sesiones de hemodiafiltración con regeneración del ultrafiltrado (HFR) (caso 2).