La infección por el virus de la hepatitis C (VHC) es muy prevalente entre los pacientes en hemodiálisis y condiciona un peor pronóstico respecto a los que no la padecen. El tratamiento con interferón y ribavirina es mal tolerado y existen pocos datos sobre la experiencia con los nuevos antivirales de acción directa (AAD). El objetivo de este trabajo es estudiar retrospectivamente la prevalencia actual de la infección por el VHC y los resultados de eficacia y seguridad con distintas pautas de AAD en la población en hemodiálisis de 2áreas hospitalarias.
Estudio multicéntrico, retrospectivo y observacional en el que se analizan los anticuerpos frente al VHC en 465 pacientes, entre los que 54 de ellos eran positivos (11,6%). Entre estos, 29 casos (53,7%) con genotipos 1 y 4 fueron tratados con distintas pautas de AAD, que incluían combinaciones de paritaprevir/ritonavir, ombitasvir, dasabuvir, sofosbuvir, simeprevir, daclatasvir y ledipasvir, con/sin ribavirina. La edad media era de 53,3+7,9 años, el 72,4% eran varones y la causa más importante de la enfermedad renal crónica eran las alteraciones glomerulares. En el 100% de los casos se obtuvo una respuesta viral sostenida a las 24 semanas independientemente de la pauta de AAD recibida. Los efectos secundarios fueron poco relevantes y ningún caso precisó suspender el tratamiento. En 15 de ellos, se asoció ribavirina a los AAD. En estos casos, el efecto adverso más destacable fue la tendencia a la anemización, reflejada en el incremento de la dosis de agentes estimulantes de la eritropoyesis, aunque ninguno precisó transfusiones.
En resumen, concluimos que los nuevos AAD para el tratamiento del VHC en pacientes en hemodiálisis presentan una gran eficacia, con mínimos efectos secundarios, y constituyen un avance muy importante en su manejo, con lo que cabe esperar un pronóstico mucho mejor que el que presentaban hasta muy recientemente.
Hepatitis C virus (HCV) infection is highly prevalent among patients on haemodialysis and leads to a poorer prognosis compared to patients who do not have said infection. Treatment with interferon and ribavirin is poorly tolerated and there are limited data on the experience with new direct-acting antivirals (DAAs). The aim of this study is to retrospectively analyse the current prevalence of HCV infection and efficacy and safety results with different DAA regimens in the haemodialysis population of 2hospital areas.
This is a multicentre, retrospective and observational study in which HCV antibodies were analysed in 465 patients, with positive antibody findings in 54 of them (11.6%). Among these, 29 cases (53.7%) with genotypes 1 and 4 were treated with different DAA regimens, including combinations of paritaprevir/ritonavir, ombitasvir, dasabuvir, sofosbuvir, simeprevir, daclatasvir and ledipasvir, with/without ribavirin. Mean age was 53.3±7.9 years, 72.4% of patients were male and the most important aetiology of chronic kidney disease involved glomerular abnormalities. In 100% of cases, a sustained viral response was achieved after 24 weeks, regardless of DAA regimen received. Adverse effects were not relevant and no case required stopping treatment. In 15 cases, ribavirin was combined with the DAA. In these cases, the most significant adverse effect was anaemic tendency, which was reflected in the increase of the dose of erythropoietin stimulating agents, although none required transfusions.
In summary, we conclude that new DAAs for the treatment of HCV in haemodialysis patients are highly effective with minimal adverse effects; it is a very important advance in HCV management. These patients are therefore expected to have a much better prognosis than they have had until very recently.
La infección crónica por el virus de la hepatitis C (VHC) es un grave problema de salud, que afecta a más de 170 millones de personas en todo el mundo1–3 y puede ser causa de cirrosis y carcinoma hepatocelular. Su prevalencia entre la población en hemodiálisis es aún mayor. Los datos del estudio DOPPS demuestran un rango de prevalencia muy amplio entre los distintos países estudiados que, en algunos países como España, llega a ser del 8,9%4. Además, la superviviencia de los pacientes infectados disminuye con respecto a los que no tienen la infección5–7.
A principios de este siglo, la combinación de interferón pegilado y ribavirina se convirtió en el tratamiento estándar del VHC8–10. Sin embargo, los efectos adversos del tratamiento con interferón en pacientes con enfermedad renal crónica potenciados con el tratamiento con ribavirina, junto con su pobre respuesta10, han supuesto una gran limitación para su uso generalizado. Recientemente, el desarrollo de antivirales de acción directa (AAD) sobre la replicación viral ha cambiado completamente el pronóstico de la infección, al alcanzar una respuesta viral sostenida (RVS) superior al 90% entre la población general11–15. En pacientes en hemodiálisis con infección por el VHC, la experiencia con los AAD es muy reducida y está referida a series cortas de pacientes en casi todos los casos. Sin embargo, los resultados son muy prometedores, con una RVS en la gran mayoría de los casos16–20.
El objetivo de nuestro estudio es analizar la prevalencia actual de infección por VHC en las unidades de hemodiálisis de 2hospitales y sus centros adscritos y valorar la respuesta al tratamiento con distintas pautas de AAD.
Material y métodosEstudio multicéntrico, retrospectivo y observacional, en el que analizamos a todos los pacientes prevalentes en hemodiálisis pertenecientes a 2áreas hospitalarias de Madrid. Seleccionamos seleccionamos a aquellos con anticuerpos frente al VHC y separamos a los que habían sido tratados con los AAD de los que no habían recibido tratamiento específico. La detección de anticuerpos frente al VHC se realizó mediante inmunoanálisis quimioluminiscente de micropartículas, con autoanalizador Architect plus i4000sr (Abbott, Chicago, Illinois, EE. UU.).
En todos los pacientes tratados se había realizado una elastografía impulsional (FibroScan®) previamente, valorando el resultado en kilopascales (KPa), al tiempo que se determinaron el RNA-VHC (PCR) y el genotipo del VHC. La carga viral, RNA-VHC (PCR) se realizó mediante ensayo cuantitativo Cobas Ampliprep/Cobas Taqman HCV (Roche), expresada en UI/ml (rango de cuantificación entre 15 y 7×107 UI/ml). El genotipo de VHC se realizó con el ensayo HCV GT CTLS para sistema Cobas 4800 (Roche).
En todos los casos, se recogieron inicialmente los datos de filiación, antecedentes de comorbilidad, tiempo en tratamiento renal sustitutivo con diálisis o trasplante y determinaciones de laboratorio: hemoglobina, hematocrito, plaquetas, INR, AST, ALT, GGT y bilirrubina. En los pacientes tratados con AAD, se recogieron también datos de laboratorio después del tratamiento, manejo de la anemia durante el seguimiento y los efectos adversos relacionados con el tratamiento. Se recogieron las dosis de epoetina o darbepoetina en UI/semana. Para poder comparar la dosis de epoetina (UI) y darbepoetina (mcg) se usó el factor de conversión 1:200 como viene indicado en la ficha técnica del fármaco para lo que se multiplicó por 200 la dosis de darbepoetina expresada en mcg.
Las pautas de tratamiento se basaron en las recomendaciones de las guías de la Sociedad Americana de Hepatología (American Association for the Study of Liver Diseases [AASLD]) en el momento en el que el paciente fue remitido a la consulta de hepatología. El periodo en que se empezaron a recoger los datos fue febrero de 2015. La pauta de tratamiento para pacientes con genotipo 4 incluía la combinación de paritaprevir (150mg)/ritonavir (100mg) y ombitasvir (25mg) en dosis única diaria (COMBO 2D), junto con ribavirina (200mg/día); para pacientes con genotipo 1b, se asoció COMBO 2D a dasabuvir (250mg) 2veces al día (COMBO 3D); los pacientes con genotipo 1a fueron tratados con la pauta COMBO 3D asociada a ribavirina; un paciente fue tratado con la pauta sofosbuvir (400mg) y ledipasvir (90mg) (Harvoni ®); otro, con la combinación de sofosbuvir (400mg) y simeprevir (150mg) y otro, con la combinación de simeprevir y daclatasvir (60mg). En total, 15 casos recibieron ribavirina a dosis de 200mg/día. En todas las pautas, el tratamiento se mantuvo durante 12 o 24 semanas, según las recomendaciones del Servicio de Hepatología, basándose en las guías de la AASLD. Se consideró que hubo RVS cuando el RNA-VHC (PCR) era negativo a las 24 semanas de haber finalizado el tratamiento.
Las causas de no tratamiento fueron: esperanza de vida corta, edad superior a 80 años, RNA-VHC (PCR) indetectable, genotipo 3 y estabilidad clínica con ausencia de alteraciones analíticas y alteraciones en el FibroScan®.
Análisis estadístico. Las variables cuantitativas se expresan como media y desviación estándar y la comparación entre ellas se realiza mediante la t de Student. Las variables cualitativas se expresan como porcentaje y su comparación se realiza con el test de chi cuadrado. Se consideraron diferencias significativas cuando p<0,05. Se utilizó el programa SPSS, V.17 (Chicago, Illinois, EE. UU.) para todos los cálculos.
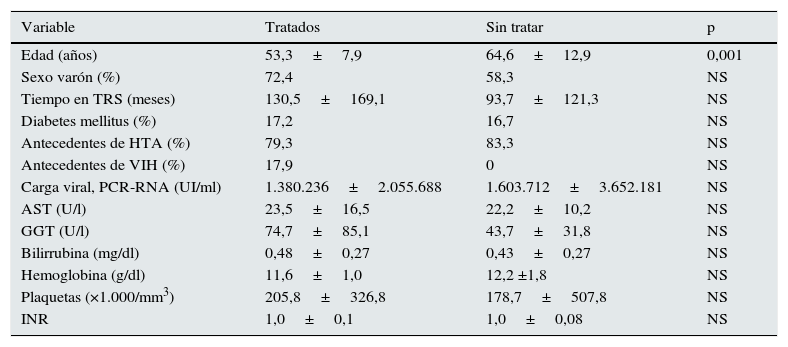
ResultadosAnalizamos los anticuerpos frente al VHC en 465 pacientes en hemodiálisis de 2áreas hospitalarias y se encontró que en 54 de ellos eran positivos (11,6%). Entre estos, 29 (53,7%) fueron tratados con distintas pautas de AAD. La tabla 1 muestra las características de los pacientes tratados y aquellos sin tratamiento. Entre ambos grupos, solo resultó significativa la diferencia de edad. En el grupo de pacientes sin tratamiento, las causas por las que no habían sido tratados incluyen la alta comorbilidad con corta esperanza de vida en 5 casos, la edad superior a 80 años en 4 casos, la estabilidad clínica con ausencia de alteraciones analíticas y alteraciones en el FibroScan® en 5 casos, por genotipo 3 en 2 casos y por carga viral indetectable en 9 pacientes (6 de forma espontánea y 3 por tratamiento previo con interferón y ribavirina).
Características basales de los pacientes con infección VHC tratados y sin tratar con antivirales de acción directa
| Variable | Tratados | Sin tratar | p |
|---|---|---|---|
| Edad (años) | 53,3±7,9 | 64,6±12,9 | 0,001 |
| Sexo varón (%) | 72,4 | 58,3 | NS |
| Tiempo en TRS (meses) | 130,5±169,1 | 93,7±121,3 | NS |
| Diabetes mellitus (%) | 17,2 | 16,7 | NS |
| Antecedentes de HTA (%) | 79,3 | 83,3 | NS |
| Antecedentes de VIH (%) | 17,9 | 0 | NS |
| Carga viral, PCR-RNA (UI/ml) | 1.380.236±2.055.688 | 1.603.712±3.652.181 | NS |
| AST (U/l) | 23,5±16,5 | 22,2±10,2 | NS |
| GGT (U/l) | 74,7±85,1 | 43,7±31,8 | NS |
| Bilirrubina (mg/dl) | 0,48±0,27 | 0,43±0,27 | NS |
| Hemoglobina (g/dl) | 11,6±1,0 | 12,2 ±1,8 | NS |
| Plaquetas (×1.000/mm3) | 205,8±326,8 | 178,7±507,8 | NS |
| INR | 1,0±0,1 | 1,0±0,08 | NS |
AST: aspartato aminotransferasa; GGT: gamma glutamil transpeptidasa; HTA: hipertensión arterial; TRS: tratamiento renal sustitutivo; VIH: infección por el virus de la inmunodeficiencia humana.
Entre los pacientes tratados con los AAD, la etiología más frecuente fue la glomerular en 11 casos (37,9%), seguida por la nefropatía diabética en 4 (13,8%), vascular en 3 (10,3%), nefropatía intersticial en 2 (6,9%), no filiada en 2 (6,9%), un caso de enfermedad poliquística (3,4%) y otras causas en 6 pacientes (20,6%). Los genotipos que presentaban eran 1b en 18 casos (62,0%), 1a en 8 casos (27,5%) y genotipo 4 en 3 pacientes (10,4%).
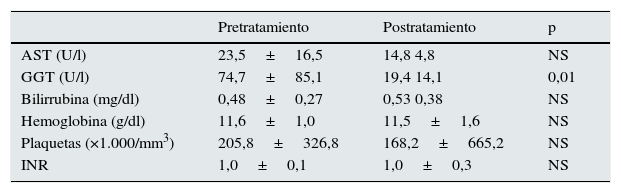
La carga viral de los pacientes antes del tratamiento con AAD era de 1.283.288±2.165.432 UI/ml. Tras el tratamiento, independientemente de la pauta recibida, todos los pacientes mostraron carga viral negativa y una RVS a las 24 semanas. La tabla 2 muestra los cambios analíticos antes y después del tratamiento, donde solo se aprecia una disminución significativa en los niveles de gamma-glutamil-transpeptidasa.
Datos analíticos antes y después del tratamiento
| Pretratamiento | Postratamiento | p | |
|---|---|---|---|
| AST (U/l) | 23,5±16,5 | 14,8 4,8 | NS |
| GGT (U/l) | 74,7±85,1 | 19,4 14,1 | 0,01 |
| Bilirrubina (mg/dl) | 0,48±0,27 | 0,53 0,38 | NS |
| Hemoglobina (g/dl) | 11,6±1,0 | 11,5±1,6 | NS |
| Plaquetas (×1.000/mm3) | 205,8±326,8 | 168,2±665,2 | NS |
| INR | 1,0±0,1 | 1,0±0,3 | NS |
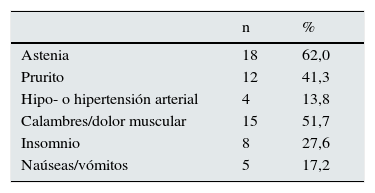
La tabla 3 muestra los efectos adversos relacionados con el tratamiento. La astenia y los calambres/dolor muscular fueron los más frecuentes. No encontramos diferencias entre las distintas pautas. Los niveles de hemoglobina sérica no se modificaron significativamente (tabla 2), pero es necesario tener en cuenta que las dosis de agentes estimulantes de la eritropoyesis (AEE) aumentaron considerablemente, aunque los cambios no alcanzaron significación estadística (4.894±4.689 vs. 7.789±6.721 UI/semana). En ningún caso se necesitó transfundir concentrados de hematíes ni se suspendió el tratamiento por la presencia de efectos adversos.
En los pacientes tratados con ribavirina, los niveles de hemoglobina sérica descendieron una media de 0,3±1,9g/dl, a pesar de haber aumentado las dosis media de AEE (5.300±6.864 UI/semana), mientras que, en los que no habían recibido ribavirina, la dosis de AEE se aumentó en menor cantidad (1.750±3.412 UI/semana), con un ligero aumento en los niveles de hemoglobina (0,16±1,3g/dl).
DiscusiónNuestro estudio demuestra que el tratamiento de pacientes en hemodiálisis con infección VHC con distintas pautas de AAD es seguro y eficaz: se obtuvo una RVS en todos los casos, con escasos efectos adversos. Hasta la actualidad, hay muy pocos datos publicados sobre el tratamiento en pacientes en hemodiálisis y la gran mayoría de ellos corresponden a series con escaso número de pacientes: nuestros datos son coincidentes con las series descritas17–21. Estudios recientes demuestran que la respuesta a los AAD de pacientes en hemodiálisis es mejor que la obtenida en pacientes sin enfermedad renal22. Nuestros resultados confirman la necesidad de tratar a todos los pacientes en hemodiálisis con esta infección, siempre que no existan contraindicaciones. Esta recomendación es especialmente importante en pacientes en lista de espera para trasplante renal, ya que la infección por VHC se acompaña de un mayor riesgo de rechazo, proteinuria, infecciones y desarrollo de diabetes, glomerulopatía asociada al VHC o complicaciones hepáticas después del trasplante23,24.
En nuestra serie, la prevalencia de infección por VHC es del 11,6%, algo superior a la reportada con los datos del estudio DOPPS V para España en 2015, que era del 8,9%4: es posible que esté disminuyendo la transmisión nosocomial como consecuencia de las medidas de aislamiento y el descenso en el número de transfusiones25.
La AASLD y la Infectious Diseases Society of America (IDSA)26, en su versión de 24/02/2016, recomiendan en pacientes con ERCA o en diálisis con infección con genotipos 1a, 1b o 4, el tratamiento diario con elbasvir (50mg) y grazoprevir (100mg) durante 12 semanas, basados en los resultados del estudio C-SURFER, recientemente publicado16. Sin embargo, en España, ninguno de esos fármacos está todavía aprobado. De los fármacos disponibles en España, para nuestra población en HD, en pacientes con genotipo 1b, se recomienda el tratamiento con la combinación de paritaprevir (150mg)/ritonavir (100mg) y ombitasvir (25mg) en dosis única diaria, junto con dasabuvir (250mg) 2veces al día durante 12 semanas; mientras que, en casos de infección por genotipo 1a, más resistentes a los AAD que los 1b, se deben añadir dosis ajustadas de ribavirina (200mg/3 veces en semana o incluso a diario), debiendo interrumpir el tratamiento si los niveles de hemoglobina disminuyen más de 2g/dl a pesar del uso de AEE19. En pacientes con infección por genotipos 2, 3, 5 o 6, se recomienda el tratamiento con interferón pegilado y dosis ajustadas de ribavirina (200mg/día)26.
No existe acuerdo sobre la pauta más adecuada de AAD para tratar la infección por VHC en pacientes en hemodiálisis. Se han descrito numerosas combinaciones, que parece que están en relación con los antivirales aceptados en los diferentes países. Simeprevir, ledipasvir, paritaprevir/ritonavir, ombitasvir, dasabuvir, asunaprevir y daclatasvir disponen de datos que indican seguridad en pacientes en diálisis22. En nuestro caso, la pauta más empleada fue la asociación de paritaprevir/ritonavir, ombitasvir y dasabuvir, aunque otras pautas con diferentes combinaciones de AAD, incluyendo sofosbuvir, simeprevir, ledipasvir y daclatasvir, fueron empleadas en menor proporción. En cualquier caso, la RVS ha sido la norma en todos los casos, independientemente de la combinación de AAD recibida.
Sofosbuvir es el primer AAD pangenotípico, pero no está recomendado en la enfermedad renal crónica avanzada (filtrado glomerular estimado menor de 30ml/min) por el riesgo de deterioro de la función renal17,20,27. En pacientes en hemodiálisis, este efecto adverso carece de importancia, al tratarse en la mayoría de los casos de pacientes anúricos. No obstante, la experiencia con este fármaco en estos casos es muy escasa y su seguridad está pendiente de confirmar. Entre nuestros pacientes, 2de ellos fueron tratados con sofosbuvir asociado a ledipasvir o simeprevir, con resultados equivalentes a las pautas más usadas y con buena tolerancia. Estos resultados corroboran los descritos por otros autores en series cortas de pacientes18,28,29, pero son necesarios estudios con mayor número de casos para poder obtener conclusiones. Otras combinaciones de AAD pendientes de incorporarse al arsenal terapéutico como grazoprevir/elbasvir y daclatasvir/asunaprevir/beclavubir pueden abrir nuevas opciones para este tipo de pacientes16.
Entre los distintos genotipos del VHC, los subtipos 1a y 1b son los más frecuentes entre la población general, así como en nuestra población en diálisis, seguidos por los genotipos 3, 2 y 4. La respuesta al tratamiento con las distintas pautas de AAD empleadas es de RVS en prácticamente el 100% de los casos, tanto en pacientes con cirrosis como sin ella. En cambio, para los genotipos 2, 3, 5 y 6, la recomendación sigue siendo el tratamiento clásico con interferón y ribavirina a dosis ajustadas26. Sin embargo, dada la mala tolerancia al interferón en pacientes en hemodiálisis, que es aún peor cuando se combina con ribavirina10,30,31, los pocos casos de nuestra serie con esos genotipos continúan aún sin tratar, a la espera de aprobación de nuevos AAD.
La ribavirina fue empleada en algunos de nuestros pacientes con dosis ajustada. En general, fue bien tolerada, aunque el descenso de los niveles de hemoglobina estuvo más acentuado que en los pacientes no tratados con este fármaco, como ha sido descrito en otras series32. En principio, parece razonable dejar este agente para asociarlo a los demás AAD, en los casos de mayor severidad, en aquellos con coinfección por virus de la inmunodeficiencia humana (VIH), genotipo 1a y en casos de cirrosis26. Además, dada la tendencia frecuente a la anemia32,33, parece razonable aumentar la dosis de AEE de forma preventiva antes de que se produzca la caída de los niveles de hemoglobina, como forma de evitar posibles transfusiones y la necesidad de suspender el fármaco.
La totalidad de los pacientes tratados presentaron una RVS al cabo de las 24 semanas, con lo que se puede pensar que eso va a ser mantenido en el tiempo, aunque sería recomendable determinar la carga viral cada 3-4 meses al principio y posteriormente de forma anual hasta tener más experiencia con resultados a largo plazo.
El riesgo de transmisión nosocomial del VHC en las unidades de hemodiálisis34 ha dado lugar a que, en muchas de ellas, los pacientes infectados con el VHC se hayan estado dializando en unidades separadas o con aislamiento por turnos o monitores. Con los resultados obtenidos con los AAD es necesario replantear estas medidas. Parece razonable proponer, con base en nuestra experiencia, que se asuma que los pacientes con anticuerpos anti-VHC pero con RVS deberían continuar dializándose en la unidad general junto con pacientes con anticuerpos anti-VHC negativos, dado que los riesgos de dejarlos con otros pacientes no tratados y con otros genotipos pueden ser mayores y complicar su pronóstico. En la medida en la que se vayan tratando la mayoría de los pacientes con infección VHC, es posible que las salas de aislamiento para pacientes con VHC tiendan a desaparecer. En cualquier caso, el desarrollo de una vacuna eficaz frente al VHC debe ser el objetivo definitivo35–37.
Una de las limitaciones más importantes del tratamiento con los AAD es su coste. Datos del Ministerio de Hacienda y Administraciones Públicas muestran que el gasto devengado neto interanual relacionado con este tipo de tratamientos hospitalarios durante 2015 se ha incrementado en un 25,8% en España38. Sin embargo, es preciso evaluar el coste-beneficio a más largo plazo, teniendo en cuenta ingresos, descompensaciones ascíticas, tratamientos complementarios y el efecto potencial sobre el desarrollo de cirrosis y sobre la mortalidad. Además, es de suponer que, durante este tiempo, se ha vivido una etapa de pico con el tratamiento masivo de pacientes, que cabe esperar que sea seguida de un valle, debido a una disminución en el número de pacientes, con lo que los costes, lógicamente, deberán descender.
Nuestro estudio presenta algunas limitaciones, como son el número reducido de pacientes incluidos, el corto seguimiento y la falta de uniformidad en las pautas de tratamiento, pero tiene las fortalezas de ser la primera serie de pacientes en hemodiálisis tratados con los AAD en España y de permitir concluir que el resultado obtenido en el tiempo de seguimiento es excelente.
En resumen, podemos concluir que el empleo de los nuevos AAD en el tratamiento del VHC en pacientes en hemodiálisis ofrece una gran eficacia, con mínimos efectos secundarios, y constituye un avance muy importante en el tratamiento de estos pacientes.
Conflictos de interésLos autores declaran no tener conflictos de interés con el contenido de esta manuscrito.