El hiperparatiroidismo secundario es muy prevalente en pacientes trasplantados renales. Cursa con frecuencia con hipercalcemia y se ha asociado al desarrollo de osteopenia y fracturas óseas. El paricalcitol ha mostrado su eficacia en el control del hiperparatiroidismo secundario en la enfermedad renal crónica con y sin diálisis, con una baja incidencia de hipercalcemia. La experiencia con paricalcitol en trasplantados renales es muy escasa. El objetivo de este trabajo fue mostrar el efecto sobre el metabolismo mineralóseo del paricalcitol en trasplantados renales con hiperparatiroidismo secundario.
Material y métodosEstudio retrospectivo multicéntrico con trasplantados renales de más de 18 años de edad y más de 12 meses de evolución postrasplante, con función renal estable, que hayan sido tratados con paricalcitol durante más de 12 meses, con seguimiento clínico hasta los 24 meses de tratamiento.
ResultadosSe incluyó a 69 pacientes, con 120±92 meses postrasplante, con creatinina inicial de 2,2±0,9mg/dl y FG-MDRD 36±20ml/min/1,73 m2. La dosis de paricalcitol se incrementó progresivamente durante el estudio: basal 3,8±1,9μg/semana, 12 meses 5,2±2,4μg/semana; 24 meses 6,0±2,9μg/semana (p<0,001). Los niveles séricos de PTH descendieron de forma rápida y significativa: basal 288±152 pg/ml; 6 meses 226±184 pg/ml; 12 meses 207±120; 24 meses 193±119 pg/ml (p<0,001). Observamos una reducción sobre PTH basal ≥30% en el 42,4% de los pacientes a los 12 meses y en el 65,2% de los pacientes a los 24 meses. La fosfatasa alcalina descendió también significativamente en los 6 primeros meses para luego estabilizarse: basal 92±50 UI/l; 6 meses 85±36 UI/l, 12 meses 81±39 UI/l (p<0,001). Globalmente no hubo modificaciones en el calcio o fósforo séricos ni en la excreción urinaria de calcio. La reducción de PTH fue más importante en trasplantados con niveles séricos más elevados de partida. Observamos que los pacientes con calcio basal más bajo mostraron un incremento significativo de sus cifras de 0,5-0,6mg/dl en promedio aunque manteniéndose en rango de normalidad, mientras que pacientes con calcio basal>10mg/dl mostraron una reducción progresiva de sus cifras. Quince (21,7%) pacientes seguían tratamiento previo con calcitriol y al cambiarlos a paricalcitol precisaron dosis significativamente mayores que los pacientes que no habían recibido calcitriol. El paricalcitol fue asociado a cinacalcet en 11 pacientes, con reducciones significativas de PTH, con evolución similar al resto de la población y con dosis de paricalcitol también similares.
ConclusionesParicalcitol es eficaz en el tratamiento del hiperparatiroidismo secundario de trasplantados renales. Globalmente no observamos modificaciones significativas de los niveles de calcio ni de fósforo, ni en su excreción urinaria. Los pacientes en tratamiento previo con calcitriol precisaron dosis mayores de paricalcitol. Cuando el paricalcitol se administra a pacientes tratados con cinacalcet, se observa un descenso significativo de la PTH con dosis de paricalcitol similar a pacientes sin cinacalcet.
Secondary hyperparathyroidism is highly prevalent in kidney transplant recipients, and commonly results in hypercalcaemia; an association to osteopenia and bone fractures has also been observed. Paricalcitol has proved effective to control secondary hyperparathyroidism in chronic kidney disease in both dialysed and non-dialysed patients, with a low hypercalcaemia incidence. Currently available experience on paricalcitol use in kidney transplant recipients is scarce. Our main aim was to show the effect of paricalcitol on mineral bone metabolism in kidney transplant recipients with secondary hyperparathyroidism.
Material and methodsA retrospective multicentre study in kidney transplant recipients aged>18 years with a 12-month or longer post-transplantation course, stable renal function, having received paricalcitol for more than 12 months, with available clinical follow-up for a 24-month period.
ResultsA total of 69 patients with a 120 ± 92-month post-transplantation course were included. Baseline creatinine was 2.2±0.9mg/dl y GFR-MDRD was 36±20ml/min/1.73m2. Paricalcitol doses were gradually increased during the study: baseline 3.8±1.9μg/week, 12 months 5.2±2.4μg/week; 24 months 6.0±2.9μg/week (P<.001). Serum PTH levels showed a significant fast decline: baseline 288±152 pg/ml; 6 months 226±184 pg/ml; 12 months 207±120; 24 months 193±119 pg/ml (P<.001). Reduction from baseline PTH was ≥30% in 42.4% of patients at 12 months y in 65.2% of patients at 24 months. Alkaline phosphatase showed a significant decrease in first 6 months followed by a plateau: baseline 92±50 IU/l; 6 months 85±36 IU/l, 12 months 81±39 IU/l (P<.001). Overall, no changes were observed in serum calcium and phosphorus, and in urine calcium excretion. PTH decline was larger in patients with higher baseline levels. Patients with lower baseline calcium levels showed significantly increased levels (mean increase was 0.5-0.6mg/dl) but still within normal range, whereas patients with baseline calcium>10mg/dl showed gradually decreasing levels. Fifteen (21.7%) patients had received prior calcitriol therapy. When shifted to paricalcitol, such patients required paricalcitol doses significantly larger than those not having received calcitriol. Paricalcitol was used concomitantly to cinacalcet in 11 patients with significant PTH reductions being achieved; clinical course was similar to other patients and paricalcitol doses were also similar.
ConclusionsParicalcitol is an effective therapy for secondary hyperparathyroidism in kidney transplant recipients. Overall, no significant changes were observed in calcium and phosphorus levels or urinary excretion. Patients having previously received calcitriol required higher paricalcitol doses. When used in patients receiving cinacalcet, paricalcitol results in a significant PTH fall, with paricalcitol doses being similar to those used in patients not receiving cinacalcet.
El paricalcitol es un activador selectivo del receptor de la vitamina D que ha demostrado ser eficaz en el tratamiento del hiperparatiroidismo secundario en la enfermedad renal crónica avanzada1–3 y en la diálisis4,5. El paricalcitol consigue reducciones en los niveles séricos de la parathormona (PTH) en hemodiálisis de más del 30% en el 68-91% de los casos y de más del 50% en el 45-60% de los pacientes2,4,6, logrando alcanzar las cifras recomendadas en las guías en el 30-50% de ellos, con una eficacia similar o incluso superior a cinacalcet en algunos estudios6. Cuando se compara con el uso de calcitriol en casos con hiperparatiroidismo resistente en hemodiálisis, se observan reducciones de PTH, aunque no fueran respondedores a calcitriol5–7. Debido a su menor efecto sobre las proteínas transportadoras de calcio y fósforo a nivel intestinal, induce menores incrementos en sus niveles séricos que calcitriol8,9, lo que permite un manejo más seguro en casos con hiperparatiroidismo más severo.
La presencia de hiperparatiroidismo residual en trasplantados renales es frecuente, en diferentes series se encuentra un 30-50% de pacientes con niveles anormales10,11. Es especialmente frecuente observar hipercalcemia durante el primer año postrasplante y hasta en el 10-40% de los trasplantados con injerto renal de más de un año de evolución10,12, lo que puede dificultar el tratamiento del hiperparatiroidismo residual con derivados de la vitamina D como el calcitriol. El paricalcitol podría tener una indicación clara para controlar el hiperparatiroidismo residual en trasplantados renales, planteándose una reducción más ambiciosa de las cifras de PTH de lo que con frecuencia se realiza en la práctica clínica diaria.
La experiencia publicada con paricalcitol en trasplante renal es muy escasa. En un ensayo aleatorizado en trasplantados renales a los que se administró paricalcitol desde el tercer día postrasplante se logró reducir la prevalencia de hiperparatiroidismo residual al 29% frente al 63% en el grupo control al final del primer año13. En un estudio retrospectivo sobre trasplantados de larga evolución, el paricalcitol mostró ser capaz de reducir los niveles séricos de PTH con poca incidencia de hipercalcemia14.
El objetivo de este trabajo fue recoger de forma retrospectiva en un estudio multihospitalario el efecto del paricalcitol sobre el metabolismo mineralóseo de trasplantados de larga evolución, analizando los posibles factores que influyen en la evolución de los niveles séricos de calcio y PTH.
Pacientes y métodosRealizamos un estudio retrospectivo multicéntrico con una única cohorte de trasplantados renales que incluía a pacientes trasplantados renales de>18 años de edad, con más de 12 meses de evolución postrasplante y con función renal estable, que en el año 2012 hubieran sido tratados con paricalcitol durante al menos 12 meses. Elegimos población de más de 12 meses postrasplante porque dentro del primer año la mejoría progresiva de la función renal o su deterioro ante la presencia de rechazo o por cualquier otro motivo inducirá cambios en los niveles de PTH que harían difícil interpretar el posible efecto del paricalcitol sobre la PTH. Por otra parte, dentro del primer año también es frecuente la administración transitoria de cinalcacet para controlar la hipercalcemia del postrasplante inmediato, que también alteraría los resultados.
Se pidió a todos los centros que aportaran datos de todos los pacientes que hubieran recibido tratamiento con paricalcitol y que cumplieran los criterios de inclusión. En cada centro los pacientes recibieron tratamiento con paricalcitol para el hiperparatiroidismo secundario según su protocolo habitual de práctica clínica, bien como primera medicación, bien sustituyendo al tratamiento con calcitriol o bien asociado al tratamiento con cinacalcet. Paricalcitol fue prescrito inicialmente a dosis de 2-3μg/semana en la mayoría de los casos para ir subiendo las dosis progresivamente. En aquellos pacientes tratados previamente con calcitriol se cambió a paricalcitol con dosis de conversión, en la mayoría de los casos, inferior a la recomendada de 4:1.
Recopilamos datos analíticos y dosis empleada de paricalcitol en el momento basal y cada 6 meses hasta completar 2 años de seguimiento. Se recogió si recibían tratamiento con calcitriol previamente a la introducción de paricalcitol, junto con la dosis que estaban tomando. Los pacientes en tratamiento con cinacalcet continuaron con dicho fármaco y se anotó la dosis empleada en cada momento. Se determinó la PTH como PTH intacta mediante electroquimioluminiscencia Elecsys de Roche® en todos los centros, por lo que no hizo falta realizar conversión de valores (rango de normalidad 15-65 pg/ml). Hemos querido recoger y mostrar sobre todo cuál fue la evolución global de todos los parámetros, mostrando las tendencias al aumento o descenso de sus valores con las medias, desviaciones estándar o errores típicos (en los gráficos), fuera de valores individuales concretos porque aportan más información general. Por ello no se muestran los datos de casos concretos, por ejemplo, de hipercalcemia, dado que estos fueron manejados de acuerdo con el criterio de cada nefrólogo. Los niveles de calcio sérico son sin corregir para proteínas ni albúmina por no disponer de determinaciones conjuntas en todos los momentos considerados. La función renal fue representada mediante los valores de creatinina sérica y con el filtrado glomerular estimado mediante ecuación MDRD4 (FG-MDRD).
El análisis estadístico fue realizado con el programa estadístico SPSS 11.5. Para todas las variables cuantitativas continuas se comprobó si seguían una distribución normal y, en caso de no seguirla, se transformó la variable mediante su logaritmo natural, como fue el caso de PTH y de fosfatasa alcalina. Las variables cuantitativas se expresan mediante la media y la desviación estándar, salvo en los gráficos en los que se muestra el error típico de la media. Para la comparación de medias no pareadas de variables cuantitativas empleamos el test de Mann-Whitney cuando eran 2 grupos y el test de Friedman si eran más de 2 grupos. Para la comparación de medias pareadas de 2 variables utilizamos el test de Wilcoxon. Para la comparación de medias pareadas de más de 2 momentos se realizó ANOVA de medidas repetidas, con las variables directamente, o tras transformarlas logarítmicamente si no seguían una distribución normal. Para el análisis de subpoblaciones de interés dividimos la población en terciles con el fin de evitar valores concretos que pudieran sesgar los resultados y para conseguir tamaños equivalentes dentro de cada estrato estudiado. Para el análisis multivariante empleamos el análisis de regresión lineal, comprobando si los residuos obtenidos seguían una distribución normal en el modelo construido. Para el análisis de correlación se utilizó siempre el coeficiente de Spearman por si las variables no seguían una distribución normal. Consideramos como significativos valores de p<0,05.
ResultadosLas características epidemiológicas de los pacientes incluidos en el estudio se muestran en la tabla 1. La mayoría de los casos fueron trasplantados renales de larga evolución, con tiempo postrasplante mayor de 2 años en el 84,1% de los pacientes y mayor de 5 años en el 63,8. La distribución de casos según el centro de seguimiento del trasplante fue: Cádiz 3 casos, Granada 24 casos, Huelva 11 casos, Jaén 21 casos, Málaga 4 casos y Sevilla 6 casos. La edad y el tiempo de seguimiento postrasplante fue similar entre sexos.
Características epidemiológicas de la población de estudio
| N | 69 |
| Edad | 55 ± 12 |
| Sexo (V/M) | 34/35 |
| Meses postrasplante | 120 ± 92 (mediana 100) |
| Peso (kg) | 75,2 ± 17,5 |
| IMC (kg/m2) | 28,6 ± 6,2 |
| TAS (mmHg) | 134 ± 18 |
| TAD (mmHg) | 76 ± 11 |
| Diabetes mellitus n (%) | 14 (20,2) |
| Inmunosupresión %: | |
| Ciclosporina A | 29,0 |
| Tacrolimus | 55,1 |
| Sirolimus | 5,8 |
| Everolimus | 5,8 |
| MMF/MFS | 84,1 |
| Azatioprina | 7,2 |
| Prednisona | 91,3 |
Los niveles de PTH iniciales en la población estudiada fueron: 17,2% con<150 pg/ml; 26,6% con 150-249 pg/ml; 31,2% con 250-349 pg/ml; 18,8% con 350-500 pg/ml y 6,2% con>500 pg/ml. La dosis inicial prescrita de paricalcitol fue 3,7±1,9μg/semana; mediana 3 y rango 1-10. En 16 pacientes (23,2%) se prescribieron menos de 3μg/semana; en 30 (43,5%) se prescribió 3μg/semana; en 11 (15,9%) se prescribieron 4-6μg/semana; en 11 (15,9%) se prescribió 7μg/semana y un paciente recibió 10μg/semana. La relación PTH/dosis fue 88±58 pg/ml/μg/semana (mediana 77). Siete pacientes (10,1%) tenían calcio sérico>10,5mg/dl antes de comenzar tratamiento con paricalcitol, de los cuales 3 tenían tratamiento previo con calcitriol y uno con cinacalcet.
La dosis de paricalcitol ascendió de forma progresiva durante la evolución: basal 3,8±1,9; 6 meses 4,4±2,2; 12 meses 4,9±2,4; 18 meses 5,3±2,3 y 24 meses 5,9±2,8μg/semana (Wilcoxon p=0,002 para 6 meses y p<0,001 para los demás).
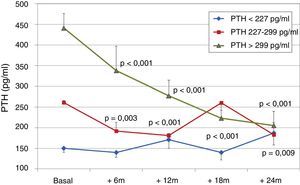
Efecto sobre el metabolismo mineralóseoEn la tabla 2 se resume la evolución de los parámetros del metabolismo mineralóseo. Los niveles de PTH y fosfatasa alcalina descendieron de forma significativa desde el sexto mes. Al dividir la población según los niveles séricos iniciales de PTH (terciles) observamos una reducción más clara entre los pacientes con niveles de partida más elevados de PTH, mientras que los pacientes del primer tercil apenas modificaron sus niveles (fig. 1). La PTH se redujo en>60% de su valor basal en el 11,9% de pacientes a los 12 meses y en el 23,9% a los 24 meses, y observamos una reducción>30% de su valor basal en el 42,4% de los pacientes a los 12 meses y en el 65,2% de los pacientes a los 24 meses.
Evolución tras tratamiento con paricalcitol de la función renal y de los parámetros del metabolismo mineralóseo en sangre y en orina
| Basal | 6 m | 12 m | 18 m | 24 m | |
|---|---|---|---|---|---|
| Cr (mg/dl) | 2,21 ± 0,93 | 2,29 ± 0,92 | 2,38 ± 0,97a | 2,41 ± 0,95b | 2,41 ± 1,05a |
| FG-MDRD | 36 ± 20 | 34 ± 18a | 35 ± 23 | 33 ± 20b | 33 ± 18a |
| PTHi (pg/ml) | 288 ± 152 | 226 ± 184c | 207 ± 120c | 211 ± 140d | 193 ± 119c |
| Reduc. PTH (mediana) (%) | –24,1 | –23,7 | –29,7 | –35,6 | |
| Pacientes con reduc. >30% de PTH basal (%) | 39 | 42,4 | 48,9 | 65,2 | |
| Fosf. alcalina (UI/l) | 92 ± 49 | 85 ± 35b | 82 ± 38d | 84 ± 44e | 87 ± 41f |
| Ca (mg/dl) | 9,7 ± 0,7 | 9,8 ± 0,6 | 9,6 ± 0,7 | 9,6 ± 0,6 | 9,6 ± 0,6 |
| P (mg/dl) | 3,4 ± 0,7 | 3,4 ± 0,9 | 3,4 ± 0,8 | 3,5 ± 0,7 | 3,6 ± 0,8 |
| Calciuria (mg/día) | 122 ± 99 | 125 ± 99 | 105 ± 82 | 120 ± 135 | 109 ± 91 |
| Ca/Cr orina (%mg/mg) | 10,5 ± 8,8 | 11,1 ± 9,1 | 9,4 ± 8,2 | 10,1 ± 12,5 | 9,6 ± 7,3 |
| Exc. Frac. Ca (%) | 1,81 ± 1,22 | 1,96 ± 1,64 | 1,80 ± 1,30 | 1,89 ± 1,21 | 1,95 ± 1,17 |
| Fosfaturia (mg/día) | 744 ± 305 | 704 ± 256 | 706 ± 316 | 667 ± 255g | 629 ± 245h |
| ClP (ml/min) | 16,3 ± 8,5 | 15,9 ± 7,7 | 15,4 ± 7,7 | 13,9 ± 6,7a | 12,8 ± 6,7i |
| RTP (%) | 64 ± 13 | 64 ± 13 | 63 ± 13 | 64 ± 15 | 63 ± 19 |
Globalmente no hubo modificaciones en los niveles séricos de calcio y fósforo. La eliminación urinaria de calcio no se modificó, mientras que observamos un descenso significativo en la fosfaturia y del aclaramiento de fósforo al final del seguimiento (determinaciones disponibles: n=48 en momentos basal y n=39 pacientes en los meses 18 y 24).
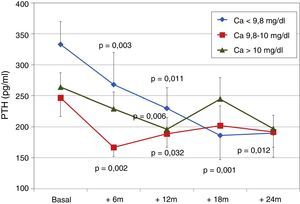
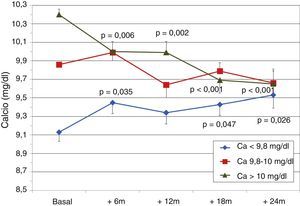
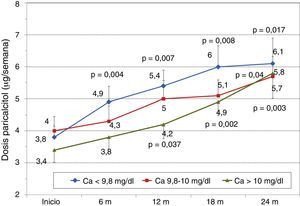
Para analizar la influencia de los niveles de calcio de partida sobre la evolución de la PTH, clasificamos a los pacientes según los terciles de calcio basal. Encontramos que los pacientes del tercil inferior presentaban basalmente niveles de PTH más elevados y en ellos descendió la PTH de forma más intensa que en el resto de los grupos (fig. 2). Los niveles séricos de calcio mostraron un incremento progresivo en pacientes que partían de calcio basal<9,8mg/dl (tercil inferior), aunque manteniéndose dentro del rango de la normalidad. Por el contrario, aquellos que partían de calcio sérico>10mg/dl (tercil superior) experimentaron un descenso progresivo significativo de esos niveles (fig. 3). La dosis de paricalcitol se incrementó progresivamente en los 3 grupos de calcio, ascendiendo de forma más rápida en el grupo con calcio de partida más bajo, para finalmente alcanzar a los 24 meses todos dosis similares (fig. 4). La función renal fue diferente entre los diferentes terciles de calcio, aunque las diferencias no llegaron a ser significativas: Ca<9,8mg/dl, Cr 2,4±0,9mg/dl; Ca 9,8-10mg/dl, Cr 2,1±0,7mg/dl; Ca>10mg/dl, Cr 1,9±1,1mg/dl. En el tercil inferior de calcio había 6/21 pacientes (28,6%) en tratamiento con cinacalcet, en el segundo tercil 2/24 (8,2%) y en el tercero 3/24 pacientes (12,5%) con cinacalcet (p no significativa).
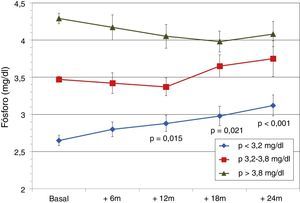
Clasificamos a los pacientes según sus niveles basales de fósforo sérico. Observamos que los trasplantados del tercil inferior de fósforo basal (p<3,2mg/dl) mostraron incremento progresivo de sus cifras con carácter significativo, aun permaneciendo dentro de la normalidad (fig. 5). En los otros grupos los cambios no llegaron a ser significativos. La función renal fue mejor en los grupos con menor fósforo: creatinina 1.er tercil 1,5±0,6mg/dl; 2.° tercil 2,4±1,1mg/dl; 3.er tercil 2,6±0,6mg/dl (p<0,001). Los niveles basales de PTH fueron diferentes entre los terciles de fósforo: 1.er tercil 238±100 pg/ml; 2.° tercil 252±101 pg/ml; 3.er tercil 362±215 pg/ml, (p<0,001). En los 3 grupos, la PTH descendió de forma gradual sin diferencias significativas a los 24 meses (154±78; 186±89; 189±114 pg/ml).
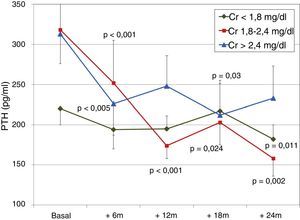
Al considerar el grado de función renal basal (terciles de creatinina), observamos un descenso de PTH más importante en pacientes con función renal más deteriorada (fig. 6). Los niveles de calcio y fósforo no se modificaron significativamente durante la evolución en ningún grupo.
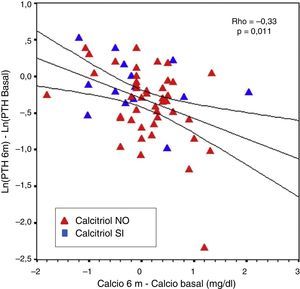
La variación porcentual de la PTH entre el sexto mes y el valor basal se correlacionó con la PTH basal (r=−0,31,; p=0,016) y con la variación de calcio entre el sexto mes y el valor basal (r=−0,33; p=0,011), aun cuando se consideraron por separado los pacientes sin tratamiento previo con calcitriol (fig. 7). La variación porcentual de la PTH a los 12 meses se correlacionó con su valor basal (r=−0,47; p<0,001) y con dosis de paricalcitol de inicio (r=−0,27; p=0,035) pero no con las dosis a los 6 o 12 meses ni con variaciones en calcio sérico en estos momentos. La dosis de paricalcitol a los 12 meses y a los 18 meses se correlacionaron con los valores basales de PTH (r=0,41 con p=0,003 y r=0,31 con p=0,030, respectivamente).
Analizamos con regresión lineal los factores predictores de la respuesta de PTH (porcentaje de cambio con respecto al basal) introduciendo como variables independientes: dosis de paricalcitol en cada momento, tratamiento con cinacalcet, tratamiento previo con calcitriol, edad, sexo, meses postrasplante, peso basal, calcio, fósforo, PTH y creatinina/FG-MDRD basales. A los 6 meses fueron predictores la dosis de paricalcitol inicial y estar en tratamiento previo con calcitriol (r=0,37; p=0,018). A los 12 meses se relacionó con PTH basal y dosis de paricalcitol al inicio (r=0,63; p<0,001). A los 18 meses solo se relacionó con niveles basales de PTH (r=0,57; p<0,001). Buscamos predictores de la dosis de paricalcitol en cada momento mediante regresión lineal y encontramos solamente la dosis basal de paricalcitol y la PTH del momento basal.
Al analizar la variación de calcio a los 6 meses mediante regresión lineal, encontramos como variables predictoras los niveles basales de calcio y de fósforo (r=0,64; p<0,001). A los 12 meses los predictores fueron el calcio basal y la dosis de paricalcitol a los 12 meses (r=0,55; p<0,001). A los 18 meses solamente dependió del nivel de calcio basal.
La variación de fosfatasa alcalina guardó correlación con la variación de la PTH a los 6 meses (r=0,29; p=0,046), a los 12 meses (r=0,41; p=0,003), a los 18 meses (r=0,29; p=0,048) y a los 24 meses (r=0,48; p=0,003), sin encontrar relación con dosis administrada de paricalcitol o con variaciones en calcio o fósforo.
El cambio de los valores de fosfatasa alcalina entre el sexto mes y el momento basal se relacionaron con el análisis de regresión lineal de forma significativa (r=0,77; p<0,001) con el valor basal de fosfatasa alcalina (beta=−0,73; p<0,001), con el tratamiento previo con calcitriol (beta=0,32; p<0,001) y con la creatinina basal (beta=−0,19; p=0,0321). Entre el mes 12.° y el momento basal, los predictores del cambio de la fosfatasa alcalina (r=0,74; p<0,001) fueron el valor basal de fosfatasa alcalina (beta=−0,67; p<0,001), el calcio basal (beta=0,25; p=0,008), el tratamiento previo con calcitiol (beta=0,25; p=0,027) y la creatinina basal (beta=−0,19; p=0,042), sin relacionarse con variación de la PTH.
Ni la evolución de la PTH, fosfatasa alcalina, calcio, fósforo, excreción de calcio y fósforo ni la dosis de paricalcitol empleada fueron diferentes al comparar ciclosporina con tacrolimus, ni comparando tener un anticalcineurínico o un inhibidor de la m-TOR como inmunosupresor. No influyeron tampoco el sexo, la edad, el tiempo postrasplante ni ser diabético.
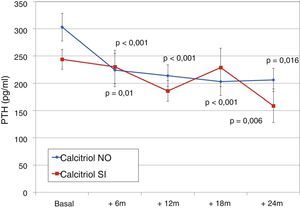
Pacientes en tratamiento previo con calcitriolQuince pacientes (21,7%) se encontraban en tratamiento previo con calcitriol, que fue cambiado por paricalcitol. La dosis de conversión inicial fue 3,5±1,8μg de paricalcitol/μg de calcitriol (mediana 3,4; rango 1-8).
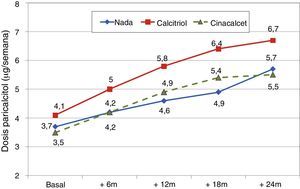
La dosis de paricalcitol se incrementó progresivamente en los pacientes tratados con calcitriol, con valores más elevados que en el resto de los pacientes como se ve en la figura 8 (Friedman p<0,001 pacientes sin calcitriol y p=0,002 con calcitriol). Las diferencias más llamativas fueron entre grupos en el mes 12.° (Mann-Whitney p=0,076) y mes 18° (Mann-Whitney p=0,019).
La evolución de PTH, fosfatasa alcalina, calcio y fósforo fueron similares, con cifras finales similares entre ambos grupos de pacientes (fig. 9). Tampoco mostraron diferencias en la excreción urinaria de calcio y fósforo.
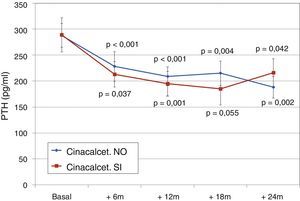
Pacientes en tratamiento con cinacalcetOnce pacientes (15,9%) estaban en tratamiento con cinacalcet cuando se introdujo el paricalcitol. La dosis inicial de paricalcitol empleada entre los pacientes que estaban en tratamiento con cinacalcet fue 3,5±1,9μg/semana, similar a la de pacientes que no lo tomaban (3,8±1,9μg/semana). La dosis de paricalcitol ascendió en ambos grupos de forma similar (fig. 8). La dosis de cinacalcet no varió a lo largo de la evolución: basal 53±36mg/día, 6 meses 60±40mg/día, 12 meses 60±47mg/día, 18 meses 71±41mg/día, 24 meses 71±48mg/día. En 7 pacientes no se cambió la dosis de cinacalcet en ningún momento, en un paciente se retiró en el mes 12, en uno se subió 30mg/día en el 6.° mes y en los otros 2 se subió la dosis 30mg/día a partir del mes 12 para no sufrir cambios posteriores.
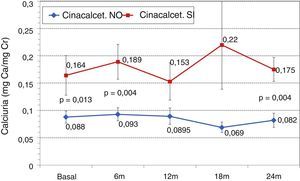
La evolución de los niveles de calcio, fósforo, PTH o fosfatasa alcalina y la evolución de la excreción de calcio y fósforo fueron paralelas entre pacientes que estaban en tratamiento con o sin cinacalcet (fig. 10). Los niveles de partida de calcio, PTH y fosfatasa alcalina fueron similares entre los 2 grupos, al igual que las dosis de paricalcitol empleadas en los diferentes meses. Los pacientes con cinacalcet mostraron inicialmente niveles de fósforo ligeramente más bajos, aunque no de forma significativa, con evolución paralela a los pacientes sin cinacalcet. La excreción urinaria de calcio fue mayor entre pacientes con cinacalcet, sin mostrar variaciones significativas en su evolución (fig. 11).
El hiperparatiroidismo secundario residual presente en trasplantados renales es frecuente. Los factores que se asocian a su mantenimiento10–12,15–17 son el tiempo en diálisis, la severidad del hiperparatiroidismo secundario previo al trasplante, la necesidad de cinacalcet en la etapa de diálisis, el grado de función renal conseguido por el injerto, el genotipo de receptores de la vitamina D y los niveles circulantes postrasplante de metabolitos de la vitamina D. A pesar de que el hiperparatiroidismo secundario se ha relacionado con una mayor incidencia de fracturas óseas postrasplante18 y con pérdida de masa ósea19–21, no hay unas directrices claras acerca del tratamiento del hiperparatiroidismo residual postrasplante. Las recomendaciones son generales y van más encaminadas a la prevención y tratamiento de la osteopenia postrasplante renal que a objetivos concretos en el tratamiento del hiperparatiroidismo secundario. A menudo se mantienen cifras de PTH relativamente elevadas para el grado de función renal conseguido, si se comparan con las recomendadas para pacientes con insuficiencia renal crónica no trasplantados. Mantener unos niveles relativamente elevados de PTH podría ser conveniente para conseguir un buen nivel de remodelado óseo, lo que permitiría hacer frente al efecto frenador de esteroides y anticalcineurínicos22. Sin embargo, la persistencia del hiperparatiroidismo secundario postrasplante incluso con hipercalcemia no asegura que exista un hueso de alto remodelado: se puede observar de forma frecuente hueso de bajo remodelado o incluso hueso adinámico23. Esta postura de no instaurar tratamiento activo salvo cuando existen complicaciones podría explicar por qué se inició paricalcitol en nuestra serie en un 29,1% con 250-349 pg/ml y en un 23,6% con PTH>350 pg/ml. Lo mismo puede verse en la serie presentada por González14 en la que partían de una PTH promedio de 333 pg/ml a la hora de iniciar paricalcitol.
El tratamiento del hiperparatiroidismo residual postrasplante descansa en los derivados de la vitamina D y en el cinacalcet. Este último tiene un uso extendido y reconocido en trasplantados renales con hipercalcemia postrasplante, especialmente durante el primer año postrasplante24,25. Con frecuencia, al intentar retirar el cinacalcet, se observan nuevos incrementos de PTH o de calcio, que obligan a mantener el tratamiento durante tiempo indefinido17,26. La suplementación con derivados de la vitamina D consigue reducir la PTH en algunas series de trasplantados renales27,28, aunque las disminuciones obtenidas son escasas cuando existen cifras de PTH de partida muy elevadas. Incluso se observan incrementos del calcio sérico27,28. Los niveles deseables de 25OH-vitamina D no están bien establecidos. Se recomienda un valor>30 ng/ml, como en pacientes no trasplantados27, aunque valores superiores a 20 ng/ml probablemente sean suficientes. El calcitriol se ha empleado en pacientes trasplantados renales, sobre todo, orientado al tratamiento de la pérdida de masa ósea, con reducciones significativas de PTH19,29,30. Con frecuencia se acompaña de un incremento de la calciuria19 y de una elevación de calcio sérico31. El alfacalcidol también logra reducir la PTH pero con un incremento acompañante de calcio sérico que consigue una reducción de la pérdida de masa ósea en la columna lumbar y el fémur32.
Paricalcitol es un análogo sintético del calcitriol que presenta como ventaja una menor absorción intestinal de calcio y fósforo33,34 que explica la menor incidencia de elevación de su calcio y fósforo séricos35. La experiencia con paricalcitol en trasplante renal es muy escasa. Amer13 ensayó el paricalcitol como tratamiento del hiperparatiroidismo secundario postrasplante, en un estudio aleatorizado en el que administraron a 51 pacientes 1μg/día de paricalcitol desde el tercer día postrasplante, subiendo a partir de las 2 semanas a 2μg/día hasta el final del estudio. Con ello lograron reducir la prevalencia de pacientes con PTH>65 pg/ml al 29 frente al 63% en el grupo placebo. González14 realizó un estudio retrospectivo sobre 58 pacientes a los que prescribieron paricalcitol a razón de 1μg/día en días alternos, observando una reducción promedio de las cifras de PTH del 30-40%, con un porcentaje de pacientes en los que consigue una reducción ≥30% en sus niveles del 55-76%. En nuestro estudio, la población que consiguió una reducción ≥30% a los 12 meses fue del 33,9%. Esta menor respuesta en nuestra serie hay que sumarla a la observación de que encontramos un incremento progresivo de las dosis de paricalcitol empleadas durante el estudio, llegando a doblar la dosis que finalmente emplearon en el estudio de González14. La población de Amer13 no es comparable a la nuestra ya que son pacientes con muy corta estancia en diálisis (11 meses), con la mitad de los pacientes con trasplante anticipado y con un nivel de partida de PTH inferior.
En nuestro trabajo, los cambios inducidos en PTH se correlacionaron inversamente con las variaciones de calcio sérico a los 6 meses, para luego perderse esta correlación. El principal predictor del descenso de PTH fue el propio valor de partida de PTH, sin encontrar influencia del grado de función renal, del nivel inicial de fósforo ni de las dosis de paricalcitol empleadas. Esta relación es lógica dado que los pacientes que parten de PTH más elevadas sufrirán cuantitativamente mayores descensos hasta llegar al objetivo final de PTH buscado, frente a los pacientes con PTH más bajas, en los que un leve descenso hará que entren en el rango de PTH buscado.
En algunos trabajos se ha objetivado una relación entre la dosis de paricalcitol empleada y el grado de reducción de PTH conseguida1. En nuestro estudio la dosis de paricalcitol se relacionó directamente con el nivel de PTH inicial pero no con la PTH final, y se relacionó inversamente con los niveles de calcio. Esto probablemente es debido a que las dosis empleadas de paricalcitol en cada momento fueron adaptadas por el nefrólogo a las cifras iniciales de PTH y a las cifras de calcio sérico, buscando un objetivo de PTH más bien moderado, sin pretender normalizarla en la mayoría de los casos. Esto lo diferencia de otros estudios prospectivos y controlados, en los que el protocolo fue más rígido y homogéneo de dosis crecientes y con un objetivo de PTH más ambicioso al aquí considerado por cada uno de los nefrólogos.
Los pacientes que estuvieron previamente bajo tratamiento con calcitriol mostraron una evolución de la PTH similar a la de pacientes sin calcitriol, pero precisando dosis de paricalcitol superiores. Los pacientes en tratamiento con cinacalcet experimentaron descensos progresivos de PTH, empleando dosis de paricalcitol similares a las de pacientes sin cinacalcet. El tratamiento combinado con paricalcitol-cinacalcet resulta atractivo desde el punto de vista fisiopatológico en estos pacientes. Cinacalcet ha mostrado en pacientes trasplantados que es capaz de restablecer el set-point de calcio36,37 e incrementar los receptores RVD de las células paratiroideas38. En pacientes en hemodiálisis, cinacalcet es capaz de reducir el tamaño glandular con independencia del tamaño de partida, lo que indicaría que podría ser eficaz en casos con hiperplasia nodular39. Las glándulas paratiroideas extirpadas de pacientes trasplantados con hipercalcemia presentan una densidad de receptores sensores del calcio y de RVD reducidos solamente en las glándulas con hiperplasia nodular, mientras que es casi normal cuando tienen hiperplasia difusa40. El índice de apoptosis de las células paratiroideas es muy superior en las glándulas con hiperplasia difusa que en las nodulares, estos índices están incluso por encima de los presentes en pacientes en hemodiálisis40. Esto, junto a la menor proliferación, podría explicar la reducción observada del tamaño glandular postrasplante41,42.
El número de receptores de la vitamina D y del receptor sensor del calcio de las células paratiroideas está reducido en la insuficiencia renal40,43 y también al inicio del trasplante renal43, con posterior normalización si no existe hiperplasia nodular40,16. El paricalcitol, a diferencia de otros análogos de vitamina D, es capaz de estimular la expresión del receptor sensor del calcio y ejercer un efecto antiproliferativo en células paratiroideas44. El paricalcitol podría potenciar el efecto de cinacalcet sobre las células paratiroideas y favorecer una reducción añadida de la PTH. En nuestra corta serie de pacientes no hemos observado variaciones en el calcio en pacientes con cinacalcet. En caso de producirse un incremento de la calcemia, cinacalcet ayudaría a controlar este ascenso, apoyando el empleo de mayores dosis de paricalcitol para frenar la producción glandular de PTH en casos con hiperparatiroidismo grave. La dosis de cinacalcet empleada no varió en la mayoría de los pacientes y en un paciente se retiró. No sabemos si una reducción añadida de los niveles de PTH con paricalcitol podría facilitar la retirada progresiva de cinacalcet en algunos pacientes.
Globalmente no hemos observado un incremento en los niveles de calcio como sí han encontrado en las otras 2 series13,14. En parte puede ser debido a que los nefrólogos hayan sido bastante cautos a la hora de subir las dosis de paricalcitol, ajustándolas en función de los niveles de calcio de cada momento, con un ascenso gradual (fig. 3). La incidencia de hipercalcemia fue del 20% en la serie de Amer, que obligó a suspender el paricalcitol en el 10% de los pacientes. Esto se explica probablemente por las dosis mayores empleadas (2μg/día) y por administrar suplementos de calcio junto con paricalcitol, sumado a la tendencia a la hipercalcemia que se observa en el primer año postrasplante en una importante proporción de pacientes.
Hemos observado que la evolución del calcio sérico depende del calcio basal: pacientes que partieron de niveles más bajos (Ca<9,6mg/dl) experimentaron un pequeño incremento en sus cifras, pero manteniéndose dentro del rango de la normalidad, mientras que pacientes con Ca>9,9mg/dl no modificaron sus cifras o incluso mostraron descensos ligeros. Esto se acompañó de niveles basales de PTH más altos cuando el calcio basal<9,6mg/dl, con una reducción en la PTH más importante con respecto a pacientes con calcio más elevado. Estos pacientes mostraron discreta peor función renal y mayores niveles de PTH basales, habiendo empleado mayores dosis de paricalcitol, lo que podría ser la explicación de la evolución ascendente del calcio sérico. Los casos pertenecientes al tercil superior de calcio mostrarían una reducción de los niveles de calcio como consecuencia de un frenado de la reabsorción tubular renal y de la resorción ósea de calcio al descender PTH.
Los niveles de fosfatasa alcalina descendieron progresivamente, acompañando al descenso de PTH, con relación parcial entre la variación de la PTH y los cambios en los valores de fosfatasa alcalina. En el estudio VITAL también se encontró esta relación, señalando que el descenso en la fosfatasa alcalina sería consecuencia de un descenso de la PTH, pero también de un efecto directo frenador de paricalcitol sobre el osteoblasto1. Los niveles de fosfatasa alcalina fueron superiores en los pacientes en tratamiento previo con calcitriol y descendieron con paricalcitol de forma paralela a la de los pacientes que no recibieron previamente calcitriol. No observamos que tales descensos se relacionasen con ningún factor, al igual que otros autores tampoco lo han hallado1. El tipo de inmunosupresor no mostró influencia sobre el cambio de la fosfatasa alcalina, aunque el tamaño muestral de los pacientes con inhibidores de la m-TOR fue pequeño como para compararlos con los anticalcineurínicos y poder sacar conclusiones definitivas.
En resumen, describimos en este trabajo la evolución de PTH en diferentes subpoblaciones de pacientes trasplantados renales de larga evolución con hiperparatiroidismo secundario que fueron tratados con paricalcitol, con una reducción significativa de sus niveles en todos los rangos de PTH. El descenso inicial de PTH se relaciona en parte con el ascenso de los niveles séricos de calcio, especialmente en pacientes con niveles de partida más bajos, aunque después esta relación se pierde. La respuesta no parece depender de la función renal ni del nivel de calcio sérico de partida. Los pacientes en tratamiento previo con calcitriol precisan de dosis más elevadas de paricalcitol, mientras que los pacientes en tratamiento con cinacalcet exhiben una buena respuesta, con dosis similares a pacientes sin esta medicación. El uso de paricalcitol parece ser prometedor en los pacientes trasplantados renales. Podría establecerse un tratamiento del hiperparatiroidismo secundario residual más ambicioso y ver qué repercusiones tiene esto sobre el grado de mineralización ósea, especialmente en trasplantados de larga evolución. En los pacientes en tratamiento con cinacalcet podría realizarse un tratamiento combinado con paricalcitol encaminado a controlar mejor la PTH y ver incluso si posibilita posteriormente la retirada de cinacalcet. Faltaría por estudiar el posible efecto beneficioso del paricalcitol sobre la mineralización ósea cuando se consiguen reducir convenientemente los niveles de PTH.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.