Introducción: El acetato cálcico/carbonato magnésico (MgCO3) es un quelante de fósforo con ventajas en cuanto a coste, seguridad y tolerancia, con similar eficacia a la de otros fármacos. El objetivo del estudio es evaluar los efectos sobre el metabolismo fosfocálcico al sustituir hidróxido de aluminio [Al(OH3)] por MgCO3 en una cohorte de pacientes en hemodiálisis. Material y métodos: Se incluyen 21 pacientes con fósforo < 5 mg/dl, con Al(OH3) como único quelante. La conversión a MgCO3 se realizó sin variar el número de comprimidos. Se registraron características clínico-demográficas, tratamiento para hiperparatiroidismo secundario y parámetros analíticos antes de la conversión, y mensualmente durante cuatro meses. Resultados: La fosforemia disminuyó de 4,52 ± 0,99 a 4,02 ± 1,07 mg/dl (p = 0,027), con una reducción del producto calcio-fósforo de 40,20 ± 10,44 a 35,16 ± 11,06 mg2/dl2 (p = 0,037). No encontramos variaciones significativas en los niveles de calcio, hormona paratiroidea o 25-OH-vitamina D3. El número prescrito de comprimidos diarios se redujo de 3,33 ± 2,29 a 2,15 ± 2,21 (p = 0,020). Los tratamientos concomitantes no variaron. Observamos un aumento significativo inicial de la magnesemia de 2,21 ± 0,24 a 2,43 ± 0,39 mg/dl (p = 0,001), que posteriormente se mantuvo estable. Encontramos una disminución del aluminio sérico de 14,91 ± 8,55 a 8,47 ± 3,98 µg/l (p = 0,004), con niveles en rango recomendado en todos los pacientes. Conclusiones: El MgCO3 permite un buen control del fósforo sérico en pacientes en hemodiálisis previamente bien controlados con Al(OH)3, con menos comprimidos diarios. Se produce un ligero aumento en el magnesio sérico, sin significado clínico a corto plazo. Desconocemos los efectos de este aumento a más largo plazo.
Introduction: Calcium acetate/magnesium carbonate (MgCO3) is a phosphorus binder with advantages in terms of cost, safety and tolerance and it has a similar efficacy to other drugs. The objective of the study is to assess the effects of replacing aluminium hydroxide [Al(OH3)] with MgCO3 on phosphorus and calcium metabolism in a cohort of haemodialysis patients. Materials and methods: We included 21 patients with phosphorus <5mg/dl, with Al(OH3) as the only binder. The conversion to MgCO3 was carried out without changing the number of pills. We recorded clinical-demographic characteristics, treatment for secondary hyperparathyroidism and laboratory parameters before conversion and every month for four months. Results: Phosphataemia decreased from 4.52±0.99 to 4.02±1.07mg/dl (p=.027), and there was a decrease in the calcium-phosphorus product from 40.20±10.44 to 35.16±11.06mg2/dl2 (p=.037). We did not observe significant changes in levels of calcium, parathyroid hormone or 25-OH-vitamin D3. The daily number of pills prescribed was reduced from 3.33±2.29 to 2.15±2.21 (p=.020). Concomitant treatments were not altered. We observed an initial significant increase in magnesaemia from 2.21±0.24 to 2.43±0.39mg/dl (p=.001), which subsequently remained stable. We found a decrease in serum aluminium from 14.91±8.55 to 8.47±3.98µg/l (p=.004), with levels within the recommended range in all patients. Conclusions: MgCO3 allowed good control of serum phosphorus in haemodialysis patients who were previously well controlled with Al(OH)3, using fewer daily pills. There was a slight increase in serum magnesium, without short-term clinical significance. We do not know the effects of this increase in the longer term.
INTRODUCCIÓN
La enfermedad cardiovascular es la principal causa de mortalidad en pacientes en hemodiálisis1. Las alteraciones del metabolismo mineral, y en concreto la hiperfosforemia, son uno de los factores directamente implicados a través de la calcificación vascular2-5. Por ello, el control de la hiperfosforemia y del hiperparatiroidismo secundario (HPTS) es uno de los pilares básicos del tratamiento de los pacientes en hemodiálisis. La restricción de fósforo en la dieta y una adecuada diálisis son los primeros pasos, pero con frecuencia resultan insuficientes y suelen requerir la prescripción de quelantes del fósforo.
Aunque el quelante ideal aún no se ha encontrado, actualmente se dispone de varios fármacos efectivos en su objetivo principal. No obstante, existen diferencias en sus efectos pleiotrópicos y adversos, así como en su coste, por lo que la elección del quelante debe ser razonada e individualizada para cada paciente6-8.
El hidróxido de aluminio [Al(OH)3] ha sido desde siempre uno de los captores con mayor poder quelante. Su uso se ha visto clásicamente restringido por potenciales efectos tóxicos, aunque sin clara evidencia científica9,10. En nuestra unidad, se ha empleado regularmente sin observar niveles séricos de aluminio superiores a los recomendados ni eventos adversos relacionados. Sin embargo, su fabricación se ha visto recientemente interrumpida en nuestro país por razones comerciales.
Una de las últimas opciones terapéuticas surgidas en el mercado es la combinación de acetato cálcico y carbonato de magnesio (MgCO3). Entre sus ventajas, presenta un aporte más reducido de calcio frente a otros quelantes cálcicos en monoterapia y un coste menor que los nuevos quelantes no-cálcicos para una misma eficacia, así como los potenciales beneficios de un aporte añadido de magnesio11.
El objetivo de este estudio es evaluar la tolerancia y eficacia en el control de la hiperfosforemia al sustituir Al(OH)3 (Pepsamar®) por MgCO3 (Osvaren®) en una cohorte de pacientes en hemodiálisis.
MATERIAL Y MÉTODOS
Pacientes
Entre octubre y diciembre de 2012, se seleccionaron aquellos pacientes de nuestra unidad de hemodiálisis que presentaban un adecuado control de la fosforemia (fosforo sérico < 5 mg/dl) con tratamiento quelante en monoterapia con Al(OH)3 y que precisaran continuar con dicho tratamiento. Se realizaron de forma rutinaria y sin variaciones las indicaciones sobre restricción dietética en alimentos ricos en fósforo, según el protocolo habitual de la unidad. Veintiún pacientes (66,7 % varones, edad 56,7 ± 16,4 años) cumplían los criterios de inclusión. Todos ellos se dializaban tres sesiones semanales de cuatro horas, 6 de ellos en hemodiálisis de alto flujo y 15 con hemodiafiltración online. Tanto las pautas como los baños de diálisis se mantuvieron sin cambios a lo largo del estudio, con una concentración de magnesio constante de 0,5 mmol/l. La concentración de calcio en el baño tampoco varió, siendo de 1,25 mmol/l en ocho pacientes y de 1,5 mmol/l en los 13 restantes. Las características basales de los pacientes se recogen en la tabla 1. La conversión a MgCO3 se realizó sin variar el número de comprimidos ni el momento de la toma, que se indicaba en mitad de las comidas o inmediatamente después. La dosis de mantenimiento se ajustó a criterio clínico en función de los niveles mensuales de fósforo sérico.
Variables
Se registraron las características demográficas y clínicas de los pacientes. Antes de la conversión y durante los cuatro meses posteriores, se recogieron mensualmente datos relativos al tratamiento para el HPTS, así como parámetros analíticos relativos al metabolismo fosfocálcico: calcio total y libre, fósforo, 25-OH-vitamina D3, hormona paratiroidea (PTH) y magnesio séricos. El aluminio sérico se midió de forma basal y a los cuatro meses. Se interrogó periódicamente a los pacientes sobre su adherencia al tratamiento con los captores de fósforo.
Análisis estadístico
Todos los análisis estadísticos se realizaron con el programa SPSS versión 17.0 (SPSS Inc, Chicago, IL). Las variables se reflejan mediante porcentaje, o como media ± desviación estándar. La comparación de las variables cualitativas se realizó mediante el test de McNemar y los datos cuantitativos se analizaron mediante el test de Wilcoxon para variables relacionadas no paramétricas. Se consideran significativas aquellas relaciones con una p < 0,05.
RESULTADOS
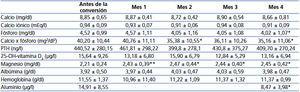
Se observa una disminución estadísticamente significativa de los niveles de fósforo sérico cuatro meses tras la conversión a MgCO3 (4,52 ± 0,99 frente a 4,02 ± 1,07 mg/dl, p = 0,027), así como del producto calcio-fósforo (40,20 ± 10,44 frente a 35,16 ± 11,06 mg2/dl2, p = 0,037). A pesar del aporte añadido de calcio oral, la variación del calcio sérico no es significativa (8,85 ± 0,65 frente a 8,66 ± 0,81 mg/dl). No se observan variaciones significativas en los niveles de PTH o vitamina D. Las variaciones analíticas a lo largo del seguimiento se resumen en la tabla 2.
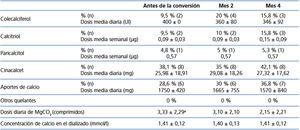
La mejoría del control de la fosforemia se consigue con una disminución del número de comprimidos de MgCO3 (de 3,33 ± 2,29 a 2,15 ± 2,21 comprimidos diarios, p = 0,020). El resto de los fármacos empleados en el tratamiento del HPTS no sufrieron variaciones estadísticamente significativas (tabla 3).
Se suspendió el tratamiento con MgCO3 en seis pacientes (30 %), en cinco por hipofosforemia y en uno por intolerancia digestiva. Se observa un aumento significativo de la magnesemia a partir del primer mes (2,21 ± 0,24 frente a 2,43 ± 0,39 mg/dl, p = 0,001), que se mantiene estable durante los cuatro meses. Se registró un único caso de hipermagnesemia (> 3 mg/dl), que se resolvió adecuadamente con reducción de la dosis.
Asimismo, encontramos una disminución en los niveles de aluminio sérico de 14,91 ± 8,55 a 8,47 ± 3,98 µg/l (p = 0,004), con niveles en el rango recomendado (< 40 µg/l) en todos los pacientes.
DISCUSIÓN
La conversión de Al(OH)3 por MgCO3 permite mantener un adecuado control del fósforo en esta cohorte de pacientes en hemodiálisis. Aunque no se ha conseguido demostrar de forma clara que una disminución del fósforo sérico conlleve una reducción en la mortalidad, el evidente papel fisiopatológico que juega ha llevado a unas indicaciones claras en las guías nacionales e internacionales12.
En el momento actual, disponemos de una amplia diversidad de quelantes, todos ellos eficaces en la reducción de la hiperfosforemia, pero con diferencias en otros aspectos que obligan al clínico a tomar una decisión de prescripción13-15. Hasta hace poco, las sales de aluminio se consideraban el fármaco con mayor poder quelante, con una ratio coste/beneficio muy baja11. Sin embargo, la potencial toxicidad del aluminio había restringido su uso en la literatura a entornos con menores recursos económicos16-18. Incluso ha existido cierta preocupación sobre los aportes de aluminio que suponen otros medicamentos, tanto en aportes ocultos como con otras indicaciones, especialmente antiácidos19. La mejora en los tratamientos del agua para diálisis, con la consiguiente menor concentración de aluminio, y su bajo coste en esta época de ajustes, ha puesto en duda estas limitaciones. Varios estudios recientes en los que no se observó toxicidad a largo plazo han reabierto el debate sobre la posible utilidad de las sales de aluminio9,10,20,21.
En nuestro estudio, constatamos que la supresión de los quelantes basados en sales de aluminio disminuye efectivamente los niveles séricos de este elemento, si bien ningún paciente presentó niveles superiores a 40 µg/l en ningún momento. Por ahora, y hasta que exista más evidencia sobre el uso de sales de aluminio con los actuales controles de agua, las guías siguen desaconsejándolas. Además, recientemente la fabricación y distribución del quelante alumínico disponible en nuestro entorno se ha interrumpido, obligando a buscar otras opciones terapéuticas.
La finalidad de nuestro estudio era evaluar la sustitución de Al(OH)3 por MgCO3. Los primeros estudios en esta línea se realizaron en los años ochenta, en condiciones diferentes a las actuales22. Desde entonces, han sido muchos los estudios que han utilizado las sales de magnesio como captores de fósforo23. De los múltiples fármacos disponibles, el MgCO3 presenta ventajas en cuanto a seguridad y tolerancia, con una eficacia comparable a la de otros captores más modernos24. En nuestro estudio, encontramos una reducción significativa del número de comprimidos, lo que permite mejorar la adherencia y con ello el control de la hiperfosforemia25. También tiene un coste menor que el de otros quelantes no cálcicos, detalle nada desdeñable en las circunstancias actuales8.
Otra de las ventajas del uso de MgCO3 es el derivado del aporte de magnesio, elemento que cada vez está cobrando una mayor importancia26. Hay evidencia creciente de la relación entre niveles disminuidos de magnesio en la población general y la aparición o peor control de patologías como la diabetes, la hipertensión arterial o la enfermedad cardiovascular27-31. En pacientes con enfermedad renal crónica, se han asociado niveles reducidos de magnesio con mayor mortalidad, empeoramiento de la enfermedad mineral ósea y aumento en las calcificaciones vasculares32-35. Un estudio de intervención demostró un retraso en la calcificación arterial con reducción del grosor íntima-media en relación con la suplementación de magnesio36. Por el momento, los estudios sobre los efectos de diferentes concentraciones en el baño de diálisis son escasos37,38. Parece que podrían existir ciertas ventajas al utilizar baños con mayor contenido en magnesio, como mejor tolerancia hemodinámica39. Tampoco quedan claros los niveles adecuados de magnesio sérico, si bien cada vez parece haber mayor consenso en que niveles algo más elevados podrían ser beneficiosos para los pacientes en diálisis. Son necesarios ensayos de intervención que evalúen los efectos a medio y largo plazo de aumentar los niveles de magnesio, ya sea mediante aportes orales o con concentraciones más altas en el baño.
En nuestro estudio, vemos un aumento leve en los niveles de magnesio, que, al igual que en el estudio CALMAG, se produce al inicio del tratamiento y posteriormente se mantiene estable24. Solo se registró un caso de hipermagnesemia asintomática, que revirtió a niveles inferiores a 3 mg/dl tras la reducción de la dosis. Asimismo, solo encontramos un caso de intolerancia digestiva por diarrea que obligó a suspender el tratamiento.
Nuestro estudio presenta varias limitaciones: se trata de un estudio observacional no controlado, con un pequeño tamaño muestral, y sin un estricto control de la adherencia a la dieta baja en fósforo y los captores. Es posible que debido al «efecto estudio» los pacientes mejoraran su nivel de cumplimiento. Sin embargo, las variaciones observadas en los niveles séricos de aluminio y magnesio sugieren un cumplimiento terapéutico, al menos parcial.
CONCLUSIONES
Tras la conversión de Al(OH)3 a MgCO3, se mantiene un adecuado control del fósforo sérico, requiriendo un menor número de comprimidos. Se observa un aumento leve de la magnesemia dentro de los límites normales, cuyo significado clínico a largo plazo aún se desconoce. Son necesarios estudios prospectivos con un mayor período de seguimiento para una correcta valoración de los efectos a largo plazo de niveles elevados de magnesio sérico en los pacientes en diálisis.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 3. Otros tratamientos empleados para las alteraciones del metabolismo fosfocálcico.
Tabla 1. Características basales de los pacientes.
Tabla 2. Evolución de parámetros analíticos tras sustitución de hidróxido de aluminio por acetato cálcico/carbonato magnésico.