Tras el trasplante renal se produce de manera global un incremento del peso pudiendo aumentar el riesgo de enfermedad renal crónica (ERC) y de pérdida del injerto. Pero no todos los pacientes ganan peso, y la repercusión sobre el injerto de esta diferente evolución, no está bien estudiado. El objetivo fue determinar las causas de esta diferente evolución y su efecto sobre el injerto.
Pacientes y métodosEstudio de cohortes retrospectivo unicéntrico de 201 pacientes seguidos tras el trasplante, analizando los determinantes de la variación del peso al año mediante regresión logística, y su efecto sobre la pérdida del injerto al final del seguimiento mediante regresión de Cox.
ResultadosGlobalmente se produjo durante el primer año un aumento de peso de 4,5kg de media, pero un 26,6% perdieron peso. El 37,2% aumentó su índice de masa corporal (IMC), mientras que el 9,5% lo disminuyó. Los determinantes de la diferente evolución del peso fueron la edad (OR por cada 10 años: 0,6; p=0,002), la modalidad de diálisis previa (ref. hemodiálisis) (OR: 0,3; p=0,003) y el IMC previo al trasplante (OR: 0,9; p=0,003). La diferente evolución del peso no influyó en la pérdida del injerto. Sí influyeron el IMC al año como variable continua (HR: 1,3; p=0,003) y la obesidad, con peor evolución (HR: 7,0; p=0,025).
ConclusionesAunque no todos los pacientes ganan peso tras el trasplante renal, la diferente evolución del peso no influye en la supervivencia del injerto.
After kidney transplantation, there is an overall increase in weight, which may increase the risk of chronic kidney disease (CKD) and graft loss. But, not all patients gain weight, and the impact on the graft of this different evolution has not been well studied. The objective was to determine the causes of this different evolution and its effect on the graft.
Patients and methodsRetrospective single-center cohort study of 201 patients followed up after transplantation, analyzing the determinants of the variation in weight at one year using logistic regression, and its effect on graft survival at the end of follow-up using Cox regression.
ResultsGlobally, there was an average weight gain of 4.5kg in the first year, but 26.6% lost weight. 37.2% increased their BMI, while 9.5% decreased it. The determinants of the different evolution of weight were age (OR for every 10 years: 0.6, P=.002), previous dialysis modality (ref. hemodialysis) (OR 0.3, P=.003), and BMI before transplantation (OR 0.9, P=.017). The different evolution of weight did not influence the final situation of the graft. The BMI at one year did influence as a continuous variable (HR 1.3, P=.003), and obesity, with a worse evolution (HR 7.0, P=.025).
ConclusionsAlthough not all patients gain weight after kidney transplantation, the different evolution of weight does not influence graft survival.
- -
Aunque tras el trasplante renal mayoritariamente los pacientes ganan peso, existe un importante porcentaje de pacientes que lo pierden.
- -
La edad, el tipo de diálisis previa y el IMC previo al trasplante, son los determinantes de la ganancia o la pérdida de peso.
- -
La ganancia o la pérdida de peso en sí misma, no se asocia con la pérdida del injerto.
- -
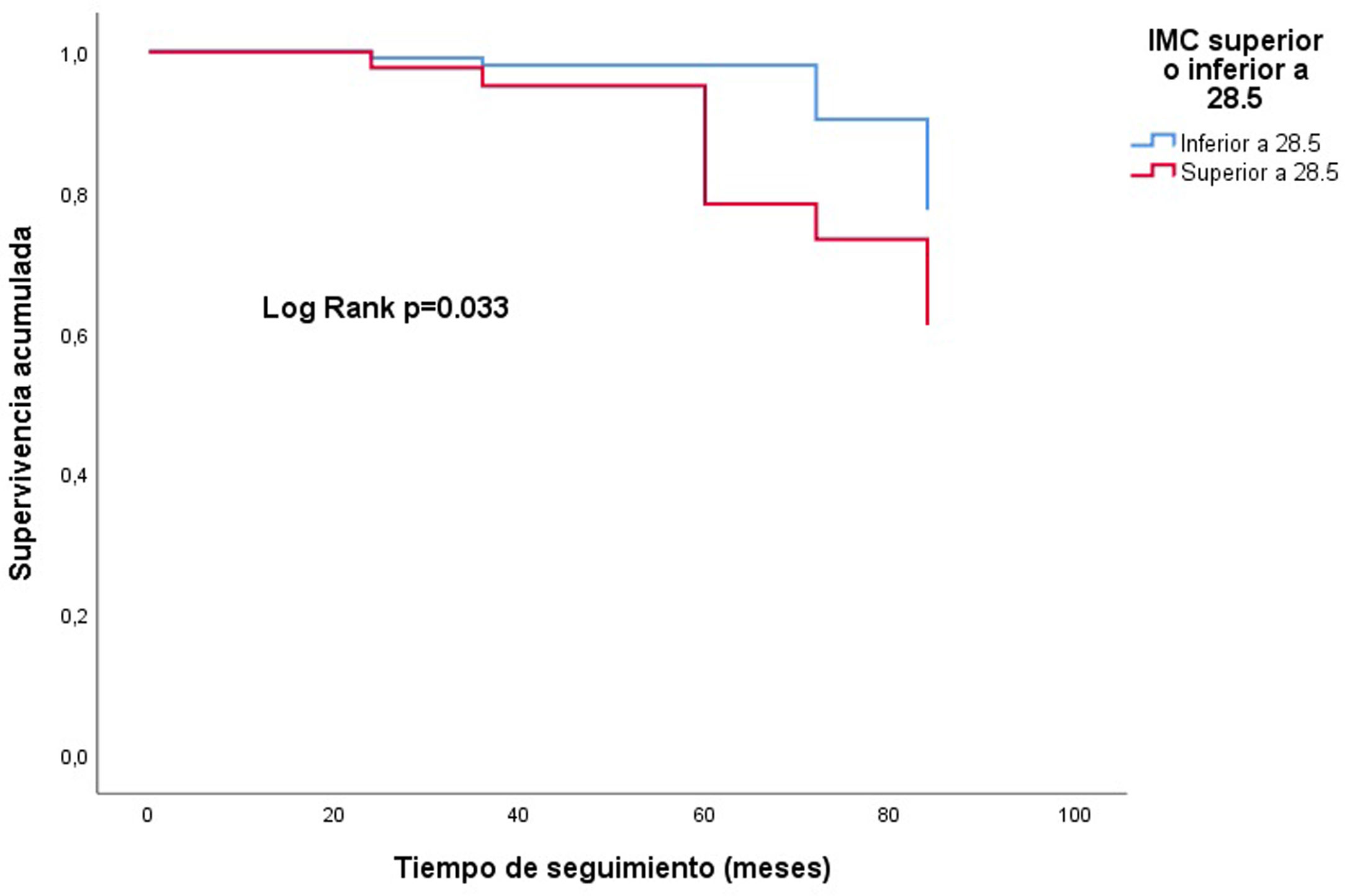
El IMC alcanzado al año del trasplante influye en la supervivencia del injerto, presentando mayor riesgo de pérdida del mismo los pacientes con un IMC a partir de 28,5kg/m2.
Varios estudios han demostrado que la obesidad es un factor de riesgo para el desarrollo de la enfermedad renal crónica (ERC)1–3. Son varios los factores involucrados en su desarrollo y, aunque los pacientes obesos tienen un mayor riesgo de desarrollo de diabetes mellitus (DM)4, causa conocida de ERC, el riesgo de aparición y progresión de ERC va más allá del causado por la propia DM4,5.
Diversos trabajos han demostrado la existencia de un aumento del peso y, por tanto, del índice de masa corporal (IMC), tras el trasplante renal. Este aumento de peso sucede durante el primer año, y fundamentalmente durante los primeros 6 meses tras el trasplante6. Aunque este aumento del IMC llevaría asociado un aumento del riesgo de deterioro de la función del injerto al igual que sucede en población no trasplantada, el efecto de la obesidad sobre la evolución del trasplante no está suficientemente dilucidado7. Por un lado, hay estudios que afirman que la obesidad no influye en la evolución del injerto8, mientras que la mayoría afirman encontrar un efecto negativo sobre la función del trasplante9 demostrando incluso una peor función renal ya en el rango del sobrepeso10,11. Este aumento del peso se produce fundamentalmente a expensas de un aumento del tejido adiposo, especialmente de la grasa visceral, con el consiguiente desarrollo de resistencia a la insulina aumentando el riesgo de diabetes12.
La mayoría de estudios describen un aumento de peso de manera global tras el trasplante renal6; sin embargo, en la práctica clínica diaria observamos pacientes que no solo no aumentan de peso, sino que incluso lo pierden. Los determinantes de esta ganancia o pérdida de peso, o su repercusión en la evolución del injerto no está suficientemente estudiado.
El objetivo de nuestro estudio fue analizar los determinantes de la ganancia o pérdida de peso tras el trasplante renal y su repercusión en la evolución del injerto, así como en la aparición de nuevos pacientes diabéticos al año, y el desarrollo de eventos cardiovasculares (ECV) en nuestra población.
Pacientes y métodoSe ha realizado un estudio de cohortes retrospectivo sobre todos los pacientes trasplantados renales desde enero de 2013 hasta abril de 2018 que tenían al menos 12 meses de seguimiento tras el trasplante en nuestro centro. Durante el periodo de seguimiento no se realizó ningún trasplante de donante vivo, y los pacientes con dobles trasplantes fueron excluidos.
Se han recogido las siguientes variables: edad al momento del trasplante, sexo, modalidad de diálisis previa al trasplante, diagnóstico de la ERC, diagnóstico previo de la DM, desarrollo de la DM al año del trasplante (desarrollo de la DM denovo durante el primer año tras el trasplante), antecedentes de la enfermedad cardiovascular (cardiopatía isquémica, ictus isquémico o arteriopatía periférica), número de incompatibilidades HLA, tipo de inmunosupresión, tipo de donación, trasplante renal previo, desarrollo de retraso en la función del injerto (considerada como la necesidad de al menos una sesión de diálisis en el postrasplante inmediato), desarrollo de rechazo agudo durante el primer año, edad del donante, desarrollo de eventos cardiovasculares mayores durante el periodo de seguimiento (infarto agudo de miocardio, ictus isquémico o arteriopatía periférica sintomática), y dosis de esteroides acumulada durante el primer año. Para su cálculo, se sumó la dosis diaria de prednisona oral administrada durante el primer año, así como las dosis de metilprednisolona administradas en el periodo peri-trasplante (500mg previo al trasplante y 125mg a las 24h del mismo), las dosis administradas en caso de rechazo agudo (500mg en bolus único diario durante 3 días consecutivos), y las dosis administradas previo a la administración de timoglobulina cuando fue considerada. Para unificar la dosificación de esteroides, se han transformado las dosis de metilprednisolona por su equivalencia en prednisona, a razón de metilprednisolona:prednisona 1:1,25.
Se calculó el tiempo (meses) en diálisis previo al trasplante, así como el tiempo de seguimiento (meses) de los pacientes tras el trasplante. Se recogió la situación del injerto al final del seguimiento como injerto funcionante vs. vuelta a diálisis por pérdida del injerto, censurando los exitus con injerto funcionante.
Se recogió la altura, el peso al momento del trasplante, a los 3, 6, 9 y 12 meses, así como al final del seguimiento. Se calculó con ello el IMC con la fórmula IMC=peso(kg)/talla(m2), así como el área de superficie corporal mediante la fórmula de Dubois & Dubois (m2). Los estadios de IMC se establecieron según las referencias de la OMS utilizando el estadio que comprende el intervalo entre 18,5 y 25kg/m2 como el de referencia; se consideró obesidad a un IMC igual o superior a 30kg/m2. La ganancia o pérdida de peso al año y al final del seguimiento respecto al del momento del trasplante se calculó mediante la diferencia entre el peso al año o al final del seguimiento y el peso al momento del trasplante. Se creó una variable binaria en función de la ganancia o la pérdida de peso. Se crearon otras variables binarias utilizando como puntos de corte un IMC mayor o menor a 30kg/m2, mayor o menor a 25kg/m2, y según el valor del IMC a partir del cual implicó mayor riesgo de pérdida del injerto.
Las variables se expresan como media y desviación estándar (DS) para las variables cuantitativas o mediante mediana y rango intercuartil (RIC) según la normalidad de la variable, analizada esta mediante estadístico de Kolmogorov-Smirnov; y como número y porcentaje para las variables cualitativas. La significación del cambio del peso durante el periodo del estudio se analizó mediante la prueba no paramétrica Test de Wilcoxon, mientras que el cambio en el IMC se evaluó mediante pruebas no paramétricas con la prueba de McNemar. Se utilizó la t de student o la U de Mann-Whitney para la comparación de variables continuas entre grupos según el caso. Para la comparación de variables categóricas entre grupos se utilizó Chi-cuadrado o el test exacto de Fisher según correspondiera. La relación entre variables continuas se realizó mediante el coeficiente de correlación de Pearson o de Spearman según el caso. Mediante regresión logística multivariable se establecieron los determinantes de la ganancia o la pérdida de peso mediante el método de «pasos sucesivos hacia atrás». Mediante el modelo de regresión de riesgos proporcionales de Cox se analizó la influencia de la ganancia o de la pérdida de peso tras el trasplante, ajustada a las posibles variables de confusión, en la pérdida del injerto al final del seguimiento, así como el efecto del propio IMC sobre la evolución final. La supervivencia del injerto en función de la ganancia o pérdida de peso, así como de cada estadio del IMC se evaluó mediante el método de Kaplan-Meier utilizando el log-rank para establecer la presencia de diferencias estadísticamente significativas. Mediante regresión logística multivariable se analizó la influencia de la ganancia o pérdida de peso, o del IMC ajustada a las variables de confusión en el desarrollo de nuevos diabéticos al año del trasplante. Se usó el modelo de regresión de riesgos proporcionales de Cox para analizar la influencia de la ganancia o de la pérdida de peso tras el trasplante, ajustada a las posibles variables de confusión, en la aparición de un evento cardiovascular (ECV) mayor al final del seguimiento. Se consideró como estadísticamente significativa una p<0,05.
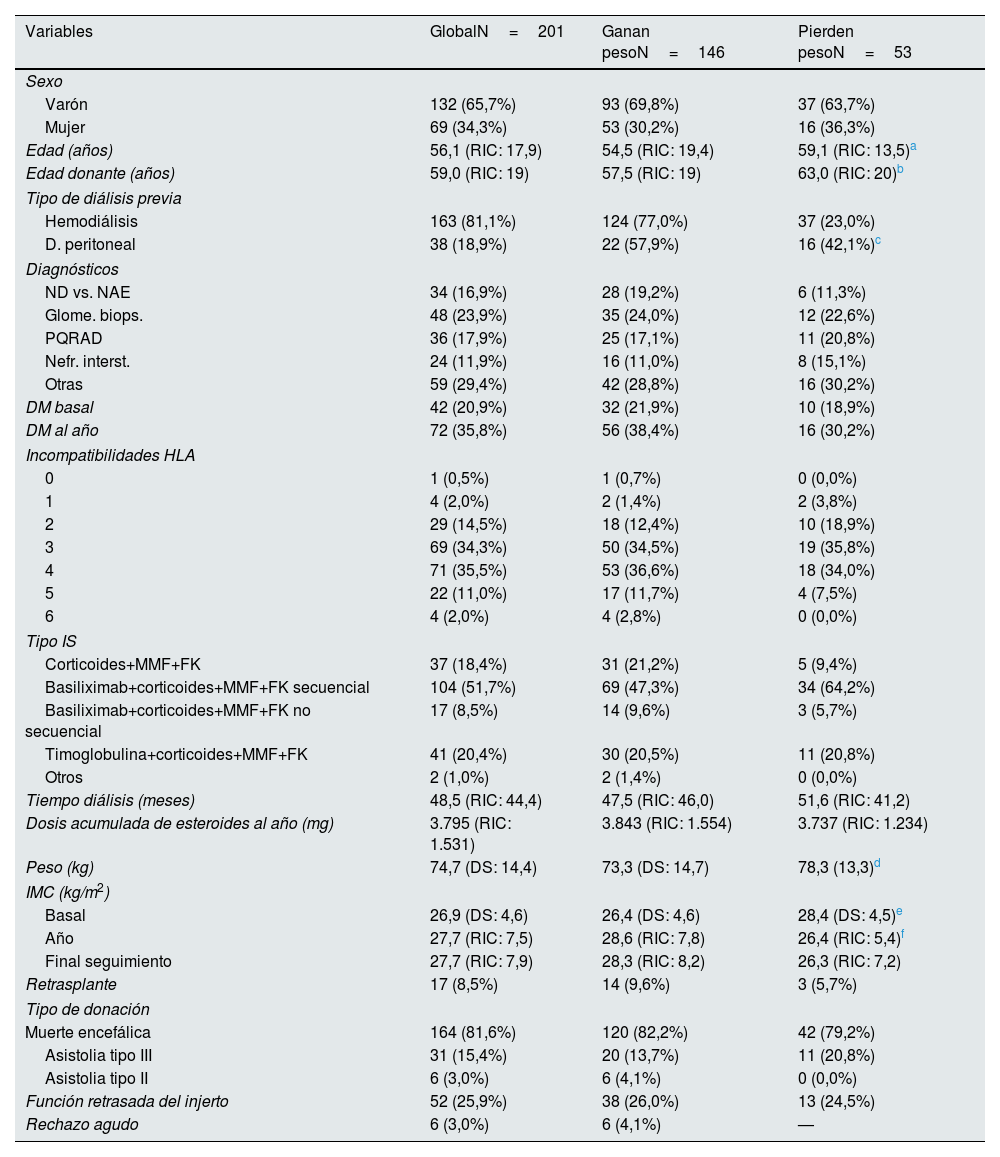
ResultadosSe siguieron 201 pacientes, de los cuales 17 (8,5%), volvieron a diálisis durante el periodo de estudio, con una mediana de seguimiento de 47 meses. Veintiuno pacientes (10,4%) fallecieron con injerto funcionante. La edad mediana fue de 561 años (RIC: 17,9), con un 67,5% de varones. Las características de la muestra se exponen en la tabla 1.
Características basales según ganancia o pérdida de peso al año
| Variables | GlobalN=201 | Ganan pesoN=146 | Pierden pesoN=53 |
|---|---|---|---|
| Sexo | |||
| Varón | 132 (65,7%) | 93 (69,8%) | 37 (63,7%) |
| Mujer | 69 (34,3%) | 53 (30,2%) | 16 (36,3%) |
| Edad (años) | 56,1 (RIC: 17,9) | 54,5 (RIC: 19,4) | 59,1 (RIC: 13,5)a |
| Edad donante (años) | 59,0 (RIC: 19) | 57,5 (RIC: 19) | 63,0 (RIC: 20)b |
| Tipo de diálisis previa | |||
| Hemodiálisis | 163 (81,1%) | 124 (77,0%) | 37 (23,0%) |
| D. peritoneal | 38 (18,9%) | 22 (57,9%) | 16 (42,1%)c |
| Diagnósticos | |||
| ND vs. NAE | 34 (16,9%) | 28 (19,2%) | 6 (11,3%) |
| Glome. biops. | 48 (23,9%) | 35 (24,0%) | 12 (22,6%) |
| PQRAD | 36 (17,9%) | 25 (17,1%) | 11 (20,8%) |
| Nefr. interst. | 24 (11,9%) | 16 (11,0%) | 8 (15,1%) |
| Otras | 59 (29,4%) | 42 (28,8%) | 16 (30,2%) |
| DM basal | 42 (20,9%) | 32 (21,9%) | 10 (18,9%) |
| DM al año | 72 (35,8%) | 56 (38,4%) | 16 (30,2%) |
| Incompatibilidades HLA | |||
| 0 | 1 (0,5%) | 1 (0,7%) | 0 (0,0%) |
| 1 | 4 (2,0%) | 2 (1,4%) | 2 (3,8%) |
| 2 | 29 (14,5%) | 18 (12,4%) | 10 (18,9%) |
| 3 | 69 (34,3%) | 50 (34,5%) | 19 (35,8%) |
| 4 | 71 (35,5%) | 53 (36,6%) | 18 (34,0%) |
| 5 | 22 (11,0%) | 17 (11,7%) | 4 (7,5%) |
| 6 | 4 (2,0%) | 4 (2,8%) | 0 (0,0%) |
| Tipo IS | |||
| Corticoides+MMF+FK | 37 (18,4%) | 31 (21,2%) | 5 (9,4%) |
| Basiliximab+corticoides+MMF+FK secuencial | 104 (51,7%) | 69 (47,3%) | 34 (64,2%) |
| Basiliximab+corticoides+MMF+FK no secuencial | 17 (8,5%) | 14 (9,6%) | 3 (5,7%) |
| Timoglobulina+corticoides+MMF+FK | 41 (20,4%) | 30 (20,5%) | 11 (20,8%) |
| Otros | 2 (1,0%) | 2 (1,4%) | 0 (0,0%) |
| Tiempo diálisis (meses) | 48,5 (RIC: 44,4) | 47,5 (RIC: 46,0) | 51,6 (RIC: 41,2) |
| Dosis acumulada de esteroides al año (mg) | 3.795 (RIC: 1.531) | 3.843 (RIC: 1.554) | 3.737 (RIC: 1.234) |
| Peso (kg) | 74,7 (DS: 14,4) | 73,3 (DS: 14,7) | 78,3 (13,3)d |
| IMC (kg/m2) | |||
| Basal | 26,9 (DS: 4,6) | 26,4 (DS: 4,6) | 28,4 (DS: 4,5)e |
| Año | 27,7 (RIC: 7,5) | 28,6 (RIC: 7,8) | 26,4 (RIC: 5,4)f |
| Final seguimiento | 27,7 (RIC: 7,9) | 28,3 (RIC: 8,2) | 26,3 (RIC: 7,2) |
| Retrasplante | 17 (8,5%) | 14 (9,6%) | 3 (5,7%) |
| Tipo de donación | |||
| Muerte encefálica | 164 (81,6%) | 120 (82,2%) | 42 (79,2%) |
| Asistolia tipo III | 31 (15,4%) | 20 (13,7%) | 11 (20,8%) |
| Asistolia tipo II | 6 (3,0%) | 6 (4,1%) | 0 (0,0%) |
| Función retrasada del injerto | 52 (25,9%) | 38 (26,0%) | 13 (24,5%) |
| Rechazo agudo | 6 (3,0%) | 6 (4,1%) | — |
DM: diabetes mellitus; DS: desviación estándar; FGe: filtrado glomerular estimado por CKD-EPI; ND vs. NAE: nefropatía diabética vs. nefroangiosclerosis; IMC: índice de masa corporal; PQRAD: poliquistosis renal autosómica dominante; RIC: rango intercuartil.
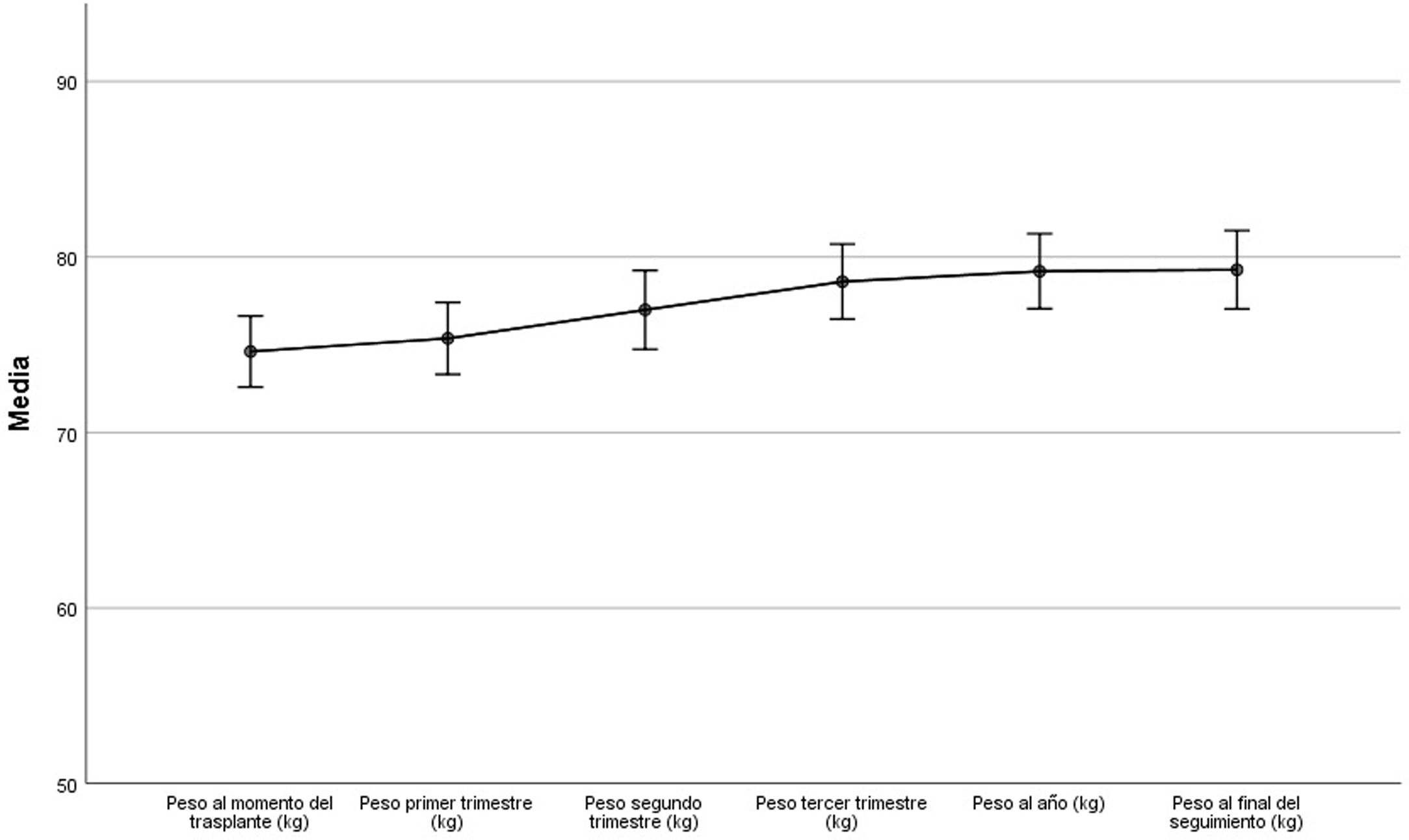
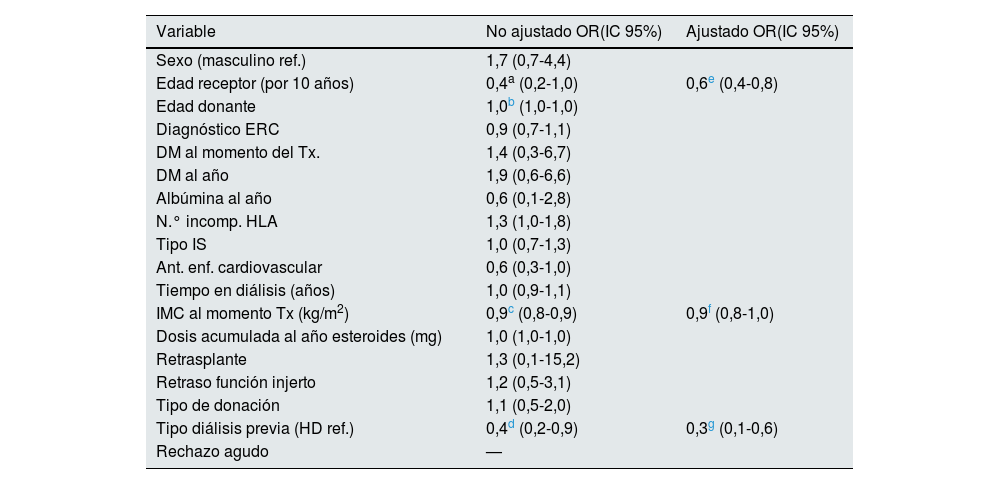
De manera global existió una ganancia de peso estadísticamente significativa durante el primer año del trasplante, con una ganancia media de 4,5kg (IC 95%: 3,5-5,6; p<0,001). Esta tendencia se mantuvo hasta el final del seguimiento, aunque la ganancia de peso entre el año y el final del estudio fue pequeña y no estadísticamente significativa: media 0,09kg, IC 95%: −0,9-1,0; p=0,858 (fig. 1). Al año del trasplante, 146 pacientes (73,4%) habían ganado peso (7,0kg de mediana [RIC: 7,6]). Pero hubo un 26,6% del total, (53 pacientes) que presentaron una pérdida de peso: −3,9kg (RIC: 5,3). Al final del seguimiento, 142 pacientes (71,4%) ganan peso respecto al momento del trasplante (7,2kg, [RIC: 9,2]), con un 28,6% de pacientes que pierden peso [−4,4kg, (RIC: 5,0]). Un 54,3% de los pacientes presentaron una ganancia de peso superior al 5%, mientras que un 11,6% perdieron más del 5% del peso al año respecto al momento del trasplante. No hubo diferencias significativas en la ganancia de peso entre varones y mujeres (p=0,637 y p=0,256 para el año y final del seguimiento, respectivamente), y tampoco se encontró relación con la dosis acumulada de esteroides recibida (p=0,358 y p=0,455 para el año y final del seguimiento, respectivamente). En la regresión logística multivariable, la edad del paciente (OR por cada 10 años: 0,6; IC 95%: 0,4-0,8; p=0,002), la modalidad de diálisis previa (OR: 0,3; IC 95%: 0,1-0,6; p=0,003), y el IMC al momento del trasplante (OR: 0,9; IC 95%: 0,8-1,0; p=0,003), fueron los determinantes de la ganancia o de la pérdida de peso, con una tendencia a pérdida de peso en los pacientes con un IMC mayor al momento del trasplante, los de edad más avanzada y en los procedentes de diálisis peritoneal (tabla 2).
Regresión logística univariable y multivariable. Determinantes del cambio en el peso al año del trasplante
| Variable | No ajustado OR(IC 95%) | Ajustado OR(IC 95%) |
|---|---|---|
| Sexo (masculino ref.) | 1,7 (0,7-4,4) | |
| Edad receptor (por 10 años) | 0,4a (0,2-1,0) | 0,6e (0,4-0,8) |
| Edad donante | 1,0b (1,0-1,0) | |
| Diagnóstico ERC | 0,9 (0,7-1,1) | |
| DM al momento del Tx. | 1,4 (0,3-6,7) | |
| DM al año | 1,9 (0,6-6,6) | |
| Albúmina al año | 0,6 (0,1-2,8) | |
| N.° incomp. HLA | 1,3 (1,0-1,8) | |
| Tipo IS | 1,0 (0,7-1,3) | |
| Ant. enf. cardiovascular | 0,6 (0,3-1,0) | |
| Tiempo en diálisis (años) | 1,0 (0,9-1,1) | |
| IMC al momento Tx (kg/m2) | 0,9c (0,8-0,9) | 0,9f (0,8-1,0) |
| Dosis acumulada al año esteroides (mg) | 1,0 (1,0-1,0) | |
| Retrasplante | 1,3 (0,1-15,2) | |
| Retraso función injerto | 1,2 (0,5-3,1) | |
| Tipo de donación | 1,1 (0,5-2,0) | |
| Tipo diálisis previa (HD ref.) | 0,4d (0,2-0,9) | 0,3g (0,1-0,6) |
| Rechazo agudo | — |
DM: diabetes mellitus; ERC: enfermedad renal crónica; HD: hemodiálisis; HLA: Human Leukocyte Antigen; IC 95%: intervalo de confianza del 95%; IMC: índice de masa corporal; IS: inmunosupresión; OR: odds ratio; Tx: trasplante renal.
a p=0,008.
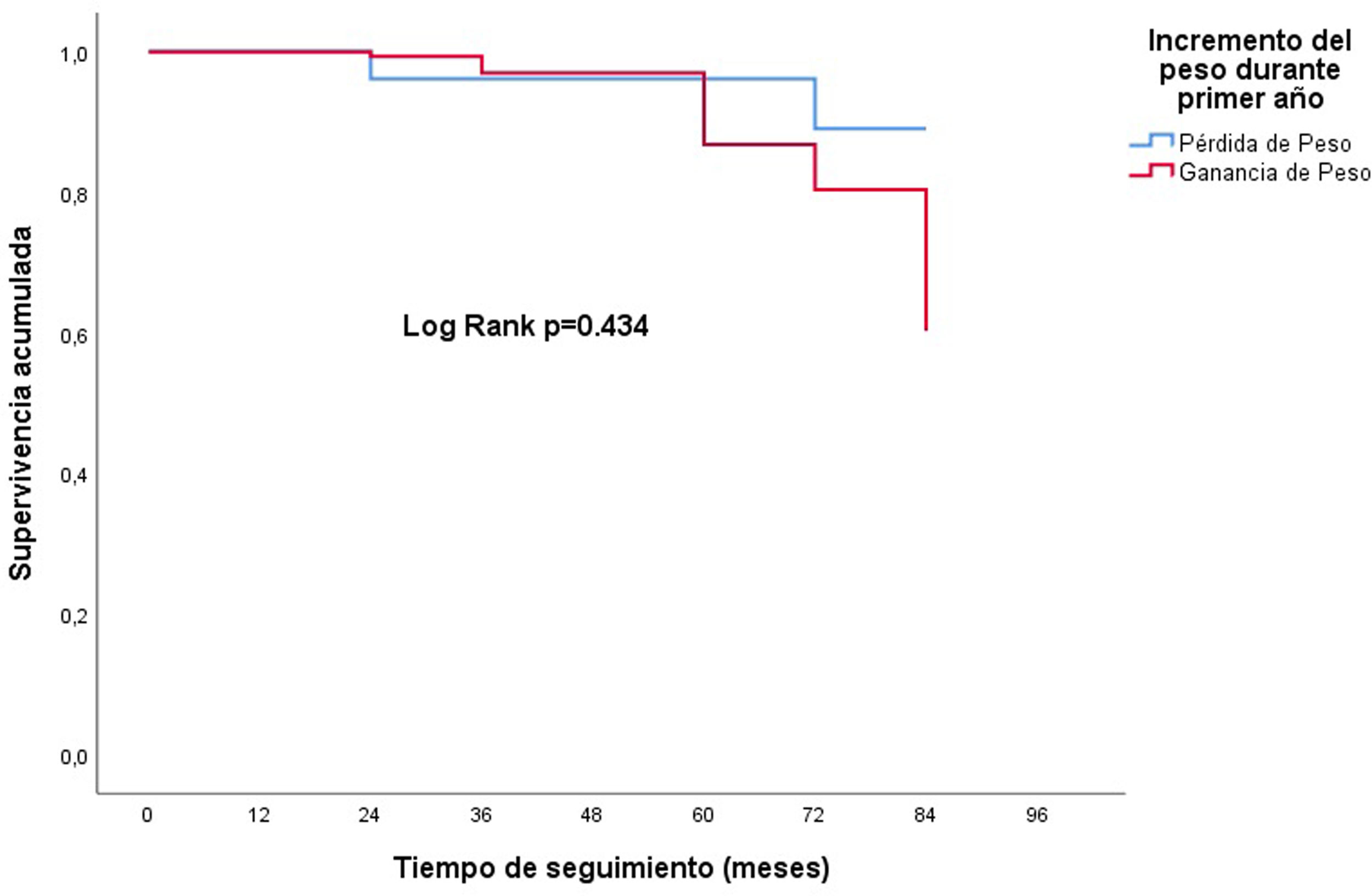
Mediante modelo de regresión de Cox multivariable ajustado a las posibles variables de confusión, el aumento o descenso del peso al año per se no influyó en la pérdida del injerto: HR: 1,1; IC 95%: 0,3-4,8; p=0,895 (fig. 2). Tampoco influyó si la ganancia o pérdida de peso era superior al 5% (p=0,5).
Influencia del índice de masa corporal en la evolución del injertoAl momento del trasplante había 49 pacientes (24,6%) con IMC superior a 30kg/m2. Este porcentaje de obesos aumentó al 37,5% (75 pacientes) al año del trasplante y al 39,5% (79 pacientes) al final del seguimiento siendo estadísticamente significativo para ambas comparaciones (p<0,001). La edad media de los pacientes obesos era de 59,1 (RIC: 13,7) años, siendo superior a la de los no obesos: 55,7 (RIC: 19,0) años (p=0,023).
De los 73 pacientes que se trasplantaron con un IMC normal, 30 (41,1%) evolucionaron a sobrepeso, y uno (1,4%) a obesidad grado 1 al año; ninguno perdió peso. Setenta y cinco pacientes se trasplantaron con sobrepeso, evolucionando 30 (40,0%) a obesidad grado 1, y un paciente (1,3%) a obesidad grado 2; 8 pacientes (10,7%) pasaron de sobrepeso a IMC normal. Con obesidad grado 1 se trasplantaron 40 pacientes; de ellos, 9 (22,5%) evolucionaron a obesidad grado 2, y 2 (5,0%) a obesidad mórbida; 6 pacientes (15,0%), pasaron a sobrepeso; ninguno pasó a IMC normal. Un paciente (12,5%) de los 8 con obesidad grado 2, cambió su estadio a obesidad mórbida; el 37,5% (3 pacientes) pasaron a obesidad grado 1; ninguno cambió a IMC normal. Dos pacientes se trasplantaron con IMC inferior a 18,5kg/m2, recuperando ambos un IMC normal tras el trasplante. Un paciente se trasplantó con obesidad mórbida, permaneciendo en la misma situación al año.
Al año, 74 pacientes (37,2%) aumentaron su IMC, mientras que un 9,5% lo disminuyeron. El resto mantuvieron mismo IMC que al momento del trasplante. Un 14,4% de pacientes pasaron de IMC normal a sobrepeso, y un 1,0% de IMC normal a obesos, mientras que un 4,0% pasaron de sobrepeso a IMC normal. Ningún paciente obeso pasó a IMC normal. El 25,0% de los pacientes presentaban un IMC normal al año del trasplante, con 112 pacientes (61,0%) sin obesidad. Este porcentaje de IMC normal subió al 27,5% al final del seguimiento.
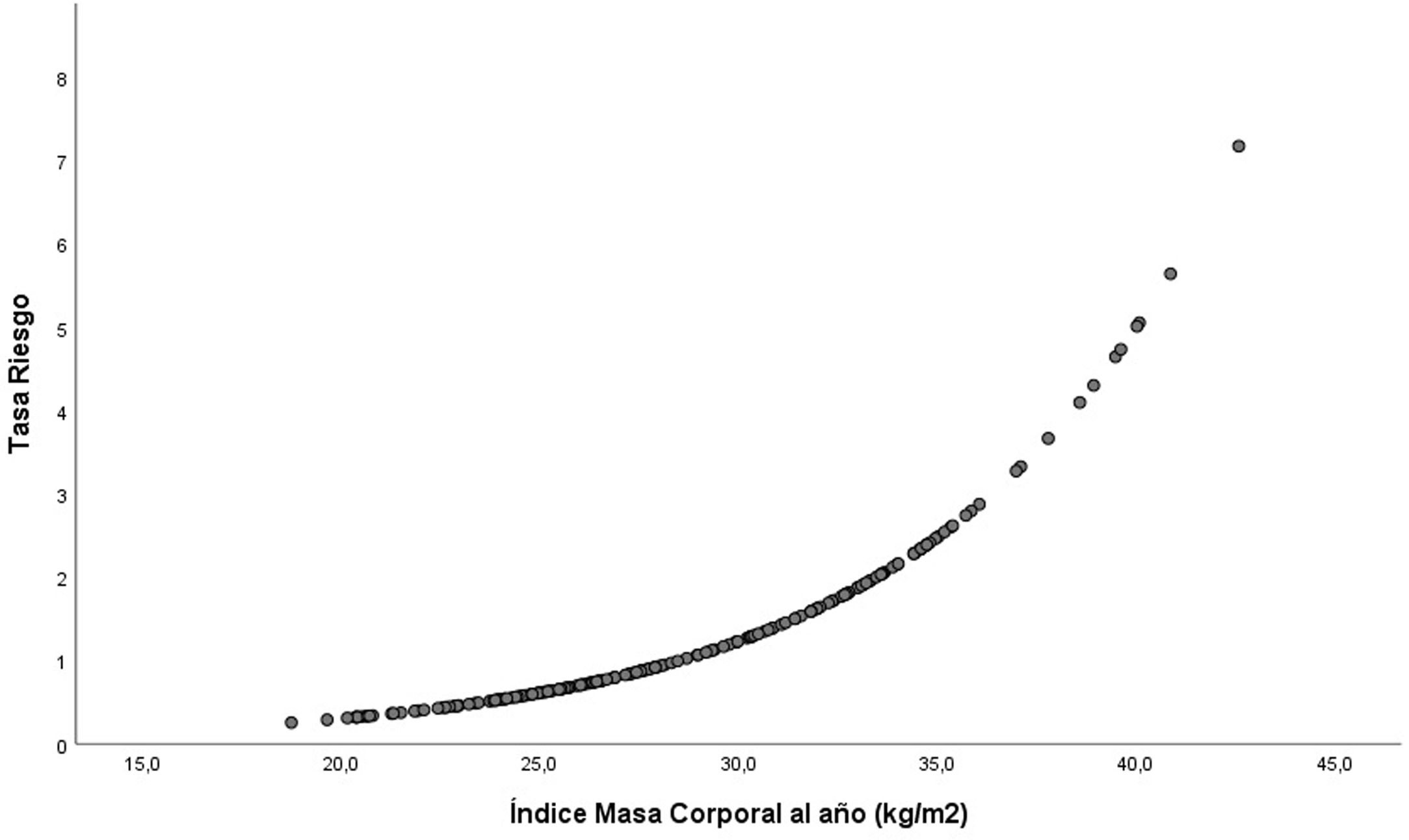
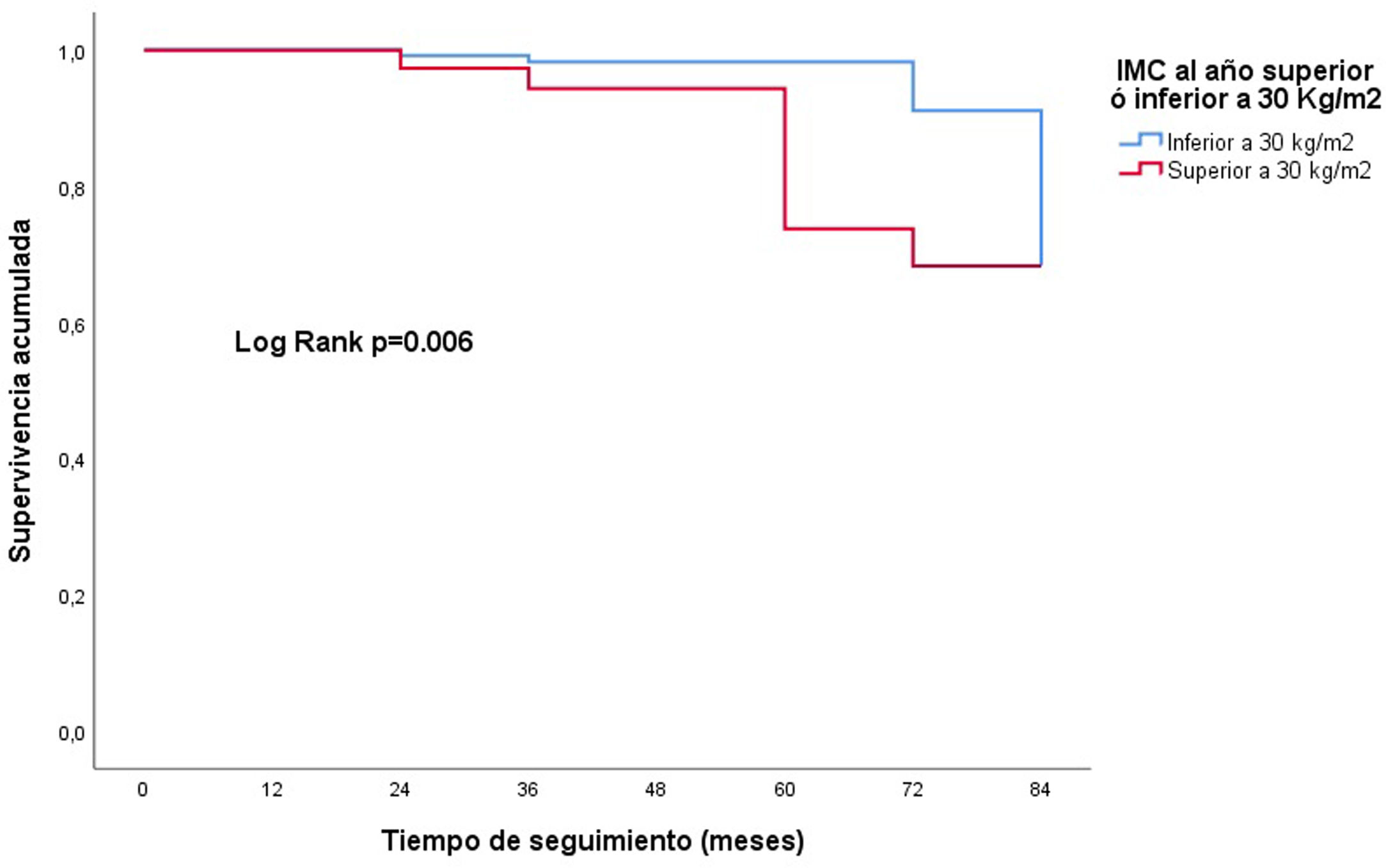
En el análisis de regresión de Cox multivariable ajustada, el IMC como variable continua se relacionó con una peor supervivencia del injerto: HR 1,3; IC 95%: 1,1-1,6; p=0,003 (fig. 3). La obesidad al año (IMC≥30kg/m2), influyó de manera negativa en la evolución del injerto al final del seguimiento: HR: 7,0 (IC 95%: 1,3-38,0); p=0,025 (fig. 4). No se encontró un aumento del riesgo tomando como punto de corte un IMC por encima de la normalidad (25kg/m2). En la muestra, el valor de IMC al año a partir del cual comienza el riesgo de pérdida del injerto, fue de 28,5kg/m2. Los pacientes con un IMC por encima de este valor tenían un riesgo mayor de perder el injerto: HR: 3,4 (IC 95%: 1,1-32,1; p=0,039) (fig. 5).
Relación del índice de masa corporal y de la ganancia o pérdida de peso con el desarrollo de diabetes mellitus y eventos cardiovascularesAl año del trasplante hubo un 14,9% de nuevos pacientes diabéticos pasando de un 20,9% al momento del trasplante a un 35,8% al año de seguimiento. El incremento de peso durante este primer año no se relacionó con el desarrollo de nuevos diabéticos (p=0,360). Tampoco se relacionó con la aparición de nuevos diabéticos el IMC, tanto como variable continua (p=0,954), como por estadios de IMC (p=0,665). Los determinantes de la aparición de nuevos diabéticos al año del trasplante mediante regresión logística multivariable fueron la edad: OR 2,4 por cada 10 años (IC 95%: 1,4-4,0); p<0,001, el tiempo en diálisis previo al trasplante: OR 1,1 por cada año (IC 95%: 1,0-1,2); p=0,022, y el tipo de donante: asistolia tipo III (OR: 3,4; IC 95%: 1,2-9,6; p=0,022) y asistolia tipo II (OR: 7,9; IC 95%: 1,1-55,6; p=0,037) tomando la donación de cadáver como referencia.
Durante el periodo de seguimiento, 21 pacientes (10,4%) presentaron un ECV mayor, siendo el síndrome coronario agudo el evento más frecuente (42,9%), seguido de la arteriopatía periférica con un 33,3% de los casos. El 19,0% presentaron un ictus isquémico. La ganancia o la pérdida de peso per se, ni el IMC influyó en el desarrollo de ECV, siendo el antecedente previo al trasplante de enfermedad cardiovascular y la condición de diabético al año, las variables que se relacionaron con un mayor riesgo de nuevos eventos cardiovasculares: HR: 1,9; IC 95%: 1,3-2,9; p=0,001 y HR: 5,6; IC 95%: 1,9-16,9; p=0,002, respectivamente.
DiscusiónNuestros resultados muestran que, aunque de manera global existe una ganancia de peso tras el trasplante renal, existe un porcentaje importante de pacientes que pierden peso. Entre los determinantes de esta ganancia o pérdida de peso en nuestra muestra se encuentra la edad, con una menor ganancia de peso o pérdida del mismo a edades más avanzadas. Datos similares son reportados por otros estudios donde encuentran una relación inversa entre la edad y la ganancia de peso tras el trasplante, con una mayor ganancia en pacientes jóvenes relacionado quizás con una mayor ingesta alimenticia al desaparecer las restricciones dietéticas asociadas a la propia insuficiencia renal crónica13–15. En el estudio de Workeneh et al, un aumento en la ingesta de grasas en la dieta diaria, fue el único determinante del aumento de peso tras el trasplante renal, a expensas fundamentalmente de tejido adiposo en la región troncular12. Por ello, la aplicación de consejos dietéticos podría evitar esta ganancia de peso; sin embargo, una intervención intensiva nutricional no consiguió demostrar una menor ganancia de peso frente a las recomendaciones nutricionales estándar16.
Otro de los determinantes de la evolución del peso tras el trasplante en nuestro estudio, fue la modalidad de terapia renal sustitutiva previa, con una tendencia a una menor ganancia de peso en los pacientes procedentes de diálisis peritoneal. Este hecho, descrito ya en otros estudios, se cree que es debido a un estado de sobrehidratación previo al trasplante en este grupo de pacientes, normalizándose la volemia tras el trasplante al mejorar la función renal, así como debido a una diferente concentración plasmática de distintas hormonas relacionadas con el apetito entre los pacientes procedentes de una y otra técnica17,18. Aunque observamos una tendencia a un mayor riesgo de incremento del peso en el sexo femenino, nosotros no encontramos diferencias significativas en la evolución del peso asociada al sexo, al contrario de lo recogido en otros estudios. Diferencias raciales de los distintos estudios podrían explicar estas diferencias13,15. Tampoco encontramos diferencias asociadas a la dosis de esteroides recibida durante el primer año. La tendencia actual a disminuir o suspender rápidamente la dosis de esteroides derivada de una mejora en la terapia inmunosupresora actual, sería la causante de la pérdida de influencia de los esteroides en la evolución del peso tras el trasplante encontrada en trabajos antiguos6,18,19.
La influencia del IMC en la evolución del injerto no está suficientemente dilucidada. En nuestro trabajo, encontramos una tendencia a un mayor riesgo de pérdida del injerto en los pacientes obesos. También encontramos relación entre pérdida del injerto y el IMC, tomado este como variable continua, o cuando dividimos la muestra tomando como punto de corte el valor del IMC a partir del cual comienza el riesgo de perder el injerto, con un IMC englobado en el rango del sobrepeso. Estudios con gran número de pacientes no encuentran relación entre la obesidad y la pérdida del injerto, o encuentran una peor supervivencia del injerto solo en trabajos antiguos, sin demostrarse esta peor evolución en trabajos más recientes, haciendo alusión a cambios en la terapia inmunosupresora actual como responsable de esta diferencia14,19. Pero la gran mayoría de trabajos encuentran una peor evolución a medida que aumenta el IMC10,11,20,21. El aumento del IMC se asocia con mayor riesgo de desarrollo de ERC, así como una evolución más rápida hacia la ERC terminal22. Esto es debido, no solo a la asociación de la obesidad con otros factores comórbidos que también produce ERC como puede ser la DM y la HTA, sino también debido al desarrollo de daño histológico derivado de la glomerulomegalia adaptativa en estos pacientes, que a su vez puede verse influido por otros factores como puede ser una baja carga nefronal al nacimiento; esta hipertrofia glomerular tiene como consecuencias el desarrollo de hiperfiltración y proteinuria dando lugar a la glomeruloesclerosis asociada en estos pacientes23,24. Tras el trasplante renal, se produce de manera natural una situación de hiperfiltración al recibir un único riñón, la cual puede verse agravada en receptores con un IMC superior al del donante. Por ello, el IMC debe ser tenido en cuenta en el correcto emparejamiento donante-receptor.
Tras el trasplante renal, como se ha comentado anteriormente, se produce de manera global una ganancia de peso, aunque hay pacientes que lo pierden. Esta ganancia o pérdida de peso, con un aumento o descenso del IMC asociado, daría lugar a un mayor o menor riesgo de perder el injerto14,21. Sin embargo, la ganancia o la pérdida de peso por sí misma en nuestro trabajo no se relacionó con la pérdida del injerto, ni aun considerando una ganancia o pérdida superior al 5% como se recoge en algunos trabajos17, aunque otros encuentran una peor evolución con porcentajes de ganancia o pérdida más elevados14. Un paciente con ganancia de peso tras el trasplante y, por tanto, con un aumento del IMC, tendría una peor evolución del injerto que un paciente que pierde peso y, por tanto, disminuye su IMC. Nosotros consideramos que no es la ganancia o pérdida de peso en sí la que influye, sino el IMC alcanzado al año del trasplante. Así, un paciente que gana peso y evoluciona de sobrepeso a obesidad grado 1 tras el trasplante, tiene el mismo riesgo de perder el injerto que otro paciente que pierde peso y cambia de obesidad grado 2 a obesidad grado 1.
La obesidad y la DM son factores comórbidos frecuentemente asociados dentro del síndrome metabólico asociado al desarrollo de la enfermedad cardiovascular, tanto en población general como en trasplantada25–27. La obesidad se ha relacionado en diversos estudios, aunque no en todos, con una mayor incidencia de la DM tras el trasplante renal y, por tanto, con un riesgo añadido de deterioro de la función renal28. El aumento del peso tras el trasplante renal fundamentalmente debido a un aumento del tejido adiposo, en especial de la grasa visceral abdominal, podrían predisponer al desarrollo de resistencia a la insulina, aparición de diabetes, inflamación crónica y eventos cardiovasculares12. En nuestro trabajo hubo casi un 15% de nuevos diabéticos al año, pero tampoco encontramos relación con la ganancia o pérdida de peso, ni con el IMC. Al igual que lo reseñado en otros estudios29,30, nosotros tampoco encontramos asociación entre la ganancia o pérdida de peso, o el IMC con los eventos cardiovasculares tras el trasplante a pesar del porcentaje elevado de obesos al final del seguimiento, debido probablemente a las diferentes características de la población estudiada.
Son varias las limitaciones de nuestro estudio. En primer lugar, se trata de un estudio unicéntrico, con un tamaño de muestra, por tanto, limitado, sin diversidad racial. Por ello, los resultados podrían no ser extrapolables a otro tipo de población. La ganancia de peso global tras el trasplante es inferior a la reseñada en otros estudios6,13. Esto puede dar lugar a que pacientes que ganen o pierdan peso se mantengan dentro del mismo intervalo de IMC que presentaban al momento del trasplante, y por ello que el cambio en el peso no refleje el efecto sobre la evolución del injerto cuanto se toma el IMC como variable categórica. Sin embargo, al considerar el IMC como variable continua, sí se evidencia este efecto. Por otra parte, no podemos evaluar el efecto de un IMC inferior a 18kg/m2 en la evolución del injerto ni en el desarrollo de DM o enfermedad cardiovascular, al no tener ningún paciente por debajo de ese límite durante el seguimiento.
ConclusiónEn nuestro estudio, aunque la tendencia global tras el trasplante renal es hacia la ganancia de peso, existe una proporción importante de pacientes que lo pierden. No encontramos una menor supervivencia del injerto según esta ganancia o pérdida de peso, pero sí con el IMC. Una ganancia de peso, con un consiguiente aumento del IMC, conllevará por tanto una peor evolución. A pesar de la frecuente asociación entre obesidad, DM y desarrollo de enfermedad cardiovascular, en nuestro estudio la ganancia o pérdida de peso o el IMC, no influyó de manera significativa en la aparición de nuevos diabéticos o en el desarrollo de enfermedad cardiovascular.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno por parte de todos los autores.